具免疫活性的平卧菊三七多糖及其制备方法和应用与流程
本发明属于多糖和医药用途领域,涉及平卧菊三七多糖,同时涉及该多糖的制备方法,进一步涉及该平卧菊三七多糖的抗感染免疫活性作用。
背景技术:
多糖是一类大分子物质,广泛存在于生物体中。此外,多糖具有多种生物活性,如免疫调节、抗肿瘤、抗氧化和降血糖活性。由于植物多糖具有无毒无公害等特点,与合成化合物相比不会引起明显的副作用,因此它们是现代医学的理想候选物。
平卧菊三七是一种药用植物,广泛应用于许多国家,以治疗各种疾病,如风湿病、糖尿病、便秘、高血压等。目前对平卧菊三七的研究主要集中在黄酮、皂苷等方面的研究,多糖的分离纯化也有相关报道,但对于平卧菊三七多糖的明确结构和相关药理活性机制的系统研究未见报道。
技术实现要素:
本发明的目的是提供一种结构明确的具免疫活性的平卧菊三七多糖,同时提供该平卧菊三七多糖的制备方法,还提供该平卧菊三七多糖的抗感染免疫活性作用。
为达上述目的,本发明采用的技术方案是:一种平卧菊三七多糖,其为均一的中性杂多糖,主要由葡萄糖(glc)、甘露糖(man)、半乳糖(gal)、木糖(xyl)、鼠李糖(rib)和阿拉伯糖(ara)按48.6:20.0:15.7:9.7:3.3:2.6的摩尔比组成,分子量为4886.68da。
本发明的多糖结构是以吡喃糖环glc为主骨架构成,其主要结构由araf-(1→,→4)-rhap-(1→,→4)-xylf-(1→,manp-(1→,galp-(1→,→4)-glcp-(1→,→6)-glcp-(1→,→3)-galp-(1→,→6)-manp-(1→,→4,6)-glcp-(1→组成。
本发明的上述平卧菊三七多糖是由以下方法制备得到:
(1)以平卧菊三七茎为原料,利用水提醇沉法制得粗多糖;
上述水提醇沉法为常规技术,粗多糖的制备过程为:将平卧菊三七茎用水超声提取得到水提取液,离心,上清液用乙醇沉淀;去除沉淀中的蛋白,透析,用乙醇沉淀;将沉淀离心,乙醇洗涤,干燥即得粗多糖。具体地,上述粗多糖的制备过程为:取平卧菊三七茎,于其中加入为平卧菊三七茎重量10-25倍的水,超声提取35-65分钟,其中,超声功率为50w-90w,温度为60-85℃;将得到的水提取液过滤,在6000×g下离心5-15min,上清液用75%-90%质量浓度的乙醇在室温下沉淀12-24h;用sevag法去除沉淀蛋白,在透析袋中透析36-60h,然后用75%-95%质量浓度的乙醇沉淀12-24h;将得到的沉淀在6000×g下离心5-15min,用75%-95%质量浓度的乙醇洗涤三次,然后将沉淀干燥后收集,即得粗多糖。
(2)将粗多糖采用大孔吸附树脂柱,用水洗脱去除非糖杂质,收集水洗脱分、冻干,得初步纯化的多糖;
较佳的,上述大孔吸附树脂柱采用非极性吸附树脂,如ab-8/d-101等。
(3)将初步纯化的多糖采用阴阳离子交换树脂柱,依次用蒸馏水、0.3mol/l氯化钠溶液和0.5mol/l氯化钠溶液进行洗脱,收集蒸馏水洗脱组分,冷冻干燥后再采用凝胶层析柱,依次用蒸馏水、0.3mol/l氯化钠溶液和0.5mol/l氯化钠溶液进行洗脱,收集主要洗脱峰的洗脱液,浓缩、冷冻干燥,得到本发明的平卧菊三七多糖gpps-b。
较佳的,上述阴阳离子交换树脂柱采用amberlitefpa90-cl和fpc-3500纤维素柱,凝胶层析柱采用deae-sepharosefastflow。
发明的平卧菊三七多糖具有抗感染免疫活性,能够完全抵消lps诱导的细胞毒性对thp-1细胞的影响,通过抑制seap和荧光素酶降解分别阻断lps刺激的巨噬细胞中nf-κb/irf信号通路,表明平卧菊三七多糖具有良好的抗感染免疫活性,能用于制备抗感染免疫药物。
本发明平卧菊三七均一多糖的制备方法工艺简便,易于操作,重现性良好,成本低,易于大规模生产。制得的平卧菊三七单体均一多糖结构明确,多糖结构由多个单糖组成。药效学实验证明,本发明所提供的平卧菊三七多糖具有良好抗感染免疫活性作用,可作为抗感染免疫与抗炎类药物进行开发应用。
附图说明
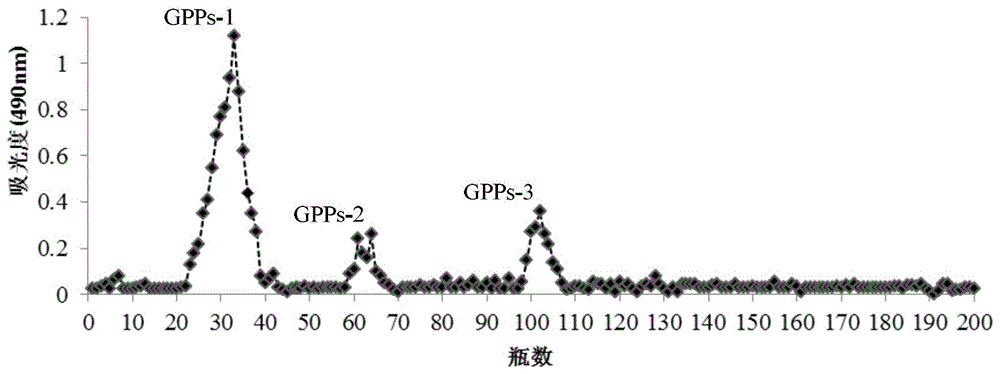
图1是阴阳离子交换树脂洗脱曲线。
其中:gpps-1为蒸馏水洗脱时的洗脱组分,gpps-2为0.3mol/l氯化钠溶液洗脱时的洗脱组分,gpps-3为0.5mol/l氯化钠溶液洗脱时的洗脱组分。
图2是deae-sepharosef.f的洗脱曲线。
图3是本发明多糖的高效液相色谱串联凝胶柱谱图;
其中,横坐标时间的单位为分钟。
图4是本发明多糖的单糖组成气相色谱图;
其中:a-单糖标准品谱图,b-gpps-b的单糖气相色谱图,1-阿拉伯糖,2-鼠李糖,3-木糖,4-甘露糖,5-葡萄糖,6-半乳糖;横坐标表示时间(单位:分钟)。
图5是本发明多糖的紫外和红外色谱图;
其中:a-紫外光谱图,b-红外光谱图。
图6是采用不同方法检测不同浓度gpps-b处理后的thp-1细胞活力图;
其中:a-mtt法,b-quanti-luctm法。
具体实施方式
下面通过实施例对本发明做进一步的说明验证,所有实施例仅用于例证本发明,不限制本发明的保护范围。本领域技术人员知晓对于本发明权利要求内所做的更改或等效变更,均落入本发明的保护范围之内。
实施例1本发明平卧菊三七多糖的制备
1.仪器与试剂
仪器:分析天平、旋转蒸发仪、冷冻干燥机、离心机、气相色谱仪等。
试剂:平卧菊三七(购于江西省丰城市),细胞因子(il-1、il-6和tnf-α)检测elisa试剂盒(购于上海威唐生物科技有限公司),d-木糖、l-鼠李糖、d-葡萄糖、d-半乳糖、d-甘露糖和l-阿拉伯糖(购于美国西格玛官网),rpmi-1640(购于武汉博斯特生物技术),其他化学品均为ar级。
2.平卧菊三七多糖的制备
取平卧菊三七茎,于其中加入10倍至25倍重量的水超声提取51分钟,得水提取液,其中超声功率为74w,温度为60-85℃。将得到的水提取液过滤,在6000×g下离心10min,将得到的上清液用95%质量浓度的乙醇在室温下沉淀18h。用sevag法去除沉淀蛋白,在透析袋中透析48h后用95%质量浓度的乙醇沉淀12h,将得到的沉淀在6000×g下离心10min,用85%质量浓度的乙醇洗涤三次,然后将沉淀干燥,得到粗多糖。
将粗多糖用水溶解后上大孔吸附树脂ab-8/d-101,用水洗脱,收集水洗脱组分,冻干,得初步纯化的多糖。将初步纯化的多糖配成水溶液,上样于阳离子和阴离子(amberlitefpa90-cl和fpc-3500)纤维素柱,依次用蒸馏水、0.3mol/l氯化钠溶液和0.5mol/l氯化钠溶液进行梯度洗脱(参见图1),分管收集,用苯酚硫酸法检测,至无糖组分流出,收集液冷冻干燥;将冷冻干燥后的gpps-1组分(即蒸馏水洗脱组分)配成溶液,上样于deae-sepharosef.f,依次用蒸馏水、0.3mol/l氯化钠溶液和0.5mol/l氯化钠溶液进行梯度洗脱(参见图2),分管收集,合并主要洗脱峰的收集液,将gpps-b洗脱峰对应的洗脱液进行浓缩和冷冻干燥,得到本发明的平卧菊三七多糖gpps-b。
实施例2本发明平卧菊三七多糖gpps-b的结构分析
1.相对分子质量的测定
称取前述制备的本发明多糖适量,用超纯水溶解,制备成5mg/ml的样品,进一步采用高效液相色谱法测定多糖的相对分子质量,得到了如图3所示多糖单体峰,保留时间为14.28min。因此,基于一系列标准糖(t3-t500)的对数分子量与保留时间(tr),在tsk-gelg3000pwxl柱上用hpsec-elsd方法,t3-t500建立回归方程。根据回归方程(logmw=-0.1004tr+5.1464,r=0.9964),用标准曲线法计算gpps-b的相对分子质量。结果:用hpsec-elsd方法测定本发明多糖的相对分子质量为4886.68da。测定结果表明,本发明的多糖为均一多糖,相对分子质量为4886.68da。
2.还原乙酰化分析单糖组成
称取前述制备的本发明多糖10mg,加入3ml的2mol/l的三氟乙酸,在110℃下水解4h,后用甲醇洗涤,除去三氟乙酸的残留。将水解后的样品还原成糖醇。蒸干后,再加入1:1乙酸酐和吡啶溶液于90℃反应30min。冷却后,加水和氯仿萃取3次,残渣用氯仿溶解,0.22μm有机相滤膜过滤,取过滤清液,待gc分析。气相色谱条件:sh-rtx-5硅毛细管柱(30m×0.25mm×0.25μm),载气为n2,进样量为1μl,温度条件为:初始温度为100℃保持0min,以5℃/min从180℃升到250℃,后以10℃/min从250℃升到320℃,保持5min。
结果如图4a和图4b所示,本发明多糖gpps-b主要由葡萄糖(glc)、甘露糖(man)、半乳糖(gal)、木糖(xyl)、鼠李糖(rib)和阿拉伯糖(ara)组成,摩尔比为48.6:20.0:15.7:9.7:3.3:2.6。这些结果表明,本发明多糖是一种中性的杂多糖,其中man、glc和gal含量相对较高。
3.紫外光谱及红外光谱分析
对前述制备的本发明多糖进行紫外光谱和红外光谱分析,紫外光谱如图5a所示。紫外光谱分析显示,本发明多糖在波长为260nm和280nm附近的吸收处含有少量的核酸和蛋白质,这与化学分析结果一致。为了进一步分析本发明多糖的结构,采用4000-500cm-1的ftir光谱进行了红外光谱分析,结果如图5b所示,在3382cm-1附近出现的光谱峰是由于o-h基团的存在产生的,在2912cm-1区域显示存在-ch2,h-c=o基团,在2358cm-1处的峰值为c-h跃迁角。1724cm-1和1604cm-1处的吸收峰归因于羧基(coor)的吸收,表明本发明多糖gpps-b含有酯化基团或弱酸性基团。在1369cm-1~1165cm-1区域的伸缩振动峰主要是糖环振动与(c-oh)侧基的伸缩振动重叠和(c-o-c)糖苷键振动。此外,从1018cm-1到1006cm-1的吸收带证实了吡喃糖环glc的存在。
4.甲基化分析
取20mg充分干燥后的前述制备的本发明多糖置于甲基化反应瓶中,加入5ml干燥的dmso(过无水硫酸钠小柱)后超声处理20min使样品完全溶解,然后快速加入20mg预先干燥的naoh粉末,超声使naoh粉末完全溶解,用移液管分别缓慢加入2ml干燥的碘甲烷至冻结的反应完全溶解,充入氮气,再分别超声处理反应液1h。然后分别加入1ml蒸馏水至反应瓶中使甲基化反应结束。再加入1mol/l的乙酸中和反应液。流水透析至反应液颜色转为无色,冷冻干燥,红外检测多糖羟基是否完全甲基化,若没有则需重复上述操作。样品的水解同步骤2乙酰化分析单糖组成中的记载。利用gc-ms对总离子图进行分子离子峰碎片分析,归属各连接不同类型糖苷组成。
结果如表1所示,本发明得到的平卧菊三七多糖gpps-b的主要结构由araf-(1→,→4)-rhap-(1→,→4)-xylf-(1→,manp-(1→,galp-(1→,→4)-glcp-(1→,→6)-glcp-(1→,→3)-galp-(1→,→6)-manp-(1→,→4,6)-glcp-(1→组成。其结构主要以glc为主骨架,侧链分别连接不同构型的man,gal,一侧端基连接为ara,rha,xyl构成。本发明的均一多糖糖结构小巧,分子量相对较小,单糖组成丰富。
表1不同构型阿尔迪醇乙酸酯gc-ms归属
实施例3平卧菊三七多糖gpps-b的抗感染免疫活性
1.细胞培养
在rpmi1640培养基中加入10%胎牛血清、2mm谷氨酰胺、1mm丙酮酸钠和抗生素。
2.mtt法测定本发明多糖gpps-b对细胞活力的影响
采用mtt法检测。取活化的对数生长期tph-1细胞以1×105个/ml的浓度接种于96孔板,培养12h后,加入不同浓度的gpps-b,以不加药物作为空白对照,继续培养24h,然后加入180μl无血清培养基和20μlmtt溶液继续培养4h后,吸去孔内培养基,每孔加入150μl二甲基亚砜使结晶物充分溶解。
结果如图6a所示,脂多糖(lps)刺激产生的细胞毒性可被gpps-b抑制,并且这种效应与剂量有关。当处理组的gpps-b的治疗剂量低于10μg/ml时,对照组与处理组无显著性差异。与对照组相比,gpps-b(治疗剂量为10、60、120和250μg/ml)能显著提高细胞活力(p<0.05),特别是在60、120和250μg/ml剂量下。因此,可以选择gpps-b的浓度进行抗感染免疫活性的进一步研究。
3.quanti-luctm法测定本发明多糖gpps-b对免疫通路的作用
96孔细胞培养板中的每孔先加入终浓度1g/mllps-b5,再加入20μl用dmso稀释的化合物。化合物的浓度为5000μg/ml,2500μg/ml,1250μg/ml,625μg/ml,312.5μg/ml,156μg/ml,设3个重复孔。阳性对照化合物为lps-b5,浓度为100μm。不加药对照组加20μl含1%dmso的生理盐水。
细胞计数,调整细胞浓度至1×106/ml,每孔加入180μl的细胞进行孵育。因此,每个测试孔的终体积为200μl,dmso的含量为0.3%/1%,化合物的测试浓度为500μg/ml,250μg/ml,125μg/ml,62.5μg/ml,31.25μg/ml,15.6μg/ml。对照化合物为终浓度1g/mllps-b5,孵育24小时进行检测;另空白组加200μl培液。
检测显色反应:24小时后,每孔取20μl的培养液至新的96孔板中,加入显色液quanti-blue200μl.放置37℃的培养箱,0.5-2小时后测定od650值。
lum反应:吸取上清每孔20μl,加入50μl荧光剂,混匀立刻进行检测。
lps是激活天然免疫系统的革兰氏阴性细菌的主要成分。lps识别主要由toll样受体4(tlr4)介导,并最终导致nf-κb的激活和促炎细胞因子的产生,本实验中先用lps进行诱导,促进炎症因子产生,同时加入gpps-b,看其是否能够抗感染或者抑制炎症的产生。结果如图6b所示,lps刺激可降低seap和荧光素酶的表达,而gpps-b可以阻断其降解,因此,本发明多糖gpps-b能够抑制lps诱导的细胞毒性对thp-1细胞的影响,通过抑制seap和荧光素酶降解分别阻断lps诱导的巨噬细胞中nf-κb/isg信号通路,并且具备良好的抗感染免疫活性机制。
3.测定细胞炎症因子实验
采用elisa试剂盒测定本发明多糖gpps-b对细胞因子(il-1、il-6和tnf-α)的影响,如下表2所示,lps诱导刺激thp-1细胞后,与空白组相比,模型组所有致炎细胞因子il-1β、il-6和tnf-α的产生均显著增加(p<0.05)。与模型组相比,给药组经不同浓度的gpps-b(60,120和250μg/ml)处理后,细胞因子(il-1、il-6和tnf-α)表达明显降低,说明本发明多糖gpps-b具有良好的抗感染免疫活性。
表2不同组thp-1细胞中tnf-α,il-1,和il-6因子
注:表中,*为与模型组对比有显著差异,p<0.05。
- 还没有人留言评论。精彩留言会获得点赞!