一种手性芳基N-杂芳基甲胺及其制备方法与流程
一种手性芳基n
‑
杂芳基甲胺及其制备方法
技术领域
1.本方法属于绿色催化不对称合成技术,具体涉及一种手性芳基n
‑
杂芳基甲胺及其不对称还原胺化合成方法。
技术背景
2.手性芳基n
‑
杂芳基甲胺是许多药物和生物活性化合物的重要结构元素,也是手性配体的关键构建块。通常以亚胺的不对称还原或加成、二芳基甲胺去对称化和转氨酶催化来制备,然而,这些方法需要预先形成的胺酮,这些胺酮在纯化和储存过程中不稳定。相反,用二芳基酮和胺的还原胺化法进行手性二芳基甲胺的不对称合成更为方便。
3.不对称转移加氢因其方便、避免压力容器和危险的氢气而成为加氢的另一种方法,同时过渡金属配合物与手性n
‑
甲苯磺酰基
‑
1,2
‑
二戊基乙二胺配合的noyori催化剂因其转化效率高而广泛应用。我组在各种合成方面取得了一些进展noyori型催化剂催化功能化手性醇的不对称转移加氢及相关的一锅串联反应。
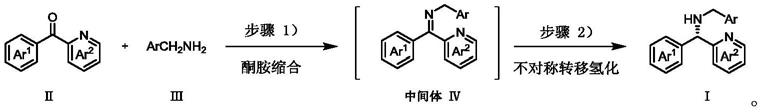
[0004][0005]
本发明利用一锅法逐步还原胺化芳基n
‑
杂芳基酮和苄基胺,不分离不稳定的胺酮,使用对甲苯磺酸作为催化剂生成亚胺,以手性铱配合物为催化剂,甲酸/三乙胺混合物为还原剂进行串联不对称转移氢化反应,得到ee含量高达99%的手性芳基n
‑
杂芳基甲胺。
技术实现要素:
[0006]
一种手性芳基n
‑
杂芳基甲胺及其制备方法,以廉价易得的芳基n
‑
杂芳基酮和苄基胺为原料,采用“两步一锅法”策略,不需要分离纯化中间体,直接合成手性芳基n
‑
杂芳基甲胺。本发明的技术方案根据手性二胺金属催化剂在其他亚胺底物的催化模式,本发明对手性偕二芳基甲胺的合成路径进行了推测。甲酸与催化剂上的氯形成氯化氢,并与三乙胺以
盐的形式离去。甲酸阴离子与金属铱形成共价键,此时形成了过渡态。在金属铱的作用下,甲酸阴离子分解为二氧化碳,形成了金属氢化物。底物酮经缩合后形成亚胺,添加物对甲基苯磺酸此时不仅起脱水的作用,又作为酸活化亚胺。在氢键和超共轭效应的作用下,底物与催化剂形成过渡态。随后,不稳定的过渡态进行了氢的转移,生成了目标产物,而此时过渡态在与甲酸阴离子的作用下,进行下一轮的催化。
[0007]
步骤1):该手性芳基n
‑
杂芳基甲胺以n
‑
杂芳基酮和苄基胺为原料,甲苯为溶剂,对甲苯磺酸为催化剂,进行了酮胺缩合生成中间体亚胺;步骤2):在中间体亚胺的混合体系中加入不对称转移氢化反应催化剂,氢源,不对称转移氢化得到手性芳基n
‑
杂芳基甲胺,反应式如下:
[0008][0009]
化合物ii中ar1选自r1是氢,甲基,乙基,烷基氧基,氟,氯,溴,碘,三氟甲基,羟基,硝基,氰基中的任意一种;化合物ii中ar2选自是氢,甲基,乙基,烷基氧基,氟,氯,溴,碘,三氟甲基,羟基,硝基,氰基中的任意一种;化合物iii中ar选自r3是氢,甲基,乙基,烷基氧基,氟,氯,溴,碘,三氟甲基,羟基,硝基,氰基中任意一种;
[0010]
步骤1中所述的催化剂,对甲苯磺酸为10mol%
‑
30mol%,优选20mol%。在本技术的添加量下反应更充分,废料剩余少。
[0011]
所述步骤1):酮胺缩合反应的温度为100
‑
130℃,反应时间为10
‑
14小时;优选反应温度为120℃,反应时间为12h;
[0012]
所述步骤2):不对称转移氢化反应所用的催化剂为(r,r)
‑
或(s,s)
‑
n
‑
单磺酰
‑
二芳基手性乙二胺与过渡金属钌或铑或者铱的配合物;其结构通式如式v所示,
[0013][0014]
所述结构通式v中,m为ru,或ph或ir;
[0015]
ar为苯基或对甲氧基、甲基取代的苯基、萘基;
[0016]
r为
‑
ch3、
‑
cf3、
‑
c6h5、4
‑
ch3c6h4、4
‑
cf3c6h4、4
‑
(t
‑
bu)
‑
c6h4‑
、3,4
‑
(ch3)2‑
c6h3‑
、4,6
‑
(ch3)3‑
c6h2‑
、2,6
‑
cl2‑
c6h3‑
、2,4,6
‑
(i
‑
pr)3‑
c6h2‑
、c6f5‑
、或萘基;
[0017]
l为苯、1,4
‑
二甲基苯、1
‑
甲基
‑4‑
异丙基苯、1,3,5
‑
三甲基苯、1,2,3,4,5
‑
五甲基苯、1,2,3,4,5,6
‑
六甲基苯或五甲基环戊二烯;
[0018]
x为cl、[otf]
‑
、[pf6]
‑
、[bf4]
‑
、[sbf6]
‑
或手性磷酸阴离子;
[0019]
所述步骤2):不对称转移氢化反应所用催化剂,进一步优选,代表性催化剂结构如下:
[0020][0021]
所述步骤2):不对称转移氢化反应所用氢源为甲酸钠、甲酸钾、甲酸/三乙胺的混合物,优选为:甲酸/三乙胺的混合物;
[0022]
所述步骤2):不对称转移氢化反应的温度为25
‑
50℃,反应时间为10
‑
15h,进一步优选为40℃,反应时间为12h。
[0023]
所述的二芳基酮、苄胺、对甲苯磺酸、不对称转移氢化反应催化剂、氢源的摩尔比为1:1
‑
2:0.1
‑
0.3:0.01
‑
0.05:1
‑
3;摩尔比进一步优选为为1:1.5:0.2:0.05:2.5。
[0024]
本发明成功实现了以芳基n
‑
杂芳基酮和苄基胺为原料,经对甲苯磺酸催化的酮胺缩合反应和手性二胺金属络合物催化的不对称转移氢化多组分不对称串联反应来制备手性芳基n
‑
杂芳基甲胺的新方法。通过一锅反应体系中甲苯磺酸和手性二胺金属络合物催化剂双接力催化作用来实现,第一步反应体系与后续不对称转移氢化反应和谐共生,对不对称转移氢化反应的产率和对映选择性没有影响,同时简化了后处理过程。
具体实施方式
[0025]
下面结合具体实施例,对本发明作进一步说明,但本发明并不限于以下实施例。
[0026]
实施例1:(s)
‑
n
‑
苄基
‑1‑
(吡啶
‑2‑
基)
‑1‑
(邻甲苯基)甲胺的不对称合成
[0027][0028]
将吡啶
‑2‑
基(邻甲苯基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到(s)
‑
n
‑
苄基
‑1‑
(吡啶
‑2‑
基)
‑1‑
(邻甲苯基)甲胺(40.4mg),收率70%,ee值为99%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=99:1(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=10.36min,t2=13.79min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=5.6hz,1h),7.65
–
7.60(m,2h),7.40
–
7.34(m,4h),7.29
–
7.24(m,3h),7.21
–
7.16(m,3h),5.37(s,1h),3.85(q,j=12.4hz,2h),2.34(s,3h);
13
c nmr(100mhz,cdcl3):δ=162.0,149.1,140.0,139.9,136.7,136.6,130.6,128.4,127.3,127.2,127.0,126.3,122.2,122.0,63.4,52.0,29.7。
[0029]
选用不同的反应条件时,结果列表1如下:
[0030][0031]
[0032]
本发明以0.2ml f/t(1.1/1,摩尔比)作为氢源,5mol%催化剂,35℃下反应24h为标准,对不同的催化剂进行筛选(表2
‑
2)。保持配体l1不变,对常用过渡金属ru、rh、ir进行筛选。发现金属钌或铑络合物不能对亚胺起到催化还原作用,仅金属铱催化剂对反应具有催化效果,得到51%收率和97%ee。而确定催化剂中心金属为铱之后,对不同配体进行了筛选(表1)。考虑到(s,s)
‑
1配体苯基上甲基有一定的供电子效应,随后筛选了吸电子基团(entry 4)和大位阻基团(entry 5)对反应的影响。实验结果显示,三氟甲氧基的电子效应和异丙基位阻效应对反应均能够表现出同等的对映选择性(ee值达99%),但后者在反应产率方面表现较好。紧接着,通过调整不同位置取代的吸电子基团(entries 6
–
8),探讨能否改变手性胺的产率。结果表明,芳基的二取代或三取代吸电子基团,能够提高反应的产率,但产物的ee值均有降低。于是本发明确定了最佳催化剂为(s,s)
‑
5(如实施例1中的序号1
‑
8中的条件筛选)。
[0033]
为分析催化剂用量对反应的影响,本发明降低催化剂用量(表2)。当催化剂(lr
‑
l3即为(s,s)
‑
5)的用量只有1mol%时(entry 1),得到手性化合物的对映选择性仅有38%;而当催化剂用量为3mol%时(entry 2),ee值提高到84%。这一结果表明催化剂用量不仅能够控制反应进行的快慢,还能控制对映选择性的高低。随后,对反应时间也进行筛选。当缩短反应时间至6h时(entry 3),产率和ee值略有降低。延长反应时间至12h时(entry 4),产率和ee值均有所提高。在此基础上,适当的升高反应温度至40℃时(entry 5),得到了75%的收率和99%的ee值。基于以上结果,最佳的反应条件(标准反应条件)被确定为:(1)底物酮(0.2mmol),苄胺(1.5eq.),对甲苯磺酸(0.2eq.),甲苯溶液(2ml)中120℃反应12h;(2)ir
‑
l3(5mol%),0.2ml的fa/tea(1.1/1)作氢源,40℃下反应12h。
[0034]
表2催化剂用量、时间和温度筛选
[0035][0036][0037]
实施例2:(s)
‑
n
‑
苄基
‑1‑
(2
‑
乙基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0038][0039]
将(2
‑
乙基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到(s)
‑
n
‑
苄基
‑1‑
(2
‑
乙基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(36.3mg),收率60%,ee值为85%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=5.34min,t2=5.80min。1h nmr(400mhz,cdcl3):δ=8.62(d,j=5.2hz,1h),7.67
–
7.60(m,2h),7.40
–
7.34(m,5h),7.30
–
7.23(m,4h),7.17(t,j=6.0hz,1h),5.32(s,1h),3.82(s,2h),2.85
–
2.76(m,1h),2.72
–
2.62(m,1h),1.17(t,j=7.6hz,3h)ppm;
13
c nmr(100mhz,cdcl3):δ=149.1,142.6,140.4,139.6,136.6,128.8,128.4,128.3,127.5,127.3,127.0,126.2,122.3,121.9,63.1,52.2,25.5,15.5ppm.
[0040]
实施例3:(s)
‑
n
‑
苄基
‑1‑
(2
‑
乙基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0041][0042]
将(2
‑
甲氧基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(2
‑
乙基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(43.2mg),收率71%,ee值为96%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=26.49min,t2=32.61min。1h nmr(400mhz,cdcl3):δ=8.61(d,j=4.8hz,1h),7.62(t,j=7.6hz,1h),7.51(d,j=7.6hz,1h),7.42
–
7.34(m,5h),7.29(t,j=8.0hz,2h),7.14(dd,j=8.4,5.2hz,1h),7.02(t,j=7.2hz,1h),6.93(d,j=8.4hz,1h),5.48(s,1h),3.84
–
3.82(m,5h)ppm;
13
c nmr(100mhz,cdcl3):δ=62.4,157.2,149.1,140.6,136.2,130.7,128.4,128.3,128.2,126.8,122.4,121.7,120.9,110.8,60.5,55.5,52.0ppm.
[0043]
实施例4:(s)
‑
n
‑
苄基
‑1‑
(2
‑
氟苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0044]
将(2
‑
氟苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(2
‑
氟苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(43.8mg),收率75%,ee值为98%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=7.68min,t2=8.22min。1h nmr(400mhz,cdcl3):δ=8.63(d,j=4.8hz,1h),7.64(q,j=8.0hz,3h),7.40
–
7.33(m,5h),7.32
–
7.24(m,2h),7.19(dd,j=12.4,8.0hz,2h),5.52(s,1h),3.83(dd,j=19.6,12.8hz,2h)ppm;
13
c nmr(100mhz,cdcl3):δ=160.9,149.4,141.3,140.1,136.5,132.9,129.6,128.8,128.4,128.3,127.9,127.0,124.8,122.6,122.2,65.5,52.0ppm.
[0045]
实施例5:(s)
‑
n
‑
苄基
‑1‑
(2
‑
氯苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0046][0047]
将(2
‑
氯苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(2
‑
氯苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(40.1mg),收率65%,ee值为87%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=6.67min,t2=7.62min。1h nmr(400mhz,cdcl3):δ=8.63(s,1h),7.66(dd,j=21.6,7.6hz,3h),7.40
–
7.36(m,7h),7.27
–
7.20(m,1h),7.20
–
7.17(m,1h),5.56(s,1h),3.87(s,2h)ppm;
13
c nmr(100mhz,cdcl3):δ=161.0,149.4,140.3,140.1,139.7,136.5,134.1,129.6,129.3,128.4,128.2,127.2,127.0,122.5,122.2,63.0,53.2ppm.
[0048]
实施例6:(s)
‑
n
‑
苄基
‑1‑
(2
‑
溴苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0049]
[0050]
将(2
‑
溴苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(2
‑
溴苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(48.0mg),收率68%,ee值为96%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=7.44min,t2=9.25min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=4.4hz,1h),7.65(dd,j=18.4,8.0hz,2h),7.42
–
7.37(m,5h),7.36
–
7.29(m,3h),7.27
–
7.22(m,1h),7.19(dd,j=7.6,5.2hz,1h),5.55(s,1h),3.83(d,j=20.0,12.8hz,2h)ppm;
13
c nmr(100mhz,cdcl3):δ=160.9,149.4,140.1,139.7,136.5,134.0,129.6,129.3,128.4,128.3,127.2,127.0,122.5,122.2,100.0,63.0,51.9ppm.
[0051]
实施例7:(s)
‑
n
‑
苄基
‑1‑
(萘
‑1‑
基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0052][0053]
将萘
‑1‑
基(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(萘
‑1‑
基)
‑1‑
(吡啶
‑2‑
基)甲胺(48.0mg),收率74%,ee值为88%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=8.86min,t2=10.10min。1h nmr(400mhz,cdcl3):δ=8.67(d,j=4.8hz,1h),8.25(d,j=6.4hz,1h),7.91(d,j=8.0hz,1h),7.86
–
7.81(m,2h),7.60
–
7.55(m,2h),7.50(t,j=4.0hz,2h),7.43
–
7.36(m,4h),7.33
–
7.27(m,2h),7.18(dd,j=7.2,4.8hz,1h),5.82(s,1h),3.92(dd,j=24.0,12.8hz,2h)ppm;
13
c nmr(100mhz,cdcl3):δ=162.3,149.0,140.4,137.9,136.6,134.1,131.8,128.8,128.5,128.4,128.1,127.0,126.0,125.6,125.5,125.4,124.1,122.5,122.1,64.1,52.3ppm.
[0054]
实施例8:(s)
‑
n
‑
苄基
‑1‑
(4
‑
甲基吡啶
‑2‑
基)
‑1‑
(邻甲苯基)甲胺的不对称合成
[0055]
将(4
‑
甲基吡啶
‑2‑
基)(邻甲苯基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却
后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(4
‑
甲基吡啶
‑2‑
基)
‑1‑
(邻甲苯基)甲胺(38.7mg),收率64%,ee值为82%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=9.03min,t2=10.61min。1hnmr(400mhz,cdcl3):δ=8.41(d,j=5.0hz,1h),7.57(d,j=7.1hz,1h),7.36
–
7.26(m,6h),7.25
–
7.20(m,2h),7.19
–
7.12(m,2h),7.01(s,1h),6.94(d,j=4.5hz,1h),5.17(s,1h),3.81
–
3.71(m,2h),2.29(s,3h),2.26(s,3h)ppm;
13
c nmr(100mhz,cdcl3):δ=161.95,148.81,147.72,140.40,136.63,130.57,128.45,128.37,128.22,127.26,127.03,126.93,126.28,123.07,123.00,77.38,77.06,76.75,63.49,52.11,21.18,19.67ppm.
[0056]
实施例9:(s)
‑
n
‑
苄基
‑1‑
(5
‑
甲基吡啶
‑2‑
基)
‑1‑
(邻甲苯基)甲胺的不对称合成
[0057][0058]
将(5
‑
甲基吡啶
‑2‑
基)(邻甲苯基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(5
‑
甲基吡啶
‑2‑
基)
‑1‑
(邻甲苯基)甲胺(38.1mg),收率63%,ee值为72%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:254nm,温度:30℃,t1=7.76min,t2=9.16min。1h nmr(400mhz,cdcl3):δ=8.44(d,j=2.2hz,1h),7.62(dd,j=7.5,1.3hz,1h),7.43(dd,j=8.1,2.3hz,1h),7.39
–
7.35(m,4h),7.34
–
7.24(m,2h),7.23
–
7.16(m,2h),7.14(d,j=8.0hz,1h),5.22(s,1h),3.86
–
3.76(m,2h),2.33(d,j=1.6hz,6h)ppm;
13
c nmr(100mhz,cdcl3):δ=159.30,149.42,140.44,137.18,136.57,131.31,130.56,128.44,128.36,128.20,127.21,127.00,126.91,126.26,121.69,63.31,52.10,19.62,18.12ppm.
[0059]
实施例10:(s)
‑
n
‑
苄基
‑1‑
(喹啉
‑2‑
基)
‑1‑
(邻甲苯基)甲胺的不对称合成
[0060][0061]
将喹啉
‑2‑
基(邻甲苯基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油
nmr(400mhz,cdcl3):δ=8.62(d,j=4.1hz,1h),7.66(td,j=7.7,1.8hz,1h),7.40
–
7.34(m,6h),7.33
–
7.30(m,1h),7.30
–
7.25(m,2h),7.21
–
7.17(m,1h),7.02
–
6.95(m,1h),5.01(s,1h),3.86
–
3.75(m,2h)ppm;
13
c nmr(100mhz,cdcl3):δ=164.32,161.89,149.33,145.27(d,3j
c
‑
f
=6.8hz),140.07,136.75,130.02(d,3j
c
‑
f
=8.2hz),128.45,128.30,127.06,123.53(d,4j
c
‑
f
=2.8hz),122.27,121.98,114.57(d,2j
c
‑
f
=21.8hz),114.29(d,2j
c
‑
f
=21.2hz),66.97(d,4j
c
‑
f
=1.8hz),51.73ppm;
19
f nmr(400mhz,cdcl3):δ=
‑
112.82ppm.
[0068]
实施例13:(s)
‑
n
‑
苄基
‑1‑
(3
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0069][0070]
将(3
‑
甲氧基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(3
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(46.3mg),收率76%,ee值为45%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=9.94min,t2=10.49min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=5.2hz,1h),7.63(t,j=7.6hz,1h),7.41
–
7.34(m,5h),7.29(t,j=8.0hz,2h),7.17(dd,j=7.6,4.8hz,1h),7.10(s,2h),6.85(d,j=8.4hz,1h),5.00(s,1h),3.86
–
3.77(m,5h)ppm;
13
c nmr(400mhz,cdcl3):δ=162.4,159.9,149.1,144.2,140.3,136.6,129.6,128.4,128.3,126.9,122.1,122.0,120.3,113.2,112.9,67.5,55.2,51.8ppm.
[0071]
实施例14:(s)
‑
n
‑
苄基
‑1‑
(4
‑
氟苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0072][0073]
将(4
‑
氟苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(4
‑
氟苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(41.5mg),收率71%,ee值为40%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=95:5(v/v),流速1.0ml/min,波长:254nm,温度:25℃,t1=10.15min,t2=12.01min。1h nmr(400mhz,cdcl3):δ=8.61(d,j=4.1hz,1h),7.65(td,j=7.7,1.9hz,1h),7.52
–
7.45(m,2h),7.40
–
7.33(m,5h),7.32
–
7.29(m,1h),7.20
–
7.17(m,1h),7.11
–
7.02(m,2h),5.00(s,1h),3.80(d,j=7.4hz,2h),2.43(brs,1h)ppm;
13
c nmr(100mhz,cdcl3):δ=163.33,
162.31,160.89,149.29,140.16,138.32,136.70,129.38(d,3j
c
‑
f
=8.0hz),128.44,128.29,127.03,122.01(d,2j
c
‑
f
=27.2hz),115.42(d,2j
c
‑
f
=21.3hz),66.72,51.72ppm;
19
f nmr(400mhz,cdcl3):δ=
–
115.38ppm.
[0074]
实施例15:(s)
‑
n
‑
苄基
‑1‑
(4
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0075][0076]
将(4
‑
甲氧基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(4
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(43.8mg),收率72%,ee值为20%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=16.40min,t2=19.43min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=4.8hz,1h),7.63(t,j=8.0hz,1h),7.44
–
7.41(m,2h),7.38
–
7.34(m,5h),7.30
–
7.28(m,1h),7.16(dd,j=7.2,4.8hz,1h),6.92(d,j=8.8hz,2h),4.98(s,1h),3.84
–
3.75(m,5h)ppm;
13
c nmr(100mhz,cdcl3):δ=162.8,158.8,149.1,140.4,136.6,134.7,128.9,128.4,128.3,127.0,121.9,121.8,114.0,66.8,55.3,51.7ppm.
[0077]
实施例16:(s)
‑
n
‑
苄基
‑1‑
(3,5
‑
二(三氟甲基)苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0078][0079]
将(3,5
‑
二(三氟甲基)苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(3,5
‑
二(三氟甲基)苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(49.2mg),收率60%,ee值为70%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=4.63min,t2=5.51min。1h nmr(400mhz,cdcl3):δ=8.64(d,j=4.8hz,1h),7.99(s,2h),7.80(s,1h),7.71(t,j=8.0hz,1h),7.34
–
7.32(m,6h),7.25(dd,j=7.6,4.8hz,1h),5.10(s,1h),3.80(s,2h)ppm;
13
c nmr(400mhz,cdcl3):δ=160.7,149.8,145.4,139.5,137.1,131.7(d,2j
c
‑
f
=24.8hz),128.4(d,2j
c
‑
f
=20.1hz),128.1,127.3,123.1(d,1j
c
‑
f
=247.7hz),122.8,122.0,
66.6,51.8ppm.
[0080]
实施例17:(s)
‑
n
‑
苄基
‑1‑
(3,5
‑
二甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0081][0082]
将(3,5
‑
二甲氧基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、苄胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
苄基
‑1‑
(3,5
‑
二甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(50.1mg),收率75%,ee值为54%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=10.33min,t2=11.44min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=4.8hz,1h),7.63(td,j=7.6,2.0hz,1h),7.41
–
7.34(m,5h),7.31
–
7.27(m,1h),7.16(dd,j=7.2,4.8hz,1h),6.70(s,2h),6.40(s,1h),4.94(s,1h),3.83(dd,j=25.4,13.4hz,2h),3.81(s,6h)ppm;
13
c nmr(400mhz,cdcl3):δ=162.2,160.9,149.1,145.0,140.3,136.6,128.4,128.3,126.9,122.1,122.0,105.7,99.3,67.6,55.4,51.8ppm.
[0083]
实施例18:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
苯基
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0084][0085]
将苯基(吡啶
‑2‑
基)甲酮(0.2mmol)、(2,6
‑
二甲基苯基)甲胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
苯基
‑1‑
(吡啶
‑2‑
基)甲胺(36.3mg),收率60%,ee值为90%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=95:5(v/v),流速1.0ml/min,波长:260nm,温度:30℃,t1=5.37min,t2=5.70min。1h nmr(400mhz,cdcl3):δ=8.60(dt,j=4.8,1.2hz,1h),7.66(td,j=8.0,1.2hz,1h),7.55(d,j=8.0hz,2h),7.44(d,j=7.6hz,1h),7.38(t,j=7.6hz,2h),7.32
–
7.28(m,1h),7.19
–
7.16(m,1h),7.12
–
7.08(m,1h),7.04(d,j=8.4hz,2h),5.10(s,1h),3.76(d,j=1.6hz,2h),2.39(s,6h)ppm;
13
c nmr(100mhz,cdcl3):δ=162.8,149.1,142.7,137.3,136.7,136.6,128.5,128.2,127.8,127.4,127.1,122.1,121.7,69.5,46.8,19.6ppm.
[0086]
实施例19:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
(3
‑
氟苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0087]
将(3
‑
氟苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、(2,6
‑
二甲基苯基)甲胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
(3
‑
氟苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(46.1mg),收率72%,ee值为45%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=95:5(v/v),流速1.0ml/min,波长:260nm,温度:25℃,t1=6.23min,t2=7.30min。1h nmr(400mhz,cdcl3):δ=8.61(d,j=4.4hz,1h),7.68(td,j=7.7,1.8hz,1h),7.41(d,j=7.9hz,1h),7.38
–
7.27(m,3h),7.22
–
7.19(m,1h),7.15
–
7.04(m,3h),7.02
–
6.99(m,1h),5.08(s,1h),3.77(s,2h),2.40(s,6h),2.34(s,1h)ppm;
13
c nmr(100mhz,cdcl3):δ=163.1(d,1j
c
‑
f
=245.9hz),162.2,149.2,145.5(d,2j
c
‑
f
=6.8hz),137.3,136.7,136.5,130.0(d,2j
c
‑
f
=8.1hz),128.2,127.1,123.5(d,3j
c
‑
f
=2.8hz),122.3,121.8,114.6,114.4(d,3j
c
‑
f
=3.0hz),114.2,68.9(d,4j
c
‑
f
=1.8hz),46.7,19.6ppm.
[0088]
实施例20:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
(3
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成
[0089][0090]
将(3
‑
甲氧基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、(2,6
‑
二甲基苯基)甲胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
(3
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(45.8mg),收率69%,ee值为51%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=95:5(v/v),流速1.0ml/min,波长:260nm,温度:25℃,t1=7.84min,t2=9.44min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=4.3hz,1h),7.66(td,j=7.7,1.8hz,1h),7.44(d,j=7.9hz,1h),7.33
–
7.29(m,1h),7.22
–
7.04(m,6h),6.89
–
6.83(m,1h),5.08(s,1h),3.84(s,3h),3.79(d,j=5.6hz,1h),2.66(brs,1h),2.42(s,6h)ppm;
13
cnmr(100mhz,cdcl3):δ=162.65,159.84,149.02,144.36,137.31,136.66,
129.53,128.19,127.07,122.12,121.77,120.21,113.07,113.05,69.40,55.24,46.81,19.66ppm.
[0091]
实施例21
[0092]
(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
(4
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺的不对称合成将(4
‑
甲氧基苯基)(吡啶
‑2‑
基)甲酮(0.2mmol)、(2,6
‑
二甲基苯基)甲胺(0.3mmol)、对甲苯磺酸(0.04mmol)和甲苯(2ml)加入10ml玻璃管中。在120℃下搅拌反应混合物12h,反应完成并在室温下冷却后,加入(s,s)
‑
5(0.01mmol)和甲酸
‑
三乙胺共沸物(摩尔比甲酸:三乙胺=1.1/1,0.2ml)。用氮气置换3次,在40℃下搅拌12h。反应完成后,在反应混合物中加入饱和nahco3水溶液,用乙酸乙酯(3
×
5ml)萃取混合物。有机层在na2so4上干燥,真空蒸发。硅胶柱层析分离(石油醚/乙酸乙酯=10:1),得到:(s)
‑
n
‑
(2,6
‑
二甲基苄基)
‑1‑
(4
‑
甲氧基苯基)
‑1‑
(吡啶
‑2‑
基)甲胺(50.5mg),收率76%,ee值为48%。hplc分离条件:手性柱ia
‑
h柱,流动相正己烷/2
‑
丙醇=98:2(v/v),流速1.0ml/min,波长:254nm,温度:25℃,t1=11.19min,t2=12.45min。1h nmr(400mhz,cdcl3):δ=8.60(d,j=4.2hz,1h),7.66(td,j=7.7,1.8hz,1h),7.50
–
7.41(m,3h),7.19
–
7.16(m,1h),7.14
–
7.02(m,3h),6.97
–
6.90(m,2h),5.05(s,1h),3.84(s,3h),3.77(d,j=2.7hz,2h),2.41(s,6h)ppm;
13
c nmr(100mhz,cdcl3):δ=163.09,158.91,149.06,137.29,136.74,136.60,134.92,128.82,128.17,127.02,121.98,121.61,113.93,68.83,55.27,46.75,19.64ppm.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1