高效水解白酒丢糟的混合菌酶液的制备方法与流程
1.本发明属于白酒丢糟再利用领域,涉及一种高效水解白酒丢糟的混合菌酶液的制备方法。
背景技术:
2.白酒丢糟是酒糟的一种,是谷物等经过反复发酵及蒸馏提取酒精后营养贫瘠的谷物外壳及残留渣体,水分、纤维素含量高,但粗蛋白、粗脂肪等含量较酒糟低,丢糟中纤维素本身是极具开发潜力的物质,经水解后可转化为葡萄糖单糖。但由于丢糟的纤维素,半纤维、木质素这3种大分子物质构成致密结构——木质纤维素,组成了抗水解屏障,并且纤维素被半纤维素及木质素包裹,使得纤维素难以被水解。
3.2018年11月30日的专利cn108913604a公开了一种白酒丢糟的高效水解菌株的筛选方法,包括:菌种库中相关水解白酒丢糟可能水解白酒丢糟的有效真菌、从白酒丢糟堆放环境中直接分离培养真菌;将筛选出来的真菌以白酒丢糟中难以水解的单一聚合物为唯一碳源,依次通过羧甲基纤维素钠—刚果红培养基、pda—苯胺蓝培养基、木聚糖—刚果红培养基进行初步筛选;将菌株在以白酒丢糟为唯一营养物质的丢糟液中培养,判断菌株对丢糟水解能力;将复合菌组在白酒丢糟液中进行酶活力测试,筛选具有协同作用、酶活力高的菌组即为高效复合水解菌组。但该方法所采用的培养基较多,方法较为复杂;其以白酒丢糟中难以水解的单一聚合物为唯一碳源,只能对白酒丢糟进行基本的水解,其水解性能较差。
4.有研究表明纤维素主要由成千上万个d
‑
吡喃型葡萄糖残基经β
‑
1,4糖苷键联结而成的大分子链状聚合体,从而使丢糟的转化受到极大的限制。且丢糟酸度大,水分含量较高,极易腐败变质造成环境污染。现有菌株对白酒丢糟的水解效果较差,酶解工艺成本较高,因此研究一种能高效水解白酒丢糟的方法很有必要。
技术实现要素:
5.本发明所要解决的技术问题是现有菌株对白酒丢糟的水解效果较差,酶解工艺成本较高的问题。
6.本发明解决其技术问题所采用的技术方案是:高效水解白酒丢糟的混合菌酶液的制备方法,包括如下步骤:
7.a.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用以白酒丢糟为碳源的筛选培养基进行筛选富集,经分离纯化后得到菌样;
8.b.将步骤a得到的菌样活化后进行发酵培养,然后将其浸提,抽滤,离心后得到菌酶液a,将菌酶液a用于白酒丟糟的酶解,筛选得到h菌(里氏木霉属),经发酵制得h菌酶液,h菌酶液酶活为5.0
‑
5.8iu/ml;
9.c.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用以h菌酶液酶解后的白酒丟糟为碳源的筛选培养基进行筛选富集,经分离纯化后得到菌样;
10.d.将步骤c得到的菌样活化后进行发酵培养,然后将其浸提,抽滤,离心后得到菌
酶液b,将菌酶液b与h菌酶液按1∶5
‑
15的体积比混合后用于白酒丟糟的酶解,筛选得到l菌(黑曲霉属),经发酵制得l菌酶液,l菌酶液酶活为0.70
‑
0.78iu/ml;
11.e.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用以h菌酶液和l菌酶液共同酶解的白酒丟糟为碳源的筛选培养基进行筛选富集,经分离纯化后得到菌样;
12.f.将步骤e得到的菌样活化后进行发酵培养,然后将其浸提,抽滤,离心后得到菌酶液c,将菌酶液c、h菌酶液和l菌酶液按1∶10
‑
20:1
‑
10的体积比混合后用于白酒丟糟的酶解,筛选得到m菌(毛霉属),经发酵制得m菌酶液,m菌酶液酶活为0.45
‑
0.49iu/ml;
13.g.将h菌酶液、l菌酶液和m菌酶液按照15
‑
17∶2
‑
4∶1的体积比混合均匀,得到提高白酒丢糟水解性能的混合菌酶液。
14.上述步骤a中,所述以白酒丢糟为碳源的筛选培养基的主要成分为:白酒丢糟1
‑
1.3%,(nh4)2so40.3
‑
0.5%,mgso40.04
‑
0.06%,kh2po40.08
‑
0.12%,蛋白胨0.1
‑
0.15%,nacl0.05
‑
0.07%。
15.上述步骤c中,所述以h菌酶解后的白酒丟糟为碳源的筛选培养基的主要成分为:经h菌酶液酶解后的白酒丢糟1
‑
1.3%,(nh4)2so40.3
‑
0.5%,mgso40.04
‑
0.06%,kh2po40.1
‑
0.15%,蛋白胨0.1
‑
0.15%,nacl 0.05
‑
0.07%。
16.上述步骤e中,将h菌酶液和l菌酶液按3
‑
5∶1的体积比混合后共同酶解白酒丟糟,所述以h菌酶液和l菌酶液共同酶解的白酒丟糟为碳源的筛选培养基的主要成分为:经h菌酶液和l菌酶液共同酶解的白酒丟糟1
‑
1.3%,(nh4)2so40.3
‑
0.5%,mgso40.04
‑
0.06%,kh2po40.1
‑
0.15%,蛋白胨0.1
‑
0.15%,nacl 0.05
‑
0.07%。
17.上述步骤b、d、f任一项中,采用固体发酵培养基进行发酵培养,活化菌样的接种量为固体发酵培养基的9
‑
11%。
18.进一步的是,上述固体发酵培养基由白酒丟糟与盐溶液按照质量体积比1∶1.3
‑
1.7g/ml混合,所述盐溶液的成分为:(nh4)2so40.9
‑
1.1%,nano31.9
‑
2.1%、kh2po40.9
‑
1.1%、cacl20.1
‑
0.15%、mgso40.1
‑
0.15%,豆饼粉0.9
‑
1.1%,其余为水。
19.上述步骤b、d、f任一项中,浸提的方法为:将发酵后的菌样与ph4.8
‑
5.2的柠檬酸缓冲液按1∶9
‑
11g/ml的质量体积比混合后浸提。
20.进一步的是,在28
‑
30℃,175
‑
185rpm的条件下浸提1.8
‑
2.2h。
21.上述步骤a、c、e任一项中,用马铃薯葡萄糖琼脂(pda)培养基进行分离纯化,马铃薯葡萄糖琼脂培养基的主要成分为:马铃薯18
‑
22%,葡萄糖2
‑
3%,琼脂0.13
‑
0.17%。
22.上述步骤b、d、f任一项中,利用种子液培养基将菌样活化,种子液培养基的主要成分为:口服葡萄糖0.35
‑
0.45%,(nh4)2so40.35
‑
0.4%,mgso40.03
‑
0.05%,kh2po40.1
‑
0.12%,cacl20.04
‑
0.05%,酵母提取物0.05
‑
0.07%,蛋白胨0.18
‑
0.22%。
23.本发明的有益效果是:本发明分别从窖泥、丟糟、酒厂周边环境土壤中取样,在制备h菌(里氏木霉属)时利用白酒丢糟作为富集培养过程的碳源,既筛选了能利用白酒丢糟的菌种,同时也提高了菌株对白酒丢糟的选择适应能力;而后续制备l菌(黑曲霉属)和m菌(毛霉属)时,本发明分别经h菌酶液酶解后的白酒丢糟、经h和l菌酶液共同酶解后的白酒丢糟作为富集培养基的唯一碳源,可筛选出能继续利用经过h菌酶解后、经h和l菌酶液共同酶解后的营养相对贫瘠的丢糟,进而筛选出能与h菌协同作用的菌种l、与h和l菌协同作用的菌种m,使白酒丢糟进一步水解,极大提高了水解白酒丢糟的能力。
24.另外,在设计筛选培养基时,除了碳源的设计,本发明还考虑到白酒丢糟本身的酸性和代谢过程产酸,还降低了培养基中缓冲液kh2po4的用量(由常规培养的0.2%,降低至0.08
‑
0.12%);另外还添加了nacl,可维持微生物培养所需要的渗透压。
25.同时本发明采用的固体发酵培养基,创意地使用白酒丢糟为固体介质,为培养基发酵唯一碳源;为了提高细胞膜的通透性,加强微生物胞外酶的释放还特别添加了cacl2,其也是多种酶的激活剂;而豆饼粉能为微生物发酵提供氮源和生长因子,且豆饼粉价格便宜,降低了工艺成本。
26.本发明通过筛选、富集、培养,获得对丢糟降解具有协同作用的h菌(里氏木霉属)、l菌(黑曲霉属)和m菌(毛霉属),并通过发酵分别制得将h菌酶液、l菌酶液和m菌酶液。通过三种菌酶液的配合使用,可以增强酶系间的配伍,达到相互促进的作用,改变底物的结构,暴露更多的接触位点,使得底物更易于酶接近,从而进一步的提高白酒丢糟的水解效果,同时显著降低酶液用量,进而降低酶解工艺的成本。
具体实施方式
27.本发明的技术方案,具体可以按照以下方式实施。
28.高效水解白酒丢糟的混合菌酶液的制备方法,包括如下步骤:
29.a.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用以白酒丢糟为碳源的筛选培养基进行筛选富集,经分离纯化后得到菌样;
30.b.将步骤a得到的菌样活化后进行发酵培养,然后将其浸提,抽滤,离心后得到菌酶液a,将菌酶液a用于白酒丟糟的酶解,筛选得到h菌,经发酵制得h菌酶液,h菌酶液酶活为5.0
‑
5.8iu/ml;
31.c.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用以h菌酶液酶解后的白酒丟糟为碳源的筛选培养基进行筛选富集,经分离纯化后得到菌样;
32.d.将步骤c得到的菌样活化后进行发酵培养,然后将其浸提,抽滤,离心后得到菌酶液b,将菌酶液b与h菌酶液按1∶5
‑
15的体积比混合后用于白酒丟糟的酶解,筛选得到l菌,经发酵制得l菌酶液,l菌酶液酶活为0.70
‑
0.78iu/ml;
33.e.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用以h菌酶液和l菌酶液共同酶解的白酒丟糟为碳源的筛选培养基进行筛选富集,经分离纯化后得到菌样;
34.f.将步骤e得到的菌样活化后进行发酵培养,然后将其浸提,抽滤,离心后得到菌酶液c,将菌酶液c、h菌酶液和l菌酶液按1∶10
‑
20∶1
‑
10的体积比混合后用于白酒丟糟的酶解,筛选得到m菌,经发酵制得m菌酶液,m菌酶液酶活为0.45
‑
0.49iu/ml;
35.g.将h菌酶液、l菌酶液和m菌酶液按照15
‑
17∶2
‑
4∶1的体积比混合均匀,得到能提高白酒丢糟水解性能的混合菌酶液。
36.为了筛选了能利用白酒丢糟的菌种,同时提高菌株对白酒丢糟的选择适应能力,因此优选的是,上述步骤a中,所述以白酒丢糟为碳源的筛选培养基的主要成分为:白酒丢糟1
‑
1.3%,(nh4)2so40.3
‑
0.5%,mgso40.04
‑
0.06%,kh2po40.08
‑
0.12%,蛋白胨0.1
‑
0.15%,nacl0.05
‑
0.07%。
37.为了筛选了能与h菌协同作用的菌种,进一步提高菌种的水解能力,因此优选的是,上述步骤c中,所述以h菌酶解后的白酒丟糟为碳源的筛选培养基的主要成分为:经h菌
酶液酶解后的白酒丢糟1
‑
1.3%,(nh4)2so40.3
‑
0.5%,mgso40.04
‑
0.06%,kh2po40.1
‑
0.15%,蛋白胨0.1
‑
0.15%,nacl 0.05
‑
0.07%。
38.为了筛选了能与h菌和l菌协同作用的菌种,更进一步提高菌种的水解能力,因此优选的是,上述步骤e中,将h菌酶液和l菌酶液按3
‑
5∶1的体积比混合后共同酶解白酒丟糟,所述以h菌酶液和l菌酶液共同酶解的白酒丟糟为碳源的筛选培养基的主要成分为:经h菌酶液和l菌酶液共同酶解的白酒丟糟1
‑
1.3%,(nh4)2so40.3
‑
0.5%,mgso40.04
‑
0.06%,kh2po40.1
‑
0.15%,蛋白胨0.1
‑
0.15%,nacl 0.05
‑
0.07%。
39.为了得到水解能力更好的菌种同时降低生产成本,因此优选的是,上述步骤b、d、f任一项中,采用固体发酵培养基进行发酵培养,活化菌样的接种量为固体发酵培养基的9
‑
11%,更优选的是,上述固体发酵培养基由白酒丟糟与盐溶液按照质量体积比1∶1.3
‑
1.7g/ml混合,所述盐溶液的成分为:(nh4)2so40.9
‑
1.1%,nano31.9
‑
2.1%、kh2po40.9
‑
1.1%、cacl20.1
‑
0.15%、mg
s
o40.1
‑
0.15%,豆饼粉0.9
‑
1.1%,其余为水。
40.柠檬酸作为抗氧化剂和防腐剂,可以保护纤维素的酶活,因此优选的是,上述步骤b、d、f任一项中,浸提的方法为:将发酵后的菌样与ph4.8
‑
5.2的柠檬酸缓冲液按1∶9
‑
11g/ml的质量体积比混合后浸提;为了提高浸提率,更优选的是,在28
‑
30℃,175
‑
185rpm的条件下浸提1.8
‑
2.2h。
41.为了达到更好的实验效果,因此优选的是,上述步骤a、c、e任一项中,用马铃薯葡萄糖琼脂(pda)培养基进行分离纯化,马铃薯葡萄糖琼脂培养基的主要成分为:马铃薯18
‑
22%,葡萄糖2
‑
3%,琼脂0.13
‑
0.17%。
42.为了保证微生物生长所需的碳源、氮源、无机盐、生长因子,因此优选的是,上述步骤b、d、f任一项中,利用种子液培养基将菌样活化,种子液培养基的主要成分为:口服葡萄糖0.35
‑
0.45%,(nh4)2so40.35
‑
0.4%,mgso40.03
‑
0.05%,kh2po40.1
‑
0.12%,cacl20.04
‑
0.05%,酵母提取物0.05
‑
0.07%,蛋白胨0.18
‑
0.22%。
43.下面通过实际的例子对本发明的技术方案和效果做进一步的说明。
44.实施例
45.(1)混合菌酶液的制备,包括如下步骤:
46.a.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用筛选培养基i进行筛选富集,用马铃薯葡萄糖琼脂(pda)培养基进行分离纯化;将分离纯化后的菌样,利用种子液培养基活化后,然后按照10%的接种量,接种至固体发酵培养基,进行发酵培养;发酵结束后,将发酵后的菌样与ph5.0的柠檬酸缓冲液按1∶10g/ml的质量体积比混合在28℃,180rpm条件下浸提2h,抽滤,离心,得菌酶液a;将菌酶液a用于白酒丟糟的酶解,筛选得到水解效果较好的h菌,经发酵制得h菌酶液,经iupac公布的滤纸酶活力的测定方法,该h菌的酶液酶活为5.4iu/ml;
47.b.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用筛选培养基ii进行筛选富集,用马铃薯葡萄糖琼脂培养基进行分离纯化;将分离纯化后的菌样,利用种子液培养基活化后,然后按照10%的接种量,接种至固体发酵培养基,进行发酵培养;发酵结束后,将发酵后的菌样与ph5.0的柠檬酸缓冲液按1∶10g/ml的质量体积比混合在28℃,180rpm条件下浸提2h,抽滤,离心,得菌酶液b;将菌酶液b与h菌酶液按1∶10的体积比混合后用于白酒丟糟的酶解,筛选得到l菌,经发酵制得l菌酶液,l菌酶液酶活为0.78iu/ml;
48.c.分别从窖泥、丟糟、酒厂周边环境土壤中取样,用筛选培养基iii进行筛选富集,用马铃薯葡萄糖琼脂培养基进行分离纯化;将分离纯化后的菌样,利用种子液培养基活化后,然后按照10%的接种量,接种至固体发酵培养基,进行发酵培养;发酵结束后,将发酵后的菌样与ph5.0的柠檬酸缓冲液按1∶10g/ml的质量体积比混合在28℃,180rpm条件下浸提2h,抽滤,离心,得菌酶液c;将菌酶液c、h菌酶液和l菌酶液按1∶15∶5的体积比混合后用于白酒丟糟的酶解,筛选得到m菌,经发酵制得m菌酶液m菌酶液酶活为0.47iu/ml;
49.d.将h菌酶液、l菌酶液和m菌酶液按照15
‑
17∶2
‑
4∶1的体积比混合均匀,得到混合菌酶液。
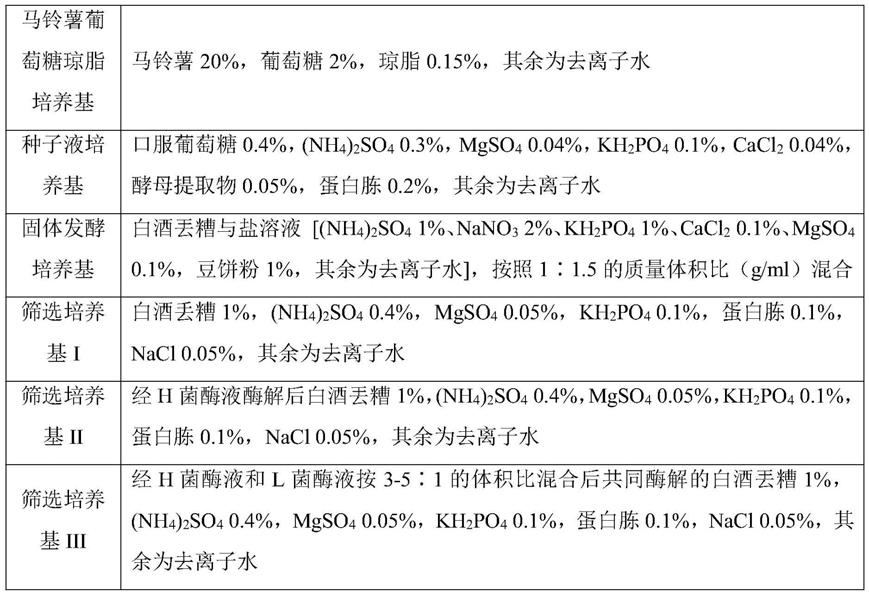
50.上述实验中采用的培养基配方如表1所示。
51.表1培养基配方
[0052][0053]
(2)本发明提供2组采用本发明制备的混合菌酶液水解白酒丢糟的实施例1、2,提供1组仅采用单一h菌酶液水解白酒丢糟的对比例3,三组实验采用的菌酶液成分如表2所示。
[0054]
表2实施例采用的菌酶液成分
[0055]
实施例1h菌酶液:l菌酶液:m菌酶液为16∶3∶1实施例2h菌酶液:l菌酶液:m菌酶液为15∶4∶1对比例1h菌酶液
[0056]
实施例1
[0057]
a.丟糟处理:将白酒丟糟用自来水漂洗,经抽滤后,烘干,得干燥丢糟;
[0058]
b.丢糟的酶解:将干燥丢糟与混合酶液按照1:10g/ml的质量体积比混合后,在50℃,140rpm条件下恒温震荡64h,抽滤后得酶解糖液;
[0059]
c.检验:经检验酶解糖液还原糖浓度为50g/l,对应每g干丢糟可产生0.54g的还原
糖。
[0060]
实施例2
[0061]
a.丟糟处理:将白酒丟糟用自来水漂洗,经抽滤后,烘干,得干燥丢糟;
[0062]
b.丢糟的酶解:将干燥丢糟与混合酶液按照1:10g/ml的质量体积比混合后,在50℃,140rpm条件下恒温震荡72h,抽滤后得酶解糖液;
[0063]
c.检验:经检验酶解糖液还原糖浓度为47g/l,对应每g干丢糟可产生0.51g的还原糖。
[0064]
对比例1
[0065]
a.丟糟处理:将白酒丟糟用自来水漂洗,经抽滤后,烘干,得干燥丢糟;
[0066]
b.丢糟的酶解:将干燥丢糟与h菌酶液按照1:10g/ml的质量体积比混合后,在50℃,140rpm条件下恒温震荡72h,抽滤后得酶解糖液;
[0067]
c.检验:经检验酶解糖液还原糖浓度为43g/l,对应每g干丢糟可产生0.47g的还原糖。
[0068]
由实施例1、2与对比例1可知,采用本发明制备的混合菌酶液水解白酒丢糟可生产更多的还原糖,本发明制备的混合菌酶液可有效提高白酒丢糟的水解效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1