一种含氧杂卓并咔唑结构化合物及其应用的制作方法
1.本发明涉及一种含氧杂卓并咔唑结构化合物及其应用,属于有机电致发光材料技术领域。
背景技术:
2.oled(有机发光二极管)是一种自发光固体材料,相比于其他的发光材料,具有视角宽,对比度高,响应时间短,发光亮度优异,驱动电压低,响应速度快等特征,被业内人士称为“梦幻般的显示技术”,是最有发展前景的新型显示技术之一,也是国际上高新技术领域的一个竞争热点。
3.oled发光原理是用itf玻璃透明电极和金属电极分别作为器件的阳极和阴极,在一定电压驱动下,电子和空穴分别从阴极和阳极注入到电子和空穴传输层,然后分别迁移到发光层,相遇后形成激子是发光分子激发,后者经过辐射后发出可见光。辐射光可从itf一侧观察到,同时金属电仪也起了反射层的作用。
4.但是,由于oled器件仍存在发光效率低、寿命相对较短、制作成本偏高等问题,因此,解决效率、寿命及降低成本等问题已经是oled行业的技术研究重点。
技术实现要素:
5.本发明针对现有技术存在的不足,提供一种含氧杂卓结构的化合物能提高器件热稳定性,改善器件使用寿命,同时提高器件发光效率,同时具有合成步骤短,路线简单等特点,可降低合成成本,以该化合物制备的oled器件具有优良的发光效率,更长的发光寿命。
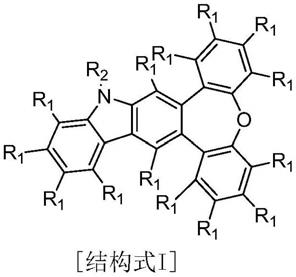
6.本发明解决上述技术问题的技术方案如下:一种含氧杂卓并咔唑结构化合物,其特征在于,所述含氧杂卓并咔唑结构化合物如[结构式i]所示:
[0007][0008]
其中,结构式i中,r1表示氢原子或氘原子中的一种;r2表示苯基、联苯基、取代或未取代的c10~c14的稠环芳基或噻吩基、呋喃基、芘、苯基芴、三联苯基、蒽基、萘基、菲基、二甲基芴、苯基咔唑、三亚苯基中的一种。
[0009]
进一步的,所述含氧杂卓并咔唑结构化合物选自如下化学式[2-1]~[2-14]中的任意一个:
[0010]
[0011][0012]
其中,x选自h或cn,z独立的选自o或s。
[0013]
进一步的,所述含氧杂卓并咔唑结构化合物选自如下化学式中的任意一个:
[0014]
[0015]
[0016]
[0017]
[0018][0019]
本发明还公开了所述含氧杂卓并咔唑结构化合物的应用,所述含氧杂卓并咔唑结构化合物应用于有机电致发光器件。
[0020]
进一步的,所述有机电致发光器件包括阴极层、阳极层和有机层,所述有机层包括空穴注入层、空穴传输层、发光层、空穴阻挡层、电子注入层、电子传输层中的至少一层,所述有机层中至少有一层含有所述的含氧杂卓并咔唑结构化合物。
[0021]
进一步的,所述含氧杂卓并咔唑结构化合物应用于有机电致发光器件的发光层。
[0022]
进一步的,如结构式i所表示的一种含氧杂卓结构的有机化合物可以单独使用在有机电致发光器件中,或和其他化合物混合使用;如结构式i所表示的化合物可以使用其中一种化合物,也可以同时使用结构式i中的两种或两种以上化合物;
[0023]
在本发明中,所述发光层为蓝色发光层时,采用上述所述的有机电致器件用化合物作为红色主体,可得到高效率、高分辨率、高亮度及长寿命的有机电致器件。
[0024]
进一步的,所述含氧杂卓并咔唑结构化合物应用于有机电致发光器件的电子传输层。
[0025]
在本发明中,所述有机层优选包括发光层和电子传输层,所述发光层和电子传输层均含有所述的含氧杂卓并咔唑结构化合物,所述发光层和电子传输层中的含氧杂卓并咔唑结构化合物可以相同也可以不同。
[0026]
本发明的有益效果是:本发明涉及的含氧杂卓结构的化合物能提高器件热稳定性,提高器件发光效率,同时具有合成步骤短,路线简单等特点,可降低合成成本,以该化合物制备的oled器件具有优良的发光效率,更长的发光寿命。
附图说明
[0027]
图1为实施例中所述有机电致发光器件结构层图;
[0028]
图中,1 ito基板,2阳极,3空穴注入层,4空穴传输层,5发光层,6电子传输层,7电
子注入层,8阴极。
具体实施方式
[0029]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
[0030]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。
[0031]
合成例
[0032]
1.中间体m-1制备:
[0033][0034]
在氮气保护条件下,将3-溴-2-氯-9h-咔唑28.1g,(2-苯氧苯基)硼酸21.4g,碳酸钾34.6g,四三苯基膦合钯0.8g,甲苯100ml,水75ml加入到反应瓶中,升温回流保温12h。反应完全后,加入100ml甲苯萃取有机相,分层,分出有机相,纯化水水洗至有机相为中性。水洗毕,经层析(氯仿/正己烷)、重结晶(丙酮/甲醇),得到淡黄色固体27.7g,收率为75%。根据lc-ms分析,该固体鉴定为中间体m-1。lc-ms:m/z=369.1。
[0035]
2.中间体m-2制备:
[0036][0037]
在氮气保护条件下,将m-127.7g,醋酸钯0.3g,三环己基膦四氟硼酸盐0.6g,碳酸钾15.5g,n,n-二甲基乙酰胺100ml加入到反应瓶中,升温至150.0℃保温6h。反应毕,加水水解后加入二氯乙烷萃取水洗至中性,经层析(氯仿/正己烷)、重结晶(丙酮/甲醇),得类白色固体11.2g,收率:45%。根据lc-ms分析,该类白色固体鉴定为中间体m-2,lc-ms:m/z=333.12。
[0038]
实施例
[0039]
1.化合物3-1制备
[0040][0041]
在氮气保护条件下,将中间体m-2 33.3g,溴苯15.7g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体24.6g,收率:60%。根据lc-ms分析,该类白色固体鉴定为化合物3-1,lc-ms:m/z=409.17。
[0042]1h nmr:δ7.16-7.29(2h,7.22(ddd,j=8.5,1.4,0.5hz),7.23(ddd,j=8.5,1.4,0.5hz)),7.39-7.67(9h,7.46(ddd,j=7.0,5.8,1.7hz),7.49(ddd,j=8.4,6.5,1.4hz),7.48(tdd,j=7.4,1.6,1.1hz),7.49(ddd,j=8.5,6.5,1.7hz),7.50(ddd,j=8.4,6.5,1.4hz),7.56(dddd,j=8.1,7.4,1.5,0.4hz),7.57(ddd,j=7.0,6.5,1.4hz),7.60(ddd,j=8.5,6.5,1.7hz)),7.84-8.12(6h,7.91(dddd,j=8.1,1.6,1.4,0.4hz),7.94(ddd,j=8.4,1.7,0.5hz),7.95(ddd,j=6.5,1.7,0.5hz),7.95(ddd,j=8.4,1.7,0.5hz),8.07(d,j=0.5hz)),8.24(1h,ddt,j=5.8,1.4,0.5hz),8.96(1h,t,j=0.5hz).
[0043]
2.化合物3-4制备
[0044][0045]
在氮气保护条件下,将中间体m-2 33.3g,对溴苯腈18.2g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体26.0g,收率:60%。根据lc-ms分析,该类白色固体鉴定为化合物3-4,lc-ms:m/z=434.4。
[0046]1h nmr:δ7.03-7.17(2h,7.10(ddd,j=8.5,1.4,0.5hz),7.10(ddd,j=8.5,1.4,0.4hz)),7.47-7.73(6h,7.54(ddd,j=8.5,7.7,1.6hz),7.54(ddd,j=8.5,7.7,1.6hz),7.54(ddd,j=6.9,5.1,1.8hz),7.59(ddd,j=7.7,7.3,1.4hz),7.60(ddd,j=7.7,7.3,1.4hz),7.66(ddd,j=6.9,5.6,1.5hz)),7.82-8.21(8h,7.88(ddd,j=8.7,2.6,0.5hz),7.96(ddd,j=8.7,1.7,0.5hz),8.01(ddd,j=7.3,1.6,0.5hz),8.02(ddd,j=7.3,1.6,0.4hz),8.06(ddd,j=5.6,1.8,0.5hz),8.16(d,j=0.5hz)),8.33(1h,ddt,j=5.1,1.5,0.5hz),8.84(1h,t,j=0.5hz).
[0047]
3.化合物3-7制备
[0048][0049]
在氮气保护条件下,将中间体m-2 33.3g,4-溴联苯23.3g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体32.7g,收率:67%。根据lc-ms分析,该类白色固体鉴定为化合物3-7,lc-ms:m/z=485.48。
[0050]1h nmr:δ7.15-7.34(2h,7.21(ddd,j=8.5,1.4,0.4hz),7.28(ddd,j=8.5,1.4,0.4hz)),7.44-7.83(13h,7.51(dddd,j=8.0,6.2,1.8,0.5hz),7.52(tdd,j=6.2,1.9,1.5hz),7.54(ddd,j=8.5,7.7,1.7hz),7.54(ddd,j=8.5,7.7,1.6hz),7.60(ddd,j=7.7,7.0,1.4hz),7.61(ddd,j=7.7,7.1,1.4hz),7.63(ddd,j=6.9,5.0,1.6hz),7.66(ddd,j=6.9,5.5,1.5hz),7.67(dddd,j=8.0,1.7,1.2,0.5hz),7.77(ddd,j=8.3,1.4,0.4hz)),7.92-8.22(6h,7.98(ddd,j=8.3,1.6,0.4hz),8.05(ddd,j=5.5,1.6,0.5hz),8.14(ddd,j=7.1,1.7,0.4hz),8.15(ddd,j=7.0,1.6,0.4hz),8.17(d,j=0.6hz)),8.35(1h,ddt,j=5.0,1.5,0.5hz),8.84(1h,t,j=0.6hz).
[0051]
4.化合物3-10制备
[0052][0053]
在氮气保护条件下,将中间体m-2 33.3g,2-溴苯并[b]噻吩21.3g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体24.7g,收率:55%。根据lc-ms分析,该类白色固体鉴定为化合物3-10,lc-ms:m/z=465.42。
[0054]1h nmr:δ7.16-7.29(2h,7.22(ddd,j=8.5,1.4,0.4hz),7.23(ddd,j=8.5,1.4,0.4hz)),7.36-7.64(8h,7.43(ddd,j=7.8,7.4,1.9hz),7.46(ddd,j=7.0,6.9,1.8hz),7.48(ddd,j=8.4,6.6,1.4hz),7.48(ddd,j=8.4,6.6,1.4hz),7.52(dddd,j=7.8,7.4,1.8,0.4hz),7.53(ddd,j=8.5,6.6,1.7hz),7.55(ddd,j=8.5,6.6,1.7hz),7.57(ddd,j=7.0,6.3,1.5hz)),7.83-8.15(7h,7.89(ddt,j=7.8,1.8,0.4hz),7.94(ddd,j=8.4,1.7,0.4hz),7.95(ddd,j=8.4,1.7,0.4hz),8.02(dddd,j=7.8,2.1,1.9,0.4hz),8.02(dt,j=
2.1,0.4hz),8.04(ddd,j=6.3,1.8,0.5hz),8.10(d,j=0.5hz)),8.24(1h,ddt,j=6.9,1.5,0.5hz),8.50(1h,t,j=0.5hz).
[0055]
5.化合物3-22制备
[0056][0057]
在氮气保护条件下,将中间体m-2 33.3g,3-溴-二苯并呋喃24.7g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体31g,收率:62%。根据lc-ms分析,该类白色固体鉴定为化合物3-22,lc-ms:m/z=499.24。
[0058]1h nmr:δ7.20-7.33(2h,7.26(ddd,j=8.4,1.4,0.4hz),7.27(ddd,j=8.4,1.4,0.4hz)),7.39(1h,dd,j=1.9,0.5hz),7.45-7.87(9h,7.52(ddd,j=8.4,7.6,1.5hz),7.53(ddd,j=8.4,7.6,1.7hz),7.56(ddd,j=8.4,7.6,1.7hz),7.59(ddd,j=7.6,7.1,1.4hz),7.60(ddd,j=7.6,7.1,1.4hz),7.64(ddd,j=6.9,5.0,1.8hz),7.67(ddd,j=6.9,5.5,1.9hz),7.71(ddd,j=8.4,7.6,1.8hz),7.81(ddd,j=8.4,1.8,0.5hz)),8.00-8.25(7h,8.06(ddd,j=5.5,1.8,0.5hz),8.08(dd,j=8.7,1.9hz),8.13(ddd,j=7.1,1.7,0.4hz),8.14(ddt,j=8.4,1.5,0.5hz),8.14(ddd,j=7.1,1.7,0.4hz),8.18(d,j=0.6hz),8.19(dt,j=8.7,0.5hz)),8.35(1h,ddt,j=5.0,1.9,0.5hz),8.85(1h,t,j=0.6hz).
[0059]
6.化合物3-25制备
[0060][0061]
在氮气保护条件下,将中间体m-2 33.3g,2-溴-二苯并噻吩26.3g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体36.1g,收率:70%。根据lc-ms分析,该类白色固体鉴定为化合物3-25,lc-ms:m/z=515.13。
[0062]1h nmr:δ7.19-7.45(3h,7.26(ddd,j=8.4,1.4,0.4hz),7.28(ddd,j=8.4,1.4,0.4hz),7.38(dd,j=8.5,0.4hz)),7.46-7.77(8h,7.53(ddd,j=8.4,6.5,1.7hz),7.53(ddd,j=6.9,5.1,1.8hz),7.55(ddd,j=8.4,6.5,1.6hz),7.58(ddd,j=7.2,6.5,1.4hz),
7.58(td,j=7.5,1.6hz),7.59(ddd,j=7.2,6.5,1.4hz),7.64(ddd,j=6.9,5.5,1.8hz),7.70(ddd,j=8.1,7.5,2.1hz)),7.87-8.20(7h,7.93(dd,j=8.5,1.9hz),7.98(dt,j=1.9,0.4hz),8.01(ddd,j=8.1,1.6,0.5hz),8.03(ddd,j=5.5,1.8,0.5hz),8.12(ddd,j=7.2,1.7,0.4hz),8.13(ddd,j=7.2,1.6,0.4hz),8.15(d,j=0.5hz)),8.25-8.41(2h,8.31(ddt,j=5.1,1.8,0.5hz),8.35(ddt,j=7.6,2.1,0.5hz)),9.00(1h,t,j=0.5hz).
[0063]
7.化合物3-34制备
[0064][0065]
在氮气保护条件下,将中间体m-2 33.3g,9-溴菲25.7g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体29g,收率:57%。根据lc-ms分析,该类白色固体鉴定为化合物3-34,lc-ms:m/z=509.22。
[0066]1h nmr:δ7.15-7.28(2h,7.21(ddd,j=8.5,1.4,0.5hz),7.22(ddd,j=8.5,1.4,0.5hz)),7.37-7.77(10h,7.44(ddd,j=7.7,7.0,1.8hz),7.52(ddd,j=7.7,5.9,2.2hz),7.53(ddd,j=8.5,7.7,1.6hz),7.53(ddd,j=8.5,7.7,1.6hz),7.58(dddd,j=7.7,7.4,2.8,0.4hz),7.60(ddd,j=6.8,5.0,1.8hz),7.62(ddd,j=7.7,7.0,1.4hz),7.63(ddd,j=7.7,7.0,1.4hz),7.64(ddd,j=7.7,7.4,2.3hz),7.71(ddd,j=6.8,5.4,1.5hz)),7.97(1h,dq,j=2.0,0.4hz),8.05-8.61(9h,8.11(ddd,j=5.4,1.8,0.5hz),8.17(ddd,j=7.0,1.6,0.5hz),8.18(ddd,j=7.0,1.6,0.5hz),8.18(dddd,j=7.4,2.0,1.8,0.5hz),8.21(d,j=0.5hz),8.30(ddt,j=7.4,2.2,0.5hz),8.37(ddq,j=7.0,2.8,0.5hz),8.45(ddt,j=5.0,1.5,0.5hz),8.55(ddt,j=5.9,2.3,0.5hz)),8.88(1h,t,j=0.5hz).
[0067]
8.化合物3-35制备
[0068][0069]
在氮气保护条件下,将中间体m-2 33.3g,9-溴蒽25.7g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体36.1g,收率:71%。根据lc-ms分析,该类白色固体鉴定为化合物3-35,lc-ms:m/z=509.31。
[0070]1h nmr:δ7.06-7.28(2h,7.12(ddd,j=8.5,1.4,0.5hz),7.21(ddd,j=8.5,1.4,
0.5hz)),7.40-7.77(10h,7.47(ddd,j=7.6,6.7,1.5hz),7.52(ddd,j=8.5,7.7,1.6hz),7.52(ddd,j=8.5,7.7,1.6hz),7.54(dddd,j=7.6,6.8,2.0,0.4hz),7.59(ddd,j=6.8,5.0,1.8hz),7.62(ddd,j=7.7,7.0,1.4hz),7.63(ddd,j=7.7,7.0,1.4hz),7.70(ddd,j=6.8,5.3,1.8hz)),8.06-8.29(6h,8.12(ddd,j=5.3,1.8,0.5hz),8.16(ddd,j=7.0,1.6,0.5hz),8.17(ddd,j=7.0,1.6,0.5hz),8.21(d,j=0.5hz),8.22(dddd,j=6.8,2.0,1.5,0.5hz)),8.35-8.50(3h,8.41(ddt,j=6.7,2.0,0.5hz),8.45(ddt,j=5.0,1.8,0.5hz)),8.75(1h,tquint,j=2.0,0.5hz),8.88(1h,t,j=0.5hz).
[0071]
9.化合物3-42制备
[0072][0073]
在氮气保护条件下,将中间体m-2 33.3g,3-溴-9,9-二甲基-9h-芴27.3g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体37.8g,收率:72%。根据lc-ms分析,该类白色固体鉴定为化合物3-42,lc-ms:m/z=525.25。
[0074]1h nmr:δ1.84(6h,s),7.15-7.28(2h,7.21(ddd,j=8.5,1.4,0.5hz),7.22(ddd,j=8.5,1.4,0.5hz)),7.31-7.76(12h,7.38(ddd,j=7.1,6.0,1.2hz),7.46(ddd,j=8.5,7.7,1.7hz),7.46(ddd,j=8.5,7.7,1.7hz),7.48(ddd,j=7.4,5.6,1.7hz),7.49(ddd,j=7.1,1.8,0.5hz),7.50(ddd,j=8.4,6.0,1.8hz),7.53(dd,j=8.6,0.4hz),7.58(ddd,j=7.6,7.4,1.6hz),7.61(ddd,j=8.2,7.7,1.4hz),7.61(ddd,j=8.2,7.7,1.4hz),7.65(ddd,j=8.4,1.2,0.5hz),7.71(dd,j=2.3,0.4hz)),7.85(1h,dd,j=8.6,2.3hz),7.99-8.17(4h,8.05(ddd,j=7.6,1.7,0.5hz),8.09(ddd,j=8.2,1.7,0.5hz),8.10(ddd,j=8.2,1.7,0.5hz),8.12(d,j=0.5hz)),8.26(1h,ddt,j=5.6,1.6,0.5hz),8.79(1h,t,j=0.5hz).
[0075]
10.化合物3-47制备
[0076][0077]
在氮气保护条件下,将中间体m-2 33.3g,4-溴-9,9-二苯基-9h-芴39.7g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,经层析(氯仿/正己烷)、重结晶
(丙酮/甲醇)得类白色固体45.5g,收率:70%。根据lc-ms分析,该类白色固体鉴定为化合物3-47,lc-ms:m/z=649.71。
[0078]1h nmr:δ7.15-7.83(25h,7.22(ddd,j=8.5,1.4,0.5hz),7.22(dddd,j=8.0,1.3,1.1,0.6hz),7.23(tt,j=7.7,1.1hz),7.24(ddd,j=8.5,1.4,0.5hz),7.27(dddd,j=8.0,7.7,1.8,0.6hz),7.40(ddd,j=8.5,6.1,1.5hz),7.46(ddd,j=8.5,7.7,1.7hz),7.46(ddd,j=8.5,7.7,1.7hz),7.49(ddd,j=8.0,5.6,1.7hz),7.51(ddd,j=8.5,1.7,0.5hz),7.57(ddd,j=8.2,6.1,1.7hz),7.58(ddd,j=8.0,6.7,1.6hz),7.61(ddd,j=8.2,7.7,1.4hz),7.62(ddd,j=8.2,7.7,1.4hz),7.66(dd,j=8.6,0.4hz),7.69(ddd,j=8.2,1.5,0.5hz),7.72(dd,j=2.0,0.4hz),7.77(dd,j=8.6,2.0hz)),8.00-8.17(4h,8.06(ddd,j=6.7,1.7,0.5hz),8.10(ddd,j=8.2,1.7,0.5hz),8.11(ddd,j=8.2,1.7,0.5hz),8.12(d,j=0.5hz)),8.27(1h,ddt,j=5.6,1.6,0.5hz),9.11(1h,t,j=0.5hz).
[0079]
11.化合物3-51制备
[0080][0081]
在氮气保护条件下,将中间体m-2 33.3g,1-溴-9-苯基-9h-咔唑32.2g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体34.5g,收率:60%。根据lc-ms分析,该类白色固体鉴定为化合物3-51,lc-ms:m/z=574.33。
[0082]1h nmr:δ7.21-7.34(2h,7.27(ddd,j=8.1,1.5,0.5hz),7.28(ddd,j=8.1,1.4,0.5hz)),7.40-7.78(12h,7.47(ddd,j=7.6,6.6,1.4hz),7.47(tdd,j=7.6,1.9,1.3hz),7.55(ddd,j=7.9,7.1,1.8hz),7.56(ddd,j=8.1,7.6,1.7hz),7.55(td,j=7.9,2.6hz),7.57(ddd,j=8.1,7.6,1.7hz),7.58(dddd,j=8.0,7.6,1.6,0.4hz),7.59(ddd,j=7.6,6.6,1.5hz),7.63(ddd,j=6.9,5.1,1.8hz),7.67(ddd,j=6.9,5.5,1.9hz),7.71(dd,j=8.2,7.1hz)),7.90-8.41(11h,7.96(dddd,j=8.0,1.6,1.4,0.4hz),8.01(dd,j=8.2,2.2hz),8.06(ddd,j=5.5,1.8,0.5hz),8.14(ddd,j=6.6,1.7,0.5hz),8.15(ddd,j=6.6,1.7,0.5hz),8.18(d,j=0.6hz),8.23(ddd,j=7.9,1.8,0.4hz),8.26(ddd,j=7.1,2.2,0.5hz),8.28(ddt,j=7.1,2.6,0.5hz),8.35(ddt,j=5.1,1.9,0.5hz)),9.15(1h,t,j=0.5hz).
[0083]
12.化合物3-58制备
[0084][0085]
在氮气保护条件下,将中间体m-2 33.3g,2'-溴-1,1':4',1
”‑
三联苯30.9g,溴化亚铜2.9g,碳酸钾27.6g,n,n-二甲基甲酰胺120ml加入到反应瓶中,升温至回流保温15h,反应毕,加水水解后,加甲苯萃取,分层,有机相分出水洗至中性,脱干溶剂后经层析(氯仿/正己烷)、重结晶(丙酮/甲醇)得类白色固体36.5g,收率:65%。根据lc-ms分析,该类白色固体鉴定为化合物3-58,lc-ms:m/z=561.45。
[0086]1h nmr:δ7.20-7.34(2h,m),7.44-7.72(12h,7.50(tdd,j=6.1,2.2,1.1hz),7.54(ddd,j=8.5,7.7,1.7hz),7.54(tdd,j=7.4,1.8,1.6hz),7.55(ddd,j=8.4,6.5,1.6hz),7.57(dddd,j=8.1,6.1,1.8,0.5hz),7.59(ddd,j=7.1,6.5,1.4hz),7.60(ddd,j=7.7,7.1,1.4hz),7.60(dddd,j=8.1,7.4,1.7,0.5hz),7.62(ddd,j=6.9,5.1,1.8hz),7.66(ddd,j=6.9,5.4,1.8hz)),7.78-7.92(4h,7.85(dddd,j=8.1,2.3,1.7,0.5hz),7.85(dddd,j=8.1,1.7,1.5,0.5hz)),8.00-8.47(8h,8.06(ddd,j=5.4,1.8,0.5hz),8.13(ddd,j=7.1,1.7,0.4hz),8.14(ddd,j=7.1,1.6,0.4hz),8.17(d,j=0.6hz),8.25(dd,j=8.4,2.0hz),8.33(ddt,j=5.1,1.8,0.5hz),8.41(dd,j=8.4,0.4hz),8.41(dd,j=2.0,0.4hz)),8.84(1h,t,j=0.6hz).
[0087]
13.化合物3-1~3-58制备
[0088]
化合物3-1~3-58的制备方法同制备化合物3-34,所用原料为中间体m-2和其它溴代化合物原料,具体如下表:
[0089]
[0090]
[0091]
[0092]
[0093]
[0094]
[0095]
[0096][0097]
下面通过对比以实施例1~12化合物和eg1~3化合物制备的15组oled器件来展示本发明在oled中的应用效果。
[0098]
将涂布有150nm厚ito层的玻璃基板(以下简称为ito基板,ito基板含有基板1和阳极层2)置于含有洗洁剂的蒸馏水中,并以超声波清洗30分钟,更换蒸馏水后,再以超声波清洗10分钟以洗净ito基板,并重复上述洗净步骤一次,洗净后,将前述玻璃基板以异丙醇、丙酮和甲醇以超声波震荡洗净,并使之干燥;然后将ito基板置于电浆表面清洁机内,并以氧电浆清洁玻璃基板5分钟,再将清洁后的ito基板置于真空蒸镀机内。
[0099]
之后,将真空蒸镀机的真空度维持在1
×
10-6
torrr至3
×
10-7
torrr,并于基板1上的ito阳极层2上按照下表顺序依次沉积空穴注入层3、空穴传输层4、发光层5、电子传输层6、电子注入层7、阴极8。
[0100][0101]
以此获得实施例1至12及比较例1至3的oled装置。
[0102][0103]
对于在实验例1至12和比较实验例1至3中制造的有机发光器件,测量了在10ma/cm2的电流密度下的驱动电压、发光效率,并且测量了在20ma/cm2的电流密度下亮度变为初始亮度的95%时的时间(以lt
95
表示),结果在下表中示出。
[0104][0105]
由上表数据分析对比可知,以本发明中涉及的氧杂卓作为发光层或电子传输层所制备的oled器件具有更好的发光效率及更长的发光寿命。
[0106]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0107]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护
范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1