CYLD,IFFO1及下游靶基因在卵巢癌耐药综合治疗及检测中的应用
cyld,iffo1及下游靶基因在卵巢癌耐药综合治疗及检测中的应用
技术领域
1.本发明属于肿瘤耐药性检测应用技术领域,具体涉及一种同时检测cyld及iffo1以及下游靶基因abcb1、bcl-xl、bax和bcl3用以卵巢癌耐药性综合治疗药物以及综合检测试剂盒的开发应用。
背景技术:
2.卵巢癌是一种严重威胁女性健康的疾病,其发病率仅为妇科恶性肿瘤的第3位,但其死亡率却位居于第1位,并且根据最新的数据显示,其发病率存在逐年上升的趋势,而死亡率并无明显改善。目前卵巢癌的治疗原则为:在尽可能无残留的手术切除(r0切除)基础上,辅以铂类为基础的化疗。然而,由于器官位置位于腹腔中,临床不能寻求到合适的早期诊断方法,70%患者确诊时已处于疾病的中晚期(临床上的ⅲ期、ⅳ期),同时也导致手术治疗困难,甚至丧失手术时机;而靶向治疗,免疫治疗也仅有少数患者可以从中获益。因此,以铂类为基础的化疗成为了所有患者的最有效治疗手段,然而19%的早期卵巢癌、60%-85%的复发卵巢癌最终会出现铂类耐药,导致了化疗困难。因此,研究卵巢癌铂类耐药过程中的重要调控基因及其调控机制,将对卵巢癌患者药物的选择及治疗方案的制定具有重要意义,既可以最大限度节约医疗成本,又可以减少患者因为化疗药物使用不当而造成的耐药和副反应,具有重要的科学意义和临床应用价值。
3.铂类药物属于细胞周期非特异性药物,主要通过进入肿瘤细胞后与dna结合形成pt-dna加合物,介导肿瘤细胞坏死或凋亡,起到抗肿瘤的目的。铂类药物导致的dna损伤,可以促进nf-κb通路的激活。该通路的激活可以抑制细胞凋亡通路的进程;可以促进p-gp蛋白的转录;还可以促进机体的肿瘤炎症反应,促进血管新生和转移、颠覆抗肿瘤免疫应答,是导致化疗药物耐药的重要原因之一。然而,有研究表明,nf-κb通路的激活和调控机制是具有细胞特异性的,由于nf-κb通路可以接受炎症因子、肿瘤坏死因子、细菌脂多糖等多种因子的刺激,进而激活肿瘤细胞的不同通路,其调控机制复杂,在卵巢癌细胞中,nf-κb通路对铂耐药的调控机制,尚需要进一步的研究。
4.cyld是泛素特异性蛋白水解酶(ubiquitin-specific proteases,usps)家族的成员,是一种特异性去除k63连接泛素链的去泛素化酶。同时,去泛素化酶cyld在nf-κb通路中起着关键作用。cyld可以通过去泛素化nemo(ikkγ)、traf2、traf6等分子,从而抑制nf-κb信号通路的活性;同时,cyld还可在核膜与b淋巴细胞瘤蛋白3(bcl-3)相互作用抑制其泛素化与入核,进而抑制其与nf-κb家族的转录因子p50和p52相互作用,促进nf-κb信号通路的活化,调节凋亡。另一方面,cyld还负调控tgf-β信号通路,直接去泛素化k63位泛素修饰的smad7,同时,cyld还可以去泛素化并抑制蛋白激酶b(akt)的活性,促进smad3的降解,进而抑制tgf-β信号通路。肿瘤细胞通过抑制cyld的表达,进一步抑制nf-κb及tgf-β通路,通过促进凋亡、周期从而达到促进肿瘤发生/发展的目的。
5.中间纤维蛋白iffo1(intermediate filament family orphan 1)是细胞骨架蛋
白家族成员。现有研究表明,在多种肿瘤中iffo1基因的上游启动子区域存在高度甲基化,导致iffo1基因的表达沉默。在肺癌细胞中检测iffo1启动子区的甲基化水平,为肺癌的早期诊断提供了依据;并且癌症细胞的染色体易位频率也与iffo1表达量高度负相关。而重新表达iffo1,可以抑制iffo1表达沉默的癌症细胞中的染色体易位发生频率。这说明,肿瘤细胞通过甲基化iffo1启动子区抑制它的表达,从而促进了染色体易位的产生,进一步驱动了肿瘤的发生发展。iffo1还与核纤层蛋白lamin a/c相互作用,形成细胞核内部的核骨架结构。但在肿瘤耐药中,却罕有研究报道。
技术实现要素:
6.为了解决现有技术的缺点和不足之处,本发明的目的在于提供一种同时检测cyld及iffo1以及下游靶基因abcb1、bcl-xl、bax和bcl3在卵巢癌耐药性产生的检测试剂盒的应用。
7.本发明目的通过以下技术方案实现:
8.实时检测cyld及iffo1以及下游靶基因abcb1、bcl-xl、bax和bcl3检测卵巢癌耐药性产生的检测试剂盒的应用。
9.所述的肿瘤耐药性检测包括以cyld及iffo1以及下游靶基因abcb1、bcl-xl、bax和bcl3为靶点的检测试剂或检测试剂盒。
10.所述的耐卵巢癌的耐药药物为顺铂、卡铂等铂类药物。
11.所述的cyld引物序列为
12.f:5
’‑
ttggcaactgggatggaaga-3’13.r:5
’‑
tcctttcctgcgtcacactc-3’14.所述的iffo1序列为
15.f:5
’‑
gatgcggttcacaatgcctc-3’16.r:5
’‑
tgcttgagacagtgacacca-3’17.上述cyld及iffo1序列应用包括制备成用于检测卵巢癌病人耐药的检测试剂以及检测试剂盒。
18.本发明的应用具有如下优点及有益效果:
19.1.在卵巢癌中,癌细胞通过下调cyld,进而抑制促凋亡基因bax,促进凋亡蛋白bcl-xl,bcl3等的表达,并有效的促进药物转运蛋白的表达增加,进而促进卵巢癌细胞的药物耐药性增加。这些结果都预示着,cyld可以作为一种卵巢癌的肿瘤标志基因,来对胶质瘤的治疗及预后具有指导意义。
20.2.iffo1同样可以作为一个卵巢癌耐药检测指标。我们的研究展示了在卵巢癌耐药细胞系中iffo1的表达量下调,而在卵巢癌细胞系中下调iffo1的表达可以降低铂类药物的敏感性,这将为卵巢癌患者的预后及治疗提供新的分子靶标。
21.本发明研究者利用qrt-pcr,cck-8,流式细胞术等在敏感及耐药的卵巢癌细胞株水平检测cyld及iffo1的表达水平及其对细胞凋亡,及药物敏感性的影响。再应用原位杂交技术及免疫组化方法从正常卵巢、卵巢交界性肿瘤及卵巢癌患者的卵巢样本中进行结果的验证。说明肿瘤细胞通过下调cyld及iffo1的表达,进一步抑制抗凋亡蛋白bax及促进凋亡蛋白bcl-xl及药物转运蛋白abcb1的表达,降低卵巢癌对铂类药物的敏感性,而检测cyld及
iffo1及其下游各分子的表达,有望在患者治疗的初期对患者预后及药物敏感性做出合理的判断,为患者的药物选择提供依据。
附图说明
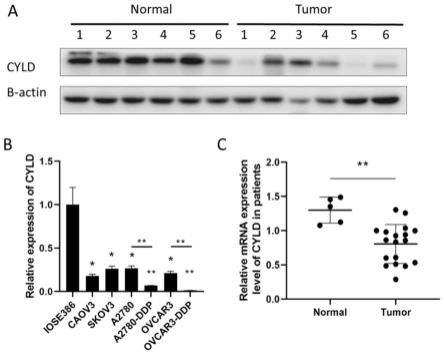
22.图1:卵巢癌患者组织中cyld的表达量较正常卵巢组织低,卵巢癌细胞系中可见同样的结果,并且,在耐药卵巢癌细胞系中表达量更低。
23.图2:在耐药卵巢癌细胞系中,cyld表达量降低。
24.图3:在卵巢癌细胞系中沉默cyld,细胞的顺铂药物敏感性降低,在卵巢癌耐药细胞系中过表达cyld,细胞的顺铂药物敏感性升高。
25.图4:抑制cyld的表达,在顺铂药物作用下,卵巢癌细胞系的凋亡率明显降低。并且促凋亡蛋白bax表达下降,抑制凋亡蛋白bcl-xl及bcl2的表达量升高。
26.图5:在卵巢癌细胞系中沉默cyld,加入罗丹明123后,发现药物外排作用增强。
27.图6:沉默cyld表达,药物转运蛋白abcb1表达量增高,在耐药细胞系中过表达cyld,abcb1表达量降低。
28.图7:在卵巢癌组织样中,iffo1的表达量降低。
29.图8:在卵巢癌耐药细胞株中,iffo1表达量降低。
30.图9:抑制iffo1表达,卵巢癌细胞药物敏感性下降。
具体实施方式
31.下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
32.实施例中末注明具体条件的实验方法,基本上都按照sambrook,j等人编著的《分子克隆实验指南(第3版)》中所述的条件及方法或按照材料提供商所建议的条件及方法进行,其它没有详细描述的技术相应于本领域人员来说是熟知的标准方法。
33.实施例1:
34.我们收集了18例卵巢癌患者组织以及6例正常卵巢组织,通过qrt-pcr检测各例患者标本的cyld表达水平。通过与正常卵巢组织患者的cyld的表达水平做对比,发现cyld在卵巢癌患者的标本中表达量明显降低,并远远低于正常卵巢组织中cyld的表达水平。于是我们认为cyld在卵巢癌的发生发展中起着抑制作用。同时,我们在患者组织样本中用western bloting检测患者组织中cyld蛋白表达水平,也得到了同样的结果。
35.实施例2:
36.在卵巢癌铂类药物敏感细胞株ovcar3及铂类药物耐药细胞株ovcar3-ddp中,应用western bloting检测cyld的蛋白表达水平;具体方法:
37.1.提取细胞总蛋白
38.2.sds-page电泳
39.3.半干式转膜
40.4.免疫印迹
41.转膜结束,检验marker是否已转至膜上(或丽春红染色)以判定转膜效果。tbst清洗膜后,5%脱脂奶粉(tbst配制)4℃封闭过夜。加一抗cyld多克隆抗体(1:1000)(购自cst
公司),室温摇动2h。tbst漂洗3次,每次10min。加二抗(1:200)(购自cell signal公司),室温摇动1h。tbst漂洗3次,每次10min。
42.5.ecl检测
43.6.结果分析:与铂类药物敏感株相比,铂类药物耐药株中cyld的蛋白表达水平低。
44.实施例3:
45.通过慢病毒包装,再经过嘌呤霉素的筛选的方法构建稳定抑制cyld表达的ovcar卵巢癌铂类药物敏感细胞株,以及稳定过表达cyld的ovcar-ddp卵巢癌铂类药物耐药细胞株。再通过western bloting的方法检测稳定细胞株ovcar/shnc、ovcar/shcyld1、ovcar/shcyld3以及卵巢癌铂类药物敏感细胞株ovcar3、铂类药物耐药细胞株ovcar3-ddp及耐药细胞株中稳定表达cyld的ovcar3-ddp cyld中cyld的表达水平,经过三次验证后,确保cyld的沉默及过表达细胞株构建完成。经过western bloting检测发现沉默cyld的细胞株中,cyld的表达量明显下降;在另一细胞系ovcar-ddp cyld中发现,过表达cyld后,cyld的蛋白水平明显上升。验证成功后,进行细胞药物敏感性实验。
46.将稳定过表达的ovcar/shnc、ovcar/shcyld1、ovcar/shcyld3细胞系分别种植与96孔板上,12h后向已贴壁细胞中加入顺铂,使药物终浓度分别为:50μm、30μm、20μm、10μm、7μm、5μm、3μm、1μm、0。培养72h后,使用cck-8试剂盒进行实验,放入多功能酶标仪进行检测,观察其od450的吸光值用于检测细胞药物敏感性实验,将数据统计汇表。发现抑制cyld的ovcar3细胞系的药物敏感性明显下降,并有统计学意义。
47.用上诉相同方法检测卵巢癌铂类药物敏感细胞株ovcar3、铂类药物耐药细胞株ovcar3-ddp及耐药细胞株中稳定表达cyld的ovcar3-ddp cyld的铂类药物敏感性,结果发现,耐药细胞株ovcar3-ddp较药物敏感细胞株ovcar3的铂类药物的敏感性下降,但是在耐药细胞株中过表达cyld后,细胞对铂类药物的敏感性增强,逆转了耐药细胞株中的药物敏感性下降趋势,差异有统计学意义。
48.实施例4:
49.将稳定过表达的ovcar/shnc、ovcar/shcyld1、ovcar/shcyld3细胞系分别种植与6孔板上,每个孔种植2
×
105个细胞,12h后在每孔中加入顺铂5μm,在37℃培养箱中培养48h后,收取细胞至1.5ml ep管中,用vazyme annexin v-fitc/pi试剂盒染色,用流式细胞仪检测细胞凋亡率。具体实验步骤如下:
50.1.用500g转速离心收集所需实验细胞,新鲜培养基重悬后,用细胞计数仪计数1
×
106每管。
51.2.用预冷的pbs清洗细胞两次,500g转速5min离心去除上清后,加入1倍的binding buffer重悬每个样品细胞。需要将pbs对照组分为4份:阴性对照组、pi单染组、膜联蛋白v单染组、双染组。室温、避光染色10min。
52.3.上机前,向每个样品中再次加入1倍的binding buffer,充分混匆后再上机。
53.4.然后用flowjo软件对得到的结果进行分析。
54.结果分析:通过流式细胞仪检测后发现,pbs组沉默cyld后并未发现卵巢癌细胞系的凋亡水平变化;但是在5μm顺铂处理后,沉默cyld表达组的细胞凋亡率明显低于对照组。用western bloting检测与凋亡相关蛋白,发现促凋亡蛋白bax表达量下降,抑制凋亡蛋白bcl-xl表达量升高,bcl-3表达量升高。考虑卵巢癌细胞通过沉默cyld,进而影响凋亡相关
蛋白的表达量而影响卵巢癌的耐药。
55.实施例5:
56.罗丹明123药物积累实验检测沉默cyld后对细胞外排功能的影响。
57.1.将稳定过表达的ovcar/shnc、ovcar/shcyld1、ovcar/shcyld3细胞系分别种植与6孔板上,每个孔种植2
×
105个细胞,12h后在每孔中加入罗丹明123(浓度梯度实验浓度为:2μm,5μm),在37℃培养箱中培养2h,pbs清洗3次后,新鲜培养基培养12h,用流式细胞仪检测细胞的荧光强度。
58.2.时间梯度实验,在6孔板每孔中加入2μm罗丹明123,在37℃培养箱中培养2h,pbs清洗3次后,加入新鲜培养基,培养时间分别为12h,14h,16h,用流式细胞仪检测细胞的荧光强度。
59.3.消化收集细胞,调整细胞浓度为1
×
106个/ml。随后将细胞转移至1.5ml的ep管中,每管1ml,离心弃去上清液,冷pbs洗涤细胞3次后,细胞重悬,于激发波长488nm处,发射波长530nm处检测各组的平均荧光强度(mean fluorescence intensity,mfi)。
60.结果分析:
61.1.用不同浓度罗丹明123处理的稳定沉默cyld的卵巢癌细胞株中的荧光强度较对照低,说明沉默cyld后卵巢癌细胞的药物外派作用增强,差异有统计学意义。且2μm浓度处理组比5μm浓度处理组的差异更明显,差异有统计学意义。
62.2.不同时间处理组比较后发现,12h处理组中,药物外派作用差异更明显。16h处理组,药物外派作用未见明显差异。
63.实施例6:
64.应用western bloting检测沉默cyld的卵巢癌细胞系ovcar3中药物转运蛋白的表达量,发现药物转运蛋白abcb1表达量增高,在另一个细胞系a2780中也同样看到了相同的结果,在卵巢癌耐药细胞株中过表达cyld后,药物转运蛋白abcb1的表达量下降。说明卵巢癌耐药细胞株是通过抑制cyld表达进而促进了abcb1表达后,促进了卵巢癌耐药性的产生。
65.实施例7:
66.我们在18例卵巢癌患者组织以及6例正常卵巢组织中,通过qrt-pcr检测各例患者标本的iffo1表达水平。通过与正常卵巢组织患者的iffo1的表达水平做对比,发现iffo1在卵巢癌患者的标本中表达量明显降低,并远远低于正常脑组织中iffo1的表达水平。于是我们认为iffo1在卵巢癌的发生发展中起着抑制作用。同时,我们在患者组织样本中用western bloting检测患者组织中iffo1蛋白表达水平,也得到了同样的结果。
67.实施例8:
68.在卵巢癌铂类药物敏感细胞株ovcar3及铂类药物耐药细胞株ovcar3-ddp中,应用western bloting检测iffo1的蛋白表达水平;与铂类药物敏感株相比,铂类药物耐药株中iffo1的蛋白表达水平低。
69.实施例9:
70.通过慢病毒包装,再经过嘌呤霉素的筛选的方法构建稳定抑制iffo1表达的ovcar卵巢癌铂类药物敏感细胞株。再通过western bloting的方法检测稳定细胞株ovcar/shnc、ovcar/shiffo1-1、ovcar/shiffo1-2,经过三次验证后,确保iffo1的沉默细胞株构建完成。经过western bloting检测发现沉默iffo1的细胞株中,iffo1的表达量明显下降。验证成功
后,进行细胞药物敏感性实验。
71.将稳定过表达的ovcar/shnc、ovcar/shiffo1-1、ovcar/shiffo1-2细胞系分别种植与96孔板上,12h后向已贴壁细胞中加入顺铂,使药物终浓度分别为:30μm、10μm、7μm、5μm、3μm、1μm、0.3μm、0。培养72h后,使用cck-8试剂盒进行实验,放入多功能酶标仪进行检测,观察其od450的吸光值用于检测细胞药物敏感性实验,将数据统计汇表。发现抑制iffo1的ovcar3细胞系的药物敏感性明显下降,并有统计学意义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1