一种靶向CD44的异质型CIC细胞模型的制备方法及应用
一种靶向cd44的异质型cic细胞模型的制备方法及应用
技术领域
1.本发明属于生物技术领域,涉及一种靶向cd44基因的异质型cic(heterotypic cell-in-cell)细胞模型的制备方法及其在体外细胞和体内动物肿瘤免疫中的应用。
背景技术:
2.cell-in-cell(cic)细胞叠套结构是指一个或多个活细胞存在于另一个细胞内部形成的细胞套细胞的特殊结构,其中外部细胞(outer cell)称为靶细胞(target cell),内部细胞(inner cell)称为效应细胞(effector cell)。免疫细胞可进入多种细胞内部形成cic结构,这种不同来源的细胞间形成的cic结构称为异质型cic。比如自然杀伤细胞进入表皮癌细胞,t细胞进入肝癌细胞等。
3.异质型cic的形成机制研究较少,其形成涉及到靶细胞和效应细胞的作用,现有研究表明异质型cic形成依赖于靶细胞表达的埃兹蛋白(ezrin)、钙粘蛋白e-cadherin和肌动蛋白(actin)等;而效应细胞的作用则体现为选择性,淋巴细胞表达的mhc驱动整个进入胸腺孵育细胞的过程。但尚未发现可直接调控异质型cic形成的上游基因。
4.免疫细胞进入肿瘤细胞内部形成异质型cic常常导致内部免疫细胞的死亡,例如转移性黑色素瘤细胞吞食活的t细胞来获取营养;异质型cic结构中的nk细胞发生凋亡,导致肿瘤细胞存活。此外,异质型cic具有多种重要的生理病理功能,与肿瘤恶性程度和患者生存期相关。但是,肿瘤细胞是否利用异质型cic介导的免疫细胞死亡实现免疫逃逸尚无定论。
5.目前的异质型cic研究缺乏由特定基因调控的细胞模型,在体外研究体系中无法通过靶向特定基因而调控异质型cic形成;并且未明确内部免疫细胞的命运及对其肿瘤细胞生长的影响,在体内外研究体系中无法通过靶向异质型cic而调控肿瘤生长。
技术实现要素:
6.本发明的目的是提供一种靶向cd44的异质型cic细胞模型的制备方法及应用,通过调控作为靶细胞的肿瘤细胞中cd44基因的表达来制备得到所述靶向cd44的异质型cic细胞模型;进而促进免疫细胞对肿瘤细胞的胞内杀伤,抑制肿瘤细胞的体内外生长。
7.为实现上述目的,本发明提供如下技术方案:
8.本发明的第一方面提供一种靶向cd44的异质型cic细胞模型的制备方法,通过调控作为靶细胞的肿瘤细胞中cd44基因的表达来制备得到所述靶向cd44的异质型cic细胞模型,进而调控肿瘤胞内杀伤。
9.其中,所述靶细胞为肿瘤细胞,具体可以为肝癌细胞。所述效应细胞为免疫细胞ccrf-cem,也可以为自然杀伤细胞nk92mi。
10.进一步地,所述方法可分为如下方法a或方法b:
11.方法a:抑制所述靶细胞中cd44基因的表达或者抑制cd44蛋白的功能,从而制备所述靶向cd44的异质型cic细胞模型;
12.方法b:使所述靶细胞中过量表达cd44基因,从而制备所述靶向cd44的异质型cic细胞模型。
13.更进一步地,在所述方法a中,所述靶细胞可为cd44基因有效表达的细胞。在所述方法a中,所述靶细胞为cd44高表达的细胞系,如通过western blot检测出cd44蛋白的表达量比对照野生型细胞的多。
14.在所述方法b中,所述靶细胞可为cd44基因表达缺失或cd44基因功能缺失的细胞。在所述方法b中,所述靶细胞为cd44低表达的细胞系,如通过western blot检测到cd44蛋白的表达比对照野生型细胞的少。
15.更进一步地,在所述方法a中,抑制所述靶细胞中cd44基因的表达,能通过如下技术手段实现:
16.如通过小干扰rna(sirna)降低cd44基因在所述靶细胞中的表达;
17.或通过病毒敲低载体介导的cd44基因在靶细胞表达量降低;
18.或通过crispr-cas9技术敲除cd44基因在所述靶细胞中的表达;
19.或通过cd44蛋白的封闭性抗体hermes-1抑制cd44蛋白的活性和功能。
20.在本发明其中一个具体实施方式中,在所述方法a中,抑制靶细胞中cd44基因的表达是通过sirna和hermes-1实现的。其中,合成sirna序列靶向的cd44基因序列为ggcaacuccuaguaguaca和uguacuacuaggaguugcctg。封闭性抗体hermes-1产品信息为bioxcell#be0262,使用条件为10ug/ml处理细胞12小时。
21.在所述方法b中,使所述靶细胞中过量表达cd44基因是通过向靶细胞中导入cd44基因的重组载体实现的;
22.其中,重组表达载体为逆转录病毒载体pqcxip-egfp-n1为骨架,插入序列为基因cd44的蛋白质编码区(sequence coding for aminoacids in protein,cds),构建cd44过表达载体;
23.基因cd44被插入到病毒载体pqcxip-egfp-n1的酶切位点xhoi和ecori之间,得到cd44基因的重组表达载体;
24.通过293t细胞包装生产逆转录病毒颗粒,将表达cd44基因的逆转录病毒颗粒感染靶细胞并筛选阳性细胞,从而实现所述靶细胞中过量表达cd44基因。
25.在本发明其中一个具体实施方式中,所述cd44基因在染色体的位置为11p13,包含21个外显子,其核苷酸序列如genebank:nc_000011.10的第35139168-35232402位所示。
26.在本发明其中一个具体实施方式中,所述cell-in-cell的种类为异质型cell-in-cell,即免疫细胞进入肿瘤细胞内部形成的cell-in-cell结构。
27.本发明的第二方面,要求保护一种由上述制备方法得到的靶向cd44的异质型cic细胞模型。
28.在本发明具体实施例中,检测异质型cic细胞模型,可以通过如下技术手段实现:
29.1)如通过将肿瘤细胞与免疫细胞的共培养体系进行消化、甩片、显微拍照后统计cic形成率;
30.2)或通过活细胞工作站显微镜进行长时程地拍摄肿瘤细胞与免疫细胞的共培养体系,观察统计cic形成率;
31.3)或将不同颜色荧光蛋白标记的肿瘤细胞与免疫细胞的共培养体系进行消化、流
式检测双阳性细胞的比例来定量cic形成率。
32.在本发明其中一个具体实施方式中,制备异质型cic细胞模型是通过肿瘤细胞与免疫细胞的共培养实现的。其中,肿瘤细胞为肝癌细胞plc/prf/5,免疫细胞为ccrf-cem或nk92mi;共培养条件为肿瘤细胞与免疫细胞的比例为1∶5;肿瘤细胞贴壁生长,上方加入悬浮生长的免疫细胞;使用免疫细胞的培养基;37℃培养箱中共培养8小时。定量方法为甩片、显微拍照后统计cic形成率。
33.本发明的第三方面提供一种靶向cd44的异质型cic细胞模型在调控肿瘤免疫杀伤的应用,具体为如下任一中的应用:
34.(1)利用所述异质型cic细胞模型建立新的肿瘤治疗方案,如免疫细胞治疗;包括利用cic结构进行肿瘤杀伤、利用cic结构运输药物、基因、蛋白等;
35.(2)将待测物靶向所述异质型cic细胞模型从而评价所述待测物的生物安全性;
36.(3)利用所述异质型cic细胞模型制备肿瘤治疗药物;
37.(4)通过所述异质型cic细胞模型评价待测物对肿瘤相关疾病进程的影响;如评价待测物对肿瘤免疫杀伤、免疫逃逸及其生长的影响;
38.(5)通过或借助所述异质型cic细胞模型建立新的动物模型。
39.需要说明的是,上述提及的待测物可以为:化合物、多肽、蛋白质、基因、治疗性细胞等。
40.在所述方法a中,促进免疫细胞对所述靶细胞的免疫杀伤、抑制肿瘤生长是通过促进异质型cic结构形成及其介导的胞内杀伤实现的。
41.实验证明,使用sirna技术或者慢病毒敲低载体靶向基因cd44的特定序列,可敲低肝癌细胞plc/prf/5的内源性cd44表达;抗cd44分子的封闭性抗体hermes-1可抑制cd44蛋白的活性,进而提高plc/prf/5细胞内化免疫细胞的能力,促进异质型cic形成。诱导异质型cic细胞模型可增强免疫细胞对肿瘤细胞的体内外杀伤、抑制肿瘤生长。
42.另一方面,通过逆转录病毒表达载体转染在肝癌细胞plc/prf/5中过量表达cd44蛋白可获得抑制异质型cic细胞模型。抑制异质型cic细胞模型可减弱免疫细胞对肿瘤细胞的杀伤、促进肿瘤细胞生长。
43.本发明的有益效果:
44.1、本发明提供一种靶向cd44的异质型cic细胞模型的制备方法及应用,通过调控作为靶细胞的肿瘤细胞中cd44基因的表达来制备得到所述靶向cd44的异质型cic细胞模型;进而促进免疫细胞对肿瘤细胞的胞内杀伤,抑制肿瘤细胞的体内外生长。
45.2、本发明的发明人首次发现,cd44基因在肝癌细胞内表达降低可以促进其内化免疫细胞ccrf-cem和nk92mi的能力,促进异质型cic结构的形成;进而促进免疫细胞对肿瘤细胞的胞内杀伤(in-cell killing),抑制肿瘤细胞的体内外生长。
46.3、靶向异质型cic细胞模型可调控肿瘤免疫杀伤。抑制靶细胞中cd44基因的表达可制备诱导异质型cic细胞模型,进而促进对肿瘤的免疫杀伤(胞内杀伤);使靶细胞中过度表达cd44基因可制备抑制异质型cic细胞模型。本发明所提供的这种通过干预cd44基因表达调控异质性cic结构形成的方法,通过该方法促进异质型cic介导的胞内杀伤,实现杀死肿瘤细胞、抑制肿瘤生长的目的。
附图说明
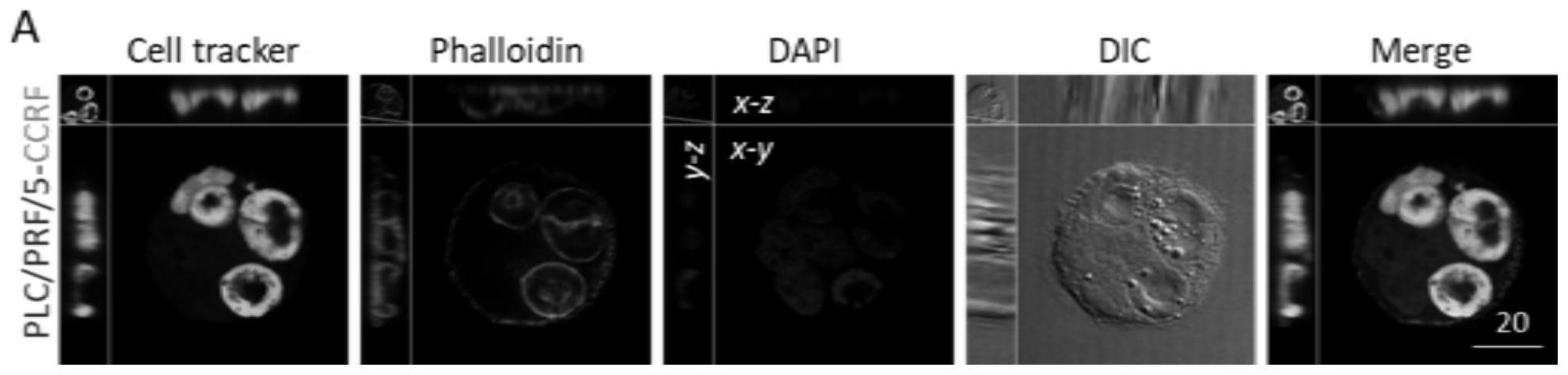
47.图1为肝癌细胞plc/prf/5内化免疫细胞ccrf-cem形成的异质型cic结构的免疫荧光示意图,绿色的cell tracker指示ccrf-cem细胞的位置,三维视野展示ccrf-cem细胞位于plc/prf/5细胞内部,比例尺20μm。
48.图2为在肝癌细胞中敲低cd44基因分别促进异质型cic形成。a:real time-pcr检测sirna处理的肝癌单克隆细胞f6ft中cd44基因的mrna表达量。b:western blot检测sirna处理的肝癌单克隆细胞f6ft中cd44基因的蛋白表达量。c:sirna处理的肝癌单克隆细胞f6ft与ccrf-cem细胞的异质型cic形成率(cell-in-cell 1=cic结构中的plc细胞数量/所有plc细胞数量)。d:sirna处理的肝癌单克隆细胞f6ft与ccrf-cem细胞的异质型cic形成率(cell-in-cell 2=cic结构中的ccrf细胞数量/所有plc细胞数量)。
49.图3为在肝癌细胞中过量表达cd44基因抑制异质型cic形成。a:real time-pcr检测肝癌单克隆细胞a4s中cd44的mrna表达量。b:western blot检测肝癌单克隆细胞a4s中cd44的蛋白表达量。c:肝癌单克隆细胞a4s与ccrf细胞的异质型cic率(cic结构中的plc细胞数量/所有plc细胞数量)。d:肝癌单克隆细胞a4s与ccrf细胞的异质型cic率(cic结构中的ccrf细胞数量/所有plc细胞数量)。
50.图4为异质型cic结构介导的胞内杀伤。a,b:肝癌细胞plc/prf/5(绿色)与免疫细胞nk92mi共培养24小时(效靶比1∶1),胞外接触杀伤和异质型cic结构介导的胞内杀伤过程(a)和杀伤效率(b),比例尺10μm,n=80(kiss),n=117(cic)。c:异质型cic结构中靶细胞和免疫细胞出现颗粒酶b(granzyme b)阳性,比例尺10μm。d:y27632(10μm)和z-aad-cmk(50μm)处理自然杀伤细胞nk92mi与肝癌细胞plc/prf/5共培养体系(效靶比4∶1)6小时,甩片后统计的异质型cic形成率。ns:p>0.05;***p<0.001。e:y27632(10μm)和z-aad-cmk(50μm)处理自然杀伤细胞nk92mi与肝癌细胞plc/prf/5共培养体系(效靶比1∶1)24小时,通过cck8试剂盒测量的肝癌细胞存活率。**p<0.01;***p<0.001。
51.图5为通过促进异质型cic形成增强免疫杀伤效率。a,b:肝癌细胞低cic形成率的单克隆f6ft与免疫细胞ccrf-cem共培养(效靶比5∶1)形成的异质型cic结构图(a),形成率(b);比例尺50μm;hermes-1预先处理f6ft细胞1小时后在f6ft细胞与nk92mi细胞的共培养体系中处理细胞8小时。c:肝癌细胞低cic形成率的单克隆f6ft与nk92mi细胞(效靶比4∶1)共培养8小时的异质型cic形成率;n>800,**p<0.01,***p<0.001,****p<0.0001。d,e,f,g:hermes-1处理nk92mi细胞与f6ft细胞的共培养体系(效靶比1∶1)24小时后,存活的f6ft细胞(d);nk92mi细胞对f6ft细胞的杀伤率(e);利用cck8试剂盒测量得到的hermes-1对nk92mi细胞(f)和肝癌细胞单克隆f6ft(g)生长的影响。比例尺50μm;*p<0.05,****p<0.0001。
52.图6为通过促进异质型cic形成抑制肿瘤生长。a:肝癌细胞在免疫缺陷小鼠皮下的移植瘤生长曲线。b,c:荷瘤21后移植瘤的照片(b)和体积(c)。d,e:肝癌细胞f6ft与免疫细胞nk92mi混合荷瘤时移植瘤中的异质型cic结构荧光显微照片(d)和形成率(e)。荷瘤时每个瘤体接种的f6ft细胞数量为1x107;nk92mi细胞5x106共3次;50μg抗体hermes-1;比例尺15μm;*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
具体实施方式
53.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
54.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
55.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
56.plc/prf/5细胞:atcc细胞库,#crl-8024。
57.ccrf-cem细胞:atcc细胞库,#ccl-119
58.nk92mi细胞:atcc细胞库,#crl-2408。
59.hek 293ft细胞:北纳生物细胞库,#bncc339263。
60.granzyme b抗体:proteintech,#13588-1-ap。
61.hermes-1抗体:bioxcell,#be0262。
62.nkp46抗体:ebioscience,#11-3351-82。
63.z-add-cmk:merck millipore,#368050。
64.scid beige小鼠:北京维通利华实验动物技术有限公司。
65.pvpack-vsv-g质粒:优宝生物,#vt8154。
66.gag/pol质粒:addgene,#14887。
67.plvx-shrna2-puro质粒:优宝生物,#vt2240。
68.pcag-dr8.9质粒:碧云天,#d8216。
69.pcmv-vsv-g质粒:addgenge,#8454。
70.sirna:购于中国苏州吉玛公司。
71.逆转录病毒载体pqcxip-egfp-n1:记载于“wang m,ning x,chen a,huang h,ni c,zhou c,et al.impaired formation of homotypic cell-in-cell structures in human tumor cells lacking alpha-catenin expression.scientific reports.2015;5:12223”一文,公众可从申请人处获得,仅可用于重复本发明实验使用。
72.逆转录病毒载体pqcxip-mcherry-n1通过将pqcxip-egfp-n1质粒的egfp荧光蛋白替换为mcherry荧光蛋白构建,构建方法为常规分子克隆方法。
73.实施例1、诱导异质型cic细胞模型的建立
74.本实施例中的靶细胞是plc/prf/5肝癌细胞的单克隆系f6ft,western blot可检测出cd44基因编码蛋白的表达(图2),具体参见本实施例步骤一6中western blot。
75.一、plc(f6ft)-shcd44敲低细胞系的建立
76.1.利用sirna敲低cd44基因
77.1)设计sirna:设计靶向cd44基因的两条sirna序列分别为5
′‑
ggcaacuccuaguaguacatt-3
′
,5
′‑
gaagacucccauucgacaatt-3
′
,由苏州吉玛公司合成。
78.2)转染sirna:利用转染试剂盒rnaimax reagent(invireogen,#13778)进行sirna转染,反应体系和条件是依据试剂盒的说明书操作。具体如下:准备1
×
105/孔肝癌细胞单克隆f6ft贴壁生长于12孔板;取sirna溶液2.5μl与rnaimax 2.5μl混合于100μl opti-mem培养基(invitrogen,#31985070)并加入到12孔板细
胞上方;静置10分钟后再加入opti-mem培养基400μl;培养6小时后换为dmem完全培养基。
79.3)提取rna:转染48小时后去除细胞原培养上清;向细胞中加入0.5ml trizol试剂(invitrogen,#15596018)使其裂解;再加入200μl氯仿剧烈震荡混匀后,室温静置5min;4℃,13000
×
g离心15min;吸取上层液体500μl至新的ep管中,加入500μl异丙醇,上下颠倒混匀,4℃静置10min;4℃,13000
×
g离心10min,弃上清,管侧、管底出现胶状沉淀;加入1ml 75%乙醇,4℃,7500
×
g离心5min,尽量弃上清;室温晾干5min,当沉淀由白色变透明即可;用20μl预热(65℃)depc水溶解;使用nanodrop2000超微量分光光度计检测rna的浓度及纯度。
80.4)反转录:反转录是利用反转录试剂盒transscript one-step gdna removal and synthesis supermix(全式金,#at311),反应体系和条件是依据试剂盒的说明书操作。具体如下:anchored oligo(dt)primer(0.5μg/μl)1μl,2
×
ts reaction mix 10μl,transscript rt/ri enzyme mix 1μl,gdna remover 1μl,total rna 1μg,rnase-free water至20μl,以上组分混匀。42℃孵育15min,85℃加热5s失活。反转录得到的20μlcdna加水80μl稀释5倍。
81.2.设计shrna序列
82.以cd44基因为靶序列ggcaactcctagtagtacaac,设计两端携带限制性酶切位点ecori、bamhi的shrna序列,正义链和反义链分别如下:
83.gatccggcaactcctagtagtacaaccttcctgtcagagttgtactactaggagttgcctttttg;
84.aattcaaaaaggcaactcctagtagtacaactctgacaggaaggttgtactactaggagttgccg(大写字母为载体骨架,小写字母为靶向cd44基因特定序列)。
85.3.构建敲低cd44-shrna的质粒
86.1)制备双链:将100μm正义单链和反义单链溶液混合,通过梯度退火制成双链;
87.2)酶切:将慢病毒载体plvx-shrna2-puro用限制性内切酶ecori(neb,#r0101s)、bamhi(neb,#r0136s)进行双酶切(37℃,1小时),通过dna纯化回收试剂盒(天根,#dp214-03)纯化回收得到酶切片段;
88.3)连接:利用t4 dna连接酶(neb,#m0202s)将shrna双链片段与载体骨架进行连接(16℃过夜或者室温30分钟);
89.4)转化:连接后的敲低质粒shcd44转化到大肠杆菌感受态(全式金,#cd101),含氨苄青霉素(100μg/ml)的lb培养基37℃过夜培养筛选;
90.5)测序:挑选大肠杆菌单克隆测序,选择测序正确的质粒进行保存。
91.4.包装敲低cd44-shrna的病毒
92.1)铺细胞:按1
×
106个每孔种植hek 293ft细胞于鼠尾i型胶原溶液(bd,#34236)包被过的六孔板,贴壁生长12h之后转染。
93.2)包被:使用ltx&plus
tm reagent(invitrogen,#15338-100)配制质粒脂质体复合物,(a)配dna-plus complex:4μl plus、500ng pcag-dr8.9质粒、400ng慢病毒载体和60ng pcmv-vsvg质粒,加opti-mem减血清培养基定容至100μl。(b)配lipofectamine mix:5μl lipofectamine ltx,95μl opti-mem。(c)将dna-plus complex和lipofectamine mix混合后,将hek 293ft细胞的dmem培养基替换成包含质粒脂质体复合物的opti-mem培养基。(d)37℃孵育6h后,弃opti-mem培养基,加入含血清的dmem完全培养基。
94.3)收集病毒:收集24h病毒上清,暂存于4℃,与48h病毒上清混合,用于感染,使用前应2500rpm离心5min,将悬浮的细胞和碎片离心弃去。
95.5.cd44-shrna的病毒感染plc细胞单克隆f6ft
96.1)病毒感染:病毒侵染前一天,种植待感染细胞f6ft至6孔板内使其贴壁生长至汇合度30%。次日,弃去原培养基,将0.5ml完全培养基、1ml病毒上清和1.5μl polybrene(终浓度5μg/ml)混匀后加入,使病毒侵染。第三天上午更换培养基,使细胞恢复生长状态。
97.2)筛选稳定转染的细胞系。第四天,更换含嘌呤霉素puromycin(终浓度1μg/ml)的培养基,筛选细胞。
98.6.实时定量rt-pcr检测cd44敲低效率
99.1)铺细胞:取转染cd44-shrna质粒、对照空载的f6ft细胞2.5
×
105个/孔铺于12孔板中;
100.2)提取rna。
101.3)反转录。
102.4)rt-pcr:荧光定量pcr是利用试剂sybr green realtime pcr master mix(toyobo,#qpk-201),反应体系和条件是依据试剂盒的说明书操作。具体如下:2
×
sybr premix ex taqtmii4.5μl,10μmforward primer0.25μl,10μmreverse primer0.25μl,cdna1μl,nuclease-free water4μl,以上组分混匀。pcr程序中循环40次。所用cd44基因的rt-pcr引物由中美泰和公司合成,正义链为gacagaatccctgctaccac,反义链为taccagccatttgtgttgttg。
103.7.western blot检测cd44敲低效率
104.1)提取蛋白质:在10cm培养皿中培养转染cd44-shrna质粒、对照空载的f6ft细胞至汇合度约80-90%,加入500μl预冷的细胞裂解液ripa(含蛋白酶抑制剂、蛋白磷酸酶抑制剂),裂解液充分覆盖细胞,刮刀刮取细胞并收集至1.5ml离心管。4℃、12000rpm、10min离心,取上清。取1μl上清用于bca法蛋白定量(thermofisher,#23225)。剩余上清中加入5
×
loading buffer(即sds上样缓冲液),100℃加热10min变性。
105.2)免疫印迹实验:配制10%sds-page凝胶。加样,每个加样孔内加入蛋白20μg。电泳通电,电压60v、20min使蛋白进入浓缩胶,当染料进入分离胶后,电压改为100v、90min。取蛋白胶转膜至0.2μm孔径的pvdf膜,转膜条件:100v、1h。取出pvdf膜置于5%(质量百分比)脱脂奶粉中室温放置1h进行封闭。接着孵育待检测分子的一抗)放置于4℃摇床过夜,如抗cd44抗体(博士德,#bm0321)1∶1000溶解于脱脂奶粉。置于1
×
tbst溶液中洗涤3
×
10min。孵育相应种属的二抗(1∶3000)室温1h。置于1
×
tbst溶液中洗涤3
×
10min。
106.3)显影:pvdf膜平铺于保鲜膜上方,滴加化学发光液(thermofisher,#34095)适量至完全覆盖膜,避光孵育1-2min。pvdf膜平铺于压片暗盒,暗室中将x光片放入压片暗盒内pvdf膜上方适当时间,取x光片依次放入显影液-水-定影液;室温晾干,标上marker、样品名称。或者在化学发光之后使用显影仪器进行曝光显影、拍照记录。
107.rt-pcr和western blot结果表明:与对照相比,转染敲低质粒后肝癌细胞单克隆f6ft的cd44基因表达量在mrna水平和蛋白水平都显著降低(图2a,b)。
108.二、异质型cic形成实验
109.1.肿瘤细胞贴壁培养
110.第一天,12孔板内每孔铺1.0
×
105肝癌细胞plc/prf/5,过夜培养至贴壁。
111.2.加入免疫细胞共培养
112.第二天,细胞计数,按效应细胞(免疫细胞)∶靶细胞(肿瘤细胞)=5∶1计算,每个孔需要ccrf-cem细胞(带绿色荧光蛋白egfp标记,或者利用cell tracker进行染色)5.0
×
105,细胞离心(1000rpm,3min)沉淀后备用。将漂洗过的ccrf-cem细胞用1ml/孔的完全培养基重悬,加入长有plc/prf/5细胞的12孔板(弃原培养上清),细胞混匀,共培养8h。
113.3.细胞甩片
114.弃去培养上清,用pbs润洗2次,加入胰酶消化并重悬细胞。准备好甩片装置并在每个甩片孔内加入200μl细胞重悬液进行甩片(500rpm、4min),细胞被离心至粘附载玻片上。
115.4.制片
116.将载玻片放置于4%多聚甲醛溶液(质量体积比)中固定细胞,室温放置10min。用pbs润洗3
×
10min,加入5%bsa配制的alexa fluor 594phalloidin(终浓度5μg/ml,invitrogen,#a12381)溶液孵育室温1h;加入20μl封片剂(含dapi,中衫金桥)将细胞覆盖,用盖玻片小心覆盖。放入避光湿盒中,室温放置24h等待干燥。
117.5.异质型cic统计
118.宽场荧光显微镜(尼康)拍照,使用405nm、488nm、568nm、dic通道拍摄20倍镜。每张载玻片随机选取六个视野,每个视野至少统计200个细胞,dapi标记细胞核。定义绿色的免疫细胞完全被红色肿瘤细胞包裹的结构为异质型cic结构;定义异质型cic形成率=100%
×
视野内异质型cic结构中的免疫细胞数目/视野内肿瘤细胞总数目。
119.异质型cic结构如图1a所示,mcherry-phalloidin标记细胞膜骨架为红色荧光,dapi标记细胞核为蓝色荧光。统计结果表明,通过shrna敲低cd44基因在肝癌细胞的表达,可显著地促进肝癌细胞内化免疫细胞、增加异质型cic结构形成。
120.实施例2、抑制异质型cic细胞模型的建立
121.本实施例中的靶细胞是plc/prf/5肝癌细胞的单克隆系a4s,western blot可检测出cd44基因编码蛋白的表达较低(图3),具体参见本实施例步骤一6中western blot。
122.一、plc(a4s)-cd44过表达细胞系的建立
123.1.构建过表达cd44的质粒
124.1)pcr扩增cd44片段:以cdna为模板pcr扩增带有xho i、ecor i酶切位点的cd44基因编码序列片段cds,并使用胶dna片段回收试剂盒(天根,#dp208-02)进行纯化。
125.2)酶切:将pqcxip-egfp-n1骨架质粒和pcr扩增的cd44片段与限制性内切酶xho i、ecor i(new england biolabs公司)及反应buffer混合,37℃放置1小时进行双酶切;再次进行胶回收纯化。
126.3)dna连接:将上述双酶切的骨架质粒与cd44插入片段及t4 dna连接酶混合,室温放置30分钟。
127.4)转化:连接好的过表达质粒egfp-cd44利用水浴热激、冰浴冷却的方法转化到大肠杆菌感受态trans10,氨苄筛选;
128.5)测序:挑选单克隆测序,选择测序正确质粒进行保存。
129.2.包装过表达cd44的病毒
130.所用逆转录病毒包装质粒为pvpack-vsv-g和gag/pol。转染试剂为
2000 reagent(invitrogen,#11668)。
131.3.过表达cd44的病毒液感染plc/prf/5细胞单克隆a4s
132.4.rt-pcr检测cd44过表达效率
133.5.western blot检测cd44过表达效率
134.rt-pcr和western blot结果表明:与对照相比,转染过表达质粒后肝癌细胞单克隆a4s的cd44基因表达量在mrna水平和蛋白水平都显著升高(图3a,b)。
135.方法同实施例1中步骤一3-7。
136.二、异质型cic形成实验
137.1.肝癌细胞a4s贴壁培养
138.2.加入ccrf-cem细胞共培养
139.3.细胞甩片
140.4.制片
141.5.异质型cic统计
142.方法同实施例1中步骤二1-5。肝癌细胞单克隆a4s细胞过量表达cd44可显著抑制异质型cic结构形成(图3c,d)。
143.实施例3、抑制胞内杀伤模型的建立
144.本实施例中的靶细胞是plc/prf/5肝癌细胞的单克隆系a4s(高异质型cic形成率),异质型cic形成实验检测肝癌细胞内化免疫细胞的效率。
145.一、胞内杀伤实验
146.1.构建表达荧光蛋白的细胞系
147.利用hek 293ft细胞包装逆转录病毒液,将逆转录病毒载体pqcxip-mcherry-n1和pqcxip-mcherry-n1分别与包装质粒pvpack-vsv-g和gag/pol混合后,用转染试剂2000 reagent(invitrogen,#11668)转染hek 293ft细胞。取pqcxip-egfp-n1病毒液感染肝癌细胞单克隆a4s和f6ft,取pqcxip-mcherry-n1病毒液感染免疫细胞ccrf-cem,嘌呤霉素筛选阳性细胞。
148.2.肝癌细胞a4s贴壁培养
149.第一天,玻璃底12孔板每孔铺1.0
×
105肝癌细胞,过夜培养让肿瘤细胞贴壁。
150.3.加入nk92mi细胞共培养
151.取nk92mi细胞并计数,按效应细胞∶靶细胞=1∶1计算,细胞离心(1000rpm,3min)沉淀后备用。实验组为表达绿色荧光蛋白egfp的a4s细胞上方加入等比例的nk92mi细胞;对照组为单独培养的肝癌细胞a4s。
152.4.显微镜拍摄
153.使用尼康宽场荧光显微镜的20倍物镜,dic和fitc通道长时程拍摄肝癌细胞与nk92mi细胞的共培养体系,每隔20分钟拍摄一次,共拍摄24小时。
154.5.统计分析杀伤率。
155.nk92mi细胞可在a4s细胞的胞外进行接触杀伤,nk92mi细胞也可进入a4s细胞内部形成异质型cic结构并对a4s细胞进行胞内杀伤,分别统计胞外接触杀伤和cic结构的胞内杀伤效率。接触杀伤率=100%
×
被nk92mi细胞从胞外接触过并死亡a4s细胞数/被nk92mi
细胞从胞外接触过的a4s细胞总数;胞内杀伤率=100%
×
异质型cic结构中死亡的a4s细胞数/形成异质型cic结构的a4s细胞总数。
156.统计结果表明,形成异质型cic结构的胞内杀伤效率远高于胞外接触的杀伤效率(图4a,b)。
157.二、异质型cic形成实验
158.1.肝癌细胞a4s贴壁培养
159.2.加入ccrf-cem细胞共培养
160.3.细胞甩片
161.4.制片
162.5.异质型cic统计
163.方法同实施例1中步骤二1-5。异质型cic结构如图4c,d所示。统计结果表明,rock信号通路的抑制剂y27632可显著地抑制肝癌细胞异质型cic结构形成。
164.三、体外免疫杀伤实验
165.1.肝癌细胞f6ft贴壁培养
166.第一天,48孔板每孔铺1.0
×
104绿色荧光egfp标记的肝癌细胞a4s,过夜培养让肝癌细胞贴壁
167.2.加入nk92mi细胞共培养
168.取nk92mi细胞并计数,按效∶靶=1∶1计算,细胞离心(1000rpm,3min)沉淀后备用。实验组为肿瘤细胞a4s上方加入等比例的nk92mi细胞;对照组1为不加nk92mi的单独肿瘤细胞;对照组2为不加肿瘤细胞的单独nk92mi细胞。每个组别设置3个重复,加入dmso、y27632(10μm)、z-aad-cmk(50μm)培养细胞24小时。
169.3.cck8试剂盒测量细胞数量
170.共培养结束后保留细胞培养基,然后在每孔加入cck8试剂(日本同仁化学,#ck04)10μl,室温孵育10分钟,使用酶标仪测量od450nm波长的吸光度。
171.4.统计分析肝癌细胞存活率,肝癌细胞存活率=100%
×
(肝癌细胞和nk92mi细胞混合体系的吸光度-nk92mi细胞单独培养的吸光度)/肝癌细胞单独培养的吸光度;肝癌细胞杀伤率=1-肝癌细胞存活率。
172.5.步骤3-4也可替换为:共培养结束后洗去肝癌细胞与nk92mi细胞共培养体系中的nk92mi细胞;消化、重悬肝癌细胞并计数。杀伤率=100%
×
肝癌细胞和nk92mi细胞混合培养体系中的肝癌细胞数量/肝癌细胞单独培养的数量。
173.统计结果表明,rock信号通路的抑制剂y27632(mce,#hy-10071)和颗粒酶b的抑制剂z-aad-cmk(merck millipore,#368050)可显著提高肝癌细胞的存活率、抑制nk92mi细胞对肝癌细胞的杀伤率(图4e)。
174.实施例4、诱导胞内杀伤模型的建立
175.本实施例中的靶细胞是plc/prf/5肝癌细胞的单克隆系f6ft(低异质型cic形成率),异质型cic形成实验检测肝癌细胞内化免疫细胞的效率。
176.一、异质型cic形成实验
177.1.肝癌细胞f6ft贴壁培养
178.2.加入免疫细胞共培养
179.共培养的免疫细胞可以是ccrf-cem或者nk92mi;igg(50μg)、hermes-1(1μg、10μg、50μg三个浓度)预先处理肝癌细胞1小时,再处理肝癌细胞和免疫细胞的共培养体系8小时。
180.3.细胞甩片
181.4.制片
182.5.异质型cic形成率统计
183.方法同实施例1中步骤二1-5。抗cd44的封闭性抗体hermes-1可显著提高肝癌细胞内化免疫细胞ccrf-cem和nk92mi的能力并具有浓度依赖效应,促进异质型cic结构形成(图5a-c)。
184.二、体外免疫杀伤实验
185.1.肝癌细胞f6ft贴壁培养
186.2.加入nk92mi细胞共培养
187.设置1μg、10μg、50μg三个浓度浓度的hermes-1分别处理肝癌细胞和nk92mi细胞的培养体系24小时,每个组别设置3个重复。
188.3.cck8试剂盒测量细胞数量
189.4.统计分析plc细胞存活率
190.方法同实施例3中步骤三1-5。统计结果表明,抗cd44的封闭性抗体hermes-1可显著提高nk92mi细胞对肝癌细胞的杀伤率、对于肝癌细胞和nk92mi细胞各自的细胞生长没有影响(图5d-g)。
191.实施例5、诱导异质性cic模型在治疗动物肿瘤模型中的应用
192.一、体内免疫杀伤实验
193.1.小鼠皮下荷瘤
194.培养扩增肝癌细胞plc/prf/5的单克隆系f6ft和nk92mi细胞,将细胞分为四组分别为f6ft细胞混合igg抗体、f6ft细胞混合hermes-1抗体、f6ft细胞混合nk92mi细胞、f6ft细胞混合hermes-1抗体和nk92mi细胞。每组5只scid beige小鼠,每只小鼠背部皮下左右两侧荷瘤。每侧接种数量为f6ft细胞1
×
107、nk92mi细胞5
×
106、igg抗体50μg、hermes-1抗体50μg。荷瘤后每3天测量记录一次移植瘤长径、短径,移植瘤体积=(短径2×
长径)/2。
195.2.移植瘤体积统计
196.小鼠皮下荷瘤后第21天处死小鼠取出移植瘤并拍照,统计移植瘤体积。
197.统计结果表明,与肝癌细胞单独荷瘤相比,hermes-1抗体和nk92mi细胞均可抑制肝癌细胞的生长;hermes-1抗体和nk92mi细胞混合荷瘤组的瘤体最小,即hermes-1抗体和nk92mi细胞可协同抑制肝癌移植瘤的生长(图6a-c)。
198.3.免疫荧光染色
199.重复试验步骤三1-2,荷瘤3天后处死小鼠取出移植瘤,对移植瘤进行福尔马林固定、石蜡包埋、切片、免疫荧光染色,使用抗体为nkp46(1∶200;ebioscience,#11-3351-82)标记nk92mi细胞,抗体e-cadherin(1∶300;bd biosciences,#610182)标记细胞膜。
200.4.统计cic形成率
201.荧光显微镜20倍物镜拍摄fitc、mcherry、dapi、dic通道,统计异质型cic形成率,共统计3个以上的拍摄视野、1000以上的细胞总数。异质型cic结构定义为nkp46标记nk92mi细胞完全位于肝癌细胞内部,异质型cic形成率=100%
×
cic结构中的nk92mi细胞数量/统
计视野内的肝癌细胞总数。
202.统计结果表明,与对照igg抗体相比,hermes-1抗体可显著提高肝癌移植瘤中的异质型cic形成率(图6d-e),异质型cic形成率高hermes-1处理组的移植瘤生长受到抑制。
203.需要说明的是,在本文中,诸如术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
204.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1