一种降压起效温和、作用平稳、长效的ACE抑制肽及其应用
一种降压起效温和、作用平稳、长效的ace抑制肽及其应用
技术领域
1.本发明属于生物活性肽领域,具体涉及一种降压起效温和、作用平稳、长效的ace抑制肽及其应用。
背景技术:
2.心血管疾病(cardiovascular diseases,cvd)是当今社会重大的公共卫生问题之一。常见的心血管疾病包括冠心病、中风、心力衰竭、高血压心脏病、血栓栓塞性疾病等。高血压、糖尿病、高胆固醇血症、不良饮食等因素均可能引起心血管疾病。
3.高血压,也称血压升高。2021年,世界卫生组织(who)发布的首份《全球高血压流行趋势综合分析报告》显示,目前全世界30-79岁约有12.8亿人患有高血压,且超过一半的高血压患者,共7.2亿人没有得到必要的治疗,通过药物将血压有效控制在正常水平的高血压患者不足1/4,而持续的高血压会显著加剧罹患大脑、心脏、肾脏等疾病的风险。目前针对高血压的治疗研究主要集中在开发β-受体阻断药、血管紧张素转化酶(angiotensin converting enzyme,ace)抑制剂、血管紧张素ⅱ受体阻断药等,这些药物在临床上取得了很好的治疗效果,同时也有一定的副作用:咳嗽、头晕、疲劳、味觉丧失以及血管水肿等。
4.与人体血压有关的两个系统为肾素-血管紧张素系统(renin-angiotensin system,ras)和激肽释放酶-激肽系统(kallikrein-kinin system,kks),前者为升压系统,后者为降压系统。ace同时参与ras和kks系统,且在其中起着重要作用,因此开发ace抑制剂为近年的研究热点。食源性生物活性肽因其来源广泛、活性多样、具有较高的安全性等特点,成为食品健康领域的研究热点,目前,已有许多研究表明,一些生物活性肽具有抑制ace的活性,对正常血压没有影响这一类肽被称为ace抑制肽。
5.目前的生物活性肽主要以口服的形式进入人体。ace主要分布于人体的组织和血液中,ace抑制肽需要被小肠吸收后才能与ace接触,在人体中发挥作用。因此,通过体外活性验证所得的ace抑制肽具有容易被小肠吸收的特点显得尤为重要。另外,血压急速下降可能出现出汗严重、面色苍白、呼吸衰竭等症状,因此,亟需开发降压起效温和、作用平稳、长效的降压类产品。
技术实现要素:
6.本发明的目的在于提供一种降压起效温和、作用平稳、长效的ace抑制肽。
7.本发明的另一个目的在于提供上述降压起效温和、作用平稳、长效的ace抑制肽的应用。
8.本发明的上述目的通过以下技术方案实现:
9.一种六肽,为降压起效温和、作用平稳、长效的ace抑制肽,其氨基酸序列为gly-pro-phe-pro-ile-ile(gpfpii),分子量为642.37da。
10.gly表示英文名为glycine,中文名为甘氨酸的氨基酸的相应残基。
11.pro表示英文名为proline,中文名为脯氨酸的氨基酸的相应残基。
12.phe表示英文名为phenylalanine,中文名为苯丙氨酸的氨基酸的相应残基。
13.ile表示英文名为isoleucine,中文名为异亮氨酸的氨基酸的相应残基。
14.所述的降压起效温和、作用平稳、长效的ace抑制肽可以从酪蛋白酶解产物中获得,也可以通过化学法合成。
15.上述降压起效温和、作用平稳、长效的ace抑制肽的制备方法,包括以下步骤:
16.s1.酪蛋白的提取
17.采用碱溶酸沉的方法从牛初乳中提取出酪蛋白;
18.s2.向酪蛋白溶液中加入胰蛋白酶,胰蛋白酶的水解条件为:温度为37℃、ph=8.0,水解4h后,终止水解,冷却至室温,离心,收集上清,得到酪蛋白酶解产物;将酪蛋白酶解产物超滤分离,取mw《3kda的组分;
19.s3.将mw《3kda的组分进行色谱分离,分别得到组分a1,a2,a3,a4,a5;
20.s4.测定组分a1,a2,a3,a4,a5的ace抑制活性,ace抑制活性最强的即为ace抑制肽,氨基酸序列为gly-pro-phe-pro-ile-ile。
21.步骤s1中采用碱溶酸沉的方法从牛初乳中提取出酪蛋白的方法优选为:将牛初乳冻干粉溶解于水中,离心,取上清液;调节上清液ph至4.6,冷却,离心,取沉淀即为粗酪蛋白;将粗酪蛋白依次用水和乙醇洗涤、离心,取沉淀冻干,即得酪蛋白冻干粉。
22.所述的采用碱溶酸沉的方法从牛初乳中提取出酪蛋白的方法中,
23.所述的牛初乳冻干粉在搅拌加热条件下溶解于水中。
24.所述的离心的条件优选为3000~4000r/min、10~20min、4℃;更优选为3500r/min、15min、4℃。
25.所述的调节上清液ph至4.6的试剂优选为hcl;更优选为1.0mol/l hcl。
26.所述的水优选为纯净水。
27.所述的乙醇优选为95%乙醇。
28.步骤s2中胰蛋白酶的加酶量优选为2000~4000u/g;更优选为3000u/g。
29.步骤s2中向酪蛋白溶液中加入胰蛋白酶后,酪蛋白的终浓度优选为30~50mg/ml;更优选为40mg/ml。
30.步骤s2中所述的终止水解的方法优选为沸水浴加热法终止水解;更优选为沸水浴加热10min。
31.步骤s2中所述的离心的条件优选为:6000~8000g/min、10~30min、4℃;更优选为:7000g/min、20min、4℃。
32.步骤s3中所述的色谱分离的色谱柱优选为凝胶过滤色谱柱;更优选为凝胶过滤色谱柱sephadex g-25。
33.所述的色谱分离的条件优选为:洗脱液为纯净水,洗脱流速为0.5ml/min,检测波长为230nm,每6min收集一管。
34.所述的降压起效温和、作用平稳、长效的ace抑制肽在制备具有降血压作用的药物、保健品和功能性食品中的应用。
35.所述的降血压作用还包括预防高血压或辅助降血压作用。
36.一种降血压药物,其含有上述ace抑制肽作为活性成分。
37.一种保健品,其含有上述ace抑制肽作为活性成分。
38.一种功能性食品,其含有上述ace抑制肽作为活性成分。
39.本发明的降压起效温和、作用平稳、长效的ace抑制肽(六肽gpfpii)对ace的抑制作用随着时间变化,在4h内作用明显,随着作用时间的延长,其功效减弱,表现出温和的ace抑制作用。
40.与现有技术相比,本发明具有如下优点和有益效果:
41.(1)本发明的降压起效温和、作用平稳、长效的ace抑制肽(六肽gpfpii)具有明显的ace抑制活性,且经过肽跨膜转运实验显示,本发明的六肽(gpfpii)具有较高的生物利用度。
42.(2)本发明的降压起效温和、作用平稳、长效的ace抑制肽(六肽gpfpii)能够在较短的时间内有效抑制ace的活性,且作用时间较长,具有温和的抑制效果,可用于降血压的食品、保健品和药品中。
附图说明
43.图1为酪蛋白酶解产物、组分a、组分b和组分c的ace抑制活性结果图。
44.图2为sephadex g-25凝胶过滤色谱对组分a进行分离纯化的洗脱曲线图。
45.图3为sephadex g-25凝胶过滤色谱各洗脱峰组分对ace的抑制活性结果图。
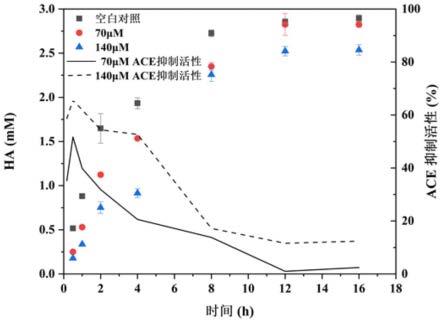
46.图4为六肽gly-pro-phe-pro-ile-ile 16h内ace抑制活性变化结果图。
具体实施方式
47.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
48.实施例1:六肽的分离纯化
49.gly-pro-phe-pro-ile-ile六肽的分离纯化方法,包括以下步骤:
50.(1)酪蛋白的提取:采用碱溶酸沉的方法从牛初乳中提取出酪蛋白。具体为将牛初乳冻干粉(购于广州市乳白金贸易有限公司)溶解于纯净水中,在40℃下充分搅拌至牛初乳冻干粉溶解,离心(3500r/min、15min、4℃),去除不溶解的物质,得上清液。使用1.0mol/l的hcl将上清液ph调至4.6,待上清液冷却至室温后,离心(3500r/min、15min、4℃)所得沉淀便为粗酪蛋白。使用少量纯净水清洗沉淀2次,离心(3500r/min、15min、4℃),去除部分水溶性杂质;用95%的乙醇清洗沉淀,搅拌后,离心(3500r/min、15min、4℃)重复两次,去除脂类杂质;将上述离心后的沉淀重新溶解于纯净水中,冻干,获得酪蛋白冻干粉。
51.(2)酪蛋白酶解物的制备:将步骤(1)得到的酪蛋白冻干粉溶解于50mm tris-hcl缓冲液(ph=8.0)中,酪蛋白终浓度为40mg/ml,使用胰蛋白酶在37℃下酶解4h,加酶量为3000u/g;随后沸水浴中加热10min,终止水解,冷却至室温后,离心(7000g/min,20min,4℃),收集上清液,得到酪蛋白酶解产物。
52.使用分子量为10kda和3kda的超滤膜将酪蛋白酶解产物分为三个组分,分别为组分a(mw《3kda),组分b(mw=3kda-10kda),组分c(mw>10kda),冷冻干燥,测试酪蛋白酶解产物和上述三个组分的ace抑制活性。
53.酪蛋白酶解产物,组分a,组分b,组分c的ace抑制活性的测定方法如下:
54.底物hhl溶液(5mm,30μl)和10μl、0.5mg/ml各组分(酪蛋白酶解产物,组分a,组分
b,组分c)样品溶液混合,在37℃的摇床中温浴6min,得到混合液。同时,血管紧张素转化酶(ace)溶液单独温浴6min。往上述混合液中加入温浴后的ace溶液(0.1u/l,20μl)混合均匀,于摇床(37℃,120rpm)中反应30min,反应结束后,加入hcl(1m,60μl)终止反应,为样品组的ha产物。同时以10μl硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3m nacl)为空白对照。
55.通过高效液相色谱法分别测定样品组和空白对照组的ha产物在228nm处的峰面积。反应体系总体积为120μl,且底物、样品和ace溶液均由上述硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3mnacl)配置。
56.ace抑制活性计算公式如下:
[0057][0058]
式中,a
空白
指空白对照组的ha产物峰面积;a
样品
指样品组的ha产物峰面积。
[0059]
高效液相色谱法:采用waters c-18(150*4.6mm,粒径5μm)色谱柱;流动相a为0.05%三氟乙酸-水溶液,流动相b为乙腈,流动相设置为75%的流动相a与25%的流动相b;流速0.5ml/min,柱温25℃,进样量为20μl,在228nm波长下分别测定样品组和空白对照组产物(ha)的出峰面积。
[0060]
结果如图1所示,组分a具有最佳的ace抑制活性,将组分a进一步分离纯化。
[0061]
(3)分离纯化得到ace抑制肽:使用凝胶过滤色谱柱sephadex g-25对组分a进行分离纯化,上样量为3ml(50mg/ml),用纯净水以0.5ml/min的流速进行洗脱,检测波长为230nm,每6min收集一管。
[0062]
洗脱曲线如图2所示,收集合并成5个组分(a1,a2,a3,a4,a5),测试组分a,a1,a2,a3,a4,a5的ace抑制活性。结果如图3所示,组分a2的ace抑制活性最强。
[0063]
组分a,a1,a2,a3,a4,a5的ace抑制活性的测定方法如下:
[0064]
底物hhl溶液(5mm,30μl)和10μl、0.5mg/ml各组分(a,a1,a2,a3,a4,a5)样品溶液混合,在37℃的摇床中温浴6min,得到混合液。同时,血管紧张素转化酶(ace)溶液单独温浴6min。往上述混合液中加入温浴后的ace溶液(0.1u/l,20μl)混合均匀,于摇床(37℃,120rpm)中反应30min,反应结束后,加入hcl(1m,60μl)终止反应,为样品组的ha产物。同时以10μl硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3m nacl)为空白对照。
[0065]
通过高效液相色谱法分别测定样品组和空白对照组的ha产物在228nm处的峰面积。反应体系总体积为120μl,且底物、样品和ace溶液均由上述硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3mnacl)配置。
[0066]
ace抑制活性计算公式如下:
[0067][0068]
式中,a
空白
指空白对照组的ha产物峰面积;a
样品
指样品组的ha产物峰面积。
[0069]
高效液相色谱法:采用waters c-18(150*4.6mm,粒径5μm)色谱柱;流动相a为0.05%三氟乙酸-水溶液,流动相b为乙腈,流动相设置为75%的流动相a与25%的流动相b;流速0.5ml/min,柱温25℃,进样量为20μl,在228nm波长下分别测定样品组和空白对照组产物(ha)的出峰面积。
[0070]
(4)对组分a2进行液质测试,目标六肽序列是gly-pro-phe-pro-ile-ile
(gpfpii)。
[0071]
实施例2:gly-pro-phe-pro-ile-ile六肽的活性检测。
[0072]
本实施例的六肽gpfpii由南京金斯瑞生物科技有限公司合成,其分子量为642.37da,通过如下方法检验六肽gpfpii的ace抑制活性。
[0073]
(1)ace抑制活性的测定
[0074]
底物hhl溶液(5mm,30μl)和10μl 25~500μm六肽gpfpii样品溶液混合,在37℃的摇床中温浴6min,得到混合液。同时,血管紧张素转化酶(ace)溶液单独温浴6min。往上述混合液中加入温浴后的ace溶液(0.1u/l,20μl)混合均匀,于摇床(37℃,120rpm)中反应30min,反应结束后,加入hcl(1m,60μl)终止反应,为样品组的ha产物。同时以10μl硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3m nacl)为空白对照。
[0075]
通过高效液相色谱法分别测定样品组和空白对照组的ha产物在228nm处的峰面积,反应体系总体积为120μl,且底物、样品和ace溶液均由上述硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3mnacl)配置。
[0076]
ace抑制活性计算公式如下:
[0077][0078]
式中,a
空白
指空白对照组的ha产物峰面积;a
样品
指样品组的ha产物峰面积。
[0079]
高效液相色谱法:采用waters c-18(150*4.6mm,粒径5μm)色谱柱;流动相a为0.05%三氟乙酸-水溶液,流动相b为乙腈,流动相设置为75%的流动相a与25%的流动相b;流速0.5ml/min,柱温25℃,进样量为20μl,在228nm波长下分别测定样品组和空白对照组产物ha的出峰面积。
[0080]
结果表明六肽gpfpii可有效抑制ace的活性,其ace半抑制浓度(ic
50
)为61.928
±
0.0225μm。
[0081]
实施例3:gly-pro-phe-pro-ile-ile六肽的吸收特性
[0082]
(1)肽跨膜转运实验
[0083]
人结直肠腺癌细胞caco-2细胞(购于atcc公司;下同)在transwell小室生长完整后,用hbss缓冲液(购于美国gibco公司,ph 7.4)轻轻冲洗细胞3次后,加入含有1mm六肽(gpfpii)(由南京金斯瑞生物科技有限公司合成,分子量为642.37da)的hbss缓冲液0.15ml,培养2h后收集bl侧的溶液通过高效液相色谱法检测bl侧溶液中gpfpii的含量。
[0084]
高校液相色谱法:采用inertsil ods-sp(250*4.6mm)色谱柱,流动相a为0.065%三氟乙酸-水溶液,流动相b为0.05%三氟乙酸-乙腈溶液,流动相梯度设置如表1,流速1ml/min,柱温25℃,进样量为20μl,在220nm波长下测定bl侧溶液中gpfpii的出峰面积。
[0085]
表1:流动相梯度设置
[0086]
[0087][0088]
六肽gpfpii在caco-2细胞单层膜上转运2h后,检测bl侧溶液中的六肽gpfpii含量,经过计算得转运2h后,bl侧溶液中的六肽gpfpii含量为225.64
±
9.22μm。ding等人从卵清蛋白中发现的ace抑制肽qiglf,在caco-2细胞单层膜上转运2h后,bl侧的qiglf含量仅为5μm,与之相比,本发明的六肽gpgpii具有更优的转运效果,说明六肽gpfpii在肠道中具有较高的生物利用度的潜能。
[0089]
实施例4:gly-pro-phe-pro-ile-ile六肽的代谢特性
[0090]
(1)ace抑制活性的测定
[0091]
底物hhl溶液(5mm,30μl)和10μl、浓度分别为70μm和140μm的gpfpii六肽样品(由南京金斯瑞生物科技有限公司合成,分子量为642.37da)混合,在37℃的摇床中温浴6min,得到混合液。同时,血管紧张素转化酶(ace)溶液单独温浴6min。往上述混合液中加入温浴后的ace溶液(0.1u/l,20μl)混合均匀,于摇床(37℃,120rpm)中分别反应0.167h、0.5h、1h、2h、4h、8h、12h和16h,反应结束后,加入hcl(1m,60μl)终止反应,作为样品组的ha产物。以10μl硼酸盐缓冲液(ph=8.3、0.1mol/l,含有0.3m nacl)为空白对照。
[0092]
分别通过高效液相色谱法测定样品组和空白对照组的ha产物在228nm处的峰面积,反应体系总体积为120μl,且底物、样品和ace溶液均由上述硼酸盐缓冲液(ph=8.3、0.1mol/l)配置。
[0093][0094]
式中,a
空白
指空白对照组的ha产物峰面积;a
样品
指样品组的ha产物峰面积。
[0095]
高效液相色谱法:采用waters c-18(150*4.6mm,粒径5μm)色谱柱;流动相a为0.05%三氟乙酸-水溶液,流动相b为乙腈,流动相设置为75%的流动相a与25%的流动相b;流速0.5ml/min,柱温25℃,进样量为20μl,在228nm波长下测定ha产物的出峰面积。
[0096]
如图4所示,不同浓度的六肽gpfpii(70μm和140μm)与底物hhl、ace作用,测试不同作用时间(0.167h、0.5h、1h、2h、4h、8h、12h和16h)下ha产物的生成量和ace抑制活性。两个浓度(70μm和140μm)的六肽gpfpii对ace的抑制活性在0.5h达到最高,在0.5h后随着时间的增加ace抑制活性逐步降低,4h后,140μm六肽gpfpii的ace抑制活性仍有52.67%,70μm六肽gpfpii的ace抑制活性为20.58%。140μm六肽gpfpii与ace作用8-16h时仍有15%左右的ace抑制活性,70μm六肽gpfpii在与ace作用12h后抑制活性便接近0。
[0097]
以上实例说明本发明的六肽gpfpii不仅具有ace抑制活性,还具备较高的生物利用度且作用时间较长,具有潜在的降血压效果,对开发降血压的食品、保健品或药品具有十分重要的意义。
[0098]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1