一种莲子草假隔链格孢致病基因Unigene0007998及其应用
一种莲子草假隔链格孢致病基因unigene0007998及其应用
技术领域
1.本发明涉及有害生物治理技术领域,特别是涉及一种莲子草假隔链格孢致病基因 unigene0007998及其应用。
背景技术:
2.空心莲子草(alternanthera philoxeroides)为水旱两生的多年生宿根草本植物,属苋科,莲子草属,又名革命草、水花生、喜旱莲子草、空心苋,原产于南美洲的巴西、巴拉圭南部和阿根廷东北部的里奥拉普拉塔盆地、巴拉圭和巴拿马河的湿地以及巴西南部沿海地带。目前在中国、美国、印度、印度尼西亚、泰国、缅甸、澳大利亚、新西兰等32个国家造成严重危害,已成为一种世界范围的恶性杂草。。由于空心莲子草传播寄生虫、营养成分低且含有皂甙等有毒物质,猪牛不爱取食,因此不再将其作为饲料利用,导致其外逸为恶性杂草。空心莲子草由于强大的克隆繁殖能力和超强的适应性,几乎遍及黄河流域以南所有地区,给生物多样性、农业生产和航运业造成了巨大的破坏。
3.目前空心莲子草的防除方法难以兼顾高效、低耗和环保,因此国内外科学家一直在探索其有效、安全的生物防治途径。莲子草假隔链格孢(n.alternantherae)被公认为是一种潜在的空心莲子草生防真菌,该菌寄主专一性强,除苋科莲子草属的空心莲子草和莲子草外不侵染其他植物。莲子草假隔链格孢产生的2-乙酰基3,4-二羟基-5-甲氧基苯乙酸(vulculic acid)具有除草活性。vulculic acid是一种聚酮类化合物,能够引起空心莲子草叶片和根尖细胞质壁分离,质膜消解;叶绿体片层紊乱,膜消解;线粒体膜破裂,内嵴消解;细胞核核膜消解,细胞核变形。vulculic acid可人工合成,从商业购买的3,4,5-三甲氧基苯乙酸出发,经甲酯化、傅克乙酰化、脱三甲基化、选择性上单甲基以及水解等5步反应,可合成vulculic acid。但人工合成vulculic acid,成本高、产率低。
4.聚酮化合物是一类重要的次生代谢产物,其生物合成过程有一个共同特点,即均产生含有多个酮基的中间产物,聚酮合成酶(polyketide synthase,pks)是催化这种中间产物合成的关键酶。近年来科学家们已经对一些pks基因进行了克隆和功能验证,并成功尝试通过基因工程技术提高聚酮化合物产率。而本发明拟通过选取致病力强弱不同的莲子草假隔链格孢,研究与莲子草假隔链格孢致病力相关的pks基因,为防治有害生物空心莲子草提供一种新的生物防治手段。
技术实现要素:
5.本发明的目的是提供一种莲子草假隔链格孢致病基因unigene0007998及其应用,以解决上述现有技术存在的问题,该基因的超表达转化子能显著防治空心莲子草,为有害生物空心莲子草的治理提供一条安全有效的生物防治途径。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种莲子草假隔链格孢致病基因unigene0007998,其核苷酸序列如 seq id no.1所示。
8.本发明还提供一种上述的莲子草假隔链格孢致病基因unigene0007998编码的蛋白,所述蛋白的氨基酸序列如seq id no.9所示。
9.本发明还提供上述的莲子草假隔链格孢致病基因unigene0007998或上述的蛋白在制备防治空心莲子草制剂中的应用。
10.进一步地,所述防治空心莲子草制剂包含促进所述的莲子草假隔链格孢致病基因 unigene0007998表达或提高所述的蛋白活力的制剂。
11.本发明还提供一种上述的莲子草假隔链格孢致病基因unigene0007998的重组载体,所述重组载体是通过扩增引物扩增所述莲子草假隔链格孢致病基因unigene0007998后,将其连接插入超表达载体中得到的。
12.进一步地,所述扩增引物的核苷酸序列如seq id no.6-7所示。
13.本发明还提供上述的重组载体在防治空心莲子草或制备防治空心莲子草制剂中的应用。
14.本发明还提供一种防治空心莲子草的制剂,含有上述的重组载体。
15.本发明公开了以下技术效果:
16.本发明选取致病力最强和最弱的莲子草假隔链格孢分别进行转录组测序,通过比较转录组从中鉴定与莲子草假隔链格孢致病力相关的pks:unigene0007998,并通过构建该基因的沉默表达载体和超表达载体,对其功能进行验证,实验结果显示:该基因的超表达载体转化至弱致病力菌株中会导致其致病力显著增强,且超表达转化子接种后空心莲子草叶片有明显黄化和坏死的现象;并经盆栽实验验证,unigene0007998 基因的超表达转化子能显著防治空心莲子草,为有害生物空心莲子草的治理提供一条安全有效的生物防治途径。
附图说明
17.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
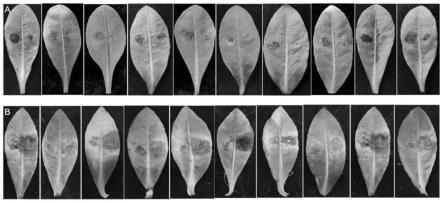
18.图1为致病力稳定的莲子草假隔链格孢在空心莲子草叶片的致病情况;
19.图2为莲子草假隔链格孢中的聚酮合成酶表达情况统计结果:
20.图3为rnai载体插入的正反片段扩增产物电泳图,其中m:marker:dl 2000; 1:正向插入片段;2:反向插入片段;
21.图4为pslient-1载体示意图;
22.图5为rnai载体的pcr验证结果,其中m:marker dl2000;1-8:pslient-1载体正向插入转化子;
23.图6为rnai载体的pcr验证结果,其中m:marker dl2000;1-10:pslient-1载体正向插入基础上反向插入的转化子;
24.图7为unigene0007998基因全长扩增产物电泳图,其中marker:dl8000;1:目的片段;
25.图8为超表达载体示意图;
26.图9为超表达载体的pcr验证结果,其中marker:dl8000;1-18:超表达载体转化子;
27.图10为rnai和超表达转化子的致病力测定结果,a为rnai转化子,b为超表达转化子;
28.图11为rnai和超表达转化子的致病力的盆栽测定结果,a为rnai转化子接种 0天、3天和6天结果,b为超表达转化子接种0天、3天和6天结果,c为对照组接种0天、3天和6天结果。
具体实施方式
29.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
30.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
31.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
32.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
33.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
34.本试验从长沙及周边地区分离到85株致病力强弱不同的莲子草假隔链格孢,从中选取致病力最强和最弱的3个菌株分别进行转录组测序,通过比较转录组从中鉴定与莲子草假隔链格孢致病力相关的pks,并对其功能进行了验证。在此基础上,将该 pks在莲子草假隔链格孢中超表达,在实验室条件下对其防治空心莲子草的潜力进行了试验。具体方法如下:
35.1材料与方法
36.1.1病原菌的采集、分离与鉴定
37.2020年9月至2020年11月,分别从湖南长沙、株洲、湘潭、浏阳四地采集农田、池塘、沟渠环境下自然感病的空心莲子草叶片、茎秆带回实验室,并按照《植病研究法》中介绍的方法进行病原菌分离(方中达,1979)。28℃培养5天后,挑取小块病组织边缘未污染的菌丝,再次移入pda平板上培养,编号备用。
38.将分离获得的菌株分别接种到pda平板上培养7天后,每个菌株取直径6mm的菌饼采用半叶法,接种于健康的空心莲子草上,对照为琼脂块,重复3组。
39.半叶法具体接种方法如下:
40.选取6片大小相近的健康的空心莲子草叶片。取其中3片采取有伤接种,以叶脉为
中心用针尖在叶片左右两侧各刺1下,人为制造伤口,然后左边接种琼脂块,右边接种菌饼;另外3片做无伤接种。然后将接种的所有叶片的基部用浸泡过水的棉花包裹(保湿),放入保鲜盒中,并置于28℃、无光环境的培养箱中,3天后调查发病情况。
41.提取有致病力的菌株基因组dna,用真菌鉴定its通用引物 (its1-tccgtaggtgaacctgcgc和its4-tcctccgcttattgatatgc)扩增,扩增体系见表1。pcr产物送公司测序,测序结果在ncbi进行blast n,保存its比对为n.alternantherae的菌株备用。
42.表1 pcr反应体系
[0043][0044]
反应程序:
[0045][0046]
1.2空心莲子假隔链格孢致病力鉴定
[0047]
在湖南长沙、株洲、湘潭、浏阳四地采集农田、池塘、沟渠等环境下自然感病的空心莲子草叶片、茎秆上共分离85个真菌菌株,其中莲子草假隔链格孢致病力最强。在its鉴定中,有29个菌株被鉴定为莲子草假隔链格孢。对这29株进行复筛,最后确定14个致病力稳定的菌株,编号依次为k1、k3、k4、k5、k6、k9、k10、k13、 k17、k20、k24、k26、k27、k28(见图1)。
[0048]
1.3致病力强、弱菌株转录组测序
[0049]
分别选取致病力强的菌株k26、k27、k28和致病力弱的菌株k1、k3、k9进行转录组测序。测序结果拼接出9个聚酮合成酶基因,其表达量如图2所示。其中 unigene0007998的表达量最高,且在致病力强和致病力弱的菌株之间表达量差异显著,推测unigene0007998是莲子草假隔链格孢负责合成vulculic acid的关键聚酮合成酶。
[0050]
1.4 unigene0007998基因的功能验证
[0051]
1.4.1 unigene0007998rnai载体的构建
[0052]
选择unigene0007998序列(seq id no.1)中一段保守序列设计2对rnai引物(seq id no.2;seq id no.3;seq id no.4;seq id no.5。备注:下划线部分为酶切位点,下划线前3个碱基为保护碱基),核苷酸序列如下:
[0053]
seq id no.2
[0054]
ccgctcgagtgaagaagctccccaagaac;
[0055]
seq id no.3
[0056]
cccaagcttcatgtctcgtcgtcttgagaac。
[0057]
seq id no.4
[0058]
aaaaggcctcatgtctcgtcgtcttgagaac;
[0059]
seq id no.5
[0060]
cggggtaccgagtgaagaagctccccaagaac。
[0061]
扩增得到1个正向插入片段和1个反向插入片段(图3),将2个片段利用酶切连接法先后插入rnai载体pslient-1中(图4),pcr验证正确的克隆,图5为正向插入片段的重组载体克隆,图6为反向插入片段的重组载体克隆,送公司测序进一步验证,测序正确的载体保存用于后继转化。
[0062]
1.4.2 unigene0007998超表达载体的构建
[0063]
根据unigene0007998 5’和3’序列设计1对扩增该pks基因全长序列的引物(下划线部分的序列是将基因克隆进超表达载体的同源重组臂),其核苷酸序列如下:
[0064]
seq id no.6:
[0065]
gcaggaattcgatatcaagcttatgggctcaactcctcc
[0066]
seq id no.7:
[0067]
gtcgacggtatcgataagcttctaatccgaagaaaaataggc
[0068]
扩增得到unigene0007998 dna全长序列(图7),切胶回收最大的片段(其余片段为非特异扩增),利用同源重组法将该pks基因全长插入超表达载体kstnp(图 8)中,pcr检测阳性克隆(图9),选3个pcr阳性克隆送公司测序,获得 unigene0007998的dna全长(seq id no.8),测序结果与unigene0007998比对,测序确认是全长插入的载体保存用于后继转化。unigene0007998 seq id no.1序列编码的氨基酸序列如seq id no.9所示。
[0069]
1.4.3莲子草假隔链格孢原生质体的制备及rnai载体和超表达载体的转化
[0070]
(1)莲子草假隔链格孢原生质体的制备及遗传转化:
[0071]
取pda平板上生长4-5天的莲子草假隔链格孢菌株菌落边缘的菌饼2块,接种到 50ml灭菌yepd液体培养基中,28℃恒温培养箱中震荡培养2d。2层灭菌擦镜纸过滤,收集菌丝体,并用灭菌的0.7m nacl清洗菌丝体3-4次。取黄豆大小菌丝团与1% kitalase酶解液充分混合(注意,菌丝此时不能成团块,必须尽量均匀悬浮于酶解液中,可颠倒震荡混匀)。28℃,80r/min振荡培养1-1.5小时,取10ul酶解液镜检。镜检观察到菌丝酶解,释放大量原生质体后用2层灭菌的擦镜纸过滤,用无菌的0.7m nacl洗涤8-10次,每次1ml(注意枪头不要戳破擦镜纸),收集滤液,5000r/min,室温离心 5min,超净台内弃上清,收集沉淀,用灭菌的200μl stc悬浮原生质体沉淀。取10ul stc 悬浮液镜检,40倍镜头每个视野3-4个原生质体细胞以上可继续进行peg介导的转化。取200μl原生质体,加入10~15ug质粒,缓慢滴入灭菌的1000μl ptc,轻轻颠倒混匀,冰上孵育10min后继续室温孵育10min。将离心管中全部液
体加到6ml灭菌的rm液体中,28℃,80rpm,孵育2-4h后将全部液体加入到100ml灭菌的rm培养基中(含所转化质粒相对应的抗生素),混匀倒板。28℃培养箱,2-3天可长出转化子,然后在长出转化子的平板上覆盖含抗生素的培养基3次。长出的单菌落挑到新的含抗生素的培养基上,再覆盖3次;抗生素筛选出的转化子提取dna进行pcr检测。
[0072]
(2)rnai和超表达转化子的致病性验证
[0073]
unigene0007998基因的rnai载体和超表达载体分别转化到强致病力菌株k27 和弱致病力菌株k1中,阳性转化子分别采用半叶法接种空心莲子草叶片,观察转化菌株的致病力变化(图10),结果表明rnai载体转化至强致病力菌株k27,导致其致病力显著减弱,而超表达转化子转化至弱致病力菌株k1导致其致病力显著增强,且超表达转化子接种后叶片有明显黄化和坏死的现象。在此基础上分别选取致病力显著降低的rnai载体转化子r24和致病力显著增强的超表达转化子o48分别进行盆栽试验,将3个r24和o48菌株的菌饼分别接种到100ml pd液体培养基中,180rpm, 25℃振荡培养96h后用榨汁机将培养物匀浆,稀释5倍后喷施到空心莲子草上,以未接种的pd培养基稀释5倍为对照,接种后0天、3天和6天分别拍照记录。根据图11a 可知,rnai载体转化子r24对空心莲子草的致病效果较弱,喷施6天后才出现少量黄化情况;而图11b中喷施超表达转化子o48的第3天就出现明显黄化情况,第6天大部分空心莲子草黄化枯萎;而对照组(图11c)空心莲子草正常生长。可见,超表达转化子对空心莲子草具有显著的防治效果。
[0074]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1