一种pH敏感响应的N、S共掺杂石墨烯量子点的制备及脲酶活性的测定的制作方法
本发明涉及碳纳米材料的制备领域,具体地,涉及一种N、S共掺杂石墨烯量子点的制备方法及其在脲酶活性检测中的应用。
背景技术:
(1)石墨烯量子点(Graphene Quantum Dots, GQDs),作为一种新型零维碳纳米材料,由于量子限域和尺寸、边缘效应,石墨烯量子点具有许多奇特的光学性质:很强的光致发光特性以及可以根据量子点的尺寸和元素组成对其颜色的可调控性;又具有极其窄且对称的PL发射。同时具有良好的生物相容性,低细胞毒性,环境友好,制备成本低。由于 GQDs的光学性质,可应用于体内小分子物质和阴(阳)离子等的检测、生物成像、药物运输以及药物示踪等方面,而且基于GQDs的检测具有高选择性,特异性,干扰小等优点。
(2)目前制备石墨烯量子点的主要方法是自上而下和自下而上两类方法。前者是指利用物理或化学方法将大块的含碳物质分解直至纳米尺度,包括电弧放电法、激光刻蚀法、电化学合成法等;后者是指主要利用化学合成方法,将前体小分子缩合成量子点,包括燃烧水热法、模板法、微波法等水热法。但是许多方法都无法避免原料获取困难,设备昂贵,操作麻烦耗时,工艺繁琐,成品率低等因素影响,从而限制了石墨烯量子点的广泛应用。
(3)近年来,研究者发现将石墨烯量子点经化学掺杂异原子后,石墨烯量子点共轭平面的电荷密度和带宽能隙可得到有效调节,从而改变电子的流动密度和跃迁方式,进而实现对荧光量子产率、光学性质、反应活性、催化性能等的调节,从而拓展石墨烯量子点的应用。目前对石墨烯量子点的掺杂主要是B、P、N、S等单种或多种异元素掺杂的方式。
(4)脲酶存在于大多数细菌、真菌和高等植物里,它是一种酰胺酶、能促进有机物质分子中酶键的水解。根据土壤脲酶活性可以表征土壤的氮素状况,反映土壤中各种生物化学过程的强度和方向,对改善土壤生态环境,提高土壤肥力有重要意义。脲酶还广泛存在食物当中,检测脲酶活性对食品安全有重要的意义。细菌脲酶的存在通常会导致人体许多疾病的发生,如肝性脑病、组织感染和胃溃疡等,故脲酶的活性检测为我们提供医学疾病诊断和治疗的基础。然后,很多文献报道的是脲酶的定性检测,或者在测定过程中酶的活性破坏或降低,过程也是比较繁琐。
(5)因此,提供一种操作简便、灵敏度高,能有效测得脲酶活性的石墨烯量子点及其制备方法是本发明亟需解决的问题。
技术实现要素:
(1)针对现有技术不足,本发明的目的是通过两步加热熔融制得一种新的N、S共掺杂石墨烯量子点,该物质具有激发波长不依赖性,pH敏感性,对小分子具有高选择性和干扰小等优点。
(2)为了实现上述目的,本发明所述的一种pH敏感响应的N、S共掺杂石墨烯量子点的制备方法,其特征在于,包括如下步骤:将碳源化合物和含氮、硫元素的氮硫源化合物进行第一步加热熔融反应,之后加入另一种氮源化合物进行第二步反应,反应后的混合物待自然冷却后加入一定体积的丙酮溶液,待白色沉淀析出后,离心获得白色沉淀利用截留分子量为2000 Da的透析膜透析上述的白色沉淀得到N、S共掺杂石墨烯量子点,即为具有pH响应的石墨烯量子点。
所述碳源化合物至少有一种选自柠檬酸、苹果酸。
所述氮硫源化合物为谷胱甘肽,所述另一种氮源化合物为多乙烯多胺。
所述碳源化合物、含氮、硫元素的氮硫源化合物和另一种氮源化合物之间的比例是2:0.6:10。
所述混合物的第一步加热温度为140-170℃,反应时间为15-25 min。
所述混合物的第二步加热温度为180-200℃,反应时间为0.5-1 h。
本发明还包括对截留得到的N、S共掺杂石墨烯量子点进行冷冻干燥。
本发明上述的制备方法得到的N、S共掺杂石墨烯量子点。
本发明所述的一种脲酶活性的检测方法,通过荧光分光光度法进行脲酶浓度的检测,其特征在于,所述荧光分光光度法中使用的溶剂由缓冲溶液、尿素和权利要求8所述的N、S共掺杂石墨烯量子点混合而成。
通过所述荧光分光光度法绘制的吸收光谱曲线方程为:y=-0.2788x+485.57,y为荧光强度;x为脲酶活性浓度,最低检测限(LOD)=2.5 U/L;所述溶剂中各组分的含量为:尿素的浓度为0.5 mol/L,缓冲溶液的浓度为0.003 mol/L,且所述缓冲溶液的pH为6.0。
具体地说,本发明提供了一种石墨烯量子点的制备方法,其特征在于,所述制备方法包括:将碳源化合物和含氮、硫元素化合物进行第一步加热熔融反应,再加入多乙烯多胺,得到具有pH响应的石墨烯量子点。其中,原料获取简单,对生产设备要求低,具有一定工业化生产要求。
(3)反应得到的石墨烯量子点溶液待自然冷却后加入一定体积的丙酮溶液,待白色沉淀析出后,离心得到淡黄色的石墨烯量子点固体。
(4)制备得到的N、S共掺杂石墨烯量子点溶液可能存在粒径分布较宽的特点,为获得具有较窄荧光发射的N、S共掺杂石墨烯量子点,需要对反应产物进行尺寸分级。作为优选,利用截留分子量为2000 Da的透析膜对N、S共掺杂石墨烯量子点进行透析。
(5)产物透析提纯方法为:反应产物经截留分子量为2000 Da的透析袋充分透析3天,每隔6h换水,透析袋内溶液即为N、S共掺杂石墨烯量子点溶液。经3天透析进行尺寸截留的N、S共掺杂石墨烯量子点具有相对均一的粒径分布。
(6)作为优选,本发明的制备方法还包括对透析截留得到的N、S共掺杂石墨烯量子点进行冷冻干燥。
(7)本发明还提供了一种根据上述所述的制备方法制得的石墨烯量子点。
(8)本发明制备方法合成的N、S共掺杂石墨烯量子点具有单层结构,尺寸粒径约为6 nm。在365 nm紫外光照射下发射蓝色荧光,且该发光为激发波长不依赖的荧光发射。当用290—390nm激发波长进行激发时,荧光最大发射峰位置几乎不发生变化,这说明本发明方法合成的N、S共掺杂石墨烯量子点质量高、具有均一的发光性质。
(9)针对上述现有技术,本发明的目的在于克服现有技术中脲酶活性侧重于定性检测,或者在测定过程中酶的活性容易被破坏或降低,过程也是比较繁琐的问题,提供一种操作简便、灵敏度高,能有效测得脲酶活性的石墨烯量子点及其制备方法。
(10)为了实现上述目的,本发明还提供了一种脲酶活性的定量检测方法,通过荧光分光光度法进行脲酶活性的检测,其特征在于,所述荧光分光光度法中的溶剂通过缓冲溶液、尿素和根据上述所述的石墨烯量子点混合而成。
(11)本发明的有益效果是,本发明将碳源化合物和氮、硫源化合物进行两步加热反应,得到具有pH响应的石墨烯量子点,同时脲酶水解尿素会生成OH-和NH4+,使得整个体系中pH值升高,进而通过该石墨烯量子点的pH敏感性测定其荧光强度的变化程度,用于脲酶活性的检测获得了良好的效果,操作方便,灵敏度高,并且脲酶的最低检出限可达到2.5 U/L。
(12)本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
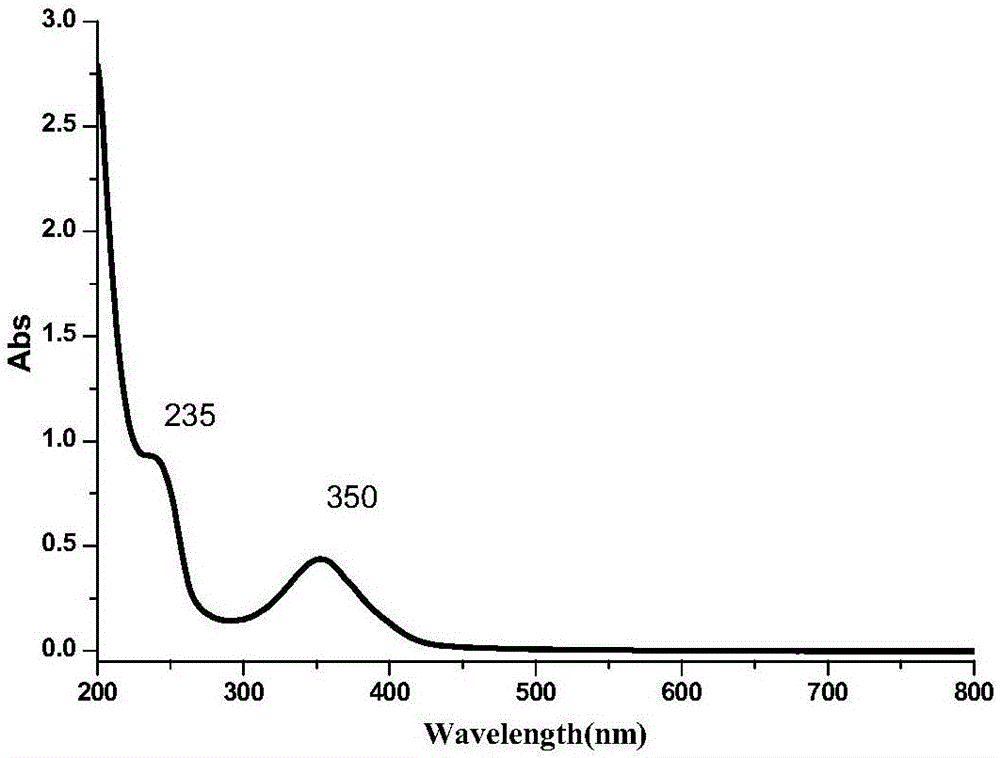
图1a是N、S共掺杂石墨烯量子点的紫外光谱图;
图1b是N、S共掺杂石墨烯量子点的荧光光谱图;
图2是N、S共掺杂石墨烯量子点290nm到390nm激发波长下得到的发射光谱(EM290,EM300,EM310,EM320,EM330,EM340,EM350,EM355,EM360,EM370,EM380,EM390);
图3是N、S共掺杂石墨烯量子点溶液在自然光和紫外光照射下的结果图,其中a为自然光照射,b为365nm紫外光激发;
图4是N、S共掺杂石墨烯量子点的透射电镜照片;
图5是N、S共掺杂石墨烯量子点的原子力显微镜照片;
图6是N、S共掺杂石墨烯量子点的XPS图;
图7是N、S共掺杂石墨烯量子点在不同pH下的荧光强度图谱;
图8a是N、S共掺杂石墨烯量子点的荧光强度与pH值之间的关系图;
图8b是N、S共掺杂石墨烯量子点的荧光强度与pH值之间的线性关系图;
图9是N、S共掺杂石墨烯量子点在加入不同活性的脲酶后的荧光强度图谱;
图10是N、S共掺杂石墨烯量子点的荧光强度和脲酶活性浓度之间的线性关系图。
具体实施方式
(1)下面结合具体实施方式和附图对本发明进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
(2)实施例1(N,S-GQDs的合成)
本实施例的N、S共掺杂石墨烯量子点通过以下步骤制得:
精确称取2.0 g柠檬酸和0.6 g谷胱甘肽,置于50ml圆底烧瓶中,在150℃的油浴锅中反应20min,20min后,柠檬酸和谷胱甘肽已完全液化,颜色由无色变成黄褐色,再加入10ml的多乙烯多胺,温度调为200℃,继续搅拌反应1h。反应结束后,取出得到的棕黄色粘稠液体,自然冷却后,加入50ml丙酮溶液,待有白色固体析出后,离心得到淡黄色的N,S-GQDs粉末,将离心得到的石墨烯量子点用0.5mL蒸馏水溶解,并透析提纯后经冷冻干燥制得石墨烯量子点固体。其中,产物透析提纯方法为:反应、离心所得的产物经截留分子量为2000Da的透析袋中充分透析3天,每隔6h换水一次,透析袋内溶液即为N、S共掺杂石墨烯量子点溶液。
(3)对本实施例制得的N、S共掺杂石墨烯量子点进行测试:
①图1a表明N, S-GQDs水溶液的紫外一可见光吸收光谱分别在235nm和350nm处有两个典型吸收峰,推测为 C=C的 π-π*跃迁和 C=O的 n-π*跃迁。图1b表明N, S-GQDs水溶液的最大激发波长和发射波长分别为350nm和452nm,基本对称。图2是N, S-GQDs在290nm至390nm变化的激发波长条件下的发射谱图,N,S-GQDs的最大发射波长保持稳定,表现出激发波长不依赖的特征,这说明本发明方法合成的N,S-GQDs尺寸均匀,质量高。
②图3 a所示N, S-GQDs在自然光照射下为棕黄色,在紫外光(365nm)的照射条件下,为亮蓝色荧光见图3b。
③图4为本实施例制得的N,S-GQDs的透射电镜图,如图4所示,N,S-GQDs颗粒分布均匀,尺寸为6 nm。
④图5为本实施例制得的N,S-GQDs的原子力显微镜图,如图5所示,N,S-GQDs的尺寸均一,且高度为~2.1 nm,表现出6层石墨原子层的特点。
⑤图6为本实施例制得的N,S-GQDs的XPS结果,如图6所示,N,S-GQDs主要表现出C, N,O三种元素和少量的S元素的信息,C, N, O和S的原子百分比分布为73.01%,14.12%,12.6%和0.27%。
⑥图7中,曲线自上而下对应的pH值分别为3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,
9.0,9.5,10,10.5,11,11.5,12,可以看出,N,S-GQDs荧光强度依赖于pH值,受pH的影响较大,在pH值变化范围内随着pH值的增大,荧光强度逐渐减小,且荧光强度与pH值有良好的规律(图8a)。然而,当pH值大于9时,N,S-GQDs荧光强度几乎稳定不变,pH值对N,S-GQDs荧光强度的影响过程可以理解为质子化一去质子化导致的表面电荷改变。在pH值范围3-9内,荧光强度与pH值呈线性关系,拟合方程为:y = -97.204x+1038.4,且R为0. 9957(图8b)。
(4)本发明还提供了一种脲酶活性的检测方法,通过荧光分光光度法进行脲酶活性的检测,其中,所述荧光分光光度法中的溶剂通过缓冲溶液、尿素和上述所述的石墨烯量子点混合而成。
①将步骤(1)制得的石墨烯量子点配成均匀分散的水溶液,得到N,S-GQDs溶液的浓度为22.4ug/ml。
②先将300µL尿素溶液和100µL一系列不同活性浓度的脲酶溶液避光反应20min,再加入上述步骤①配置的N,S-GQDs溶液100µL,保持总体积为500µL,避光反应1h后将所得溶液置于荧光分光光度计中。其中,所有的组分溶液都是用磷酸盐缓冲液配的。
③在激发波长350nm条件下,读取发射波长452处荧光强度值,根据荧光强度数据可以得出已知脲酶活性的荧光强度值,绘制标准曲线。
④在本发明提供的一种优选的实施方式中,所述溶剂中各组分的含量具体为:尿素的浓度为0. 5M/L,缓冲溶液(缓冲溶液由Na2HPO4﹒7H2O、NaH2PO4﹒2H2O、NaCl组成)的浓度为0. 003mol/L,且所述缓冲溶液的pH为6.0。图9中的曲线自上而下对应的脲酶浓度为0U/L, 5U/L, 20U/L, 40U/L, 60U/L, 80U/L, 100U/L, 200U/L, 300U/L, 400U/L, 600U/L, 800U/L, 1000U/L,从而可以看出,随着脲酶活性浓度的增大,荧光强度逐渐减弱,图10中纵坐标为溶剂荧光强度,通过该图可以看出,待测脲酶活性浓度在5-800U/L时,其活性浓度与荧光强度值有着良好的线性关系,线性方程为:y = -0.2809x+487.28,且R为0. 9960,最低检测限(LOD)=2.5U/L(S/N=3)。
⑤本发明考察基于N,S-GQDs测定不同活性浓度脲酶的重现性,在步骤④的测定条件下,重复、独立分别测定5 U/L和40 U/L六次,测定的RSD分别为1.5%和2.1%。
以上实施例仅仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!