碳量子点的制备方法及检测核酸的试剂盒、方法与流程
本发明涉及核酸检测领域,具体涉及一种碳量子点的制备方法及基于碳量子点的恒温扩增检测核酸的试剂盒、方法。
背景技术:
h7n9是禽流感的一种亚型,可引起急性呼吸道传染病。h7n9型禽流感于2013年2月在我国东部率先发现,患者的主要临床表现为发热,咳嗽,少痰,同时伴有头痛、肌肉酸痛和全身不适等;重症患者表现为重症肺炎,体温大多持续在39摄氏度以上,出现呼吸困难,可伴有咳血痰等。h7n9型禽流感的感染死亡率超过了30%,对人类健康产生了严重威胁。因此,开发快速、准确及高灵敏的检测方法实现h7n9的早期检测在生物学以及临床诊断方面均有重要意义。
传统的h7n9检测方法有荧光pcr、变性梯度凝胶电泳以及高效液相色谱法等,然而这些方法面临着一些问题,比如仪器要求高、操作复杂、实验成本高以及检测灵敏度不高等。目前,对于短链核酸如mirnas的检测,传统方法包括northern印迹和定量逆转录聚合酶链反应(qrt-pcr),是测定mirnas的金标准。然而,上述的方法存在灵敏度低,特异性差,耗时长和操作复杂等缺陷,大大限制了它们的生物学和医学的应用。因此,常采用经典的分子信标对生物分子检测。经典的分子信标(mb)设计需要选择合适的荧光染料和淬灭剂,以最大限度地改变荧光发射。然而,目前使用的荧光染料-碳量子点研究的也愈发广泛,作为荧光信号具有诸多优点,如荧光信号稳定、响应迅速、荧光寿命长,合成修饰成本低等优点。然而,目前的碳量子点粒径分布不均匀,粒径大,荧光强度不稳定,造成使用碳量子点作为荧光分子信标的荧光信号存在检测结果不准确、灵敏度低等弊端。
技术实现要素:
因此,本发明要解决的技术问题在于克服现有技术中的碳量子点荧光强度不稳定、粒径分布不均匀、粒径大缺陷,从而提供一种碳量子点的制备方法,制备得到的碳量子点荧光强度稳定、粒径分布均匀、粒径小。
本发明要解决的另一个技术问题在于克服现有技术中的核酸检测特异性低、灵敏度低、检测限高缺陷,从而提供一种特异性强、灵敏度高、检测限低的一种基于恒温扩增检测核酸的试剂盒及其检测方法。
为此,本发明提供了如下技术方案:
本发明提供了一种碳量子点的制备方法,包括如下步骤:以柠檬酸和半胱氨酸为原料,研磨成粉,混合,然后微波加热,加入去离子水得反应液,除去所述反应液中的原料。
在所述的制备方法中,所述柠檬酸和半胱氨酸以摩尔比(1-3):1混合。
在所述的制备方法中,在所述微波加热步骤中,微波功率为400-600w,反应3-6min;优选的,所述微波功率为500w,反应4.5min。
在所述的制备方法中,选用截留分子量为400-600的透析袋透析2-4天,每7-9小时换水一次。
本发明提供了一种所述的制备方法制备得到的碳量子点。
本发明提供了一种基于碳量子点的恒温扩增检测核酸的试剂盒,包括:
探针1,所述探针1一端修饰有权利要求5所述的碳量子点,所述探针1为颈环dna,其部分序列可与靶标核苷酸序列互补配对结合;
探针2,所述探针2一端修饰有淬灭基团,可与所述探针1上靠近碳量子点的部分序列互补配对结合;
dna聚合酶酶液;和/或
dntps溶液。
本发明提供了一种基于碳量子点的恒温扩增检测核酸的方法,包括如下步骤:向含待测靶标核苷酸序列的溶液中加入探针1溶液,孵育,然后向其中加入探针2溶液,孵育,最后向其中加入dna聚合酶酶液和dntps溶液,混合孵育,实时检测荧光强度。
在所述的方法中,向含待测靶标核苷酸序列的溶液中加入探针1溶液,于35-38℃下孵育25-35分钟,然后向其中加入探针2溶液,于35-38℃下孵育25-35分钟,最后向其中加入dna聚合酶和dntps溶液,于35-38℃下孵育50-70分钟,实时检测荧光强度。
在所述的方法中,所述探针1溶液中探针1的浓度为0.8-1.2μm;所述探针2溶液中探针2的浓度为2.4-3.6μm;所述dna聚合酶酶液的浓度为6-12u/ml;所述dntps溶液的浓度为8-20μm。
在所述的方法中,待测靶标核苷酸序列的长度为15-100bp。
本发明技术方案,具有如下优点:
1.本发明提供的一种碳量子点的制备方法,包括如下步骤:以柠檬酸和半胱氨酸为原料,研磨成粉,混合,然后微波加热,加去离子水得反应液,除去所述反应液中的原料;采用上述方法制备得到的碳量子点粒径分布为2-6nm,激发波长为355nm,发射波长为420nm,所述碳量子点的荧光强度稳定,响应迅速,荧光寿命长,合成修饰成本低,粒径分布在2-6nm,便于将其修饰到核酸上,并保持高度的稳定性,避免在检测过程中碳量子点从核酸上脱落,影响检测结果的准确性。
2.本发明提供的一种基于碳量子点的恒温扩增检测核酸的方法,包括如下步骤:向含待测靶标核苷酸序列的溶液中加入探针1溶液,孵育,然后向其中加入探针2溶液,孵育,最后向其中加入dna聚合酶酶液和dntp溶液,混合孵育,实时检测荧光强度;上述方案将恒温扩增方法结合荧光强度稳定的碳量子点,检测核酸,具有高度的特异性和敏感性,检测限低至3.4-10fm,同时兼顾快速、简单和低成本等优点。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
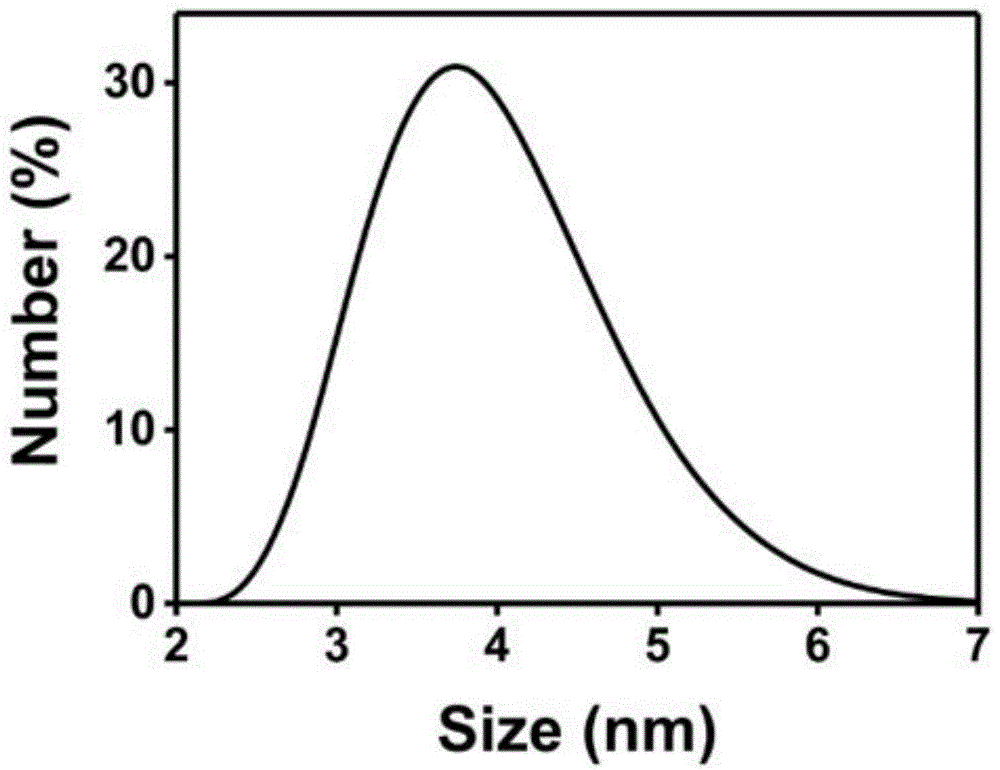
图1是本发明实施例1中的碳量子点的粒径分布曲线图;
图2是本发明实施例1中的碳量子点的荧光信号图;
图3是本发明实施例6中的基于恒温扩增检测核酸的方法的检测核酸原理图;
图4(a)是本发明实验例1中待测靶标核苷酸序列和dna聚合酶分别在存在和不存在两种情况下的荧光检测结果曲线图;
图4(b)是本发明实验例1中待测靶标核苷酸序列和dna聚合酶分别在存在和不存在两种情况下的荧光检测结果柱形图;
图5是本发明实验例2中不同浓度的n9序列和h7序列的荧光检测结果图;
图6是本发明实验例3中目标序列和干扰核酸的荧光检测结果图。
具体实施方式
下述实施例中的微波炉型号为m3-l233b生产厂家为广州美的厨房电器制造有限公司;柠檬酸和半胱氨酸市售产品。
实施例1碳量子点的制备
以柠檬酸和半胱氨酸为原料,研磨成粉,按照柠檬酸和半胱氨酸摩尔比1:1混合,在微波炉中,400w反应6分钟,加去离子水得反应液,然后用截流分子量400的透析袋透析4天,每7h换一次水以除去所述反应液中的原料,最后将获得的碳量子点溶液置于4℃冰箱中保存。
检测上述碳量子点溶液中碳量子点的粒径,结果见图1,发现采用上述方法制备得到的碳量子点的粒径分布为2-6nm。
采用fls-1000荧光光谱仪进行测量上述碳量子点溶液中碳量子点的激发波长和发射波长,结果见图2所示,其激发波长为355nm,发射波长为420nm。
实施例2碳量子点的制备
以柠檬酸和半胱氨酸为原料,研磨,按照柠檬酸和半胱氨酸摩尔比3:1混合,在微波炉中,600w反应3分钟,加去离子水得反应液,然后用截流分子量600的透析袋透析2天,每9h换一次水以除去所述反应液中的原料,最后将获得的碳量子点溶液置于4℃冰箱中保存。
实施例3碳量子点的制备
以柠檬酸和半胱氨酸为原料,研磨,按照柠檬酸和半胱氨酸摩尔比2:1混合,在微波炉中,500w反应4.5分钟,加去离子水得反应液,然后用截流分子量500的透析袋透析3天,每8h换一次水以除去所述反应液中的原料,最后将获得的碳量子点溶液置于4℃冰箱中保存。
实施例4探针的设计
(1)探针序列的确认
以h7n9病毒的核酸为靶标核苷酸序列,靶标核苷酸序列n9序列如seqidno:1所示,基于上述靶标核苷酸序列设计探针1的核苷酸序列和探针2的核苷酸序列,所述探针1的核苷酸序列n9-probe1如seqidno:2所示,所述探针2的核苷酸序列n9-probe2如seqidno:3所示;靶标核苷酸序列n7序列如seqidno:4所示,基于上述靶标核苷酸序列设计探针1的核苷酸序列和探针2的核苷酸序列,所述探针1的核苷酸序列h7-probe1如seqidno:5所示,所述探针2的核苷酸序列h7-probe2如seqidno:6所示;上述n9-probe1、n9-probe2、h7-probe1和h7-probe2的核苷酸序列由生工生物工程(上海)股份有限公司合成。
(2)探针的预处理
将步骤(1)中获得的探针1溶液、探针2溶液、靶标核苷酸序列溶液分别溶于20mm的tris缓冲液中,然后用金属浴加热至95℃,保持5分钟,然后缓慢降至室温。将处理后的探针1溶液、探针2溶液、靶标核苷酸序列溶液分别稀释至所需浓度,储存备用。
(3)探针的修饰
探针1的修饰:取实施例4中制备得到的碳量子点溶液稀释至浓度为3mg/ml,体积10ml,然后向其中加入edc10mg、nhs10mg,于室温下缓慢震荡30分钟,然后加入步骤(2)中稀释至浓度为20μm的探针1溶液,室温缓慢震荡2个小时,以水解未反应的edc,最后4℃放置过夜。
探针2的修饰:探针2修饰淬灭基团选择bhq,由生工生物工程(上海)股份有限公司合成。所述淬灭基团还可选择二甲氨基偶氮苯甲酰(dabsyl)。
上述修饰后的探针1和探针2见下表1所示:
表1探针1和探针2
实施例5一种基于恒温扩增检测核酸的试剂盒
本实施例提供了一种基于恒温扩增检测核酸的试剂盒,包括:
实施例4中的修饰碳量子点的探针1溶液,浓度为0.8μm,体积60μl;
实施例4中的修饰淬灭基团的探针2溶液的浓度为3.6μm,体积为20μl;
dna聚合酶酶液,浓度为60u/ml,体积10μl;
dntps溶液,浓度为40μm,体积10μl。
实施例6一种基于恒温扩增检测核酸的试剂盒
本实施例提供了一种基于恒温扩增检测核酸的试剂盒,包括:
实施例4中的修饰碳量子点的探针1溶液,浓度为1.2μm,体积60μl;
实施例4中的修饰淬灭基团的探针2溶液的浓度为2.4μm,体积为20μl;
dna聚合酶酶液,浓度为120u/ml,体积10μl;
dntps溶液,浓度为20μm,体积10μl。
实施例7一种基于恒温扩增检测核酸的试剂盒
本实施例提供了一种基于恒温扩增检测核酸的试剂盒,包括:
实施例4中的修饰碳量子点的探针1溶液,浓度为1μm,体积60μl;
实施例4中的修饰淬灭基团的探针2溶液的浓度为3μm,体积为20μl;
dna聚合酶酶液,浓度为90u/ml,体积10μl;
dntps溶液,浓度为30μm,体积10μl。
实施例8一种基于恒温扩增检测核酸的方法
本发明提供了一种基于恒温扩增检测核酸的方法,包括如下步骤:向含待测靶标核苷酸序列的溶液中加入实施例5中的探针1溶液,于35℃下孵育25分钟,然后向其中加入实施例5中的探针2溶液,于38℃下孵育35分钟,最后向其中加入实施例5中的dna聚合酶酶液和dntps溶液,于35℃下孵育70分钟,实时检测荧光强度,采用fls-1000荧光光谱仪进行测量,其中激发波长为355nm,发射波长为420nm。
上述的基于恒温扩增检测核酸的方法的检测核酸原理图如图3所示,待测靶标核苷酸序列存在时,目标序列可以与探针1相关序列结合,从而将颈环打开,暴露出探针2的结合序列,探针2将与该部分序列通过互补配对结合,此时碳量子点与探针2上修饰的淬灭基团因相互靠近而发生荧光能量共振转移,荧光强度将发生一定程度淬灭。然后向体系中加入dna聚合酶以及dntps溶液,dna聚合酶将以打开的单链序列为模板,以探针2为引物合成互补链,将目标序列从dnaprobe1上取代下来,然后被释放出来的目标序列可以与未打开颈环结构探针1结合进入下一循环,探针1将再次暴露出探针2的结合序列,探针2将再次与探针1结合,此时探针1上的碳量子点因与探针2上淬灭基团靠近而引发荧光淬灭,经过多次循环,碳量子点的荧光强度将会显著淬灭。荧光信号采用fls-1000荧光光谱仪进行测量,经分析,荧光强度的变化量与目标序列的浓度在一定的浓度范围内存在线性关系,检测限为3.4-10fm。
实施例9一种基于恒温扩增检测核酸的方法
本发明提供了一种基于恒温扩增检测核酸的方法,包括如下步骤:向含待测靶标核苷酸序列的溶液中加入实施例5中的探针1溶液,于38℃下孵育35分钟,然后向其中加入实施例5中的探针2溶液,于38℃下孵育25分钟,最后向其中加入实施例5中的dna聚合酶酶液和dntps溶液,于38℃下孵育50分钟,实时检测荧光强度,采用fls-1000荧光光谱仪进行测量,其中激发波长为355nm,发射波长为420nm。
实施例10一种基于恒温扩增检测核酸的方法
本发明提供了一种基于恒温扩增检测核酸的方法,包括如下步骤:向含待测靶标核苷酸序列的溶液中加入实施例5中的探针1溶液,于37℃下孵育30分钟,然后向其中加入实施例5中的探针2溶液,于37℃下孵育30分钟,最后向其中加入实施例5中的dna聚合酶酶液和dntps溶液,于37℃下孵育60分钟,实时检测荧光强度,采用fls-1000荧光光谱仪进行测量,其中激发波长为355nm,发射波长为420nm。
实验例1可行性的考察
按照实施例10实施,考察待测靶标核苷酸序列(n9序列)和dna聚合酶分别在存在和不存在两种情况下,对检测体系的影响,结果如图4(a)-图4(b)所示,当待测靶标核苷酸序列(n9序列)不存在时,荧光强度未发生猝灭;当待测靶标核苷酸序列(n9序列)存在时,荧光淬灭,荧光强度一定程度减小,说明淬灭基团与碳量子点接近引起了荧光共振能量转移,说明本发明的基于恒温扩增检测核酸的方法可以通过荧光强度的变化量表征待测靶标核苷酸序列的含量,证明了本发明的基于恒温扩增检测核酸的方法的定量检测核酸的可行性。当dna聚合酶存在时,荧光强度进一步显著减小,荧光强度的变化量大大增加,这证明dna聚合酶的存在对本发明的基于恒温扩增检测核酸的方法的灵敏度的提高至关重要。
实验例2
按照实施例10实施,检测不同浓度的待测靶标核苷酸序列(n9序列和h7序列)时的荧光强度,统计待测靶标核苷酸序列的浓度与荧光强度的线性关系。n9序列的浓度依次为0,10fm,100fm,1pm,10pm,100pm,1nm,10nm,100nm,1μm;h7序列的浓度依次为10fm,100fm,1pm,10pm,100pm,1nm,10nm,100nm。
检测结果如图5所示,图5a为不同浓度n9序列得到的荧光光谱图,图5b为n9浓度所对应的荧光强度的线性范围内统计图,图5c为不同浓度h7序列得到的荧光光谱图,图5d为h7浓度所对应的荧光强度的线性范围内统计图。由图5a及图5c分别显示了不同浓度n9、h7得到的荧光光谱图。在一定范围内荧光信号强度随着目标序列浓度的增加逐渐减弱。如图5b所示,荧光强度的对数在10fm至10nm的范围内显示与n9水平的对数的线性关系。回归方程为y=-0.258x+1.914(r2=0.999,n=3),其中y是荧光信号强度值的对数,x是n9浓度的对数。如图5d所示,荧光强度的对数在10fm至10nm的范围内显示与h7水平的对数的线性关系。回归方程为y=0256x+1.888(r2=0.998,n=3),其中y是荧光信号强度值的对数,x是h7浓度的对数。
实验例3
按照实施例10实施,检测目标待测靶标核苷酸序列和过量的干扰核酸,验证本发明的基于恒温扩增检测核酸的方法的特异性。待测靶标核苷酸序列(目标序列)的浓度为10pm,其他干扰核酸的浓度为100pm,干扰核酸分别为随机序列1(如seqidno:7所示),单碱基突变序列(m1-n9如seqidno:8所示,m1-h7如seqidno:9所示),三碱基突变序列(m3-n9如seqidno:10所示,m3-h7如seqidno:11所示),单碱基突变序列和目标序列混合样品以及三碱基突变序列和目标序列的混合样品。同时按照实施例10实施,考察不同浓度的目标序列在缓冲液中和在血清中两种情况下的荧光强度。
结果如图6所示,图6a通过使用一些过量的干扰核酸来验证本方法的特异性,在目标序列测定和对照实验之间存在显著的荧光信号差异。因此,实验结果表明目标序列与探针1的碱基互补配对具有高度的特异性,进一步证实了所提出方法的高选择性。图6b通过检测不同浓度目标序列在缓冲液及血清中的荧光强度,证实了本检测方法在实验样品中与缓冲液中具有相似的检测效果。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
sequencelisting
<110>中国科学院苏州生物医学工程技术研究所
<120>碳量子点的制备方法及检测核酸的试剂盒、方法
<130>sha201800940
<160>11
<170>patentinversion3.3
<210>1
<211>52
<212>dna
<213>人工合成
<400>1
ataagggtcattacacttacctatatttgggtcattcggtcggggattgtct52
<210>2
<211>75
<212>dna
<213>人工合成
<400>2
agacaatccccgaccgaatgacccaaatataggtaagtgtaatgacccttattgggtcat60
tcggtcggggatccc75
<210>3
<211>11
<212>dna
<213>人工合成
<400>3
tccccgaccga11
<210>4
<211>52
<212>dna
<213>人工合成
<400>4
catctgcgggaatgcagcattatctgtgtttgacaggagccatttcatttct52
<210>5
<211>75
<212>dna
<213>人工合成
<400>5
agaaatgaaatggctcctgtcaaacacagataatgctgcattcccgcagatggtttgaca60
ggagccatttcaccc75
<210>6
<211>12
<212>dna
<213>人工合成
<400>6
tgaaatggctcc12
<210>7
<211>52
<212>dna
<213>人工合成
<400>7
gcactggttgctttgaaatatttcacaagtgtgatgatgactgtatggccag52
<210>8
<211>52
<212>dna
<213>人工合成
<400>8
ataagggtcattaaacttacctatatttgggtcattcggtcggggattgtct52
<210>9
<211>52
<212>dna
<213>人工合成
<400>9
catctgcgggaattcagcattatctgtgtttgacaggagccatttcatttct52
<210>10
<211>52
<212>dna
<213>人工合成
<400>10
ataagggtcattaaacttacctctatttgggtcagtcggtcggggattgtct52
<210>11
<211>52
<212>dna
<213>人工合成
<400>11
catctgcgggaattcagcattaactgtgtttgactggagccatttcatttct52
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程