含炔键的氟取代苯并噁唑液晶化合物及其制备方法与流程
本发明属于材料技术领域,具体涉及含炔键的氟取代苯并噁唑液晶化合物及其制备方法。
背景技术:
液晶材料广泛应用于平板电脑、手机、笔记本电脑和高清电视等显示领域,以及光调制器、激光光束偏转、自适应光学等非显示领域。液晶光电器件具有驱动电压低、相位调制量大、重量轻、功耗低等优点。
液晶材料是液晶光电器件的关键核心材料,而液晶光电器件的性能优化主要是通过调控液晶材料的结构和组分来实现。近年来,快速响应是液晶光电器件一直追求的重要发展方向。为了提高液晶光电器件的响应速度,一方面可以采用低粘度的液晶化合物,液晶化合物的粘度与液晶器件的响应时间有直接关系,即液晶材料的粘度越低,液晶器件的响应时间越小、响应速度越快;另一方面可以降低液晶器件盒厚,液晶器件盒厚越低,响应速度越快,而使用大光学各向异性(δn)液晶材料能够在实际应用中有效减小液晶器件盒厚。因而大δn液晶是液晶光电器件实现快速响应的关键材料。
液晶化合物结构一般由苯环、环己基、芳杂环等作为刚性骨架构建,可以通过引入炔键、增加苯环、引入氰基或异硫氰基等增加液晶分子共轭长度,进而提升液晶化合物的δn。目前虽然有不少δn液晶材料,但是其δn不够大、种类不够多,限制了其在液晶光电器件中的应用。尤其可作为液晶光电器件使用的大δn芳杂环类液晶化合物种类非常少。
技术实现要素:
本发明的目的是提供一种具有较大双折射率的含炔键的氟取代苯并噁唑液晶化合物,并为该化合物提供一种工艺步骤简单、收率高的制备方法。
针对上述目的,本发明采用的含炔键的氟取代苯并噁唑液晶化合物的结构式如下:
式中r代表c5~c12的直链烷基,m代表h、ch3、no2中任意一种。
上述含炔键的氟取代苯并噁唑液晶化合物的制备方法由下述步骤组成:
1、制备4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇
将2,3-二氟对溴苯甲醛、对甲苯磺酸、乙二醇加入三氯甲烷中,在50~70℃反应6~8h,减压蒸除溶剂,然后在氮气保护下,加入2-甲基-3-丁炔-2-醇、碘化亚铜、三苯基膦、四(三苯基膦)钯、三乙胺,在80~90℃下反应8~10h,分离纯化,得到4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇,反应方程式如下:
2、制备2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环
将4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇与氢氧化钠在甲苯中回流4~6h,分离纯化,得到2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环,反应方程式如下:
3、制备2-(2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯基)-1,3-二氧戊环
将2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环、式i所示1-碘-4-(烷氧基)苯、碘化亚铜、三苯基膦、四(三苯基膦)钯加入三乙胺中,在氮气保护下60~80℃反应8~10h,反应结束后,分离纯化,得到2-(2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯基)-1,3-二氧戊环,反应方程式如下:
式i中,r代表c5~c12的直链烷基。
4、制备2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯甲醛
将2-(2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯基)-1,3-二氧戊环、甲酸加入四氢呋喃中,在50~70℃下反应5~6h,反应结束后,分离纯化,得到2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯甲醛,反应方程式如下:
5、制备2-((2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚
将2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯甲醛、式ii所示氨基酚加入乙醇中,搅拌回流4~6h,减压蒸馏除去溶剂,重结晶得到2-((2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚,反应方程式如下:
式ii中,m代表h、ch3、no2中任意一种。
6、制备含炔键的氟取代苯并噁唑液晶化合物
将2-((2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚、二氯二氰基苯醌(ddq)加入三氯甲烷中,回流反应4~6h后,停止反应,分离纯化,得到目标化合物——含炔键的氟取代苯并噁唑液晶化合物,反应方程式如下:
上述步骤1中,优选2,3-二氟对溴苯甲醛与对甲苯磺酸、乙二醇、摩尔比4:1~1.5:80~90,2,3-二氟对溴苯甲醛与2-甲基-3-丁炔-2-醇、碘化亚铜、三苯基膦与四(三苯基膦)钯的摩尔比1:0.4~1:0.02~0.05:0.04~0.1:0.008~0.01。
上述步骤2中,优选4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇与氢氧化钠的摩尔比为1:6~6.5。
上述步骤3中,优选2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环与1-碘-4-(烷氧基)苯、碘化亚铜、三苯基膦、四(三苯基膦)钯的摩尔比1:0.8~1.2:0.004~0.008:0.01~0.015:0.02~0.05。
上述步骤4中,优选2-(2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯基)-1,3-二氧戊环与甲酸的摩尔比为1:170~175。
上述步骤5中,优选2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯甲醛与氨基酚的摩尔比1:1.1~1.5。
上述步骤6中,优选2-((2,3-二氟-4-((4-(烷氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚与二氯二氰基苯醌的摩尔比为1:1.1~1.5。
本发明的有益效果如下:
本发明液晶化合物是以2,3-二氟对溴苯甲醛、2-甲基-3-丁炔-2-醇、1-碘-4-(烷氧基)苯、氨基酚为原料,通过sonogashira偶联、亲核加成、关环等反应制备而成,其既具有杂环液晶介晶相类型,又具有较大的双折射率,同时具有宽的向列相区间,且其制备方法步骤简单、收率高,可应用于液晶光电器件中。
附图说明
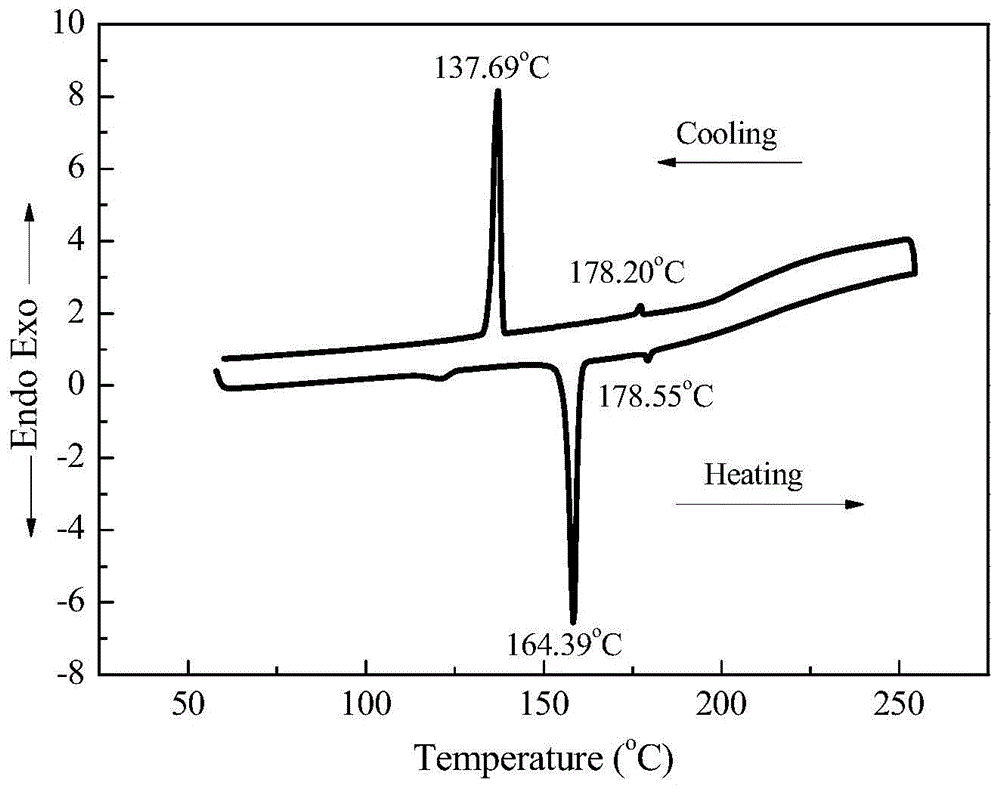
图1是实施例1得到的液晶化合物的dsc曲线(升降温速率5℃/min)。
图2是实施例1得到的液晶化合物升温至173.6℃时的pom照片(200×)。
图3是实施例1得到的液晶化合物降温至167.2℃时的pom照片(200×)。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
1、制备4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇
在装有冷凝管和搅拌子的250ml单口瓶中加入2,3-二氟对溴苯甲醛10g(49.6mmol)、对甲苯磺酸2.2g(12.7mmol)、乙二醇70g(1120.0mmol),并向其中加入经过分子筛干燥的三氯甲烷100ml,在60℃的恒温油浴锅中搅拌6h后停止反应,减压蒸除溶剂,向其中加入2-甲基-3-丁炔-2-醇2.01g(23.8mmol)、碘化亚铜0.2g(1.0mmol)、三苯基膦0.6g(2.2mmol),并加入80ml三乙胺作为反应溶剂,在80℃的恒温油浴锅中加热并通氮气保护,反应1h后,在氮气保护下迅速加入四三苯基膦钯0.5g(0.43mmol),继续反应8h后停止反应。反应结束后,用水稀释反应体系,用二氯甲烷萃取,分出有机相,并用二氯甲烷重复萃取水相,合并有机相,将得到的有机相用饱和氯化铵水溶液洗涤三次,无水硫酸镁干燥,减压蒸馏旋出溶剂,向其中加入7g硅胶制样,柱色谱分离(洗脱剂为石油醚与乙酸乙酯体积比为30:1的混合液),得到黄色油状液体4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇,收率44%,反应方程式如下:
2、制备2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环
在装有搅拌子和冷凝管的250ml单口瓶中依此加入4-(4-(1,3-二氧戊环-2-基)-2,3-二氟苯基)-2-甲基丁-3-炔-2-醇4g(14.9mmol)、氢氧化钠3.57g(89.4mmol)、甲苯80ml,将反应体系在80℃反应4h,反应结束后用二氯甲烷和水萃取反应液,合并有机相,减压蒸馏除去溶剂,加入8g硅胶制样,柱色谱分离(洗脱剂为石油醚与乙酸乙酯体积比为10:1的混合液),得到淡黄色油状液体2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环,收率67%,反应方程式如下:
3、制备2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)-1,3-二氧戊环在装有搅拌子和冷凝管的250ml三口瓶中依此加入2-(4-乙炔基-2,3-二氟苯基)-1,3-二氧戊环2.1g(10mmol)、1-碘-4-(戊氧基)苯2.7g(9mmol)、碘化亚铜0.09g(0.04mmol)、三苯基膦0.26g(0.1mmol),在70℃的恒温油浴锅中加热并通氮气保护,反应1h后,在氮气保护下迅速加入四三苯基膦钯0.23g(0.2mmol),继续反应8h后停止反应。反应结束后,用水稀释反应体系,用二氯甲烷萃取,分出有机相,并用二氯甲烷重复萃取水相,合并有机相,将得到的有机相用饱和氯化铵溶液洗涤三次,无水硫酸镁干燥,减压蒸馏旋出溶剂,向其中加入7g硅胶制样,柱色谱分离(洗脱剂为石油醚与乙酸乙酯体积比为30:1的混合液),得到淡黄色固体2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)-1,3-二氧戊环,收率55%,反应方程式如下:
4、制备2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯甲醛
在装有搅拌子和冷凝管的250ml单口烧瓶中依此加入2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)-1,3-二氧戊环2.5g(6.7mmol)、甲酸54g(1166mmol)、四氢呋喃80ml,在60℃恒温油浴中加热反应6h。反应结束后,用二氯甲烷和水萃取反应液,旋蒸浓缩,得到白色固体,加无水乙醇重结晶,得到白色固体2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯甲醛,收率81%,反应方程式如下:
5、制备2-((2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚
在装有搅拌子和冷凝管的100ml单口瓶中加入2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯甲醛0.4g(1.3mmol)、邻氨基苯酚0.17g(1.5mmol)、无水乙醇40ml,80℃搅拌回流6h至反应完全。冷却到室温,有黄色针状晶体析出,用布氏漏斗抽滤,得到黄色固体2-((2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚,收率84%,反应方程式如下:
6、制备2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)苯并噁唑液晶在装有搅拌子和冷凝管的100ml单口瓶中加入2-((2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯亚甲基)氨基)苯酚0.2g(0.5mmol)、二氯二氰基苯醌(ddq)0.13g(0.58mmol)、三氯甲烷40ml,采用恒温油浴将其加热至回流,反应5h至反应完全。待反应液冷却到室温时,用二氯甲烷和水萃取反应液,合并有机相,旋除溶剂,加入2g硅胶制样,柱色谱分离(洗脱剂为石油醚与乙酸乙酯体积比为30:1的混合液),得到白色固体2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)苯并噁唑,收率92%,反应方程式如下:
产物的波谱数据如下:
ir(kbr)v(cm-1):2943,2864,2202,1686,1607,1564,1467,1406,1248,1085,1012,830,665.
1h-nmr(400mhz,cdcl3,tms)δ(ppm)=7.99-7.93(m,1h),7.86-7.83(m1h),7.64-7.60(m,1h),7.53-7.48(m,2h),7.43-7.35(m,3h),6.97-6.83(m,2h),4.07-3.91(q,3jh-h=6.57hz,2h),1.86-1.72(m,2h),1.51-1.31(m,4h),0.99-0.84(t,3jh-h=6.88hz,3h).
ms(maldi-tof)m/z:理论值417.46,实测值418.21.
实施例2
本实施例的步骤5中,用等摩尔2-氨基-4-甲基苯酚替换实施例1步骤5中的邻氨基苯酚,其他步骤与实施例1相同,得到结构式如下的2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)-5-甲基苯并噁唑,收率89%。
产物的波谱数据如下:
ir(kbr)v(cm-1):2949,2870,2196,1686,1601,1552,1503,1406,1248,1085,1012,830,665.
1h-nmr(400mhz,cdcl3,tms)δ(ppm)=7.98-7.89(m,1h),7.62-7.59(m1h),7.64-7.60(m,1h),7.53-7.46(m,3h),7.39-7.34(m,1h),7.23-7.19(dd,3jh-h=8.27hz,4jh-h=1.68hz1h),6.96-6.81(m,2h),4.03-3.92(q,3jh-h=6.65hz,2h),2.49(s,3h),1.89-1.72(m,2h),1.51-1.32(m,4h),1.01-0.88(t,3jh-h=7.04hz,3h).
ms(maldi-tof)m/z:理论值431.48,实测值432.22.
实施例3
本实施例的步骤5中,用等摩尔2-氨基-4-硝基苯酚替换实施例1步骤5中的邻氨基苯酚,其他步骤与实施例1相同,得到结构式如下的2-(2,3-二氟-4-((4-(戊氧基)苯基)乙炔基)苯基)-5-硝基苯并噁唑,收率67%。
产物的波谱数据如下:
ir(kbr)v(cm-1):2943,2852,2202,1601,1552,1473,1346,1158,1085,1012,830,726,665.
1h-nmr(400mhz,cdcl3,tms)δ(ppm)=8.73-8.01(d,j4h-h=2.11hz,1h),8.40-8.34(dd,j3h-h=9.13hz,j4h-h=2.28hz,1h),8.01-7.95(m1h),7.77-7.71(d,j3h-h=9.26hz,1h),7.54-7.48(m,2h),7.45-7.38(m,1h),6.93-6.86(m,2h),4.07-3.94(q,3jh-h=6.81hz,2h),1.86-1.73(m,2h),1.51-1.32(m,4h),0.99-0.84(t,3jh-h=6.98hz,3h).
ms(maldi-tof)m/z:理论值462.45,实测值463.23.
实施例4
本实施例的步骤3中,用等摩尔1-碘-4-(辛氧基)苯替换实施例1步骤3中的1-碘-4-(戊氧基)苯,其他步骤与实施例1相同,得到结构式如下的2-(2,3-二氟-4-((4-(辛氧基)苯基)乙炔基)苯基)苯并噁唑,收率89%。
产物的波谱数据如下:
ir(kbr)v(cm-1):2932,2863,2205,1603,1512,1239,1158,1096,999,830,744,665.
1h-nmr(400mhz,cdcl3,tms)δ(ppm)=8.00-7.92(m,1h),7.86-7.81(m1h),7.66-7.59(m,1h),7.53-7.48(m,2h,overlap),7.44-7.35(m,3h),6.92-6.85(m,2h),4.02-3.89(q,3jh-h=6.58hz,2h),1.88-1.73(m,2h),1.50-1.41(m,2h),1.36-1.22(m,8h),0.93-0.82(t,3jh-h=6.85hz,3h).
ms(maldi-tof)m/z:理论值459.54,实测值460.25.
实施例5
本实施例的步骤3中,用等摩尔1-碘-4-(十二烷氧基)苯替换实施例2步骤3中的1-碘-4-(戊氧基)苯,其他步骤与实施例2相同,得到结构式如下的2-(2,3-二氟-4-((4-(十二烷氧基)苯基)乙炔基)苯基)-5-甲基苯并噁唑,收率91%。
产物的波谱数据如下:
ir(kbr)v(cm-1):2931,2852,2208,1601,1556,1449,1401,1248,1158,1103,1085,1024,799,635.
1h-nmr(400mhz,cdcl3,tms)δ(ppm)=7.98-7.89(m,1h),7.62-7.59(m1h),7.64-7.60(m,1h),7.53-7.46(m,3h),7.39-7.34(m,1h),7.23-7.19(d,d,3jh-h=8.27hz,1h),6.96-6.81(dd,2h),4.00-3.94(q,3jh-h=6.56hz,2h),2.48(s,3h),1.84-1.73(m,2h),1.51-1.40(m,2h),1.39-1.28(m,16h),0.95-0.85(t,3jh-h=7.10hz,3h).
ms(maldi-tof)m/z:理论值529.67,实测值530.21.
对上述实施例1~5制备的液晶化合物的光学各向异性和热性能进行测试,得到其双折射率、相转变温度和相变焓。双折射率是通过gaussian09软件得到理论值;也可以通过阿贝折光仪测试得到实验值;相转变温度和相变焓是通过差示扫描量热仪测试得出。结果见表1和表2。
表1双折射率
表2相转变温度和相变焓
注:表中cr代表结晶相;n代表向列相;i代表各向同性。
由表1可见,本发明液晶化合物(实验值δn≥0.457)与文献(liquidcrystals,2017,44:14-15,2184-2191)中大双折射率液晶化合物
由表2可见,本发明化合物具有较宽的向列相区间。
由图1的dsc曲线(升降温速率5℃/min)及图2和3的pom照片(200×)可见,本发明化合物具有向列相的液晶织构及在升降温中均具有液晶相态。
- 还没有人留言评论。精彩留言会获得点赞!