可以作为活细胞胆固醇区和高尔基体探针的胆固醇硅酞菁纳米体系及其制备方法和应用与流程
本发明属于分子探针领域,尤其属于可以作为胆固醇区和高尔基体探针的胆固醇硅酞菁纳米体系及其制备方法和应用,该两亲嵌段共聚物负载胆固醇硅酞菁纳米体系作为活细胞胆固醇区和高尔基体探针和光动力治疗光敏剂。
背景技术:
光动力疗法(pdt)被认为是一种具有临床应用前景的治疗癌症和非癌症疾病的方法。它利用光敏剂(pss)、光和氧的联合作用产生活性氧(ros)来消灭癌细胞。pdt对癌症治疗具有时空选择性,因为pss产生的ros只发生在暴露于光下的位置,而由此产生的化学反应发生在该区域周围数十纳米范围内。然而,由于缺乏理想的pss和有效的目标载体,pdt的有效性还没有得到充分的实现。酞菁及其金属衍生物是一种很有发展前途的第二代pss,由于其在光治疗窗口中的强吸收、高ros量子产率和较低的暗毒性而受到广泛关注。然而,酞菁在生理条件下的低溶解度和严重的聚集行为严重降低了它们的pdt效能。酞菁化合物在pdt中应用的第二个局限性是对靶细胞和组织缺乏选择性。
胆固醇是一种甾体分子,是生物膜的组成部分,是合成各种生物代谢物的前体。它广泛存在于各种组织中,如大脑、皮肤、神经组织、肾上腺和肝脏,并构成脂肪层的主要部分。胆固醇在血液中主要由低密度脂蛋白(ldl)转运,ldl通过受体介导的内吞过程与恶性细胞优先发生相互作用。在细胞中,胆固醇也是细胞膜系统的重要组成部分,包括质膜和细胞质中的细胞器膜。已有报道胆固醇修饰的分子可以与细胞中富含胆固醇的膜系统相互作用。目前已经见报道的可以用来观察细胞内的胆固醇分布的荧光探针分子主要有是filipin。filipin是一种多烯抗生素,可以与胆固醇形成荧光复合物。但filipin是一种细胞毒性化合物,但其只能用于固定细胞探针。目前还不完全清楚filipin染色是否能准确反映胆固醇的分布,特别是在细胞内不易接近和/或容易受到固定技术影响的部位。高尔基体作为胆固醇区主要的细胞器,其定位主要有商用的染料glogi-trackerred,但其价格昂贵,且在细胞器成像中选择性不佳,容易漂白。
针对酞菁分子易聚集和靶向性差等的问题,考虑在酞菁轴向位置引入胆固醇分子,赋予较大的空间位阻,可以有效阻止聚集体形成。另一方面胆固醇修饰的分子可以与细胞中富含胆固醇的膜系统相互作用,增强pss在肿瘤组织中的定位,有利于pss在细胞中的靶向和摄取,有利于提高pdt的疗效。此外,胆固醇修饰酞菁及其两亲嵌段共聚物负载的胆固醇硅酞菁纳米体系分别具有脂溶性和水溶性,低毒性,和强荧光信号,可以作为敏感的探针用于检测内源性胆固醇的分布和活细胞中胆固醇运输过程的示踪剂。胆固醇修饰酞菁及其两亲嵌段共聚物负载的胆固醇硅酞菁纳米体系还可以作为光敏剂,用于光动力治疗肿瘤,还可用于癌症成像引导治疗。
技术实现要素:
本发明的目的在于提供一种两亲嵌段共聚物负载胆固醇硅酞菁纳米体系用于活细胞胆固醇区和高尔基体的示踪剂及其体外光动力疗法。
本发明还提出一种胆固醇硅酞菁(chol-sipc)配合物及其制备方法。
本发明的目的是这样实现的,本发明所述的一种可以作为胆固醇区和高尔基体探针的胆固醇硅酞菁复合纳米体系,为下述组成的两亲嵌段共聚物负载的纳米体系:
本发明所述的可以作为活细胞胆固醇区和高尔基体探针的胆固醇硅酞菁纳米体系其制备方法,包括如下步骤:1)胆固醇、二氯硅酞菁(sipccl2)和无水k2co3在干燥甲苯溶剂中搅拌回流得到胆固醇硅酞菁(chol-sipc),2)dspe-mpeg2000和胆固醇硅酞菁(chol-sipc)在四氢呋喃和水存在下,通过纳米共沉淀法自组装制备出可以作为活细胞胆固醇区和高尔基体探针的胆固醇硅酞菁纳米体系。
本发明上述的二氯硅(ⅳ)酞菁是采用1,3-二亚氨基异吲哚啉,四氯化硅和喹啉,在200℃下搅拌回流,然后当反应液降温至70-90℃时,将其倾入甲醇中,趁热过滤,滤渣分别用甲苯、喹啉、甲醇以及丙酮洗涤后,干燥后得到紫红色固体。
本发明所述的胆固醇硅酞菁(chol-sipc)配合物合成优选胆固醇与二氯硅(ⅳ)酞菁和无水k2co3在甲苯中140℃回流反应。粗产品用硅胶层析柱分离,二氯甲烷:己烷为洗脱液,真空干燥得到蓝紫色物质。
本发明所述的一种可以作为活细胞胆固醇区和高尔基体探针的胆固醇硅酞菁纳米体系的合成优选dspe-mpeg2000和胆固醇基轴向取代酞菁在四氢呋喃中,逐滴加入水,超声,室温下搅拌1天。溶液经孔径0.22μm滤膜过滤得到纳米粒子的溶液。
本发明上述的一种两亲嵌段共聚物负载胆固醇硅酞菁纳米体系用于活细胞胆固醇区和高尔基体的荧光探针及光动力治疗光敏剂。
本发明的有益效果:与以前专利文献中不同取代基取代酞菁相比较,本发明合成一种胆固醇硅酞菁配合物。不仅可以利用胆固醇基大的结构的空间位阻,在一定程度上抑制酞菁的聚集行为,另一方面,胆固醇基的引入可提高系统的稳定性;可提高pdt过程中的活性氧生成效率、细胞摄取和细胞光毒性。使得胆固醇硅酞菁配合物成为一类具有良好光动力治疗潜力的光敏剂。
将具有良好生物相容性的两亲性聚合物用于负载胆固醇酞菁配合物。一方面,两亲嵌段共聚物可以作为保护层,减少包覆的功能材料暴露在氧气和水中,被证明能有效地解决单线态氧量子产率与荧光猝灭等问题。另一方面,胆固醇修饰的分子可以与细胞中富含胆固醇的膜系统相互作用,增强pss在肿瘤组织中的定位,有利于pss在细胞中的靶向和摄取,有利于提高pdt的疗效。从而为实现有效和精确的活细胞靶向和光动力疗法以及避免药物光毒性具有积极意义。此外,我们还发现,胆固醇硅酞菁主要分布在乳腺癌细胞中富含胆固醇的区域,并且优先定位于高尔基体。两亲嵌段共聚物负载后的纳米体系具有毒性低、水溶性好、荧光信号强等特点,可用作胆固醇区和高尔基体的定位的新型敏感探针。两亲嵌段共聚物负载胆固醇硅酞菁的纳米体系能在活细胞中有效产生ros,对乳腺癌细胞有良好的光毒性,并通过破坏高尔基体功能,诱导细胞凋亡。因此,胆固醇硅酞菁纳米体系有望作为成像引导的癌症治疗的候选药物和一种可以作为胆固醇区和高尔基体的定位的新型敏感探针。此外,胆固醇硅酞菁纳米体系还可以用于癌症成像引导的光动力治疗的光敏剂。
附图说明
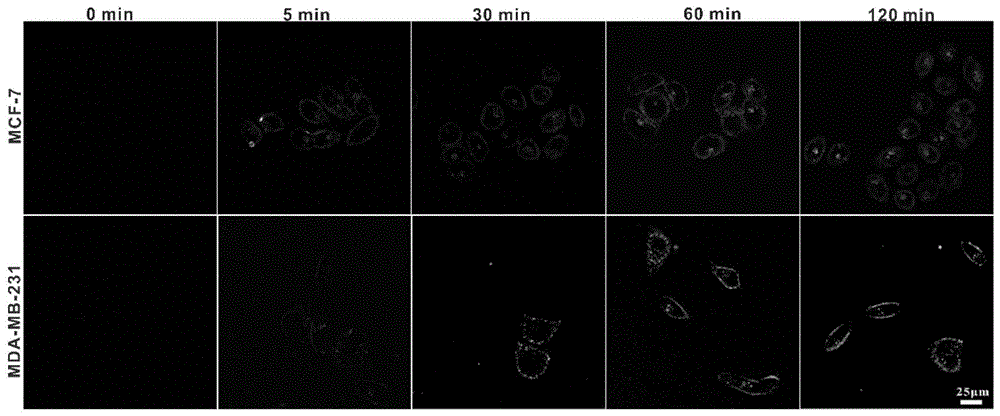
图1为两亲嵌段共聚物负载胆固醇硅酞菁纳米体系在在乳腺癌细胞mcf-7和mda-mb-231中的示踪图。
图2为两亲嵌段共聚物负载胆固醇硅酞菁纳米体系在乳腺癌细胞mcf-7和mda-mb-231中的定位图;其中(a)为胆固醇区定位图,(b)为高尔基体定位图。
图3a为两亲嵌段共聚物负载胆固醇硅酞菁纳米体系对乳腺癌细胞mcf-7的光动力活性图。
图3b为两亲嵌段共聚物负载胆固醇硅酞菁纳米体系对乳腺癌细胞mda-mb-231的光动力活性图。
图4为乳腺癌细胞mcf-7和mda-mb-231与两亲嵌段共聚物负载胆固醇硅酞菁纳米体系共孵育后的光照前后对比图。
具体实施方式
下面结合实施例对本发明进行详细说明:
具体实施例一
1)二氯硅(ⅳ)酞菁(sipccl2)的合成
在三颈烧瓶中分别加入1,3-二亚胺基异吲哚啉(7.28g,50.15mmol),四氯化硅(8.3ml)和喹啉(83ml),220℃时搅拌回流30min,冷却至室温,将其倾入500ml甲醇溶液,搅拌静置大约1h以后,过滤,滤渣用丙酮、甲醇、二氯甲烷、甲醇等溶剂洗涤各35ml洗涤,干燥后得紫红色固体(二氯硅(ⅳ)酞菁)3.6759g,产率为48.62%。
)胆固醇硅酞菁(chol-sipc)的合成
胆固醇(cas:57-88-5)(0.115g,0.3mmol),步骤1)制得的二氯硅(ⅳ)酞菁(0.0611g,0.1mmol)无水碳酸钾(0.276g,2mmol)和20ml甲苯加到100ml的反应瓶中,在120摄氏度下,回流24小时。冷却至室温,过滤,滤液浓缩后经硅胶柱层析2次(正己烷:二氯甲烷体积比2:1)。得到蓝紫色固体(胆固醇硅酞菁(chol-sipc))0.024g,产率为32%。
合成表征:irν/cm-1:745(ar-h),1080(si-o),1290(c-o),2961(-ch2);esi-ms[m]+:1310.82m/z(100%).
3)两亲嵌段共聚物负载胆固醇硅酞菁纳米体系的合成(dspe@chol-sipc)
将步骤2)制得的chol-sipc以thf为溶剂,配制成1×10-4mol/l的酞菁储备液,取1ml酞菁储备液,在超声下分别溶解1mg的两亲嵌段共聚物dspe-peg2000(购自上海亚亦生物技术有限公司),然后倒入10ml蒸馏水并继续超声120s。接着混合物在室温下搅拌一夜,蒸发有机溶剂。用0.22μm水相过滤头进一步纯化,收集滤液(dspe@chol-sipc)于2~8℃下避光保存备用。
4)荧光基团fitc标记的两亲嵌段共聚物负载胆固醇硅酞菁纳米体系的合成(dspe@chol-sipc)
将步骤2)制得的chol-sipc以thf为溶剂,配制成1×10-4mol/l的酞菁储备液,取1ml酞菁储备液,在超声下分别溶解1mg的荧光基团fitc标记的两亲嵌段共聚物fitc-dspe-peg2000(购自上海亚亦生物技术有限公司),然后倒入10ml蒸馏水并继续超声120s。接着混合物在室温下搅拌一夜,蒸发有机溶剂。用0.22μm水相过滤头进一步纯化,收集滤液(fitc-dspe@chol-sipc)于2~8℃下避光保存备用。
具体实施例二:
具体步骤同实施例一:过程2)中k2co3(0.09g,0.654mmol)改为nah(0.01g,0.654mmol),其他反应条件相同。得到蓝紫色固体(胆固醇硅酞菁(chol-sipc))6.6mg,产率2.4%。
过程2)中k2co3(0.09g,0.654mmol)改为吡啶(0.05g,0.654mmol),其他反应条件相同。得到蓝紫色固体(胆固醇硅酞菁(chol-sipc))5.8mg,产率1.46%。
)乳腺癌细胞mcf-7和mda-mb-231对fitc-dspe@chol-sipc的实时示踪
取对数生长期的mcf-7和mda-mb-231细胞,消化、离心收集、重悬计数后,以大约1×104的浓度接入3.5cm共焦皿中,放入37℃、5%co2恒温培养箱培养过夜(20~24h)。第二天小心吸去培养液,pbs洗涤细胞2次后加入混有fitc-dspe@chol-sipc纳米粒子的dmem,用激光扫描共聚焦显微镜对细胞进行实时成像。chol-sipc的激发光为双光子860nm,收集620~700nm之间的荧光信号,fitc的激发光为单光子488nm,收集400~600nm之间的荧光信号,见图1。从图中可以看出,mcf-7细胞5min内就可以在细胞膜上看到fitc-dspe@chol-sipc的荧光,mcf-7细胞与fitc-dspe@chol-sipc孵育30min后,质膜上出现绿色荧光信号,细胞质内出现红色点状荧光信号。说明chol-sipc与dspe-mpeg2000载体分离。孵育60min后,细胞膜绿色荧光密度增加,细胞质红色荧光密度增加,说明mcf-7细胞摄取了更多的fitc-dspe@chol-sipc。此时在mcf-7细胞细胞质中观察到绿色荧光,说明细胞膜上残留的载体分子dspe-mpeg2000也进入到细胞质中。mcf-7和mda-mb-231细胞对纳米颗粒fitc-dspe@chol-sipc的运输有所不同。mcf-7细胞经fitc-dspe@chol-sipc孵育120min后,细胞膜绿色荧光强度降低,细胞质中的绿色荧光强度增加,说明随着孵育时间的延长,有更多的载体分子dspe-mpeg2000从细胞膜进入细胞质中。但在mda-mb-231细胞中,细胞膜上的绿色荧光逐渐增加,但细胞质中的绿色荧光在30到120分钟没有随着时间的增加而增强。说明mcf-7和mda-mb-231的细胞膜结构的不同。
)两亲嵌段共聚物负载胆固醇硅酞菁纳米体系(dspe@chol-sipc)在乳腺癌细胞mcf-7和mda-mb-231中的活细胞中高尔基体的细胞定位
取对数生长期的mcf-7细胞,消化、离心收集、重悬计数后,以大约1×104的浓度接入3.5cm共焦皿中,放入37℃、5%co2恒温培养箱培养过夜(20~24h)。第二天小心吸去培养液,pbs洗涤细胞2次后加入混有dspe@chol-sipc纳米粒子的dmem,孵育18h。吸掉培养液,细胞用4%的多聚甲醛固定10min,吸掉废液,用pbs重复洗三次,然后加入50μg/ml的filipin孵育30min,用pbs重复洗三次。胆固醇酞菁的激发光为双光子860nm,收集620~700nm之间的荧光信号,filipin用激发光为双光子730nm,收集400~500nm之间的荧光信号,如图2中的(a)所示。dspe@chol-sipc在mcf-7细胞中的荧光主要分布在细胞核周围的细胞质中,与胆固醇区定位染料filipin的叠加图可以发现,荧光主要集中在mcf-7细胞的胆固醇区。在哺乳动物细胞内,高尔基体膜中游离胆固醇的含量最高。我们进一步将与dspe@chol-sipc共孵育后的细胞和golgi-tracker共染色,发现dspe@chol-sipc和染料重叠很好,如图2中的(b)所示。说明dspe@chol-sipc主要在mcf-7和mda-mb-231细胞的高尔基体中积累。
两亲嵌段共聚物负载胆固醇硅酞菁纳米体系(dspe@chol-sipc)对乳腺癌细胞mcf-7和mda-mb-231的光动力活性评价
取对数生长期的mcf-7和mda-mb-231细胞,消化、离心收集、重悬计数后,以大约1×104的浓度接入96孔板培养中,加入100μl含10%牛血清的dmem培养基,放入37℃,5%co2恒温培养箱培养过夜(20~24h)。第二天小心吸去培养液,pbs洗涤细胞2次后,加入不同浓度的dspe@chol-sipc继续孵化24h,用(670nm,100mw/cm2)激光照射10min后,继续孵育12小时,然后每孔加入10μlcck-8,继续培养2h。通过公式计算出细胞相对存活率。cck-8测定细胞存活率,见图3a和图3b。
从图3a和图3b可以看出,两亲嵌段共聚物负载胆固醇硅酞菁纳米体系对mcf-7和mda-mb-231细胞有明显抑制作用。从光照图(图4)可以清楚的看到,dspe@chol-sipc对细胞的损伤主要是通过pdt。
- 还没有人留言评论。精彩留言会获得点赞!