监测细胞自噬的溶酶体靶向pH荧光探针及制备和应用的制作方法
本发明涉及ph荧光探针技术领域,具体涉及监测细胞自噬的溶酶体靶向ph荧光探针及制备和应用。
背景技术:
自噬(autophagy)是由ashford和porter在1962年发现细胞内有“自己吃自己”的现象后提出的,是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。细胞自噬作为生物体中一种非常重要的代谢途径,是细胞成分降解和回收利用的基础,在细胞中起着“清道夫”的作用。传统的自噬监测策略是基于扫描电子显微镜(tem),通过蛋白免疫印迹(atg8/lc3)或基因编码的荧光蛋白法(gfp-lc3/p62)监测自噬体相关蛋白。然而,这些方法通常具有局限性,如扫描电镜和蛋白免疫印迹法通常需要进行细胞固定以使细胞易于获得抗体,即无法监测活细胞自噬状态;同时,荧光蛋白法需要复杂的设计和转染过程,不允许长时间的自噬监测,再加上gfp-lc3容易在酸性自噬溶酶体中的降解以及gfp的荧光猝灭等,通过上述方法很难实现对活细胞自噬的快速、实时、低成本的监测。因此以一种高效和经济的方式来观察自噬仍然是一个巨大的挑战。
溶酶体是真核细胞中一种具有单层膜结构的细胞器,内含许多水解酶,用来分解多种外源性和内源性生物大分子物质或细胞自身的局部细胞质或细胞器等。一般来说,自噬发生时,自噬体的膜会和溶酶体的膜进行融合形成自噬溶酶体,使内容物在酸性ph值(4.5~5.5)的水解酶的帮助下降解和再循环。在自噬的膜融合过程中,由于溶酶体和自噬体的差异,溶酶体ph值等微环境会发生变化。因此,我们可以通过检测溶酶体内ph的变化来监测自噬进行的程度。
目前文献报道了许多检测溶酶体ph变化的荧光探针,然而由于这些探针的激发和发射波长大多处于紫外区域,与细胞自发荧光相互交叠,造成背景荧光较强,且紫外光对细胞的毒副作用较大,因而不适合长时间的检测。此外,现有溶酶体靶向基团集中于传统的吗啉环和二甲氨基结构,这类弱碱性基团容易聚集在弱酸性溶酶体中引起溶酶体的“碱化效应”,长时间作用会导致细胞中毒。因此,需要开发新型的溶酶体靶向探针用于溶酶体内ph的检测。本发明引入能够有效避免溶酶体的“碱化效应”的二乙二醇单甲醚为新型溶酶体靶向基团,利用具有优良ph响应荧光性质的罗丹明b为荧光团母体结构,设计合成了新型ph荧光探针rml,通过对细胞溶酶体内ph的特异性检测实现对细胞自噬过程的监测。
技术实现要素:
本发明的目的之一是提供一种溶酶体靶向ph荧光探针rml的制备方法;目的之二是提供该荧光探针的用途,即用于制备动物细胞自噬过程中溶酶体内ph的检测试剂。
为了达到上述目的,本发明采用了下列技术方案:
一种监测细胞自噬的溶酶体靶向ph荧光探针的结构式为:
一种监测细胞自噬的溶酶体靶向ph荧光探针的制备方法,包括如下步骤:
(1)将2-(2-氨基乙基)-3',6'-双(二乙氨基)螺环[异吲哚-1,9'-黄原]-3-酮和2-(2-甲氧基乙氧基)4-甲基苯磺酸乙酯溶于n,n-二甲基甲酰胺中,加热回流反应,体系冷却至室温,减压旋蒸除去n,n-二甲基甲酰胺溶剂制得粗品;
(2)将步骤(1)所制得的粗品经硅胶柱色谱提纯得到淡黄色固体为权利要求1所述的荧光探针。
进一步,所述一种监测细胞自噬的溶酶体靶向ph荧光探针的制备方法,步骤(1)中的2-(2-氨基乙基)-3',6'-双(二乙氨基)螺环[异吲哚-1,9'-黄原]-3-酮和2-(2-甲氧基乙氧基)4-甲基苯磺酸乙酯的摩尔比是1:1.5~2,所述加热回流反应的反应温度为135℃,反应时间为12~15h。
进一步,所述一种监测细胞自噬的溶酶体靶向ph荧光探针的制备方法,步骤(2)中的硅胶柱色谱洗脱剂的体积配比为氯仿:甲醇=20:1。
一种监测细胞自噬的溶酶体靶向ph荧光探针的应用,在定性检测制备动物细胞溶酶体ph变化时作为检测试剂。
一种监测细胞自噬的溶酶体靶向ph荧光探针的应用,作为检测试剂,通过检测制备动物细胞溶酶体ph的变化以实现对细胞自噬过程的监测。
与现有技术相比,本发明具有以下有益效果:(1)所述荧光探针rml合成步骤简单,成本低廉,易于大规模生产,具有潜在的商品化应用价值;(2)所述荧光探针rml利用新型的二乙二醇单甲醚作为细胞内溶酶体的靶向基团,有效避免传统溶酶体靶向基团(如吗啉环与二甲氨基等)的“碱化效应”;(3)所述荧光探针rml以罗丹明b为荧光团母体结构,以及ph响应基团,利用h+诱导罗丹明b的环内酰胺形成开环形式,导致荧光增强,实现对ph高灵敏检测,并且其它氨基酸和离子不干扰对ph的检测;(4)pka值为4.96,ph响应线性范围4.5~5.7,非常适合溶酶体内弱酸性环境ph的检测。(5)该荧光探针rml具有良好的细胞膜渗透性,能够靶向标记溶酶体,且通过检测溶酶体ph的变化实现对细胞自噬过程的可视化监测,在溶酶体ph生理学和病理学研究中具有潜在的应用前景。(6)所述的检测手段简单,只需包括荧光分光光度计和激光共聚焦显微镜。
附图说明
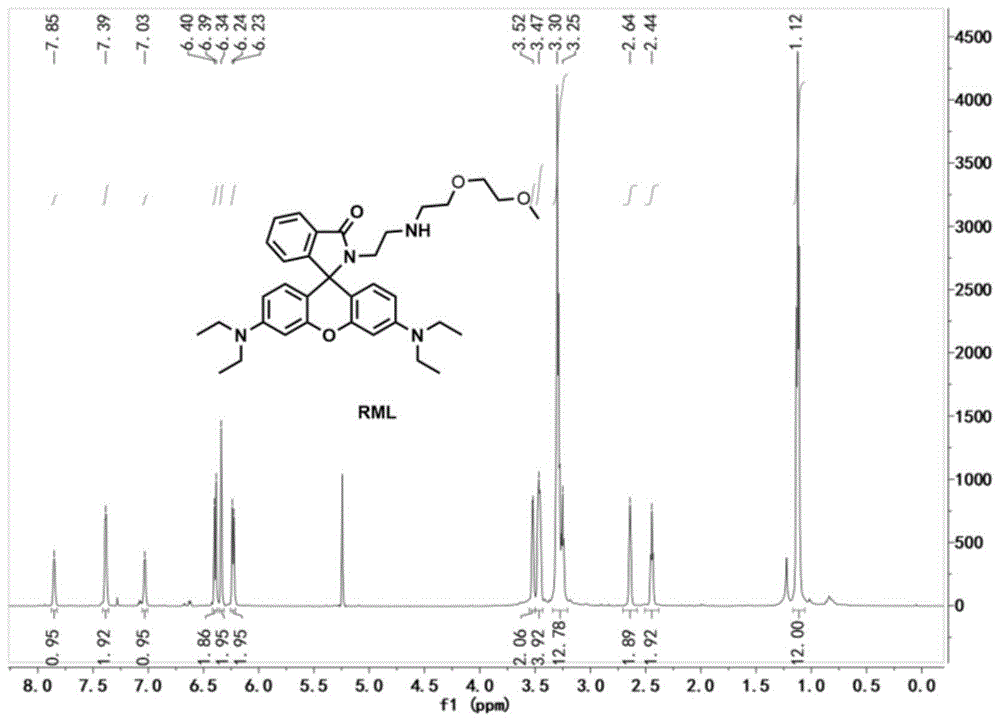
图1a为本发明探针rml的核磁表征,1h-nmr谱;
图1b为本发明探针rml的核磁表征,13cnmr谱;
图2为本发明探针rml的质谱表征,lc-ms谱;
图3为本发明探针rml在不同ph值的缓冲溶液中的紫外吸收光谱图;
图4为本发明探针rml在自然光下识别h+前后溶液颜色变化,由无色变为粉色;
图5为本发明探针rml与不同ph值的缓冲溶液中的荧光发射光谱图;
图6为本发明探针rml在紫外光下识别h+前后溶液荧光颜色变化,由无色变为红色;
图7为本发明探针rml的荧光强度i583随ph值变化的sigmoidal拟合曲线;pka值为4.96,ph响应线性范围4.5~5.7;
图8为本发明探针rml分别在ph为7.4和ph为4.4时,在常见金属离子、阴离子和氨基酸小分子存在下对h+的选择性;为本发明探针rml的荧光强度i583随ph值变化的sigmoidal拟合曲线;pka值为4.96,ph响应线性范围4.5~5.7;
图9为本发明探针rml在hela细胞培养12h后的细胞存活率(探针浓度分别为0μm、1μm、5μm、10μm、15μm、20μm);
图10为本发明探针rml分别与市售绿色溶酶体特异选择性染料(lysotrackergreendnd-26)和绿色线粒体特性选择性染料(mitotrackergreen)在ph值为7.4的条件下共同孵育30min的共定位荧光成像图;
图11为本发明探针rml分别在ph7.40,ph6.00,ph5.00和ph4.50时,与hela细胞共同孵育10min的激光共聚焦成像图;
图12为本发明探针rml分别在富含营养物质的正常培养基(rich-nutrient)、hank’sbalancedsaltsolution(hbss)(诱导细胞发生自噬过程的饥饿培养基)和抑制自噬的培养基(hbss加3-甲基腺嘌呤(3-ma))(3-甲基腺嘌呤是抑制细胞自噬的药物)培养0-4小时,观察细胞的激光共聚焦成像变化。
具体实施方式
实施例1
3',6'-双(二乙氨基)-2-(2-((2-(2-甲氧基乙氧基)乙基)氨基)乙基)螺[异二氢吲哚-1,9'-呫吨]-3-酮(rml)的制备及表征:
在圆底烧瓶中,将2-(2-氨基乙基)-3',6'-双(二乙氨基)螺环[异吲哚-1,9'-黄原]-3-酮(170mg,0.62mmol)和2-(2-甲氧基乙氧基)4-甲基苯磺酸乙酯(300mg,0.93mmol)溶于n,n-二甲基甲酰胺中,加热回流12h至反应完全;体系冷却至室温,减压旋蒸除去溶剂制得粗品;粗品经硅胶柱提纯(洗脱剂按体积比氯仿:甲醇=20:1)得到淡黄色固体为目标化合物rml。
1hnmr(600mhz,dmso-d6,图1a)δ(ppm):1.11-1.13(t,12h,-ch3-),2.44(s,2h,-ch2-),2.64(s,2h,-ch2-),3.32-3.30(m,13h,-ch2-),3.47(m,4h,-ch2-),3.52(m,2h,-ch2-),6.23-6.24(d,2h,ar-h),6.34(s,2h,ar-h),6.39-6.40(d,2h,ar-h),7.03(m,1h,ar-h),7.39(m,2h,ar-h),7.85(m,1h,ar-h).
13cnmr(150mhz,dmso-d6,图1b)δ(ppm):12.56,39.81,44.31,48.28,53.51,58.91,65.08,69.82,77.13,77.35,77.56,97.69,105.16,108.06,122.66,123.75,127.98,128.62,130.91,132.44,148.70,153.21,153.61,168.51.
hr-msm/z(图2):[m+h]+calclatedforc35h47n4o4+,587.3519;measured,587.3594.
实施例2
将实施例1中的荧光探针rml用二甲亚砜配制浓度为1mm的储备液保存。实验中用不同ph值的britton-robinson缓冲液(br)将探针稀释为终浓度25μm,记录在dmso/br(1/99,v/v)体系中随ph变化的紫外吸收光谱(图3)。随着ph值由7.4降低到4.5,561nm处的吸收峰逐渐增强。同时溶液颜色由无色变为粉色(图4)。
实施例3
同样用不同ph值的britton-robinson缓冲液将探针稀释为终浓度10μm,固定激发波长为560nm,记录荧光探针rml在dmso/br(1/99,v/v)体系中随ph变化的荧光发射光谱变化。随着ph值由7.4降低到4.4,583nm处的荧光强度逐渐增强(图5)。同时溶液荧光颜色由无色变为红色(图6)。根据荧光探针rml在583nm处的荧光强度值随ph变化的singmoidal拟合曲线计算pka值为4.96(图7),ph响应线性范围为4.5~5.7,非常适合溶酶体弱酸性环境ph变化的检测。
实施例4
将实施例1中的荧光探针rml浓度保持在10μm,分别考察该探针在常见离子及氨基酸存在下,对h+的选择性。如图8所示,在dmso/br(1/99,v/v)体系中,ph7.4和ph4.4时,荧光探针rml对上述物质几乎没有响应,证明荧光探针rml对h+具有很高的选择性。图8中物质的顺序和浓度依次为:1,空白;2,k+(150mm);3,na+(150mm);4,mg2+(2mm);5,ca2+(2mm);6,ba2+(0.2mm);7,cu2+(0.2mm);8,fe2+(0.2mm);9,fe3+(0.2mm);10,ni2+(0.2mm);11,zn2+(0.2mm);12,cl-(10mm);13,so42-(0.2mm);14,so32-(0.2mm);15,no-(0.2mm);16,ac-(0.2mm);17,cys(0.1mm);18,gsh(0.1mm);19,hcy(0.1mm);20,ala(0.1mm);21,his(0.1mm);22,arg(0.1mm);23,lys(0.1mm);24,phe(0.1mm);25,met(0.1mm);26,leu(0.1mm);27,try(0.1mm);28,glu(0.1mm);29,asn(0.1mm).
实施例5
将实施例1中的荧光探针rml进行细胞毒性测试。mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)实验是根据已报道的文献,分别在同一批hela细胞中加入0μm、1μm、5μm、10μm、15μm、20μm的荧光探针,此条件是在37℃、含5%co2的细胞培养箱中孵育12小时,根据细胞存活度的公式:细胞存活率%=od570(样品)/od570(对照组)*100,可计算得到细胞存活率(图9)从图9中我们可以看出,当探针浓度达到20μm时,细胞存活率依然有约83%,说明了本发明荧光探针rml对细胞基本没有毒性作用,因此可以用来进行细胞检测及长时监测溶酶体中的ph变化情况。
实施例6
为了观察实施例1中的荧光探针rml是否具有溶酶体靶向性,我们分别进行了荧光探针rml与商业化绿色溶酶体探针lysotrackergreendnd-26和商业化绿色线粒体探针mitotrackergreen的共定位实验。将贴壁的hela细胞分别与lysotrackergreendnd-26和mitotrackergreen(终浓度5μm)在ph7.4的条件下,于37℃、5%co2的孵育箱中孵育30min后,用磷酸盐缓冲液(ph7.4)轻轻洗涤3次,除去多余的染料。然后加入实施例1中的荧光探针rml(终浓度10μm)共同孵育10min,在激光共聚焦显微镜下分别观察二者的共定位情况。其中,荧光探针rml的固定激发波长为561nm,收集红色荧光发射范围568-650nm;lysotrackergreendnd-26和mitotrackergreen的固定激发波长为488nm,收集绿色荧光发射范围490-530nm。由图10a、10e可知,荧光探针rml呈红色荧光分布于细胞质区域,说明荧光探针rml具有良好的细胞膜通透性。此外,荧光探针rml的红色荧光与lysotrackergreendnd-26(图10b)能够很好地重叠,得到黄色荧光(图10c),经软件处理荧光探针rml与lysotrackergreendnd-26的pearson’s共定位系数高达0.89(图10d);相反,探针rml与mitotrackergreen(图10f)严重不重叠,二者pearson’s共定位系数为-0.14(图10h)。这些数据表明荧光探针rml与lysotrackergreendnd-26具有显著的共定位成像,能够靶向定位于溶酶体。
实施例7
将贴壁的hela细胞与实施例1中的荧光探针rml分别在ph7.40,6.00,5.00,4.50的条件下,于37℃、5%co2的孵育箱中共同孵育10min,然后再加入nigericin继续孵育10min。最后分别用相应ph值的磷酸盐缓冲液轻轻洗涤3次,除去多余的荧光探针rml,在激光共聚焦显微镜下观察。固定激发波长为561nm,收集红色荧光发射范围568-650nm。由图11可知,ph7.4时细胞在红色通道几乎观察不到荧光(图11a);随着ph降至4.50时,细胞的红色荧光逐渐增强(图11b-d)。明场成像进一步证实了经探针孵育后细胞的存活性(图11e-h)。图(11i-j)分别为图(11a-d)与相应的明场成像图(11e-h)的叠加图。这些结果说明荧光探针rml能够高灵敏检测细胞内溶酶体弱酸性环境ph的变化。
实施例8
将贴壁的hela细胞与实施例1中的荧光探针rml(10μm)分别在富含营养物质的正常培养基(rich-nutrient)、hank’sbalancedsaltsolution(hbss)(诱导细胞发生自噬过程的饥饿培养基,即starvation)和抑制自噬的培养基(hbss加3-甲基腺嘌呤(3-ma),即starvation+3-ma)(3-甲基腺嘌呤是抑制细胞自噬的药物)中连续培养。分别于0h,1h,2h,3h和4h时在激光共聚焦显微镜下观察其荧光变化情况,固定激发波长为561nm,收集红色荧光发射范围568-650nm。如图12所示,hela细胞在(正常培养基,rich-nutrient)条件和starvation+3-ma(抑制自噬培养基)条件下,细胞的红色荧光发射基本保持不变;只有在starvation(诱导自噬培养基)条件下细胞的红色荧光随时间的延长逐渐增强,说明在细胞自噬过程中溶酶体的ph值逐渐降低,同时表明本发明的荧光探针rml能够通过监测溶酶体ph的变化来有效的监测细胞的自噬过程。
- 还没有人留言评论。精彩留言会获得点赞!