一种检测二氧化硫的壳聚糖基荧光探针及其制备方法和应用
本发明属于分析检测技术领域,具体涉及一种检测二氧化硫的壳聚糖基荧光探针及其制备方法和应用。
背景技术:
二氧化硫(so2)被广泛认为是造成空气污染的主要气体之一,近年来被发现参与人体的许多生理活动和一些生物学功能。在生物有机体内,so2是除一氧化氮、一氧化碳和硫化氢以外的第4种气体信号分子,内源性so2能够通过含硫氨基酸如半胱氨酸和谷胱氨肽的生物合成产生以维持生物硫平衡。毒理学和流行病学研究证明,内源性so2的浓度异常与多种疾病密切相关,如呼吸系统疾病、神经系统疾病、心血管系统疾病和癌症等例如,so2作为一种气体信号分子,有研究表明其参与血管舒张、调节血液胰岛素水平、维持氧化还原平衡。当二氧化硫吸入人体通过呼吸系统,在生物体内的存在形式是亚硫酸盐(so32-)和亚硫酸氢离子(hso3-)。
在各种检测so2的方法中,荧光光谱法因其成本低、灵敏度高、选择性好等优点而备受关注。因此,利用罗丹明、bodipy、花青素和咔唑等不同的荧光基团,以及ict等识别机制,开发出了多种荧光探针。但仍存在一些缺点,如供体多样性差、stokes位移较短以及受到gsh、hcy、cys或h2s的干扰等。当检测so2的荧光探针应用到生物体中时,还存在荧光探针生物相容性差,稳定性差的缺点,且人工合成的荧光或比色探针多为有机化合物,有机化合物存在着在水中溶解度较低的特性。
壳聚糖是一种丰富的天然生物聚合物,是由甲壳素脱去乙酰基的产物,其大分子链上存在很多羟基和羧基,含有亲水基和疏水基,同时骨架链间的氢键形成了大分子的二级结构。壳聚糖结构上的特殊性以及高分子化合物的物理特性、使之和许多离子、有机物、生物分子等具有离子交换、鳌合、吸附等作用。壳聚糖还具有多功能性、生物相容性、生物降解性和低细胞毒性等优越的性能之外,还具有独特的跨细胞膜能力而备受关注。但是由于壳聚糖只溶于稀酸和某些特定的溶剂,大大限制了它的应用。壳聚糖主链中的活性羟基和胺基可以通过简单的化学修饰形成多种多样的多功能结构,且壳聚糖能够在生物体中酶解成易被生物吸收、无毒副作用的小分子物质,不会残留在活体内,是一类可生物降解吸收的高分子材料。壳聚糖链中的伯胺基团很容易和生物分子发生反应,诸如:蛋白质、dna、酶、抗原抗体、生物素以及荧光分子异硫氰酸酯(fitc)等,极有可能成为同时偶联荧光分子和生物识别分子的良好基质。
综上所述,研发一种选择性好、灵敏度高,稳定性高、生物相容性好能够在生物体内检测so2的荧光探针具有重要意义。
技术实现要素:
针对现有技术中检测so2的荧光探针稳定性和生物相容性差的缺点,本发明提供了一种检测二氧化硫的壳聚糖基荧光探针及其制备方法和应用,制备的荧光探针选择性好,稳定性高、且生物相容性好,能够对生物体内的so2进行有效检测。
本发明通过以下技术方案实现:
一种检测二氧化硫的壳聚糖基荧光探针,所述的比率型荧光探针得结构如下cs-mae所示:
本发明中,所述的检测二氧化硫的壳聚糖基荧光探针的制备方法包括以下步骤:
(1)将壳聚糖加入到naoh水溶液中,搅拌升温至50~70℃,反应20~30h,反应液过滤,反复冲洗至中性,冷冻干燥得脱乙酰的壳聚糖;
(2)将脱乙酰的壳聚糖加入到醋酸水溶液中,搅拌升温至45~60℃,完全溶解后分批次加入双氧水,停止加热后过滤除去不溶杂质,氢氧化钠调节ph值至ph>10,加入等体积的乙醇,静置过夜,下层沉淀离心,清洗、冷冻干燥得降解后的壳聚糖;
(3)降解后的壳聚糖加入的醋酸水溶液中溶解,完全溶解后用甲醇稀释,加入丁二酸酐丙酮溶液,搅拌反应1.5~3h,静置过夜,旋蒸,透析至透析液呈中性,冷冻干燥得琥珀酰化壳聚糖;
(4)将edc和nhs加入到溶解有化合物mae的dmso溶液中,避光反应3~5h,加入到琥珀酰化壳聚糖盐酸溶液中,室温下避光反应10-14h,反应产物用水透析2-3天,冷冻干燥得检测二氧化硫的壳聚糖基荧光探针;
步骤(4)中所述的mae通过以下方法制备得到:
a)取化合物a2溶于乙腈中,加入ki,110~130℃下加热回流反应0.5~2h,然后加入化合物a1的乙腈溶液,80~100℃加热回流20~30h,反应结束后,冷却至室温,过滤,滤液旋蒸,分离提纯,得化合物a;
b)取化合物b1,加入氯仿溶解,加入化合物b2和三乙胺,在75~90℃下加热回流反应4~6h,反应结束后,冷却至室温,饱和碳酸氢钠溶液和二氯甲烷萃取,旋蒸,分离提纯,得化合物b;
c)将化合物a和化合物b在乙腈溶液中80~100℃下加热回流12~20h,旋蒸,分离提纯,得检测二氧化硫的比率型荧光探针mae;
检测二氧化硫的壳聚糖基荧光探针的合成路线如下所示:
化合物mae的合成路线为:
进一步地,步骤(1)中所述的naoh为50%naoh水溶液;步骤(2)中的所述的醋酸水溶液为2%醋酸水溶液,所述的naoh为10%naoh水溶液;步骤(3)中所述的醋酸为3%醋酸溶液,所述的丁二酸酐丙酮溶液的浓度为0.47mol/l;步骤(4)中盐酸溶液为5%盐酸溶液。
进一步地,步骤(1)中每克壳聚糖中加入25~30mlnaoh溶液;步骤(2)中每克脱乙酰的壳聚糖加入30-50ml醋酸水溶液,每克脱乙酰的壳聚糖中加入0.8~1ml双氧水;步骤(3)中每克降解后的壳聚糖中加入80~120ml醋酸溶液,每克降解后的壳聚糖中加入80~120ml甲醇,每克降解后的壳聚糖中加入5~8ml丁二酸酐丙酮溶液;步骤(4)每克mae中加入10ml的dmso溶液,mae与edc与nhs的摩尔比为1:1.2;1.2,所述的mae与琥珀酰化壳聚糖的质量比为1:5。
进一步地,步骤a)中化合物a1和化合物a2的摩尔比为1:1.2;化合物a2与ki的摩尔比为1.3:1.2;步骤b)中化合物b1和化合物b2的摩尔比为1:1.2;步骤b)中化合物b1和三乙胺的摩尔比为1:0.8;步骤c)中化合物a和化合物b的摩尔比为1:1.3。
进一步地,步骤a)中所述的分离提纯方法为旋蒸后的固体用二氯甲烷溶解,用体积比10:1的二氯甲烷与甲醇的混合溶剂柱层析分离;步骤b)中所述的分离提存方法为旋蒸后的固体用甲醇溶解,用体积比50:1的石油醚与二氯甲烷的混合溶剂柱层析分离;步骤c)所述的分离提纯方法为旋蒸后的固体用甲醇溶解,用体积比30:1的二氯甲烷与甲醇的混合溶剂柱层析分离。
本发明中,所述的检测二氧化硫的壳聚糖基荧光探针在检测so2中的应用。
进一步地,所述的so2为内源性so2或外源性so2。
本发明中壳聚糖基荧光探针以荧光变化、颜色发生明显改变的方式检测二氧化硫。该壳聚糖基荧光探针对内源性和外源性二氧化硫均可以检测,当二氧化硫加入壳聚糖基荧光探针后,随着二氧化硫浓度的增加,荧光强度上升,颜色变浅。所以本发明合成的壳聚糖基荧光探针可特异性识别和检测二氧化硫。壳聚糖载体为小分子荧光探针提供了保护和屏障作用,为以后做药物载体做更好的铺垫。
有益效果
本发明以壳聚糖为载体,利用mae具有高荧光性能的特点,将mae修饰到壳聚糖表面,得到一种新型的壳聚糖基荧光探针,该探针具有荧光强度高、稳定性好、水溶性好、荧光量子产率高的特点;另外,该荧光探针为多糖基质,生物相容性好,毒性小,细胞相容性好的特点,能够适应生物体内二氧化硫的检测,也可以在生物体内提供壳聚糖的疏水环境,以达到更稳定的作用。
附图说明
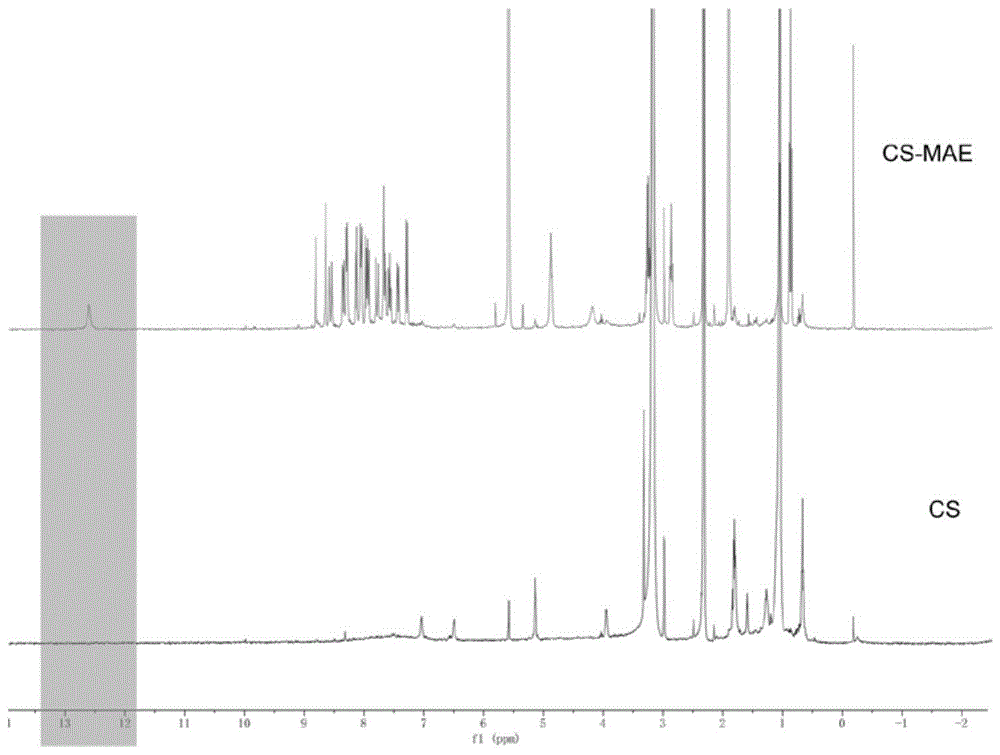
图1为mae和壳聚糖基荧光探针的1hnmr图谱;
图2为不同浓度亚硫酸氢钠条件下壳聚糖基荧光探针的荧光光谱(荧光光谱的激发波长为360nm,发射波长为420nm和440nm,检测波长为420nm和440nm);
图3为壳聚糖基荧光探针在加入不同生物小分子后的荧光强度值;
图4为细胞成像图片。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是进一步说明本发明的特征及优点,而不是对本发明进行限制。
实施例1
一种检测二氧化硫的壳聚糖基荧光探针,具有式(cs-mae)所示的结构:
一种检测二氧化硫的壳聚糖基荧光探针的制备方法,包括以下步骤:
(1)取2g的化合物a2(3-溴丙酸)溶于50ml乙腈中,加入2gki,120℃下回流1h,加入10ml化合物a1乙腈溶液(溶解有2g化合物a1),90℃下回流24h,待反应完全后,反应液冷却至室温,过滤,滤液旋蒸,除去溶剂,固体用二氯甲烷溶解,用体积比为10:1的二氯甲烷和甲醇混合溶剂柱层析法分离提纯得最终反应产物黄色固体2.5g,即化合物a,收率为78%;化合物a的化学表征数据为:1hnmr(400mhz,methanol-d4):δ8.33(d,j=8.5hz,1h),8.25(d,j=9.0hz,1h),8.17(d,j=8.2hz,1h),8.03(d,j=8.9hz,1h),7.81(t,j=7.7hz,1h),7.72(t,j=7.6hz,1h),3.31(m,4h),3.16(t,j=6.5hz,2h),1.84(s,6h);13cnmr(101mhz,methanol-d4):δ199.41,173.07,139.41,138.61,135.13,132.37,131.03,129.69,129.07,128.68,124.40,113.96,57.41,45.60,32.24,22.35,14.44(m);hrms(esi):calcd.c18h20no2+[m]+:282.15,found:282.1475;
(2)称取化合物b1186mg,加入30ml氯仿中搅拌至完全溶解,然后加入102mg的化合物b2溶解,加入1ml三乙胺,在80℃下回流反应5h,待反应结束后,冷却至室温,先后用饱和碳酸氢钠溶液和二氯甲烷萃取,旋蒸除去溶剂,固体用甲醇溶解,用提及比50:1的石油醚和二氯甲烷的混溶剂柱层析分离,得最终反应产物黄色固体98mg,即化合物b,收率为75%,化学表征数据为1hnmr(400mhz,dmso-d6):δ10.15(m,1h),8.95(m,1h),8.67(d,j=8.0hz,1h),8.47(d,j=7.9hz,1h),8.34(d,j=8.0hz,1h),8.05(d,j=7.8hz,1h),7.88(m,1h),7.38(d,j=7.8hz,1h);13cnmr(101mhz,dmso-d6):δ192.73,170.31,154.17(d,j=19.4hz),142.09,139.94,137.01,134.00(d,j=40.6hz),132.82,130.13,129.72,128.62,123.60,121.96,120.79(d,j=6.7hz),116.36,59.73,20.72,14.05;hrms(esi):calcd.forc17h10n2o6+[m]+:338.05,found:338.28;
(3)取产物0.5g化合物a和0.8g化合物b在乙腈溶液溶解,90℃下回流18h,反映结束后,反应液旋蒸除去溶剂,固体用甲醇溶解,用体积比30:1的二氯甲烷和甲醇的混合溶剂柱层析分离提纯,得最终反应产物橘黄色固体0.4g,即为mae,收率为80%。化学表征数据为:1hnmr(400mhz,methanol-d4):δ8.94(d,j=2.6hz,1h),8.66(d,j=16.7hz,2h),8.49(d,j=9.4hz,1h),8.30(d,j=8.7hz,1h),8.24(dd,j=8.9,4.9hz,2h),8.05(t,j=8.1hz,2h),7.82(t,j=7.6hz,1h),7.73(s,2h),7.51(m,1h),7.37(d,j=9.2hz,1h),5.06(m,9h),2.92(t,j=6.6hz,2h),2.16(s,7h),1.29(s,1h);13cnmr(101mhz,dmso-d6):δ171.55,166.95,154.10(d,j=37.4hz),151.84,142.24,140.12,138.41(d,j=22.2hz),136.02,134.01,133.19,131.01,130.47,129.91(d,j=22.2hz),126.69,123.20,122.01,120.96(d,j=32.0hz),116.08,113.41,69.76,67.39,65.00,54.90,53.97(d,j=2.3hz),43.06,32.39,29.77,28.33,25.46,23.22,22.36,18.62,13.86,10.77;hrms(esi):calcd.forc35h28n3o7+[m]+:602.19,found:602.1910。
以合成的mae为原料合成检测二氧化硫的壳聚糖基荧光探针,步骤包括:
a)准确称量壳聚糖粉末20g为原料,加入到含有550ml50%naoh的水溶液的三颈瓶中,搅拌过程中升温至60℃,保持温度和搅拌24小时后取出三颈瓶,过滤,用三蒸水反复冲洗至中性,冰冻后于冷冻干燥机中干燥,最终得18g脱乙酰的壳聚糖粉末;
b)称取脱乙酰处理后的壳聚糖粉末10g,加入到含有400ml2%的醋酸水溶液的三口烧瓶中,搅拌并加热到50℃,当壳聚糖完全溶解后,每隔3小时分三次加入3ml双氧水,共9个小时反应完毕,停止加热后过滤除去不溶杂质,在搅拌下逐滴加入预先配置的10%氢氧化钠溶液至ph=10.5,此时壳聚糖已完全析出,加入等体积的乙醇,静置过夜,使壳聚糖充分沉降,弃去上清液后,下层沉淀离心,用三蒸水洗净,冻干,最终得6g降解后的壳聚糖粉末;
c)取降解后的壳聚糖粉末500mg于圆底烧瓶,加入50ml3%的醋酸溶液,搅拌至完全溶解后甲醇50ml稀释,加入丁二酸酐的丙酮溶液(丁二酸酐(140mg,1.4mmol溶于丙酮3ml),剧烈搅拌2h,静置过夜,旋蒸除去有机溶剂及部分水,用3500透析袋在蒸馏水中透析,至透析液呈中性,在冷冻干燥机中冻干得到琥珀酰化壳聚糖(cs-cooh),质量为480mg;
d)将7.2mg的edc和4.5mg的nhs加入到用10ml的dmso溶解的20mg化合物mae中,在黑暗条件下搅拌4h,然后滴入到5%盐酸溶解的100mg的cs-cooh溶液中,在室温下黑暗中反应12h,产物用蒸馏水渗析,透析三天后,冷冻干燥得产物cs-mae;
化合物mae的合成路线:
壳聚糖基荧光探针的合成路线:
如图1,壳聚糖与壳聚糖基衍生物的h谱比较,如图可见,12.5ppm的羧酸化学位移和7-9ppm的苯环的化学位移出现了峰,已成功合成产物cs-mae。
实施例2
壳聚糖基荧光探针检测二氧化硫的滴定实验
在hepes缓冲液(ph=7.4)中,加入初始浓度为1mm的壳聚糖基比率型荧光探针,使溶液中荧光探针的浓度为10μm。然后,依次加入不同量的初始浓度为1.00mm的亚硫酸氢钠,使得溶液中亚硫酸氢钠的浓度分别为5μm、20μm、50μm、80μm、100μm、180μm、250μm、300μm,不加入亚硫酸氢钠作为对照,静置0.5h使亚硫酸氢钠与壳聚糖基比率型荧光探针充分反应。
用荧光光谱仪测试不同浓度亚硫酸氢钠条件下的荧光光谱,荧光光谱的激发波长为360nm,发射波长为420nm和440nm,检测波长为420nm和440nm,结果分别如图2所示。由图2可知,随着二氧化硫浓度的增加,在420nm波长下的荧光强度逐渐增强,说明本发明的壳聚糖基荧光探针对二氧化硫也能够响应。
实施例3
实施例1中制备的检测二氧化硫的壳聚糖基荧光探针选择性测试:
在hepes缓冲液(ph=7.4)中,加入初始浓度为1mm的壳聚糖基荧光探针,使溶液中荧光探针的浓度为10μm,向溶液中加入过量的其它生物活性小分子(分别为s2o62-、so42-、no2-、no3-、zn2+、fe3+、cu2+、mg2+、oh-、gsh、cys、clo4-、o22-、s2-、·o2-、vc、(ch3)3coo-、onoo-、so32-、hso3-),测试加入不同生物活性小分子之后的荧光光谱,激发波长为360nm,发射波长为440nm,检测波长为440nm,以不同生物活性小分子为横坐标,检测波长为440nm处的荧光强度为纵坐标,结果如图3所示,由图3可知,加入硫氢化钠后强光强度明显增强,其它生物活性小分子不对检测结果产生干扰,说明本发明制备的壳聚糖基荧光探针对二氧化硫具有较高的选择性。
实施例4
实施例1中制备的检测二氧化硫的壳聚糖基荧光探针的细胞实验
将10μl的10g/ml壳聚糖基荧光探针加入含有培养好的10g/ml的hela细胞的培养皿中,摇晃均匀利用共聚焦显微镜,在激发波长为405nm,发射波长为440nm,检测波长为440nm,每隔5min、10min、30min、60min拍照观察,30min后的细胞成像图片如图4(a)所示。
同样的,将10μl的10g/ml壳聚糖基荧光探针和10mg/ml的亚硫酸氢钠加入含有培养好的10g/ml的hela细胞的培养皿中,摇晃均匀,利用共聚焦显微镜在激发波长为405nm,发射波长为440nm,检测波长为440nm,每隔5min、10min、30min、60min拍照观察,30min后的细胞成像图片如图4(b)所示。
同样的,将10μl的10g/ml壳聚糖基荧光探针和5ml的二氧化硫内源性刺激物加入含有培养好的10g/ml的hela细胞的培养皿中,摇晃均匀,利用共聚焦显微镜在激发波长为405nm,发射波长为440nm,检测波长为440nm中每隔5min、10min、30min、60min拍照观察,30min后的细胞成像图片如图4(c)所示。
经对比观察发现,如图4可见,(图中abc分别为图a为壳聚糖基荧光探针在成像,图b为壳聚糖基荧光探针在加入硫氢化钠后的成像,图c为壳聚糖基荧光探针在加入二氧化硫内源性刺激物后的成像。在加入硫氢化钠和二氧化硫内源性刺激物后,荧光明显增强,说明该壳聚糖基荧光探针对二氧化硫在细胞中是响应的。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!