一种检测湖泊水生植物有机磷的酶解方法及应用与流程
本发明涉及一种检测湖泊水生植物有机磷的酶解方法及应用,属于水资源生态环境治理领域。
背景技术:
全球水资源短缺的重要原因之一就是水体污染,而湖泊富营养化是水体污染的普遍现象,蓝藻水华频繁暴发是湖泊富营养化的重要生态响应。磷、氮等营养元素的增加是导致蓝藻暴发的重要原因。这些营养元素过量积累在湖泊中,将会引起浮游藻类的迅速繁殖,从而形成蓝藻水华暴发现象。
磷作为湖泊生态系统富营养化的限制性主要因素之一,成为目前富营养化研究的重点元素。湖泊中的磷主要分为外源性磷及内源性磷,在外源磷输入得到控制的前提下,内源磷作为限制性营养盐显著影响湖泊生态系统的营养状态。内源磷的释放是导致湖泊生态系统富营养状态继续恶化的主导因素,而水生植物腐烂分解是内源营养盐的重要来源,它们影响湖泊生态系统中的各种生物地球化学过程,主要包括营养循环、食物链过程、温度、光照、大气以及各种水文过程中的动态变化,沉积物的形成以及水体和沉积物界面的氧化还原状态等,因此,研究水生植物来源磷的地球化学循环显得尤为重要。
湖泊水体中的磷主要有两种形态,分别是无机磷和有机磷。其中无机磷极易被水生生物吸收利用,而有机磷由于自身结构复杂且受到表征手段的限制,以往研究多集中于湖泊生态系统中的无机磷分析与探索,对有机磷的研究相对较为匮乏,仅有的研究也只针对有机磷的量(即总磷与无机磷差减后的量)进行简单分析。当外源输入得到一定控制的条件下,蓝藻暴发过程中为维持自身的生长繁殖将消耗掉湖泊水体中大量的无机磷,但一般蓝藻暴发持续时间产达数个月,除了沉积物的释放以外,大量的水生植物残骸腐烂降解产生的有机物(包括有机磷、有机氮、有机碳等)是否会对蓝藻持续暴发提供可以吸收利用的营养物质呢?其中的有机磷是否能够快速补充蓝藻二次暴发所需要的磷源呢?当湖泊水体中无机磷含量降低时,磷的另外一个重要形态——有机磷将会有哪些降解或转化呢?这是一个值得深思的问题。但目前现阶段对于富营养化湖泊中蓝藻暴发产生的水生植物可利用性的分析研究十分匮乏。
富营养化湖泊中广泛存在着酶等微生物,在这些微生物的作用下,占水生植物总磷一半含量的有机磷是否会在微生物的作用下发生转化?如果发生转化,在哪种酶(碱性磷酸酶、磷酸二酯酶、植酸酶等)的作用下转化率最大?转化后的磷可能进入湖泊水体中,这些磷是否会增加湖泊水体中的磷浓度或改变湖泊自然环境?转化的磷是否会有部分容易被生物再次利用?如果可以利用,又对水华再次暴发起到什么作用?除了水生植物残体释放出的磷以外,还有部分不能完全被微生物所分解,那么其余残渣磷组分的化学结构又是怎样的?伴随着这些未知,因此,在实验室中控制好外部环境条件(如pH、温度等),添加酶溶液和缓冲溶液同步进行模拟实验,分析湖泊水生植物残体腐烂分解后的降解特征及释放规律,这对内源磷的循环机理探索以及政府对富营养化湖泊的管理与治理具有重要决策意义。
技术实现要素:
本发明为了解决上述技术问题提供一种检测湖泊水生植物有机磷的酶解方法及应用,本申请以富营养化湖泊限制性营养因子——磷这种营养盐为切入点,对富营养化湖泊中广泛分布的水生植物(狐尾藻、芦苇、轮叶黑藻)进行湖泊内源负荷的相关研究,深入探讨水生植物对湖泊磷循环过程所起的重要贡献,以期为深入理解内源污染对富营养化湖泊生态系统物质循环和环境行为特性提供科学依据。
本发明解决上述技术问题的技术方案如下:一种检测湖泊水生植物有机磷的酶解方法,包括:
1)有机磷水解酶的组合设计
本发明选择富营养化湖泊中广泛存在的三种酶碱性磷酸酶(简称APase)、磷酸二酯酶(简称PDEase)和植酸酶(简称Phytase)作为降解水生植物有机磷的水解酶,由于碱性磷酸酶、磷酸二酯酶和植酸酶分别水解不同结构的有机磷,使其转化为生物可直接利用的正磷酸盐,故将三种酶单独或组合使用,以达到表征水生植物中的有机磷形态、降解特征及其生物可利用性的目的,具体为:
①碱性磷酸酶单独使用,水解活性单酯磷及聚合态磷;
②碱性磷酸酶和磷酸二酯酶组合使用,水解活性单酯磷、二酯磷及聚合态磷;
③碱性磷酸酶、磷酸二酯酶和植酸酶组合使用,水解活性单酯磷、二酯磷、植酸磷及聚合态磷;
其中,②与①相减,得二酯磷的含量,③与②相减,得植酸磷的含量;
2)有机磷水解酶溶液的配置
所述碱性磷酸酶(编号为EC3.1.3.1)来源于牛肠粘膜,固体粉末的活性为30U/mg;所述磷酸二酯酶(编号EC3.1.4.1)来源于响尾蛇毒液,固体粉末的活性为0.02U/mg;所述植酸酶(编号EC3.1.3.26)来源于小麦,固体粉末的活性为0.03U/mg,上述三种酶均购自美国Sigma公司;
2.1)碱性磷酸酶溶液的配置方法:
取3.33mg碱性磷酸酶固体粉末,用0.1mol/L pH=9.0的Tris-HCl缓冲溶液定容至100mL,配置成活性为1U/mL的碱性磷酸酶溶液;
2.2)碱性磷酸酶与磷酸二酯酶组合溶液的配置方法:
取10mg磷酸二酯酶固体粉末,用10mL活性为1U/mL的碱性磷酸酶溶液溶解,配置成活性为0.02U/mL的碱性磷酸酶与磷酸二酯酶组合溶液;
2.3)碱性磷酸酶、磷酸二酯酶与植酸酶组合溶液的配置方法:
A)取600mg植酸酶固体粉末,用1mol/L HAc-NaAc溶液定容至100mL,得活性为0.18U/mL的第一植酸酶溶液;
B)取5mL 0.18U/mL的第一植酸酶溶液,加入5mL 0.1mol/L pH=7.0的Tris-HCl缓冲溶液,得活性为0.045U/mL的第二植酸酶溶液;
C)取20mg磷酸二酯酶固体粉末,加入10mL 0.045U/mL的第二植酸酶溶液,再加入10mL 1U/mL的碱性磷酸酶溶液,配置成活性为0.06U/mL的碱性磷酸酶、磷酸二酯酶和植酸酶组合溶液;
上述步骤2.1)-2.3)配置的三种酶溶液均置于4℃冷藏,且冷藏不得超过一星期,否则弃去重配;
3)酶水解实验
3.1)碱性磷酸酶水解实验
分别取水生植物样品狐尾藻、芦苇和轮叶黑藻各0.2g,置于500mL锥形瓶中,设置对照组和处理组,向对照组中添加200mL 0.1mol/L pH=9的Tris-HCl缓冲溶液和1mL 1mol/L的迭代化纳(NaN3)溶液,向处理组中添加190mL 0.1mol/L pH=9的Tris-HCl缓冲溶液、1mL 1mol/L的NaN3溶液和10mL 1U/mL的碱性磷酸酶溶液,两组实验均放置在20℃恒温培养箱中150r/min振荡培养18h,实验设置三个平行;
3.2)碱性磷酸酶与磷酸二酯酶组合使用的水解实验
分别取水生植物样品狐尾藻、芦苇和轮叶黑藻各0.2g,置于500mL锥形瓶中,设置对照组和处理组,向对照组中添加200mL 0.1mol/L pH=9的Tris-HCl缓冲溶液和1mL 1mol/L的NaN3溶液,向处理组中添加190mL 0.1mol/L pH=9的Tris-HCl缓冲溶液、1mL 1mol/L的NaN3溶液和10mL 0.02U/mL的碱性磷酸酶与磷酸二酯酶组合溶液,两组实验均放置在20℃恒温培养箱中150r/min振荡培养18h,实验设置三个平行;
3.3)碱性磷酸酶、磷酸二酯酶与植酸酶组合使用的水解实验
分别取水生植物样品狐尾藻、芦苇和轮叶黑藻各0.2g,置于500mL锥形瓶中,设置对照组和处理组,向对照组中添加200mL 0.1mol/L pH=5.15的醋酸-乙酸钠(HAc-NaAc)缓冲溶液和1mL 1mol/L的NaN3溶液,向处理组中添加190mL 0.1mol/L pH=5.15的HAc-NaAc缓冲溶液,1mL 1mol/L的NaN3溶液,和10mL 0.06U/mL的碱性磷酸酶、磷酸二酯酶与植酸酶组合溶液,两组实验均放置在20℃恒温培养箱中150r/min振荡培养18h,实验设置三个平行;
在上述三个实验步骤中加入NaN3溶液的目的是抑制细菌生长。
分别取上述三个实验中对照组和处理组培养后的上清液各10mL,10000r/min离心30min,过0.45μm滤膜,利用磷钼蓝比色法分别测定处理组酶培养后上清液中的总磷含量TP处理组和无机磷含量Pi处理组,对照组培养后上清液中的总磷含量TP对照组和无机磷含量Pi对照组,则加酶后上清液中有机磷Po水解量=Pi处理组-Pi对照组,测完上清液中的无机磷含量Pi后,其余的190mL上清液和残渣均冷冻干燥,为下一步测31P-NMR做准备;
4)测液态31P-NMR
向冷干的残渣中加入30mL NaOH与EDTA组成的混合溶液,其中,NaOH的浓度为0.5mo/L,EDTA的浓度为0.25mmol/L,振荡16h提取残渣中的有机磷,于10000r/min下离心30min后,0.45μm滤膜过滤,留取残渣中的滤后液冷干,得残渣滤后液;
把冷干后的上清液和残渣滤后液分别溶解于1mL NaOH与EDTA组成的混合溶液中,其中,NaOH的浓度为1mo/L,EDTA的浓度为0.1mmol/L,超声振荡使其充分溶解,离心过滤后,分别测上清液和残渣滤后液中的液态31P-NMR,测试条件和仪器设置参数如下:
采用BRUKER标准腔5mm BBO探头,31P的共振频率为161.98Hz,测定温度为20℃,谱峰宽度为5Hz,获取时间AQ为0.2102s,31P-NMR参数中延迟时间D1的设置为5s,分析测试时间为15h;
5)计算
通过步骤4)中得到的波谱进行积分及对各磷组分进行定性分析,并根据步骤3)得到的TP含量计算水生植物中各磷组分的含量。
在上述技术方案的基础上,本发明还可以做如下改进。
进一步,在3)中,实验所用玻璃器皿要先用HCl浸泡24h,洗净后160℃高温灭菌1h,整个操作在无菌台进行。
进一步,在3)中,采用磷钼蓝法测定水生植物对照组和处理组上清液中的TP时,需要往测定溶液中添加1mL质量浓度为20%的十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS)溶液。
十二烷基硫酸钠溶液的配置:取20g SDS固体粉末,溶解于100mL超纯水中,即配置成了质量浓度20%的SDS溶液。
采用此步骤的有益效果是防止在测定过程中因为酸化而产生酶蛋白沉淀等干扰磷的测定。
本发明还提供一种如上所述的降解方法用于计算富营养化湖泊中水生植物有机磷的降解量,模拟水生植物腐烂分解后在湖泊水体以及沉积物中的降解过程及降解速率,揭示蓝藻循环往复暴发的机理,同时对政府管理与治理富营养化湖泊具有指导意义。
在本发明中,TP代表总磷含量,Pi代表无机磷含量,Po代表有机磷含量。
水生植物选择依据:本申请发明人对滇池、太湖、巢湖、武汉东湖、乌梁素海、洱海、抚仙湖和博斯腾湖等8个富营养化湖泊中的水生植物分布情况进行调查,发现狐尾藻、芦苇和轮叶黑藻广泛分布于富营养化湖泊中,具有典型性及可研究的价值。
本发明的有益效果是:
本发明用仪器分析(31P-NMR)和生物化学法(酶水解)研究我国富营养湖泊蓝藻水华暴发的优势水生植物有机磷的组成特征和酶降解特征(即生物有效性),开展湖泊水生植物有机磷的降解实验和模拟研究,旨在认识富营养化湖泊蓝藻水华暴发后产生的大量水生植物来源的有机磷再循环特征,及其认识该部分内源有机磷的再循环是否作为蓝藻水华二次暴发内源磷的重要来源。研究结果为进一步认识湖泊有机磷生物地球化学循环提供新的数据,并为富营养化湖泊营养盐的控制提供科学依据。
附图说明
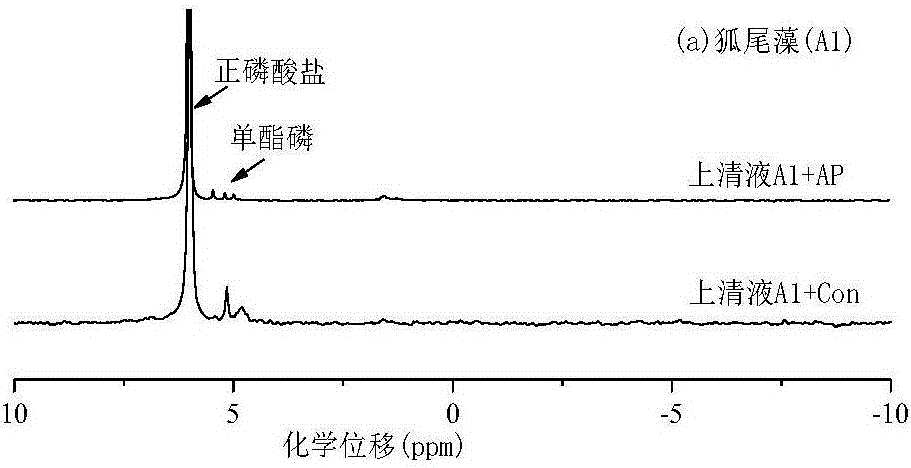
图1a为APase作用下狐尾藻上清液31P-NMR谱图;
图1b为APase作用下芦苇上清液31P-NMR谱图;
图1c为APase作用下轮叶黑藻上清液31P-NMR谱图;
图2a为APase作用下狐尾藻残渣31P-NMR谱图;
图2b为APase作用下芦苇残渣31P-NMR谱图;
图2c为APase作用下轮叶黑藻残渣31P-NMR谱图;
图3a为APase+PDEase作用下狐尾藻上清液31P-NMR谱图;
图3b为APase+PDEase作用下芦苇上清液31P-NMR谱图;
图3c为APase+PDEase作用下轮叶黑藻上清液31P-NMR谱图;
图4a为APase+PDEase作用下狐尾藻残渣31P-NMR谱图;
图4b为APase+PDEase作用下芦苇残渣31P-NMR谱图;
图4c为APase+PDEase作用下轮叶黑藻残渣31P-NMR谱图;
图5a为APase+PDEase+Phytase作用下狐尾藻上清液31P-NMR谱图;
图5b为APase+PDEase+Phytase作用下芦苇上清液31P-NMR谱图;
图5c为APase+PDEase+Phytase作用下轮叶黑藻上清液31P-NMR谱图;
图6a为APase+PDEase+Phytase作用下狐尾藻残渣31P-NMR谱图;
图6b为APase+PDEase+Phytase作用下芦苇残渣31P-NMR谱图;
图6c为APase+PDEase+Phytase作用下轮叶黑藻残渣31P-NMR谱图;
图7为各种酶作用下水生植物有机磷降解为生物可利用性磷量的估算图;
图8为湖泊水生植物有机磷循环过程示意图。
具体实施方式
以下对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
实施例1
太湖是典型富营养化浅水湖泊,近年来蓝藻水华严重,国务院将其列入需要重点治理的富营养化水体之一。二十世纪80年代后期,太湖外源输入还未得到有效控制,水体中各项指标均严重超标。直至二十世纪90年代后期,国家对太湖周边重点工业污废水进行严格控制,太湖水体氮、磷等各项水质指标呈现明显下降趋势。
但是,后续的研究发现,湖泊内源(沉积物、水生植物等)中能够积累大量的营养盐,在此状态下太湖的内源磷负荷本身已经十分严重,加之太湖系统内扰动的作用,使太湖内源营养盐与水体屡次交换,促进藻类的迅猛成长,从而促使水华的迅速暴发。因此,当外源输入得到控制的前提下,研究内源磷的循环过程对分析湖泊富营养化发生机理及探讨蓝藻水华再暴发原因具有重要意义,为有效解决湖泊富营养化问题提供理论科学依据。
太湖水生植物以沉水和挺水植物占优势,故选择太湖典型且广泛存在的水生植物(2种沉水植物、1种挺水植物)为研究对象。水生植物分别为狐尾藻(Myriophyllum spicatum Linn.)、芦苇(Phragmites australis Trin.ex Steud)和轮叶黑藻(Hydrilla verticillata),同时,这些植物也广泛分布于中国的其他富营养化湖泊中。
本发明所用碱性磷酸酶、磷酸二酯酶和植酸酶均购自美国Sigma公司,其中,所述碱性磷酸酶来源为牛肠粘膜,固体粉末的活性为30U/mg;所述磷酸二酯酶来源为响尾蛇毒液,固体粉末的活性为0.02U/mg;所述植酸酶来源为小麦,固体粉末的活性为0.03U/mg。
实验方法如下:
1)有机磷水解酶溶液的配置
1.1)碱性磷酸酶溶液的配置方法:
取3.33mg碱性磷酸酶固体粉末,用0.1mol/L pH=9.0的Tris-HCl缓冲溶液定容至100mL,配置成活性为1U/mL的碱性磷酸酶溶液;
1.2)碱性磷酸酶与磷酸二酯酶组合溶液的配置方法:
取10mg磷酸二酯酶固体粉末,用10mL活性为1U/mL的碱性磷酸酶溶液溶解,配置成活性为0.02U/mL的碱性磷酸酶与磷酸二酯酶组合溶液;
1.3)碱性磷酸酶、磷酸二酯酶与植酸酶组合溶液的配置方法:
A)取600mg植酸酶固体粉末,用1mol/L HAc-NaAc溶液定容至100mL,得活性为0.18U/mL的第一植酸酶溶液;
B)取5mL 0.18U/mL的第一植酸酶溶液,加入5mL 0.1mol/L pH=7.0的Tris-HCl缓冲溶液,得活性为0.045U/mL的第二植酸酶溶液;
C)取20mg磷酸二酯酶固体粉末,加入10mL 0.045U/mL的第二植酸酶溶液,再加入10mL 1U/mL的碱性磷酸酶溶液,配置成活性为0.06U/mL的碱性磷酸酶、磷酸二酯酶和植酸酶组合溶液;
上述步骤1.1)-1.3)配置的三种酶溶液均置于4℃冷藏,且冷藏不得超过一星期,否则弃去重配;
2)酶水解实验
实验所用玻璃器皿要先用HCl浸泡24h,洗净后160℃高温灭菌1h,整个操作在无菌台进行。
2.1)碱性磷酸酶水解实验
分别取水生植物样品狐尾藻、芦苇和轮叶黑藻各0.2g,置于500mL锥形瓶中,设置对照组和处理组,向对照组中添加200mL 0.1mol/L pH=9的Tris-HCl缓冲溶液和1mL 1mol/L的迭代化纳溶液,向处理组中添加190mL 0.1mol/L pH=9的Tris-HCl缓冲溶液、1mL 1mol/L的NaN3溶液和10mL 1U/mL的碱性磷酸酶溶液,两组实验均放置在20℃恒温培养箱中150r/min振荡培养18h,实验设置三个平行;
2.2)碱性磷酸酶与磷酸二酯酶组合使用的水解实验
分别取水生植物样品狐尾藻、芦苇和轮叶黑藻各0.2g,置于500mL锥形瓶中,设置对照组和处理组,向对照组中添加200mL 0.1mol/L pH=9的Tris-HCl缓冲溶液和1mL 1mol/L的NaN3溶液,向处理组中添加190mL 0.1mol/L pH=9的Tris-HCl缓冲溶液、1mL 1mol/L的NaN3溶液和10mL 0.02U/mL的碱性磷酸酶与磷酸二酯酶组合溶液,两组实验均放置在20℃恒温培养箱中150r/min振荡培养18h,实验设置三个平行;
2.3)碱性磷酸酶、磷酸二酯酶与植酸酶组合使用的水解实验
分别取水生植物样品狐尾藻、芦苇和轮叶黑藻各0.2g,置于500mL锥形瓶中,设置对照组和处理组,向对照组中添加200mL 0.1mol/L pH=5.15的HAc-NaAc缓冲溶液和1mL 1mol/L的NaN3溶液,向处理组中添加190mL 0.1mol/L pH=5.15的HAc-NaAc缓冲溶液,1mL 1mol/L的NaN3溶液,和10mL 0.06U/mL的碱性磷酸酶、磷酸二酯酶与植酸酶组合溶液,两组实验均放置在20℃恒温培养箱中150r/min振荡培养18h,实验设置三个平行;
分别取上述三个实验中对照组和处理组培养后的上清液各10mL,10000r/min离心30min,过0.45μm滤膜,利用磷钼蓝比色法分别测定处理组酶培养后上清液中的总磷含量TP处理组和无机磷含量Pi处理组,对照组培养后上清液中的总磷含量TP对照组和无机磷含量Pi对照组,则加酶后上清液中有机磷Po水解量=Pi处理组-Pi对照组,测完上清液中的无机磷含量Pi后,其余的190mL上清液和残渣均冷冻干燥,为下一步测31P-NMR做准备;
采用磷钼蓝法测定水生植物对照组和处理组上清液中的TP时,需要往测定溶液中添加1mL质量浓度为20%的十二烷基硫酸钠溶液。
3)测液态31P-NMR
向冷干的残渣中加入30mL NaOH与EDTA组成的混合溶液,其中,NaOH的浓度为0.5mo/L,EDTA的浓度为0.25mmol/L,振荡16h提取残渣中的有机磷,于10000r/min下离心30min后,0.45μm滤膜过滤,留取残渣中的滤后液冷干,得残渣滤后液;
把冷干后的上清液和残渣滤后液分别重新溶解于1mL NaOH与EDTA组成的混合溶液,其中,NaOH的浓度为1mo/L,EDTA的浓度为0.1mmol/L,超声振荡使其充分溶解,离心过滤后,分别测上清液和残渣滤后液中的液态31P-NMR,测试条件和仪器设置参数如下:
采用BRUKER标准腔5mm BBO探头,31P的共振频率为161.98Hz,测定温度为20℃,谱峰宽度为5Hz,获取时间AQ为0.2102s,31P-NMR参数中延迟时间D1的设置为5s,分析测试时间为15h;
4)计算
通过步骤3)中得到的波谱进行积分及对各磷组分进行定性分析,并根据步骤3)得到的TP含量计算水生植物中各磷组分的含量。
数据分析
液态31P-NMR数据采用MestReNova software 9.0软件进行分析。
结果与讨论
1、APase作用下水生植物有机磷降解实验
1.1 APase作用下水生植物上清液磷组分组成特征
利用液态31P-NMR技术检测湖泊水生植物APase酶作用前后上清液中的磷组分,控制实验(Con)与处理实验同时进行,如图1a-1c可以初步看出,未添加APase的样品磷组分中的单酯磷区域(3.0-6.0ppm)的信号峰较为明显,并且所占总积分比例较大,当添加APase培养18h后,各个样品单酯磷区域的峰值均有较大幅度的下降,二酯磷(-1.0-2.5ppm)在添加APase酶后峰值呈现不同的变化定量分析湖泊水生植物在APase作用下上清液中各磷组分的详细变化,详见表1。
如表1,无机磷包括正磷酸盐、多聚磷酸盐两部分。有机磷包括单酯磷和二酯磷。如表1,单酯磷包括植酸磷和其他单酯磷(除植酸磷以外的单酯磷)两大部分,而其他单酯磷在湖泊水生植物中又检测到葡萄糖6磷酸、α甘油酯、β甘油酯以及一些未知其他单酯磷,二酯磷又包括磷酸酯、RNA、DNA以及一些未知二酯磷。
如表1,湖泊水生植物正磷酸盐占溶解态总磷的比例除极个别样品外均较高,在71.5-90.3%之间。在部分中检测到了多聚磷酸盐组分表1中植酸磷比例并不高,因为植酸磷(IP6)是一个含有6个磷酸基团的环状化合物,其可与金属螯合形成稳定化合物,且很难溶于水。表1中,其他单酯磷中的葡萄糖6磷酸一般容易被微生物利用。α和β甘油酯一般被认为是磷脂的降解产物本研究中二酯磷(-1.0-2.5ppm)主要划分为三大类,第一类为DNA,其化学位移在-0.4±0.2ppm处,第二类为磷脂酸和RNA,其化学位移在-0.2-1.9ppm处,其余化学位移处归为第三类(未知二酯磷组分)。
APase作用后上清液磷组分与控制实验磷组分之差(表2),即为APase作用下水生植物上清液磷组分比例的变化,详见表2,若为正值,表明APase作用后磷组分增高,若为负值,表明APase作用后磷组分降低,从而模拟自然湖泊中水生植物残骸在APase的作用下磷组分向湖泊水体中释放的过程以及在短期(18h)后磷组分的变化情况。如表2,水生植物在APase作用18h后,单酯磷组分(甘油酯4.0%、植酸磷1.1%、未知单酯磷4.0%)和DNA(2.1%)转化为正磷酸盐(6.0%)和部分二酯磷(磷酯酸和RNA 5.3%)和少量其他磷组分(葡萄糖6磷酸0.39%、未知二酯磷0.5%和多聚磷酸盐0.1%),水生植物在APase作用下转化正磷酸盐的比例(矿化率)平均为6.0%。
表1 APase作用下水生植物上清液磷组分含量(mg/kg)及比例
注:aA1、A2、A3分别代表狐尾藻、芦苇、轮叶黑藻样品。
b括号里数值为水生植物上清液各磷组分占其上清液TP的比例。
c“-”表示未检出。
表2 APase作用下水生植物上清液磷组分比例变化
注:a甘油酯的值为表1中α甘油酯与β甘油酯的和。
1.2 APase作用下水生植物残渣磷组分组成特征
利用液态31P-NMR技术检测湖泊水生植物APase酶作用前后残渣中的磷组分,对照实验(Con)与处理实验同时进行,如图2可以初步看出,水生植物中单酯磷区域(3-6ppm)的信号峰较为尖锐,且具有很多详细的单酯磷组分。在添加APase后,芦苇样品中的单酯磷峰值比对照实验中的单酯磷峰值明显增高,而其他样品的单酯磷峰值在APase作用前后从图2a、2c中变化不明显,故通过积分,用水生植物残渣总磷与各峰值对应的磷组分相乘,得到各磷组分的积分比例,再计算出各磷组分的含量,以便于进一步的分析,详细数据结果见表3。
表3 APase作用下水生植物残渣中磷组分含量(mg/kg)及百分比
注:aA1、A2、A3分别代表狐尾藻、芦苇、轮叶黑藻。
b括号里数值为APase作用前后水生植物残渣各磷组分占其残渣总磷的比例。
c“-”表示未检出。
如表3,在APase作用后,检测到植酸磷四种组分,分别是chiro-IP6、neo-IP6、myo-IP6和scyllo-IP6,其中chiro-IP6在所有样品APase作用前后均可检测到,neo-IP6只在芦苇和轮叶黑藻APase作用后才检测到,占残渣总磷的4.6%。scyllo-IP6组分仅在狐尾藻样品添加APase作用18h后才检测出来(1.5%),表明植酸磷在APase作用下,只有少部分植酸磷能够释放进去湖泊水体中,而大部分植酸磷均随水生植物残渣埋藏于沉积物中
(表4)。
表4 APase作用下水生植物残渣磷组分比例变化
注:a核苷酸的值为2'鸟苷酸、3'鸟苷酸、5'鸟苷酸与腺苷酸的和。
b“-”表示未检出。
2、APase+PDEase作用下水生植物有机磷降解实验
2.1 APase+PDEase作用下水生植物上清液磷组分组成特征
碱性磷酸酶(APase)与磷酸二酯磷(PDEase)组合可以水解单酯磷和二酯磷以及聚合态磷,从图3a-3c可以看出,二酯磷区域(-1-2.5ppm)在添加了APase+PDEase后,除个别样品以外峰值均有明显的降低,与此同时,单酯磷区域的峰值也随之降低与APase作用后的水生植物上清液磷组分划分保持一致,有机磷划分为单酯磷(植酸磷、未知单酯磷)和二酯磷(磷酯酸、RNA、未知二酯磷)。
如表5,在APase+PDEase作用后,溶解于上清液中的正磷酸盐均有增加,水生植物平均占上清液总磷的4.3%,溶于上清液中的焦磷酸盐全部降解,除轮叶黑藻以外大部分有机磷在APase+PDEase的作用下发生降解,也有部分未知单酯磷和二酯磷中的磷酸酯和RNA在APase+PDEase作用后并未降解,这说明这部分磷组分短期(18h)不能够被APase+PDEase降解成无机磷组分被生物再次利用。
表5 APase+PDEase作用下水生植物上清液磷组分含量(mg/kg)及比例
注:aA1、A2、A3分别代表狐尾藻、芦苇、轮叶黑藻样品,2e代表APase+PDEase。
b括号里数值为水生植物上清液各磷组分占其上清液总磷的比例。
c“-”表示未检出。
表6 APase+PDEase作用下水生植物上清液磷组分比例变化
注:表中数值为水生植物上清液各磷组分占其上清液总磷的比例(%)。
2.2 APase+PDEase作用下水生植物残渣磷组分组成特征
如图4a-4c,在APase+PDEase作用下,有部分有机磷在短期内不能溶解于水体中,因此随水生植物残骸沉降下来。通过液态31P-NMR检测,水生植物残渣中磷组分种类丰富,在单酯磷区域中有很多尖锐的峰信号,在大部分样品中均检测到二酯磷的存在。通过积分计算,残渣中磷组分的含量及占残渣TP的百分比详见表7。
如表7,在水生植物残渣中,检测到磷组分比上清液中种类丰富,其中检测到2种无机磷组分、11种有机磷组分,其中有机磷组分中含有10种单酯磷组分,单酯磷组分中含有3种植酸磷组分(chiro-、neo-、myo-)、3种糖磷组分(果糖1磷酸、果糖6磷酸和葡萄糖1磷酸)、3种核苷酸组分(2'鸟苷酸、3'鸟苷酸、5'鸟苷酸)、1种甘油酯组分以及未知单酯磷组分。在以往研究中,仅把单酯磷当做一个整体或者仅划分为三大类,没有详细划分其单酯磷组分。
如表8,两种无机磷(正磷酸盐和焦磷酸盐)占残渣总磷的比例并不高,而残渣中有机磷的比例占残渣TP的比例相对无机磷高很多,这表明无机磷组分易溶于上清液中,释放进入湖泊水体中,而有机磷组分,尤其是植酸磷组分一般不易溶解,大部分埋藏于沉积物中。
3、APase+PDEase+Phytase作用下水生植物有机磷降解实验
3.1 APase+PDEase+Phytase作用下水生植物上清液磷组分组成特征
添加三种酶后,液态31P-NMR检测水生植物上清液中的磷组分如图5a-5c。在三种酶作用下,焦磷酸盐组分均降解,单酯磷组分降解程度也较为明显。
如表9,在三种酶作用下,水生植物上清液正磷酸盐组分约占上清液总磷的77%,在水生植物上清液中均检测到葡萄糖6磷酸组分,这表明葡萄糖6磷酸组分易溶于水,是生物利用的潜在磷源,除单酯磷组分以外,把添加三种酶后的上清液磷组分与对照实验上清液组分相减,得到添加三种酶后水生植物样品上清液中磷组分的变化趋势,如表10,水生植物中的葡萄糖6磷酸等组分转化为正磷酸盐。
表9 APase+PDEase+Phytase作用下水生植物上清液磷组分含量(mg/kg)及比例
注:aA1、A2、A3分别代表狐尾藻、芦苇、轮叶黑藻样品,3e代表APase+PDEase+Phytase,Con为对照组。
b括号里数值为水生植物上清液各磷组分占上清液总磷的比例。
c“-”表示未检出。
表10 APase+PDEase+Phytase作用下水生植物上清液磷组分比例变化
注:a表里数值为水生植物上清液各磷组分占上清液总磷的比例。
b“-”表示未检出。
3.2 APase+PDEase+Phytase作用下水生植物残渣磷组分组成特征
如图6a-6c,在添加三种酶后,利用液态31P-NMR技术进行检测,水生植物残渣中的单酯磷和二酯磷区域的峰值均有明显的降低趋势,这表明三种酶水解了大部分的单酯磷和二酯磷。
如表11,在三种酶作用下,利用液态31P-NMR技术检测出水生植物残渣中含有正磷酸盐324-550mg/kg。有机磷中检测到单酯磷(包括2种植酸磷的同分异构体、核苷酸以及一些未知单酯磷)和DNA等,通过处理组(即添加三种酶后)与对照组(Con)的差值,计算出水生植物残渣中磷组分变化率(表12)。如表12,添加三种酶后,有机磷组分大部分转化为正磷酸盐组分,转化的有机磷组分平均占残渣总磷的13.7%,其中转化的这部分有机磷中包含单酯磷和DNA。
表11 APase+PDEase+Phytase作用下水生植物残渣磷组分含量(mg/kg)及比例
注:aA1、A2、A3分别代表狐尾藻、芦苇、轮叶黑藻,2e代表APase+PDEase。
bchiro-、neo-、myo-和scyllo-:植酸磷的四种同分异构体。
c括号里数值为在APase+PDEase作用下水生植物残渣各磷组分占其残渣总磷的比例。
d“-”表示未检出。
表12 APase+PDEase+Phytase作用下水生植物残渣磷组分比例变化
注:a“-”表示未检出。
综上所述,本申请将生物化学手段(酶水解)与液态31P-NMR技术相结合,以湖泊水生植物有机磷组成特征及其生物有效性为主线,探讨其生物地球化学循环,发现了水生植物在各种生物酶的作用下,在短时间内Po快速降解成生物可利用性磷,为湖泊水体中藻类生长繁殖提供了充足的磷源,使得水华暴发循环往复进行,表明这些水生植物死亡后Po再循环对湖泊蓝藻再暴发及湖泊Po生物地球化学循环产生了重要影响,关于Po导致蓝藻再暴发的定量化结论,对富营养化湖泊管理及治理具有重要参考。
本发明在上述实验的基础上,将水生植物有机磷对太湖内源磷的贡献进行了进一步的实验,具体步骤如下:
材料与方法
样品来源
以太湖为例进行有机磷降解量的估算。样品为典型富营养化湖泊具有代表性且广泛存在的水生植物(狐尾藻、芦苇、轮叶黑藻)。
数据分析
1)根据太湖水生植物生物量以及太湖湖水面积(以2012年为例),计算出太湖水生植物总生物量;
2)通过水生植物中有机磷的质量浓度,计算出太湖水生植物有机磷的总量;
3)根据水生植物在各种生物酶(APase、APase+PDEase、APase+PDEase+Phytase)作用下向湖泊水体释放的有机磷比例和暂时埋藏于沉积物中有机磷的比例,计算出各种生物酶作用下水生植物释放于湖泊水体和沉降至沉积物中的有机磷的量;
4)通过上个实验液态31P-NMR确定的水生植物在各种酶作用下有机磷降解为正磷酸盐的比例,计算出水生植物有机磷在湖泊水体和沉积物各种酶作用下转化为可直接被生物利用的正磷酸盐(Orth-P)的量;
5)最后汇总出水生植物有机磷在短期(18h)后直接以及间接释放至湖泊水体中的生物可利用性量。
结果与讨论
水生植物有机磷降解为生物可利用性磷量的估算
根据表13中的太湖水生植物生物量与湖水面积相乘,计算出太湖水生植物总生物量为6.093×106t。
表13太湖基本指标及水生植物生物量
Yu,T.;Yuan,Z.;Fengchang,W.,et al.Six-Decade Change in Water Chemistry of Large Freshwater Lake Taihu,China[J].Environmental Science&Technology,2013,47(16):9093-9101.
根据水生植物总生物量与其有机磷的质量浓度相乘,计算出水生植物有机磷的量,为6123.5t(图7),再根据表14中的各种比例与水生植物有机磷的量相乘,计算出水生植物在各种生物酶作用下有机磷在水体以及沉积物中的释放及转化量,并估算出了太湖水生植物有机磷在各种酶作用下各个路径中的降解量及转化量(图7)。
从图7中可以看出,太湖水生植物在APase、APase+PDEase、APase+PDEase+Phytase的作用下可转化为正磷酸盐的量分别为77.0t、136.4t和603.8t,分别约占太湖水生植物总有机磷量(6123.5t)的1.3%、2.2%和9.9%。
有研究报道,太湖2012年磷酸盐(PO43--P)的释放量达900t,而本研究估算出的水生植物在三种酶同时存在时转化为正磷酸盐的量为603.8t,因此太湖水生植物占总磷酸盐释放量的67.1%。
水生植物有机磷在湖泊水体中的循环过程
如图8,湖泊水生植物死亡腐烂分解后,在各种生物酶及微生物的作用下其体内的有机磷一部分会释放到湖泊水体中,转化为生物可直接利用的正磷酸盐组分(即生物可利用性磷),另一部分有机磷则通过沉降作用埋藏于湖泊沉积物中,在沉积物中各种生物酶及微生物的作用下,这部分水生植物残骸中的有机磷将进一步转化为生物可利用性磷,随着沉积物向上覆水体中的释放作用再次进入到湖泊水体中,则水生植物直接进入水体中的生物可利用性磷和通过沉积物酶作用再次释放到湖泊水体中的生物可利用性磷总量提供了蓝藻水华二次暴发所需要的磷源,快速补充由于蓝藻暴发所消耗掉的磷,从而引起蓝藻水华的循环往复暴发,这是湖泊典型水生植物腐解后有机磷在湖泊水体中的循环过程。
表14各种生物酶作用下水生植物有机磷释放及降解比例
由图8可知,湖泊水生植物在各种生物酶的作用下,约有26.1-113.3t的有机磷直接释放至湖泊水体转化为生物可利用性磷,约有44.7-490.5t的有机磷间接(在沉积物中各种生物+酶的作用下)释放至湖泊水体中转化为生物可利用性磷。
湖泊生态修复及内源污染治理的主要措施
湖泊内源磷的主要来源为水生植物残骸的腐烂分解以及沉积物的释放,因此在控制外源污染的同时,对水生植物和沉积物的治理对改善湖泊富营养化现象具有重大意义。对于水生植物腐烂分解后的根茎等必须适时收割,避免其释放的磷再次返还湖泊水体中造成二次污染。收割后的水生植物打碎后仍可成为有机肥料进行再循环利用。本发明对湖泊内源中水生植物来源的有机磷酶解特征以及生物有效性进行了系统了研究与分析,并且以太湖为例,进行了水生植物有机磷在湖泊各种酶的作用下降解为生物可利用性磷的量进行了初步估算,研究这种内源污染源有机磷的生物地球化学机理与循环过程,希望对复杂的湖泊富营养化过程及长年暴发的蓝藻水华现象提供微小的参考与贡献,为早日恢复健康的湖泊生态系统尽一份绵薄之力。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!