硫化钼协同氮杂石墨烯材料及在近红外光脱氮中的应用的制作方法
本发明涉及一种硫化钼复合氮杂石墨烯材料及其在光催化降解氨氮中的应用。
背景技术:
利用太阳能解决环境能源问题,起源于1972年Fujishima利用TiO2光电极电解水制氢,随后Carey在1976年报道了利用TiO2光催化氧化消除多氯二酚的毒性,从此,利用太阳能降解环境污染物的研究迅速成为人们研究的热点。但是,TiO2只能利用占太阳能4%左右的紫外光,对TiO2进行掺杂及开发Fe2O3、WO3、Bi2WO6等新型催化剂,虽然部分解决了对可见光的利用问题,但是占太阳能46%的红外光尚需开发利用。
MoS2是一种与石墨烯具有类似结构的二维材料。作为一种半导体光催化剂,人们研究了MoS2在可见光辐射下的产氢特性。而在近红外光的应用方面,文献仅报道了MoS2用于光热药物释放治疗癌症的研究。作为一种半导体材料,MoS2的禁带宽度为1.29eV,理论吸收边带可延伸至961nm,可以吸收近红外光,这为近红外光光催化打下了科学基础。
另一方面,氮杂石墨烯(N-doped graphene,NG)是一种零带隙半导体材料,理论上对太阳光可以全吸收利用;此外,与石墨烯相比,NG有更高的载流子传输速率、更低的光生电子/空穴复合率、更高的量子产率,因此具有更强的光催化活性。将NG与MoS2复合,有望制备对近红外光有催化活性的NG-MoS2杂化光催化剂,以期实现对太阳能的充分利用。
技术实现要素:
本发明的目的在于提供一种硫化钼协同氮杂石墨烯材料及在近红外光脱氮中的应用,以克服现有技术的不足。
为实现前述发明目的,本发明采用的技术方案包括:
本发明实施例提供了一种硫化钼复合氮杂石墨烯材料包括硫化钼和氮杂石墨烯,所述硫化钼分布于所述氮杂石墨烯表面和/或所述氮杂石墨烯的层状结构中,其中所述硫化钼具有空间群结构。
进一步的,所述硫化钼复合氮杂石墨烯材料的粒径为4.0-5.2nm。
进一步的,相邻硫化钼层间距为0.55-0.65nm。
进一步的,所述硫化钼复合氮杂石墨烯材料的比表面积为8-9m2/g。
进一步的,所述氮杂石墨烯于所述硫化钼复合氮杂石墨烯材料中的质量百分数为1-10wt%。
本发明实施例提供了一种硫化钼复合氮杂石墨烯材料的制备方法包括:
提供硫化钼固体;
将氮杂石墨烯、硫化钼固体于溶剂中混合均匀制得混合液,之后将混合液在温度为100-150℃条件下反应6-10h,制得所述的硫化钼复合氮杂石墨烯材料。
本发明实施例还提供了所述硫化钼复合氮杂石墨烯材料于光催化降解氨氮中的用途。
本发明实施例还提供了一种降解氨氮的方法,其包括:在近红外光光照条件下,以硫化钼复合氮杂石墨烯材料作为光催化剂在碱性氛围中直接催化氧化氨氮,实现水体中氨氮的脱除。
较为优选的,采用0.1mol/L NaHCO3-Na2CO3的缓冲溶液调节所述含氨氮溶液的pH值。
较为优选的,所述近红外光的波长λ范围为780nm-2500nm。
较为优选的,所述硫化钼复合氮杂石墨烯材料与氨氮的质量比为100mg:5-50mg。
在一较为优选的实施方案中,一种降解氨氮的方法包括:将含有氨氮的水溶液与硫化钼复合氮杂石墨烯材料混合置入避光反应器中,并在所述避光反应器的光照窗口处设置仅可使近红外光通过的滤光片,之后以光源照射所述避光反应器,实现水体中氨氮的脱除。
与现有技术相比,本发明的优点包括:
(1)本发明的复合光催化剂,包括层状的氮杂石墨烯和分布于所述氮杂石墨烯表面的硫化钼,复合氮杂石墨烯之后,加速了光生电子的转移,导致吸收光谱红移,增大了对太阳能的利用率,且所述催化剂重复催化降解氨氮5-10次后,氨氮的降解率仍>90%。
(2)本发明的复合光催化剂的制备方法,利用近红外光光将氨氮一步降解为氮气放出,且无需添加多余的氧化剂,从而降低了成本,且光催化剂制备过程简单,易操作。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
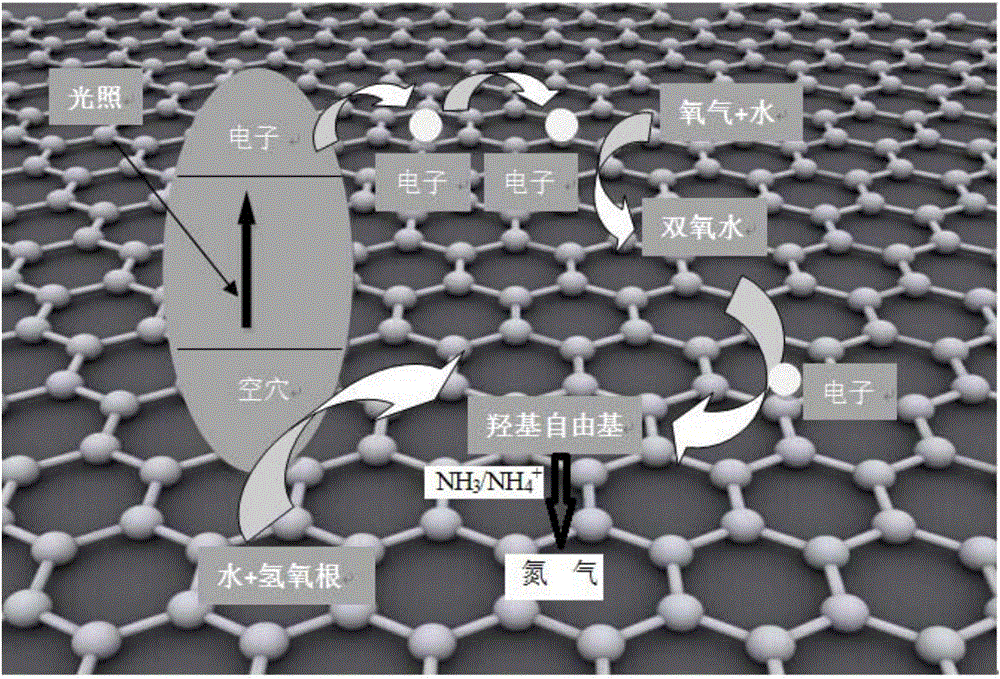
图1是本发明实施例1的反应机理图;
图2是本发明实施例1中硫化钼(MoS2)、氮杂石墨烯(NG)与氮杂石墨烯复合硫化钼(NG-MoS2)的XRD图;
图3是本发明实施例2中MoS2、NG与NG-MoS2的拉曼光谱图;
图4a-图4d是本发明实施例1中MoS2、NG与NG-MoS2的TEM图,其中图4a为氮杂石墨烯的TEM图,图4b为硫化钼的TEM图,图4c和图4d为硫化钼复合氮杂石墨烯材料的TEM图;
图5是本发明实施例1中NG-MoS2重复7后氨氮降解率的曲线图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
本发明的反应机理包括以下步骤:
NH3+·OH→NH2+H2O........................(1)
NH2+·OH→NH+H2O.........................(2)
NH+·OH→N+H2O............................(3)
NHx+NHy→N2Hx+y(x,y=0,1,2)..............(4)
N2Hx+y+(x+y)OH→N2+(x+y)H2O..........(5)
参见图1为本发明的反应机理图。
本发明实施例提供了一种硫化钼复合氮杂石墨烯材料包括硫化钼和氮杂石墨烯,所述硫化钼分布于所述氮杂石墨烯表面和/或所述氮杂石墨烯的层状结构中,其中所述硫化钼具有空间群结构。
进一步的,所述硫化钼复合氮杂石墨烯材料的粒径为4.0-5.2nm。
进一步的,相邻硫化钼层间距为0.55-0.65nm。
进一步的,所述硫化钼复合氮杂石墨烯材料的比表面积为8-9m2/g。
进一步的,所述氮杂石墨烯于所述硫化钼复合氮杂石墨烯材料中的质量百分数为1-10wt%。
本发明实施例提供了一种硫化钼复合氮杂石墨烯材料的制备方法包括:
提供硫化钼固体;
将氮杂石墨烯、硫化钼固体于溶剂中混合均匀制得混合液,之后将混合液在温度为100-150℃条件下反应6-10h,制得所述的硫化钼复合氮杂石墨烯材料。
本发明实施例还提供了所述硫化钼复合氮杂石墨烯材料于光催化降解氨氮中的用途。
本发明实施例还提供了一种降解氨氮的方法,其包括:在近红外光光照条件下,以硫化钼复合氮杂石墨烯材料作为光催化剂在碱性氛围中直接催化氧化氨氮,实现水体中氨氮的脱除。
较为优选的,采用0.1mol/L NaHCO3-Na2CO3的缓冲溶液调节所述含氨氮溶液的pH值。
较为优选的,所述近红外光的波长λ范围为780nm-2500nm。
较为优选的,所述硫化钼复合氮杂石墨烯材料与氨氮的质量比为100mg:5-50mg。
在一较为优选的实施方案中,一种降解氨氮的方法包括:将含有氨氮的水溶液与硫化钼复合氮杂石墨烯材料混合置入避光反应器中,并在所述避光反应器的光照窗口处设置仅可使近红外光通过的滤光片,之后以光源照射所述避光反应器,实现水体中氨氮的脱除。
在一较为优选的实施方案中,一种降解氨氮的处理方法具体包括:
(1)提供近红外光截止型滤光片及避光反应器,所述滤光片能覆盖所述避光反应器上部,
(2)调节含有氨氮的待测样品的pH值为碱性后与硫化钼复合氮杂石墨烯材料混合置于步骤(1)中的避光反应器并用所述滤光片覆盖,搅拌下置于光源中,之后采用纳氏试剂法每隔一小时测定剩余氨氮溶液的吸光度。
进一步的,所述纳氏试剂法包括:取1mL步骤(2)中的氨氮溶液,加1.5mL纳氏试剂,1mL酒石酸钾钠溶液稀释至50mL,用T1901紫外可见分光光度计测定388nm处的吸光度,按照以下公式计算氨氮的降解率:
氨氮降解率=(1-Ci/C0)×100%=(1-Ai/A0)×100%
式中,C0为氨氮的初始浓度,A0为初始溶液的吸光度,Ci为剩余氨氮的浓度,Ai为剩余氨氮的吸光度。
进一步的,所述硫化钼复合氮杂石墨烯材料重复催化降解氨氮5-10次后,氨氮的降解率仍>87%。
以下结合附图和实施例对本发明的技术作进一步的解释说明。
实施例1
(1)MoS2的制备:取1.21g Na2MoO4·2H2O(0.005mol),1.56g CS(NH2)2(0.020mol),倒于容积为100mL的烧杯中,搅拌直至全部溶解,然后转入聚四氟乙烯内套筒中,加入去离子水至总体积的80%,使固体充分溶解将内套筒置于不锈钢外套筒中,密封,加热至200℃,反应24小时。然后将样品在室温下冷却,用去离子水洗涤,将可溶性物质除去。得到的黑色固体在40℃烘箱中干燥6h,制的MoS2半导体材料,参见图4b所示为硫化钼的TEM图,可以清晰得看到硫化钼的层状结构。
(2)氮杂石墨烯(NG)的制备:准确称取氧化石墨烯(0.22g)溶解于100ml去离子水,超声至分散,之后配置的NH3·H2O(1.0mol/L)调节pH值约为10再取尿素(22.0g,99%)加入上述溶液混合搅拌2h。再将水合肼(2.5mL 0.16mol)磁力搅拌下加入混合液中,之后把上述混合液转入烧瓶(三口,250mL),控制温度80℃,磁力搅拌,冷凝回流反应24h,过滤,水洗,在真空箱中控制温度(70℃,6h)干燥,制得所述氮杂石墨烯,参见图4a为氮杂石墨烯的TEM图,所制备的氮杂石墨烯也是片层结构。
(4)NG-MoS2的制备。在合成MoS2的过程中,Na2MoO4·2H2O与CS(NH2)2的混合溶液里面分别加入质量分数分别为1%、3%、5%、7%、9%的NG,200℃水热反应24小时。得到不同NG含量的NG-MoS2纳米复合半导体材料。光催化实验中以NG含量为5%的MoS2作为光催化剂。参见图2所示,在2θ=14.2°,33.5°,39.5°和59.0°处的衍射峰分别对应于MoS2的(002)、(100)、(103)和(110)晶面指标,MoS2与NG-MoS2的衍射峰与标准图谱(JCPDS37-1492)一致,因此可以确定所得样品为MoS2(空间群为),参见图4c和图4d为硫化钼复合氮杂石墨烯材料的TEM图可以看出硫化钼生长在氮杂石墨烯的表面,且杂化催化剂中MoS2具有较好的结晶性。
(5)光催化实验:用锡箔纸将一个100ml烧杯的杯壁包住,以避免紫外光和可见光进入反应体系,用λ>780nm截止型滤光片覆盖在烧杯口上,以保证只有近红外光辐射进入光反应器,将300W紫外-可见光灯置于反应器上方。烧杯中加入一定浓度的氨氮溶液,用NaHCO3-Na2CO3(0.1mol/L)缓冲溶液调节pH值,向烧杯中加入一定量的催化剂,置于光源下,磁力搅拌器搅拌,每隔一小时测定剩余氨氮溶液的吸光度。取1ml氨氮溶液,加1.5ml纳氏试剂,1ml酒石酸钾钠溶液稀释至50ml,用T1901紫外可见分光光度计测定388nm处的吸光度,以此计算氨氮的降解率。
氨氮降解率=(1-Ci/C0)×100%=(1-Ai/A0)×100%
式中,C0为氨氮的初始浓度,A0为初始溶液的吸光度,Ci为剩余氨氮的浓度,Ai为剩余氨氮的吸光度。
(6)催化剂稳定性:通过多次循环实验来评价杂化催化剂的稳定性。NG-MoS2催化剂在近红外光辐射下连续7次催化降解氨氮的降解率。每一次实验持续8h,在每一次降解结束后,通过离心分离、去离子水洗涤得到催化剂,然后再继续循环使用该催化剂。参见图5,在硫化钼复合氮杂石墨烯材料作为光催化剂光催化降解氨氮7次后氨氮去除率仍在87%以上。
实施例2
(1)MoS2的制备:取1.21g Na2MoO4·2H2O(0.005mol),1.56g CS(NH2)2(0.020mol),倒于容积为100mL的烧杯中,搅拌直至全部溶解,然后转入聚四氟乙烯内套筒中,加入去离子水至总体积的80%,使固体充分溶解将内套筒置于不锈钢外套筒中,密封,加热至200℃,反应24小时。然后将样品在室温下冷却,用去离子水洗涤,将可溶性物质除去。得到的黑色固体在40℃烘箱中干燥6h,制的MoS2半导体材料。
(2)氮杂石墨烯(NG)的制备:准确称取氧化石墨烯(0.22g)溶解于100ml去离子水,超声至分散,之后配置的NH3·H2O(1.0mol/L)调节pH值约为10再取尿素(44.0g,99%)加入上述溶液混合搅拌2h。再将水合肼(2.5mL 0.16mol)磁力搅拌下加入混合液中,之后把上述混合液转入烧瓶(三口,250mL),控制温度80℃,磁力搅拌,冷凝回流反应24h,过滤,水洗,在真空箱中控制温度(70℃,6h)干燥,制得所述氮杂石墨烯。
(4)NG-MoS2的制备。在合成MoS2的过程中,Na2MoO4·2H2O与CS(NH2)2的混合溶液里面分别加入质量分数分别为1%、3%、5%、7%、9%的NG,200℃水热反应24小时。得到不同NG含量的NG-MoS2纳米复合半导体材料。光催化实验中以NG含量为7%的MoS2作为光催化剂。参见图3所示,MoS2单位晶胞是按照六角对称性堆垛而成的,属于空间群根据对称性,MoS2具有4个拉曼活性的振动模式:E1g,A1g[32],且位于385cm-1以及408cm-1处的拉曼峰分别归属于和A1g振动,这进一步表明所制备的样品是MoS2,NG-MoS2的拉曼谱图出现了硫化钼的特征和A1g振动模式,同时在1600cm-1和1335cm-1处观测出两个小峰,分别对应于石墨烯的G带及D带位移,这进一步表明NG与MoS2成功复合。
(5)光催化实验:用锡箔纸将一个100ml烧杯的杯壁包住,以避免紫外光和可见光进入反应体系,用λ>780nm截止型滤光片覆盖在烧杯口上,以保证只有近红外光辐射进入光反应器,将300W紫外-可见光灯置于反应器上方。烧杯中加入一定浓度的氨氮溶液,用NaHCO3-Na2CO3(0.1mol/L)缓冲溶液调节pH值,向烧杯中加入一定量的催化剂,置于光源下,磁力搅拌器搅拌,每隔一小时测定剩余氨氮溶液的吸光度。取1ml氨氮溶液,加1.5ml纳氏试剂,1ml酒石酸钾钠溶液稀释至50ml,用T1901紫外可见分光光度计测定388nm处的吸光度,以此计算氨氮的降解率。
氨氮降解率=(1-Ci/C0)×100%=(1-Ai/A0)×100%
式中,C0为氨氮的初始浓度,A0为初始溶液的吸光度,Ci为剩余氨氮的浓度,Ai为剩余氨氮的吸光度。
(6)催化剂稳定性:通过多次循环实验来评价杂化催化剂的稳定性。NG-MoS2催化剂在近红外光辐射下连续5次催化降解氨氮的降解率。每一次实验持续8h,在每一次降解结束后,通过离心分离、去离子水洗涤得到催化剂,然后再继续循环使用该催化剂。在5次循环降解氨氮后,氨氮去除率仍在90%以上。
应当理解,上述实施例仅为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!