超载和洗脱层析的制造方法与工艺
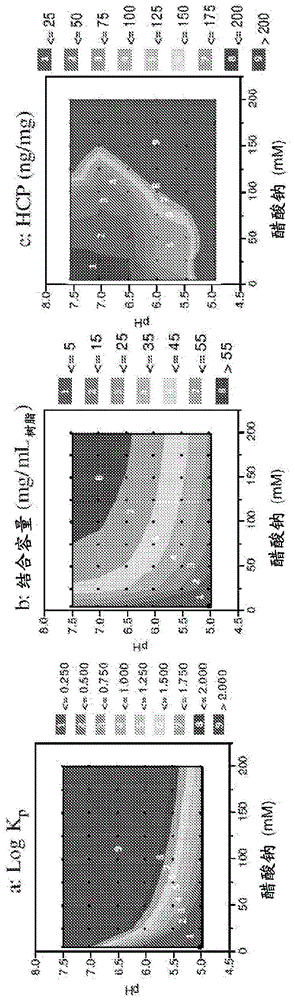
超载和洗脱层析相关申请本申请要求于2011年11月2日提交的临时专利申请U.S.系列号61/554,898的优先权益,其通过引用全文整合到本文中。发明领域本发明提供了从包含产物和至少一种污染物的组合物中纯化产物的方法,和包含通过所述方法纯化的产物的制剂。发明背景阴离子交换(AEX)层析被普遍用于流通模式中作为单克隆抗体(MAb)的平台精制步骤。在标准的流通条件下结合AEX树脂的某些Mab可以解决设备的适应性难题。对于质量要求通常较低的早期临床研发阶段,通过使用结合和洗脱模式的AEX或混合模式的树脂纯化这些非平台性的Mab。然而,由于这些树脂的低动态结合容量(DBC),晚期执行时将需要大小约1000L的柱子,或者在较小柱子上进行多次循环,因而限制了设备的通量。通常使用结合和洗脱层析(B/E)或流通(F/T)层析实施MAb纯化。目前,已经将弱分配层析(Kelley,BD等,2008BiotechnolBioeng101(3):553-566;美国专利申请公开号2007/0060741)和过载层析(PCT/US2011/037977)分别导入到AEX树脂和阳离子交换(CEX)树脂上,以增强MAb纯化。下文强调了这些层析模式每者的一般机制和限制。结合和洗脱层析:在B/E层析中,通常装载产物使层析材料的DBC最大化,然后鉴别洗涤和洗脱条件,使得洗脱液中获得最大产物纯度。B/E层析的限制是装载密度与实际树脂DBC的限制。流通层析:使用F/T层析,鉴别了这样的装载条件,在所述条件下杂质与层析材料强结合,同时产物流通。F/T层析允许对标准MAb进行高装载密度,但对非平台性MAb却不能执行,或者能够对那些非平台性MAb进行F/T操作的溶液条件不能在现有的生产设备中执行。弱分配层析:该操作模式通过鉴别溶液条件,增强了F/T模式,在所述溶液条件下具有MAb与树脂的弱结合(2至20g/L)。在这些条件下,杂质比在F/T模式下的结合更强,因而获得了增强的纯化。然而,装载条件靶向具有范围在0.1-20内的低产物分配系数(Kp)。过载层析:在该层析模式下,超过层析材料对产物的动态结合容量装载目标产物,因而被称为过载。所述操作模式已被证实用阳离子交换(CEX)基质,特别是用膜提供了MAb纯化。然而,该方法的限制是树脂的低产量,因为没有洗脱阶段。将多肽大规模的、有成本效益地纯化至足以用作人治疗剂的纯度仍然是艰巨的难题。本文引用的所有参考文献,包括专利申请和公开都通过引用全文整合到本文中。概述本发明提供了用于从包含多肽和一种或多种污染物的组合物中纯化多肽的方法,所述方法包括a)以超过层析材料对于多肽的动态结合容量的量将组合物装载到层析材料上,b)在其中一种或多种污染物仍然与层析材料结合的条件下,从层析材料上洗脱多肽,和c)混合包含步骤a)和b)的层析流出液中的多肽的级分。在一些实施方案中,多肽是抗体或免疫粘附素。在一些实施方案中,抗体是单克隆抗体;例如但不限于嵌合抗体、人源化抗体或人抗体。在一些实施方案中,抗体是抗原结合片段;例如但不限于Fab片段、Fab’片段、F(ab’)2片段、scFv、di-scFv、bi-scFv、串联(di,tri)-scFv、Fv、sdAb、三功能抗体、BiTE、双抗体和三价抗体。在一些实施方案中,多肽是酶、激素、融合蛋白、含有Fc的蛋白质、免疫缀合物、细胞因子或白介素。在一些实施方案中,多肽是从包含一种或多种污染物的组合物中纯化的;例如,中华仓鼠卵巢蛋白(CHOP)、宿主细胞蛋白(HCP)、泄露的蛋白A、羧肽酶B、核酸、DNA、产物变体、聚集的蛋白质、细胞培养基组分、庆大霉素、多肽片段、内毒素和病毒性污染物。在本发明的一些实施方案中,层析材料选自混合模式材料、阴离子交换材料、疏水性相互作用材料,和亲和材料。在一些实施方案中,以约层析材料对于一种或多种污染物的动态结合容量将组合物装载到层析材料上。在一些实施方案中,多肽的层析材料的分配系数大于30或大于100。在一些实施方案中,方法提供了这样的OEC,其中洗脱缓冲液具有小于装载缓冲液的电导率的电导率。在其他实施方案中,洗脱缓冲液具有大于装载缓冲液的电导率的电导率。在一些实施方案中,方法提供了这样的OEC,其中洗脱缓冲液具有小于装载缓冲液的pH的pH。在其他实施方案中,洗脱缓冲液具有大于装载缓冲液的pH的pH。在一些实施方案中,方法的多肽在来自亲和层析、阳离子交换层析、阴离子交换层析、混合模式层析和疏水性相互作用层析的洗出液中。在一些实施方案中,多肽在来自蛋白A层析的洗出液中。在一些实施方案中,还通过例如病毒过滤、亲和层析、阳离子交换层析、阴离子交换层析、混合模式层析和/或疏水性相互作用层析进一步纯化方法的多肽。在一些实施方案中,多肽是通过例如超滤、渗滤或超滤和渗滤的组合而进一步浓缩的。在一些实施方案中,方法的多肽还与可药用的运载体组合。附图简述图1显示了在MAb3的分批结合条件下,在CaptoAdhere树脂上的高通量筛选(HTS)结果。图1A显示了MAb3的Kp常数值的等值线。图1B显示了在用树脂尝试80g/L产物的上清液时,MAb3的实际结合容量。图1C显示了在用树脂尝试80g/L产物的上清液时,杂质(宿主细胞蛋白)的实际结合容量。所有的等值线图都是使用源自原始数据的应答表面模型生成的。图2显示了优化的OEC操作模式的层析图。用于该次运行的MAb3的装载密度为180g/L。图3显示了使用MAb3的OEC模式的装载优化。图4显示了具有OEC操作模式的靶装载条件的层析图。相似的装载和洗脱条件导致拖尾,因而导致混合物体积增加了45%。用于该次运行的MAb3的装载密度为180g/L。图5显示了使用MAb3的OEC模式的洗脱优化。图6显示了级分中的杂质分析和杂质的累积分析。图7显示了在1000g/L装载密度的OEC模式下,CaptoAdhere树脂的MAb3CHOP贯穿(breakthrough)分析。图8显示了在从70g/L至180g/L的装载密度范围内试验性规模运行的产率分析。图9显示了对弱分配层析操作模式和过载和洗脱层析操作模式的比较。产物是MAb3,层析材料是CaptoAdhere树脂。图10显示了在150g/L装载密度的OEC操作模式下,QMA树脂的MAb3CHOP分析。图11显示了在150g/L装载密度的OEC操作模式下,CaptoAdhere树脂的MAb4CHOP分析。图12显示了在150g/L装载密度的OEC操作模式下,CaptoMMC树脂的MAb4CHOP分析。图13显示了在200g/L装载密度的OEC模式下,CaptoAdhere树脂的MAb3CHOP贯穿分析。将MAb3蛋白A混合物装载到CaptoAdhere树脂上,至200g/L(超过产物结合容量50g/L)。CHOP贯穿分析显示多至200g/LMAb处理CHOP未贯穿。发明详述I.定义如本文描述的术语“产物”是待通过OEC纯化的物质;例如,多肽。术语“多肽”或“蛋白质”在本文中可互换的使用,指任何长度的氨基酸聚合物。聚合物可以是线性的或分支的,可以包含经修饰的氨基酸,并可以被非氨基酸中断。术语还涵盖了被天然地或通过介入修饰的氨基酸聚合物;例如,形成二硫键、糖基化、脂化、乙酰化、磷酸化或任何其他的操作或修饰,如与标记组分缀合。定义还包括了例如含有一个或多个氨基酸类似物(包括例如,非天然氨基酸等),以及本领域已知的其他修饰的多肽。如本文中使用的术语“多肽”和“蛋白质”具体涵盖了抗体。“纯化的”多肽(例如,抗体或免疫粘附素)意指多肽的纯度增加,使所述多肽以比其在天然环境中,和/或比初始合成时,和/或比在实验室条件下扩增时所存在的形式更纯的形式存在。纯度是一个相对的术语,不必然表示绝对纯度。本文中使用的术语“经表位标记的”指包含与“标签多肽”融合的多肽的嵌合多肽。标签多肽具有足够多的残基以提供可以制备抗体的表位,但也足够短,使其不干扰与其融合的多肽的活性。标签多肽还优选地相当独特,使抗体基本上不与其他表位交叉反应。合适的标签多肽一般具有至少6个氨基酸残基,并且通常在约8至50个氨基酸残基之间(优选在约10至20个氨基酸残基之间)。用于本文目的的“活性的”或“活性”指保留了天然或天然存在的多肽的生物学和/或免疫学活性的多肽形式,其中“生物学”活性指由天然或天然存在的多肽导致的、除了诱导针对天然或天然存在的多肽具有的抗原性表位的抗体的生产以外的能力的生物学功能(抑制性或刺激性的),并且“免疫学”活性指诱导针对天然或天然存在的多肽具有的抗原性表位的抗体的生产的能力。术语“拮抗剂”使用最宽泛的含义,并且包括部分或完全阻断、抑制或中和天然多肽的生物学活性的任何分子。类似的,术语“激动剂”使用最宽泛的含义,并且包括模拟天然多肽的生物学活性的任何分子。合适的激动剂或拮抗剂分子具体包括激动剂或拮抗剂抗体或抗体片段、天然多肽的片段或氨基酸序列变体等。用于鉴别多肽的激动剂或拮抗剂的方法可包括将多肽与候选激动剂或拮抗剂分子接触,并测量通常与多肽相关的一种或多种生物学活性的可检测的改变。“补体依赖性细胞毒性”或“CDC”指在存在补体的条件下分子裂解靶的能力。补体激活通路是由补体系统的第一组分(C1q)结合与同族抗原复合的分子(例如,多肽(例如抗体))而起始的。为了评估补体激活,可以实施CDC测定法,例如,如Gazzano-Santoro等,J.Immunol.Methods202:163(1996)中所述。“结合”目标抗原(例如,肿瘤相关多肽抗原靶)的多肽是以足够的亲和力结合抗原的多肽,使得所述多肽可用作靶向表达所述抗原的细胞或组织中的诊断剂和/或治疗剂,且不与其他多肽显著地交叉反应。在这类实施方案中,如通过荧光激活的细胞分选(FACS)分析或放射性免疫沉淀(RIA)所测定的,多肽与“非靶”多肽的结合程度将少于多肽与其特定靶多肽结合的约10%。关于多肽与靶分子的结合,术语“特异的结合”或“特异性地结合于”或特别多肽或特别多肽靶上的表位“特异性的”意指在测量上不同于非特异性的相互作用的结合。可以通过例如确定分子的结合与对照分子的结合的比较,来测量特异的结合,所述对照分子一般是不具有结合活性的结构相似的分子。例如,可以通过与类似于靶的对照分子竞争,例如,过量的未标记的靶,来确定特异的结合。在此情况下,如果标记的靶与探针的结合被过量的未标记的靶竞争性抑制,则表示了特异的结合。本文中的术语“抗体”使用最宽泛的含义,具体覆盖了单克隆抗体、多克隆抗体、由至少两种完整抗体形成的多特异性抗体(例如双特异性抗体),和抗体片段只要其表现出理想的生物学活性。术语“免疫球蛋白”(Ig)在本文中可与抗体互换的使用。抗体是天然存在的免疫球蛋白分子,具有全部基于免疫球蛋白折叠的可变结构。例如,IgG抗体具有通过二硫键合以形成功能性抗体的2条“重”链和2条“轻”链。每条重链和轻链本身包含“恒定区”(C)和“可变区”(V)。V区确定了抗体的抗原结合特异性,同时C区提供了结构支持和与免疫效应子的非抗原特异性相互作用中的功能。抗体或抗体的抗原结合片段的抗原结合特异性是抗体与特别抗原特异性结合的能力。通过V区的结构特征确定抗体的抗原结合特异性。变异性并非均匀的分布在可变结构域的110个氨基酸跨度中。相反,V区由15-30个氨基酸的被称为框架区(FR)的相对不变的片段组成,所述框架区被每个为9-12个氨基酸长的被称为“超变区”的高度变异性的较短区域分隔开。天然重链和轻链的可变结构域每者包含4个FR,主要采用β-片层构象,由3个超变区连接,所述超变区形成环状连接,并且在一些情况下形成β-片层结构的部分。每条链中的超变区通过FR与来自其他链的超变区紧密的靠在一起,对形成抗体的抗原结合位点作贡献(参见Kabat等,SequencesofProteinsofImmunologicalInterest,第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,Md.(1991))。恒定结构域不直接参与抗体与抗原的结合,但却表现出多种效应子功能,如抗体参与的抗体依赖性细胞的细胞毒性(ADCC)。每个V区通常包含3个互补决定区(CDR,每个CDR含有“超变环”)和4个框架区。抗体结合位点,以实质的亲和力与特定的理想抗原结合所必需的最小结构单元,将因此通常包括3个CDR和至少3个、优选4个框架区散布其中,以恰当的构象保持和呈递CDR。经典的四链抗体具有由配合的VH和VL结构域定义的抗原结合位点。某些抗体,如骆驼和鲨鱼抗体,缺少轻链,仅依赖于由重链形成的结合位点。可以制备单结构域改造的免疫球蛋白,其中在缺少VH和VL之间配合的情况下,由重链或轻链单独形成结合位点。术语“可变”指这样的事实,即,可变结构域的某些部分的序列在抗体之间显著不同,并用于每个特定抗体与其特定抗原的结合和特异性。然而,可变性并非均匀的分布在抗体的整个可变结构域。而是集中在轻链和轻链可变结构域中被称为超变区的3个区段中。可变结构域的更加高度保守的部分被称为框架区(FR)。天然重链和轻链的可变结构域每者包含4个FR,主要采用β-片层构象,由3个超变区连接,所述超变区形成环状连接,并且在一些情况下则形成β-片层结构的部分。每条链中的超变区通过FR与来自其他链的超变区紧密的靠在一起,对形成抗体的抗原结合位点作贡献(参见Kabat等,SequencesofProteinsofImmunologicalInterest,第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,Md.(1991))。恒定结构域不直接参与抗体与抗原的结合,但却表现出多种效应子功能,如抗体参与的抗体依赖性细胞的细胞毒性(ADCC)。术语“超变区”当用于本文中时,指抗体中负责抗原结合的氨基酸残基。超变区可包含来自“互补决定区”或“CDR”的氨基酸残基(例如,大概是VL中的残基24-34(L1)、50-56(L2)和89-97(L3),和VH中的约31-35B(H1)、50-65(H2)和95-102(H3)(Kabat等,SequencesofProteinsofImmunologicalInterest,第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,Md.(1991))和/或来自“超变环”的那些残基(例如,VL中的残基26-32(L1)、50-52(L2)和91-96(L3),和VH中的26-32(H1)、52A-55(H2)和96-101(H3)(Chothia和LeskJ.Mol.Biol.196:901-917(1987))。“框架”或“FR”残基是本文定义的超变区残基以外的那些可变结构域残基。“抗体片段”包含完整抗体的部分,优选地包含其抗原结合区。抗体片段的例子包括Fab、Fab'、F(ab')2和Fv片段;双抗体;串联双抗体(taDb)、线性抗体(例如,美国专利号5,641,870,实施例2;Zapata等,ProteinEng.8(10):1057-1062(1995));单臂抗体、单可变结构域抗体、微抗体(minibodies)、单链抗体分子;由抗体片段形成的多特异性抗体(例如,包括但不限于:Db-Fc、taDb-Fc、taDb-CH3、(scFV)4-Fc、di-scFv、bi-scFv或串联(di,tri)-scFv);和双特异性T细胞募召剂(BiTE)。木瓜蛋白酶消化抗体产生2个相同的抗原结合片段,被称为“Fab”片段,每个都具有单个抗原结合位点,和剩余的“Fc”片段,该片段的名称反映了片段易于结晶的能力。胃蛋白酶处理产生了具有2个抗原结合位点并仍然能够交联抗原的F(ab')2片段。“Fv”是含有完整的抗原识别和抗原结合位点的最小抗体片段。该区由处于紧密、非共价缔合的1条重链和1条轻链可变结构域的二聚体组成。在该构象中,每个可变结构域的3个超变区相互作用,在VH-VL二聚体的表面定义了抗原结合位点。综上所述,6个超变区赋予抗体以抗原结合特异性。然而,即使是单可变结构域(或仅包含抗原特异性的3个超变区的一半Fv)也具有识别和结合抗原的能力,虽然比整个结合位点的亲和力低。Fab片段还含有轻链的恒定结构域和重链的第一恒定结构域(CH1)。Fab’片段与Fab片段不同,区别在于在重链CH1结构域的羧基末端添加了若干残基,包括来自抗体铰链区的一个或多个半胱氨酸。Fab'-SH是本文中对其中恒定结构域的半胱氨酸残基具有至少一个游离巯基的Fab'的命名。F(ab')2抗体片段最初是作为之间具有铰链半胱氨酸的成对Fab'片段生产的。抗体片段的其他化学偶联也是已知的。来自任何脊椎动物的抗体(免疫球蛋白)的“轻链”可以分为两类明显不同的类型之一,称为kappa(κ)和lambda(λ),基于其恒定结构域的氨基酸序列。根据其重链的恒定结构域的氨基酸序列,抗体可以分为不同的类型。有五大类完整的抗体:IgA、IgD、IgE、IgG和IgM,其中一些还进一步分为亚类(同种型),例如IgG1、IgG2、IgG3、IgG4、IgA和IgA2。对应不同类型的抗体的重链恒定结构域分别被称为α、δ、ε、γ和μ。不同类型的免疫球蛋白的亚基结构和三维构象是普遍已知的。“单链Fv”或“scFv”抗体片段包含抗体的VH和VL结构域,其中这些结构域存在于单个多肽链中。在一些实施方案中,Fv多肽还在VH和VL结构域之间包含多肽接头,所述多肽接头使scFv能够形成用于抗原结合的理想的结构。关于scFv的综述,参见ThePharmacologyofMonoclonalAntibodies,第113卷,RosenburgandMoore编著,Springer-Verlag,NewYork,第269-315页(1994)中的Plückthun。术语“双抗体”指具有2个抗原结合位点的小抗体片段,所述片段包含与在同一多肽链中的轻链可变结构域(VL)相连的重链可变结构域(VH)(VH-VL)。通过使用太短以至于不允许在同一链的2个结构域之间配对的接头,强迫结构域与另一条链的互补结构域配对,并生成2个抗原结合位点。双抗体更详细地描述在例如EP404,097;WO93/11161;和Hollinger等,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993)中。术语“多特异性抗体”使用最宽泛的含义,具体覆盖了具有多表位特异性的抗体。这类多特异性抗体包括但不限于:包含重链可变结构域(VH)和轻链可变结构域(VL)的抗体,其中VHVL单元具有多表位特异性;具有2个或多个VL和VH结构域的抗体,每个VHVL单元结合不同的表位;具有2个或多个单可变结构域的抗体,每个单可变结构域结合不同的表位;全长抗体、抗体片段如Fab、Fv、dsFv、scFv、双抗体、双特异性双抗体、三价抗体、三功能抗体、共价或非共价连接的抗体片段。“多表位特异性”指特异性结合相同或不同的靶上的两个或多个不同的表位的能力。“单一特异性”指仅结合一个表位的能力。根据一个实施方案,多特异性抗体是以5μM至0.001pM、3μM至0.001pM、1μM至0.001pM、0.5μM至0.001pM或0.1μM至0.001pM的亲和力结合每个表位的IgG抗体。表达方式“单结构域抗体”(sdAb)或“单可变结构域(SVD)抗体”一般指这样的抗体,所述抗体中的单个可变结构域(VH或VL)可以赋予抗原结合。换言之,单可变结构域不需要为了识别靶抗原而与另一个可变结构域相互作用。单结构域抗体的例子包括源自骆驼科动物(羊驼和骆驼)和软骨鱼(例如护士鲨)的抗体,和通过重组方法源自人和小鼠抗体的抗体(Nature(1989)341:544-546;DevCompImmunol(2006)30:43-56;TrendBiochemSci(2001)26:230-235;TrendsBiotechnol(2003):21:484-490;WO2005/035572;WO03/035694;FebsLett(1994)339:285-290;WO00/29004;WO02/051870)。术语“单克隆抗体”在本文中用于指从基本均质的抗体的群体中获得的抗体,即,构成群体的单个抗体是相同的和/或结合相同表位,除了可能在生产单克隆抗体的过程中产生的可能的变体外,这类变体一般以少量存在。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品相反,每个单克隆抗体针对抗原上的单个决定簇。除了其特异性外,单克隆抗体的优点还在于不被其他的免疫球蛋白污染。修饰语“单克隆”表示抗体的特征是从基本均质的抗体群体获得的,并不理解为要求通过任何特定的方法生产抗体。例如,待根据本文提供的方法使用的单克隆抗体可以通过Kohler等,Nature256:495(1975)首次描述的杂交瘤方法或者可以通过重组DNA方法制备(参见例如,美国专利号4,816,567)。还可以使用例如Clackson等,Nature352:624-628(1991)和Marks等,J.Mol.Biol.222:581-597(1991)中描述的技术,从噬菌体抗体文库中分离“单克隆抗体”。本文中的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分是与源自特定物种的抗体的相应序列相同或同源的,或者属于特定的抗体类型或亚类,而链的其余部分是与源自另一种物种的抗体的相应序列相同或同源的,或者属于另一种抗体类型或亚类,以及这类抗体的片段,只要所述片段表现出理想的生物学活性(美国专利号4,816,567;Morrison等,Proc.Natl.Acad.Sci.USA81:6851-6855(1984))。本文中的目标嵌合抗体包括“灵长类化的”抗体,所述抗体包含源自非人灵长类(例如,旧世界猴,如狒狒、恒河猴或食蟹猴)的可变结构域抗原结合序列和人恒定区序列(美国专利号5,693,780)。非人(例如,鼠)抗体的“人源化”形式是含有源自非人免疫球蛋白的最少序列的嵌合抗体。在绝大部分情况下,人源化抗体是这样的人免疫球蛋白(受体抗体),其中受体超变区的残基被具有理想特异性、亲和力和能力的非人物种(供体抗体),如小鼠、大鼠、兔或非人灵长类的超变区残基取代。在一些情况下,人免疫球蛋白的框架区(FR)残基被相应的非人残基取代。此外,人源化抗体可包含在受体抗体或供体抗体中没有发现的残基。进行这些修饰以进一步改善抗体性能。一般而言,人源化抗体将包含基本上全部的至少1个,通常2个可变结构域,其中,所有的或基本上所有的超变环都对应于非人免疫球蛋白的超变环,并且所有的或基本上所有的FR都是人免疫球蛋白序列的FR,除了如上述的FR取代。人源化抗体任选地还包含免疫球蛋白恒定区的至少一部分,通常是人免疫球蛋白的恒定区。更多细节参见Jones等,Nature321:522-525(1986);Riechmann等,Nature332:323-329(1988);和Presta,Curr.Op.Struct.Biol.2:593-596(1992)。出于本文的目的,“完整抗体”是包含重链和轻链可变结构域以及Fc区的抗体。恒定结构域可以是天然序列恒定结构域(例如,人天然序列恒定结构域)或其氨基酸序列变体。优选的,完整抗体具有一个或多个效应子功能。“天然抗体”通常是约150,000道尔顿的异四聚化的糖蛋白,由2条相同的轻(L)链和2条相同的重(H)链组成。每条轻链通过1个共价的二硫键与重链相连,而不同的免疫球蛋白同种型的重链之间的二硫键数量也不同。每条重链和轻链还具有规律间隔的链内二硫桥。每条重链在一个末端具有可变结构域(VH),之后具有多个恒定结构域。每条轻链在一端具有可变结构域(VL),在另一端具有恒定结构域;轻链的恒定结构域与重链的第一恒定结构域对齐,轻链的可变结构域与重链的可变结构域对齐。特定的氨基酸残基被认为形成了轻链和重链可变结构域之间的界面。“裸露的抗体”是未与异源分子(如细胞毒性部分或放射性标记)缀合的抗体(如本文定义)。在一些实施方案中,抗体的“效应子功能”指归因于抗体的Fc区(天然序列Fc区或氨基酸序列变体Fc区)的那些生物学活性,且随抗体同种型而不同。抗体效应子功能的例子包括:C1q结合和补体依赖性细胞毒性;Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体的下调。“抗体依赖性细胞介导的细胞毒性”和“ADCC”指细胞介导的反应,在所述反应中,表达Fc受体(FcR)的非特异性细胞毒性细胞(例如,天然杀伤(NK)细胞、嗜中性粒细胞和巨噬细胞)识别在靶细胞上结合的抗体,然后导致靶细胞裂解。用于介导ADCC的主要细胞,NK细胞,仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。Ravetch和Kinet,Annu.Rev.Immunol9:457-92(1991)的第464页的表3概括了在造血细胞上的FcR表达。为了评估目标分子的ADCC活性,可以实施体外ADCC测定法,如美国专利号5,500,362或5,821,337所述。用于这类测定法的效应子细胞包括外周血单核细胞(PBMC)和天然杀伤(NK)细胞。可选的或额外的,可以在体内评估目标分子的ADCC活性,例如在动物模型中,如Clynes等,Proc.Natl.Acad.Sci.(USA)95:652-656(1998)中公开的动物模型。“人效应子细胞”是表达一种或多种FcR并实施效应子功能的白细胞。在一些实施方案中,细胞至少表达FcγRIII并执行ADCC效应子功能。介导ADCC的人白细胞的例子包括外周血单核细胞(PBMC)、天然杀伤(NK)细胞、单核细胞、细胞毒性T细胞和嗜中性粒细胞;PBMC和NK细胞是优选的。术语“Fc受体”或“FcR”用于描述与抗体的Fc区结合的受体。在一些实施方案中,FcR是天然序列的人FcR。此外,优选的FcR是结合IgG抗体的FcR(γ受体),包括FcγRI、FcγRII和FcγRIII亚类的受体,包括这些受体的等位变体和备选地可变剪切形式。FcγRII受体包括FcγRIIA(活化型受体)和FcγRIIB(抑制型受体),其具有差别主要在于其胞质结构域中的类似的氨基酸序列。活化型受体FcγRIIA在其胞质结构域中含有基于免疫受体酪氨酸的激活基序(ITAM)。抑制型受体FcγRIIB在其胞质结构域中含有基于免疫受体酪氨酸的抑制基序(ITIM)。(参见Annu.Rev.Immunol.15:203-234(1997))。Ravetch和Kinet,Annu.Rev.Immunol9:457-92(1991);Capel等,Immunomethods4:25-34(1994);和deHaas等,J.Lab.Clin.Med.126:330-41(1995)中对FcR进行了综述。其他FcR,包括将来待鉴定的那些,都被本文中的术语“FcR”涵盖。该术语还包括新生儿受体FcRn,这是负责母体IgG向胎儿转移的受体(Guyer等,J.Immunol.117:587(1976)和Kim等,J.Immunol.24:249(1994))。本文使用的术语“顺序”涉及层析时指第一层析后接第二层析。在第一层析和第二层析之间也可以包括其他步骤。本文使用的术语“连续”涉及层析时指具有直接相连的,或允许在两种层析材料之间连续流动的一些其他机制的第一层析材料和第二层析材料。“污染物”指与理想的多肽产物不同的材料。污染物包括但不限于:宿主细胞材料,如CHOP;泄露的蛋白A;核酸;理想多肽的变体、片段、聚集物或衍生物;另一种多肽;内毒素;病毒性污染物;细胞培养基组分等。在一些例子中,污染物可以是宿主细胞蛋白质(HCP),来自例如但不限于细菌细胞,如大肠杆菌细胞、昆虫细胞、原核细胞、真核细胞、酵母细胞、哺乳动物细胞、鸟类细胞、真菌细胞。层析材料的“动态结合容量”是在未结合产物显著的贯穿出现前,材料在实际的流动条件下将要结合的产品(例如多肽)的量。本文使用的“分配系数”Kp指产物(例如多肽)在静止相中的摩尔浓度除以产物在移动相中的摩尔浓度。“装载密度”指与一定体积的层析材料(例如数升)接触的组合物的量,例如克。在一些例子中,装载密度用g/L表示。本文中提及“约”一定数值或参数时,包括(描述了)对于数值或参数本身的变异。例如,涉及“约X”的描述包括了对“X”的描述。如本文和所附权利要求中使用的,单数形式“a”或“the”包括了复数指代,除非语境中另外明确指出。应理解,本文描述的本发明的方面和变异包括了“由方面和变异组成”和/或“基本由方面和变异组成”。II.纯化方法本文提供了使用过载和洗脱层析(OEC)从包含产物和至少一种污染物的组合物中纯化产物(如多肽)的方法。OEC提供了这样的操作模式,其中在单种层析模式中实现不同的层析模式提供的好处。OEC可以在多种树脂上执行,同时提供增强的杂质去除和显著的生产优势,如更小的柱体积,更好的设备适合度和更低的成本。OEC的操作模式可以分解为3种不同的组分。1.过载–将组合物装载到层析材料上,使产物(如多肽)装载到层析材料上的量超过材料对于产物的动态结合容量(DBC)。在一些实施方案中,确定杂质与层析材料强烈结合的装载条件,如pH和电导率。在一些实施方案中,选择层析条件,使得即使产物贯穿,绝大多数,如果不是所有的杂质不贯穿。在一些实施方案中,组合物的装载量是或者接近材料对于一种或多种污染物的DBC。过载模式允许所利用的层析材料超过材料对于产物的典型DBC。2.混合–洗脱液中的产物,如多肽的混合开始于产物贯穿。由于装载条件是使杂质在贯穿期间继续结合,因此可以在层析的装载阶段在洗脱液中获得清洁的产物混合物。3.洗脱–在结束将组合物装载到层析材料后,使用经鉴别的洗脱条件,从层析材料上洗脱产物(如多肽),所述洗脱条件使得洗脱结合的产物,同时大部分的杂质仍然与层析材料结合。在一些方面,OEC显著增加层析材料利用,超过材料对于产物的DBC,从而提供相比其他层析方法的好处。例如,高10倍的层析材料利用可以导致显著更低的成本。与其中优化层析材料的装载以最大化产物(如多肽)与层析树脂的结合的传统的结合和洗脱层析不同,可以优化OEC装载条件以最大化污染物与层析材料的结合而并非产物与层析材料的结合。在一些方面,向层析材料装载的组合物的量超过层析材料对于多肽的动态结合容量。在装载层析材料的过程中,一些产物将在洗涤中贯穿,而一些产物仍然与层析材料结合。在结束装载后,可以从层析材料中洗脱与层析材料结合的剩余产物。在一些上述实施方案中,层析材料是层析柱。在一些上述实施方案中,层析材料是层析膜。在本发明的一些方面,以约层析材料对组合物中的一种或多种污染物的动态结合容量将组合物装载到层析材料上。在一些实施方案中,以超过层析材料对产物的结合容量的量将组合物装载到层析材料上。在一些实施方案中,以约层析材料对一种或多种污染物的动态结合容量并超过层析材料对产物的结合容量将组合物装载到层析材料上。在一些实施方案中,以层析材料对产物的DBC的20倍将组合物装载到层析材料上。在一些实施方案中,以层析材料对产物的DBC的100倍将组合物装载到层析材料上。在一些实施方案中,以约层析材料对组合物中的所有污染物的动态结合容量将组合物装载到层析材料上。在一些实施方案中,以约层析材料对组合物中的所有污染物的动态结合容量并超过层析材料对产物的结合容量将组合物装载到层析材料上。在一些实施方案中,以少于层析材料对所有污染物的动态结合容量并超过层析材料对产物的结合容量将组合物装载到层析材料上。在一些上述实施方案中,层析材料位于层析柱中。在一些实施方案中,层析柱是工业规模的层析柱。在一些上述实施方案中,层析材料是层析膜。可以通过确定特定层析材料的产物或污染物的分配系数(Kp)作为pH和反离子浓度的函数,估算层析材料对产物和一种或多种污染物的动态结合容量。例如,可以确定层析材料(例如混合模式树脂)对多肽的动态结合容量。可以通过用过量的产物和/或污染物挑战结合,确定在具体的pH和反离子浓度组合条件下,层析材料对产物或污染物的实际结合容量。在一些实施方案中,当产物(例如多肽)的Kp大于约30时实施OEC。在一些实施方案中,当产物的Kp大于约50时实施OEC。在一些实施方案中,当产物的Kp大于约75时实施OEC。在一些实施方案中,当产物的Kp大于约100时实施OEC。可以通过测量特定层析材料在不同的pH和反离子浓度下的Kp和动态结合容量,确定包含产物(如多肽)和污染物的特定组合物的OEC条件。可以进行高通量筛选以确定这样的OEC条件,其中污染物结合高且可以在不洗脱绝大部分如果不是全部的污染物的条件下洗脱产物。例如,可以在高通量系统中,在多种pH和反离子浓度的缓冲液中孵育组合物与层析材料;例如在多孔板的孔中。在孵育期之后,分离层析材料和上清液,确定上清液中的产物或污染物的量。在一些实施方案中,使用低浓度的组合物确定Kp。在一些实施方案中,使用高浓度的组合物确定动态结合容量。除了提供关于层析材料对特定产物和污染物的Kp和动态结合容量的信息外,高通量筛选在pH和反离子浓度方面对于装载和洗脱条件提供了指导。例如,在一些实施方案中,通过高通量筛选选择装载缓冲液的pH和反离子浓度,使污染物与层析材料的结合最大化,也还使洗出液中的产物(例如多肽)量最大化,同时使洗出液中的污染物,例如宿主细胞蛋白质的量最小化。在一些实施方案中,在通过高通量筛选确定的pH和电导率下,将组合物装载到层析材料上,其中组合物中约所有的污染物都结合在层析材料上。在一些实施方案中,在通过高通量筛选确定的pH和电导率下,从层析材料上洗脱产物,其中从层析材料上洗脱了约所有的产物,而约所有的污染物仍然结合在层析材料上。在一些实施方案中,本发明提供了(例如,通过使用高通量筛选技术)用于鉴别操作条件的方法,所述操作条件导致层析材料结合最大量的污染物,而不论每mL层析材料结合的产物的量。筛选步骤用于鉴别这样的洗脱条件,所述洗脱条件使结合的产物从层析材料上洗脱而杂质仍然与层析材料紧密结合。在本文所述的任何方法的一些实施方案中,层析材料是包含能够进行一种或多种下列功能的官能团的混合模式材料:阴离子交换、阳离子交换、形成氢键和疏水性相互作用。在一些实施方案中,混合模式材料包含能够进行阴离子交换和疏水性相互作用的官能团。混合模式材料可含有N-苯甲基-N-甲基乙醇胺、4-巯基-乙基-吡啶,己胺或苯丙胺作为配体,或含有交联的聚丙烯胺。混合模式材料的例子包括CaptoAdhere树脂、QMA树脂、CaptoMMC树脂、MEPHyperCel树脂、HEAHyperCel树脂、PPAHyperCel树脂或ChromaSorb膜或SartobindSTIC。在一些实施方案中,混合模式材料是CaptoAdhere树脂。在一些上述实施方案中,混合模式材料是混合模式层析柱。在一些上述实施方案中,混合模式材料是混合模式膜。在本文所述的任何方法的一些实施方案中,层析材料是离子交换层析材料;例如,阴离子交换层析材料或阳离子交换层析材料。在本文所述的任何方法的一些实施方案中,层析材料是阴离子交换材料。在一些实施方案中,阴离子交换层析材料是带正电且具有用于交换流过或流通固相的含水溶液中的阴离子的自由的阴离子的固相。在本文所述的任何方法的一些实施方案中,阴离子交换材料可以是膜、棒状或树脂。在一个实施方案中,阴离子交换材料可以是树脂。在一些实施方案中,阴离子交换材料可包含伯胺、仲铵、叔胺或季铵离子官能团、多胺官能团或二乙氨乙基官能团。在一些上述实施方案中,阴离子交换层析材料是阴离子交换层析柱。在一些上述实施方案中,阴离子交换层析材料是阴离子交换层析膜。在本文所述的任何方法的一些实施方案中,层析材料是阳离子交换材料。在一些实施方案中,阳离子交换材料是带负电且具有用于交换流过或流通固相的含水溶液中的阳离子的自由的阳离子的固相。在本文所述的任何方法的一些实施方案中,阳离子交换材料可以是膜、棒状或树脂。在一些实施方案中,阳离子交换材料可以是树脂。阳离子交换材料可包含羧酸官能团或磺酸官能团,例如但不限于磺酸盐、羧酸、羧甲基磺酸、磺异丁基、磺乙基、羧基、磺丙基、磺酰基、磺氧乙基或正磷酸盐。在一些上述实施方案中,阳离子交换层析材料是阳离子交换层析柱。在一些上述实施方案中,阳离子交换层析材料是阳离子交换层析膜。在本发明的一些实施方案中,层析材料不是阳离子交换层析材料。在本文所述的任何方法的一些实施方案中,离子交换材料可利用常规的层析材料或对流的层析材料。常规的层析材料包括例如:灌注性材料(例如,聚(苯乙烯-二乙烯基苯)树脂)和扩散性材料(例如,交联的琼脂糖树脂)。在一些实施方案中,聚(苯乙烯-二乙烯基苯)树脂可以是Poros树脂。在一些实施方案中,交联的琼脂糖树脂可以是磺丙基-SepharoseFastFlow(SPSFF)树脂。对流层析材料可以是膜(例如,聚醚砜)或棒状材料(例如,交联的聚合物)。聚醚砜膜可以是Mustang。交联的聚合物棒状材料可以是交联的聚甲基丙烯酸缩水甘油酯-二甲基丙烯酸乙二醇酯共聚物。阴离子交换材料的例子是本领域已知的,包括但不限于:PorosHQ50、PorosPI50、PorosD、MustangQ、QSepharoseFF和DEAESepharose。阳离子交换材料的例子是本领域已知的,包括但不限于:MustangS、SartobindS、SO3Monolith、SCeramicHyperD、PorosXS、PorosHS50、PorosHS20、SPSFF、SP-SepharoseXL(SPXL)、CMSepharoseFastFlow、CaptoS、FractogelSeHiCap、FractogelSO3或FractogelCOO。在本文所述的任何方法的一些实施方案中,阳离子交换材料是PorosHS50。在一些实施方案中,PorosHS树脂可以是PorosHS50μm或PorosHS20μm颗粒。在本发明的一些方面,层析材料是疏水性相互作用层析材料。疏水性相互作用层析(HIC)是液相层析技术,其根据疏水性分离生物分子。HIC层析材料的例子包括但不限于:Toyopearlhexyl650、Toyopearbutyl650、Toyopearlphenyl650、Toyopearlether650、Source、Resource、SepharoseHi-Trap、Octylsepharose、Phenylsepharose。在一些上述实施方案中,HIC层析材料是HIC层析柱。在一些上述实施方案中,HIC层析材料是HIC层析膜。在本发明的一些方面,层析材料是羟磷灰石(HAP)层析材料。羟磷灰石层析材料的例子包括但不限于HAUltrogel和CHT羟磷灰石。在一些上述实施方案中,HAP层析材料是HAP层析柱。在一些上述实施方案中,HAP层析材料是HAP层析膜。在本发明的一些方面,层析材料是亲和层析材料。亲和层析材料的例子包括但不限于用蛋白A或蛋白G衍生的层析材料。亲和层析材料的例子包括但不限于:Prosep-VA、Prosep-VAUltraPlus、ProteinAsepharosefastflow、TyopearlProteinA、MAbSelect、MAbSelectSuRe和MAbSelectSuReLX。在一些上述实施方案中,亲和层析材料是亲和层析柱。在一些上述实施方案中,亲和层析材料是亲和层析膜。可以优化组合物在层析材料上的装载,用于通过OEC分离产物和污染物。在一些实施方案中,产物是多肽。在一些实施方案中,优化组合物在层析材料上的装载,用于污染物与层析材料的结合。例如,可以在多种不同的pH的装载缓冲液中,将组合物装载到层析材料(例如层析柱)上,而装载缓冲液的电导率是恒定的。可选的,可以在多种不同的电导率的装载缓冲液中,将组合物装载到层析材料上,而装载缓冲液的pH是恒定的。在结束将组合物装载到层析材料上和从层析材料上洗脱产物至混合级分中之后,混合级分中的污染物的量提供了关于对于给定的pH或电导率的产物和污染物的分离的信息。在本文所述的任何方法的一些实施方案中,以大于约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L、2000g/L或5000g/L层析材料中的任一的多肽的装载密度将组合物装载到层析材料上。在一些实施方案中,以约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L或2000g/L层析材料中的任一的多肽的装载密度将组合物装载到层析材料上。可以约30g/L和2000g/L之间、30g/L和1000g/L之间、30g/L和200g/L之间、30g/L和180g/L之间、50g/L和2000g/L之间、50g/L和1000g/L之间、50g/L和200g/L之间、50g/L和180g/L之间、150g/L和2000g/L之间、150g/L和1500g/L之间、150g/L和1000g/L之间、200g/L和1000g/L之间、200g/L和1500g/L之间、300g/L和1500g/L之间、400g/L和1000g/L之间或500g/L和1000g/L之间的层析材料中的任一的多肽的装载密度将组合物装载到层析材料上。在本文所述的任何方法的一些实施方案中,以大于约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L、2000g/L或5000g/L混合模式层析材料中的任一的多肽的装载密度将组合物装载到混合模式层析材料上。在一些实施方案中,以约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L或2000g/L混合模式层析材料中的任一的多肽的装载密度将组合物装载到混合模式层析材料上。可以约30g/L和2000g/L之间、30g/L和1000g/L之间、30g/L和200g/L之间、30g/L和180g/L之间、50g/L和2000g/L之间、50g/L和1000g/L之间、50g/L和200g/L之间、50g/L和180g/L之间、150g/L和2000g/L之间、150g/L和1500g/L之间、150g/L和1000g/L之间、200g/L和1000g/L之间、200g/L和1500g/L之间、300g/L和1500g/L之间、400g/L和1000g/L之间或500g/L和1000g/L之间的混合模式层析材料中的任一的多肽的装载密度将组合物装载到混合模式层析材料上。在一些实施方案中,以70g/L至180g/L的密度将多肽装载到层析材料上。在本发明的一些实施方案中,混合模式层析是CaptoAdhere树脂。在一些实施方案中,以70g/L至180g/L的密度将多肽装载到CaptoAdhere层析材料上。在上述实施方案的其他实施方案中,多肽是抗体或其片段。在本文所述的任何方法的一些实施方案中,以大于约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L、2000g/L或5000g/L阴离子交换层析材料中的任一的多肽的装载密度将组合物装载到阴离子交换层析材料上。在一些实施方案中,以约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L或2000g/L阴离子交换层析材料中的任一的多肽的装载密度将组合物装载到阴离子交换层析材料上。可以约30g/L和2000g/L之间、30g/L和1000g/L之间、30g/L和200g/L之间、30g/L和180g/L之间、50g/L和2000g/L之间、50g/L和1000g/L之间、50g/L和200g/L之间、50g/L和180g/L之间、150g/L和2000g/L之间、150g/L和1500g/L之间、150g/L和1000g/L之间、200g/L和1000g/L之间、200g/L和1500g/L之间、300g/L和1500g/L之间、400g/L和1000g/L之间或500g/L和1000g/L之间的阴离子交换层析材料中的任一的多肽的装载密度将组合物装载到阴离子交换层析材料上。在本文所述的任何方法的一些实施方案中,以大于约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L、2000g/L或5000g/L阳离子交换层析材料中的任一的多肽的装载密度将组合物装载到阳离子交换层析材料上。在一些实施方案中,以约30g/L、40g/L、50g/L、60g/L、70g/L、80g/L、90g/L、100g/L、110g/L、120g/L、130g/L、140g/L、150g/L、160g/L、170g/L、180g/L、190g/L、200g/L、300g/L、400g/L、500g/L、550g/L、600g/L、650g/L、700g/L、800g/L、900g/L、1000g/L或2000g/L阳离子交换层析材料中的任一的多肽的装载密度将组合物装载到阳离子交换层析材料上。可以约30g/L和2000g/L之间、30g/L和1000g/L之间、30g/L和200g/L之间、30g/L和180g/L之间、50g/L和2000g/L之间、50g/L和1000g/L之间、50g/L和200g/L之间、50g/L和180g/L之间、150g/L和2000g/L之间、150g/L和1500g/L之间、150g/L和1000g/L之间、200g/L和1000g/L之间、200g/L和1500g/L之间、300g/L和1500g/L之间、400g/L和1000g/L之间或500g/L和1000g/L之间的阳离子交换层析材料中的任一的多肽的装载密度将组合物装载到阳离子交换层析材料上。上述方法还可以包括装载到蛋白A亲和层析材料的步骤。在一些实施方案中,多肽产物是在OEC之前首先通过蛋白A亲和层析纯化的抗体或其片段。装载到蛋白A亲和层析材料的步骤一般但不必需是在其他层析步骤之前实施的。在一些实施方案中,装载到蛋白A亲和层析材料的步骤可以与过载的交换和洗脱层析的顺序步骤组合。在一些实施方案中,顺序步骤是连续的。在一些实施方案中,连续纯化使用相同的流速、电导率和/或pH。可以优化在OEC模式下产物(如多肽)从层析材料上的洗脱,用于产生具有最少污染物和处于最小混合体积的产物。例如,可以在装载缓冲液中将组合物装载到层析材料(例如层析柱)上。在结束装载后,可以在多种不同pH的缓冲液中洗脱产物,而洗脱缓冲液的电导率是恒定的。可选的,可以在多种不同电导率的缓冲液中洗脱产物,而洗脱缓冲液的pH是恒定的。在结束从层析材料上洗脱产物之后,混合级分中的污染物的量提供了关于对于给定的pH或电导率的产物和污染物的分离信息。大数量的级分(例如,8倍柱体积)的产物洗脱表示洗脱谱“拖尾”。在本发明的一些实施方案中,使洗脱拖尾最小化。可以根据例如缓冲液的理想pH、缓冲液的理想电导率、目标蛋白质的特征和纯化方法,使用多种缓冲液。在本文所述的任何方法的一些实施方案中,方法包括使用缓冲液。缓冲液可以是装载缓冲液、平衡缓冲液或洗涤缓冲液。在一些实施方案中,装载缓冲液、平衡缓冲液和/或洗涤缓冲液中的一种或多种是相同的。在一些实施方案中,装载缓冲液、平衡缓冲液和/或洗涤缓冲液是不同的。在本文所述的任何方法的一些实施方案中,缓冲液包含盐。装载缓冲液可包含氯化钠、醋酸钠或其混合物。在一些实施方案中,装载缓冲液是氯化钠缓冲液。在一些实施方案中,装载缓冲液是醋酸钠缓冲液。本文使用的装载是将组合物装载到层析材料上。装载缓冲液是用于将包含目标产物的组合物装载到层析材料上的缓冲液。可以在装载待纯化的组合物之前,用平衡缓冲液平衡层析材料。在一些例子中,在将组合物装载到层析材料上之后和从固相上洗脱目标多肽之前,使用洗涤缓冲液。然而,可以通过洗涤缓冲液从层析材料上去除一些目标产物(例如多肽)(例如,与流通型模式相似)。本文使用的洗脱是从层析材料上去除产物(例如多肽)。洗脱缓冲液是用于从层析材料上洗脱多肽或其他目标产物的缓冲液。在许多情况下,洗脱缓冲液具有不同于装载缓冲液的物理特征。例如,洗脱缓冲液可具有不同于装载缓冲液的电导率或不同于装载缓冲液的pH。在一些实施方案中,洗脱缓冲液具有低于装载缓冲液的电导率。在一些实施方案中,洗脱缓冲液具有高于装载缓冲液的电导率。在一些实施方案中,洗脱缓冲液具有低于装载缓冲液的pH。在一些实施方案中,洗脱缓冲液具有高于装载缓冲液的pH。在一些实施方案中,洗脱缓冲液具有不同于装载缓冲液的电导率和pH。洗脱缓冲液可以具有更高或更低电导率和更高或更低pH的任意组合。电导率指含水溶液在两个电极之间传导电流的能力。在溶液中,电流通过离子运输而流动。因此,伴随含水溶液中存在的离子量增加,溶液将具有更高的电导率。测量电导率的基础单位是Siemen(或姆欧)、姆欧(mS/cm),可以使用电导仪测量,如多种模型的Orion电导仪。由于电解电导率是溶液中的离子携带电流的容量,因此可以通过改变其中的离子浓度改变溶液的电导率。例如,可以改变溶液中的缓冲剂浓度和/或盐(例如,氯化钠、醋酸钠或氯化钾)浓度以获得理想的电导率。优选地,修饰多种缓冲液的盐浓度来获得理想的电导率。在本文所述的任何方法的一些实施方案中,装载缓冲液具有大于约4.0mS/cm、4.5mS/cm、5.0mS/cm、5.5mS/cm、6.0mS/cm、6.5mS/cm、7.0mS/cm、7.5mS/cm、8.0mS/cm、8.5mS/cm、9.0mS/cm、9.5mS/cm或10mS/cm中的任一的电导率。电导率可以在约4mS/cm和17mS/cm之间、4mS/cm和10mS/cm之间、4mS/cm和7mS/cm之间、5mS/cm和17mS/cm之间、5mS/cm和10mS/cm之间或5mS/cm和7mS/cm之间中的任一。在一些实施方案中,电导率是约4mS/cm、4.5mS/cm、5.0mS/cm、5.5mS/cm、6.0mS/cm、6.5mS/cm、7.0mS/cm、7.5mS/cm、8.0mS/cm、8.5mS/cm、9.0mS/cm、9.5mS/cm或10mS/cm中的任一。在一个方面,电导率是装载缓冲液、平衡缓冲液和/或洗涤缓冲液的电导率。在一些实施方案中,装载缓冲液、平衡缓冲液和洗涤缓冲液中的一种或多种的电导率是相同的。在一些实施方案中,装载缓冲液的电导率不同于洗涤缓冲液和/或平衡缓冲液的电导率。在一些实施方案中,在具有约5.5mS/cm的电导率的缓冲液中,将组合物装载到混合模式层析材料上。在一些实施方案中,多肽是抗体或其片段。在一些实施方案中,洗脱缓冲液具有小于装载缓冲液的电导率的电导率。在本文所述的任何方法的一些实施方案中,洗脱缓冲液具有小于约0.0mS/cm、0.5mS/cm、1.0mS/cm、1.5mS/cm、2.0mS/cm、2.5mS/cm、3.0mS/cm、3.5mS/cm、4.0mS/cm、4.5mS/cm、5.0mS/cm、5.5mS/cm、6.0mS/cm、6.5mS/cm或7.0mS/cm中的任一的电导率。电导率可以在约0mS/cm和7mS/cm之间、1mS/cm和7mS/cm之间、2mS/cm和7mS/cm之间、3mS/cm和7mS/cm之间或4mS/cm和7mS/cm之间、0mS/cm和5.0mS/cm之间、1mS/cm和5mS/cm之间、2mS/cm和5mS/cm之间、3mS/cm和5mS/cm之间或4mS/cm和5mS/cm之间中的任一。在一些实施方案中,洗脱缓冲液的电导率是约0.0mS/cm、0.5mS/cm、1.0mS/cm、1.5mS/cm、2.0mS/cm、2.5mS/cm、3.0mS/cm、3.5mS/cm、4mS/cm、4.5mS/cm、5.0mS/cm、5.5mS/cm、6.0mS/cm、6.5mS/cm或7.0mS/cm中的任一。在一些实施方案中,上述洗脱缓冲液用于混合模式OEC、阴离子交换OEC、阳离子交换OEC、亲和OEC或HICOEC。在一些实施方案中,洗脱缓冲液具有大于装载缓冲液的电导率的电导率。在本文所述的任何方法的一些实施方案中,洗脱缓冲液具有大于约5.5mS/cm、6.0mS/cm、6.5mS/cm、7.0mS/cm、7.5mS/cm、8.0mS/cm、8.5mS/cm、9.0mS/cm、9.5mS/cm、10mS/cm、11mS/cm、12mS/cm、13mS/cm、14mS/cm、15mS/cm、16mS/cm、17.0mS/cm、18.0mS/cm、19.0mS/cm、20.0mS/cm、21.0mS/cm、22.0mS/cm、23.0mS/cm、24.0mS/cm或25.0mS/cm中的任一的电导率。电导率可以在约5.5mS/cm和17mS/cm之间、6.0mS/cm和17mS/cm之间、7mS/cm和17mS/cm之间、8mS/cm和17mS/cm之间、9mS/cm和17mS/cm之间或10mS/cm和17m...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1