用于铬络合物的含有磷环的配体和由其得到的烯烃低聚催化剂的制作方法
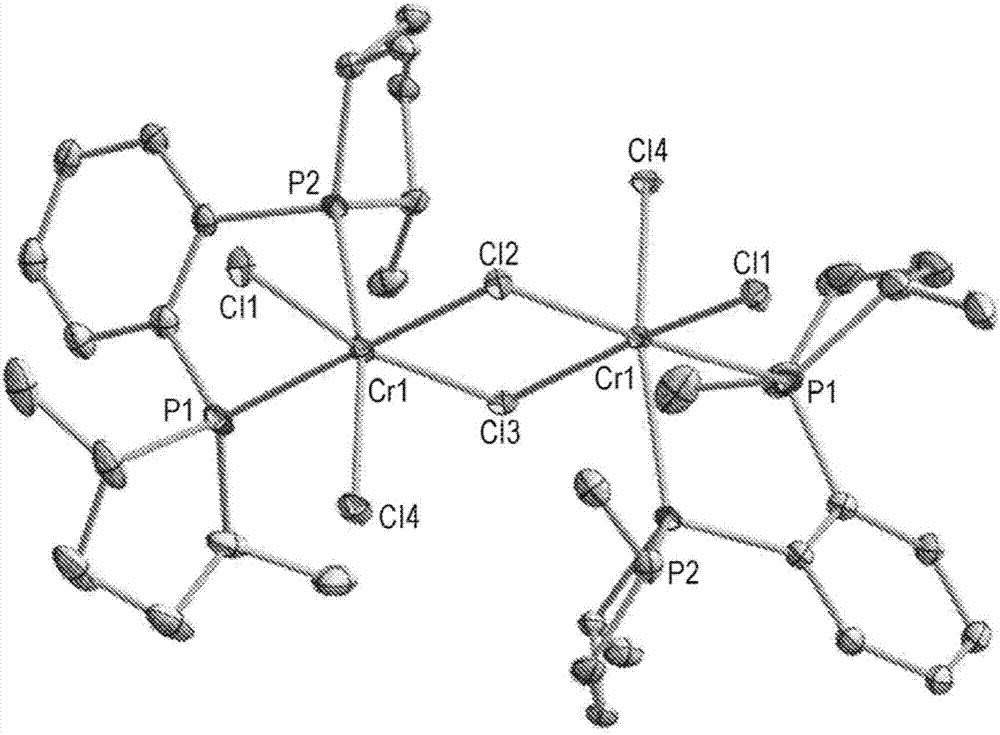
本发明涉及使用包含a)铬源、b)一种或多种活化剂以及c)含有磷环的配位化合物的催化剂系统,使如乙烯的烯烃低聚成更高级烯烃,如1-己烯与1-辛烯的混合物。另外,本发明涉及一种含有磷环的配位化合物和一种用于制备所述化合物的方法。已公开用于烯烃低聚中的催化剂系统的配位化合物的极大改进。然而,在高温条件下,催化剂效率、催化剂选择率、形成聚合物副产物和催化剂去活化仍成问题。将有利的是,发现催化剂系统能够以更高催化剂效率、更高催化剂选择率和较少聚合物副产物形成产生烯烃低聚物。据相信,c10+低聚物的形成速率涉及进行低聚的反应器中存在的1-己烯和/或1-辛烯的浓度,如美国专利申请公开案2015-0284303中所公开。使反应器中的1-己烯和1-辛烯的浓度最大化的此类反应已提供不佳产物选择率。具体来说,已在提供更高浓度的1-己烯和/或1-辛烯的条件下观测到产生更大量的c10+低聚物。铬桥连二膦催化剂的性能典型地为温度相关的。先前技术一般公开50到150℃,尤其60到90℃的优选操作温度。在此温度范围下,已报导极高活性(每小时每克催化剂超过2×106克产物)。然而,简单分批实验已显示,导致反应器中高浓度的1-己烯和1-辛烯的此较高活性也与产物选择率降低相关,具体来说,已观测到产生更高量的c10+低聚物。分批实验已显示,可通过降低反应温度改进产物选择率,但较低低聚温度不“足以”使c10+级分减到最少。如适用于乙烯的四聚,在wo2013168102中已教示具有二氧基磷无环基团的二膦配体。出人意料地,已发现,基于某些磷无环配位化合物的催化剂系统合乎需要地提供减少的聚合物形成,且在许多情况下,改进的催化剂效率和选择率。技术实现要素:本发明提供一种用于选择性地低聚烯烃的方法,其包含在足以将至少一种烯烃的至少一部分转化成至少一种烯烃的至少一种低聚物的烯烃低聚条件下,使至少一种烯烃与催化剂系统接触,所述催化剂系统包含:a)铬源、b)一种或多种活化剂以及c)表示为以下的至少一种含有磷环的配位化合物r1r2p-y-x1r3(r4)m:其中:p为磷;x1选自氮、磷、氧或硫;r1和r2中的每一个独立地为经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或具有一到50个非氢原子的经取代或未经取代的杂原子基团;m为0或1;r1和r2连接在一起形成表示为的二价部分,其与p一起形成含有3到10个环原子的环状结构(磷环);r3和r4中的每一个独立地为氢、卤素、经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或具有一到50个非氢原子的经取代或未经取代的杂原子基团;r3和r4任选地连接在一起形成表示为的二价部分,其中键的任选的特征通过虚线连接描绘,其与x1一起形成含有3到10个环原子的环状结构;y任选地与r1、r2、r3或r4中的一个或多个连接在一起形成含有4到10个环原子的环状结构,如以下所表示:其中键的任选的特征通过虚线连接描绘,其为含有一到50个非氢原子的p与x1之间的二价连接基团[l(r5)q]p;[l(r5)q]p由以下表示:其中每一l独立地选自由以下组成的群组:硼、碳、硅、锗、氮、磷、氧和硫;p为1到6,优选1到4的整数数字;r5独立地为氢、卤素、经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或经取代或未经取代的杂原子基团;q为0、1或2;限制条件为二价连接基团[l(r5)q]p的[l]p子单元不包含脒基(n-c=n);其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;又另外,优选地,限制条件为包含p或x1,优选包含p、r1和r2或包含x1、r3和r4的一个或两个磷环在磷环的环部分内不含有p-n、p-o或p-s键;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;两到十个,优选两到六个独立选择的配位化合物可任选地经由其各别独立选择的y、r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物)物质。优选地,至少一个,优选两个磷环不含有超过一个每一磷环中的碳-碳不饱和键,优选不超过一个每一磷环中的不饱和键。本发明的另一实施例提供用于低聚烯烃的催化剂系统,所述催化剂系统包含如本文所描述的a)铬源、b)一种或多种活化剂和c)至少一种含有磷环的配位化合物。本发明的另一实施例提供一种产生用于低聚烯烃的催化剂系统的方法,所述催化剂系统包含:如本文所描述的a)铬源、b)一种或多种活化剂以及c)至少一种含有磷环的配位化合物。本发明的另一实施例提供包含如本文所描述的a)铬源和b)含有磷环的配位化合物的含有磷环的配位化合物-铬络合物。本发明的另一实施例提供一种产生包含如本文所描述的a)铬源和b)含有磷环的配位化合物的含有磷环的配位化合物-铬络合物的方法。本发明的另一实施例提供如本文所描述的含有磷环的配位化合物。本发明的另一实施例提供一种产生如本文所描述的含有磷环的配位化合物的方法。本发明的另一实施例提供用于低聚烯烃的催化剂系统,所述催化剂系统包含如本文所描述的a)铬源、b)一种或多种活化剂和c)至少一种聚(配位化合物)物质。本发明的另一实施例提供一种产生用于低聚烯烃的催化剂系统的方法,所述催化剂系统包含如本文所描述的a)铬源、b)一种或多种活化剂以及c)至少一种聚(配位化合物)物质。本发明的另一实施例提供包含如本文所描述的a)铬源和b)聚(配位化合物)物质的聚(配位化合物-铬络合物)物质。本发明的另一实施例提供一种产生包含如本文所描述的a)铬源和b)聚(配位化合物)物质的聚(配位化合物-铬络合物)物质的方法。本发明的另一实施例提供如本文所描述的聚(配位化合物)物质。本发明的另一实施例提供一种产生如本文所描述的聚(配位化合物)物质的方法。附图说明图1.三氯[1,2-双[(2s,5s)-2,5-二甲基磷烷]苯](四氢呋喃)铬的晶体结构(3),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。图1.二-μ2-氯四氯二[[1,2-双[(2s,5s)-2,5-二甲基磷烷]苯]]二铬的晶体结构(4),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。图2.三氯[1,2-双[(2r,5r)-2,5-二乙基磷烷]苯](四氢呋喃)铬的晶体结构(6),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。图3.三氯[1,2-双[(2s,5s)-2,5-二-(1-甲基乙基)磷烷]苯](四氢呋喃)铬的晶体结构(8),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。图4.三氯[1,2-双[(2r,5r)-2,5-二乙基磷烷]乙烷](四氢呋喃)铬的晶体结构(12),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。图5.三氯[n,n-双(二苯基膦基)-n-异丙胺](四氢呋喃)铬*甲苯的晶体结构(14),以50%热椭圆体机率绘制。为了清楚起见省略氢原子和溶剂合物甲苯分子。碳原子由灰色热椭圆体表示。图6.(2s,5s)-n-丁基-n-(2,5-二苯基磷烷-1-基)-n-二苯基膦基胺的晶体结构(17),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。图8.二-μ2-氯四氯二[(2s,5s)-n-丁基-n-(2,5-二苯基磷烷-1-基)-n-二苯基膦基酰胺]二铬的晶体结构(19),以50%热椭圆体机率绘制。为了清楚起见省略氢原子。碳原子由灰色热椭圆体表示。具体实施方式一般定义如本文所使用,“环原子”意指与至少两种其它原子一起形成环或环状结构的原子。如本文所使用,术语“烃衍生物”,例如烃衍生物、经取代的烃衍生物、含有烃衍生物是指仅由碳和氢组成的化合物的群组。确切地说,“烃衍生物”是指由以下组成的群组:烃基、亚烃基、烃叉基和次烃基,术语“烃基”、“亚烃基”、“烃叉基”和“次烃基”与iupac(国际纯粹与应用化学联合会(internationalunionofpureandappliedchemistry))所确定具有相同的含义:烃基为通过从烃去除氢原子形成的单价基团,例如甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、环戊基、环己基、环己基甲基、苯基、苯甲基、萘基。亚烃基为通过从烃去除两个氢原子形成的二价基团,其自由价键不形成双键,例如1,2-亚苯基、-ch2ch2ch2-(丙烷-1,3-二基)、-ch2-(亚甲基)、c6h3c6h5(5-苯基-1,3-亚苯基二基)。烃叉基为通过从烃的相同碳原子去除两个氢原子形成的二价基团,其自由价键不形成双键,例如ch3ch=(亚乙基)、c6h5ch=(苯亚甲基)。次烃基为通过从烃的相同碳原子去除三个氢原子形成的三价基团,其自由价键不形成三键,例如ch3ch2c≡(次丙基)、c6h5c≡(苯次甲基)。如本文所使用的术语“烃衍生物”是指含有1到50个碳原子,优选1到30个碳原子,更优选1到20个碳原子,最优选1到16个碳原子的烃衍生物自由基,包括支链或非支链、环状或非环状、饱和或不饱和物质,如烷基、烯基、炔基、芳基、芳基烷基、环烷基、烷二基、亚烷二基、亚烷基等。如本文所使用,术语“杂烃衍生物”,例如杂烃衍生物、经取代的杂烃衍生物、含有杂烃衍生物是指如上文所定义的烃衍生物,其中烃衍生物中的至少一个碳原子且任选地其连接的氢原子经至少一个杂原子置换。确切地说,“杂烃衍生物”是指由以下组成的群组:杂烃基、杂亚烃基、杂烃叉基和杂次烃基,术语“杂烃基”、“杂亚烃基”、“杂烃叉基”和“杂次烃基”具有与如上文针对各别烃衍生物所定义相同的含义,例如烃基、亚烃基、烃叉基和次烃基,其中烃衍生物中的至少一个碳原子且任选地其连接的氢原子经至少一个杂原子置换。杂烃基为通过从烃基去除至少一个碳原子且任选地其连接的氢原子且用至少一个杂原子置换其形成的单价基团,例如ch3o-(甲氧基)、cf3-(三氟甲基)、ch3ch2nh-(乙基氨基)、(ch3ch2)2nc6h4-(二甲氨基苯基)、c6h5oc6h4ch2-(苯氧基苄基)、ch3och2ch2och2-(甲氧基乙氧基甲基)、c5h4n-(吡啶基)。杂亚烃基为通过从亚烃基去除至少一个碳原子且任选地其连接的氢原子且用至少一个杂原子置换其形成的二价基团,所述杂亚烃基的自由价键不形成双键,例如-ch2ch2n(ch3)ch2ch2-(甲基氨基二-(2,1-乙烷)二基)、-ch2ch2och2ch2-(氧基二-(2,1-乙烷)二基)、-ch2ch2ch2ch2o-(4-丁烷基-1-氧基)、-och2ch2o-(1,2-乙二基双(氧基))、-ch2ch(cf3)ch2-(2-三氟甲基-1,3-丙烷二基)、-ch2coch2ch2-(2-氧代-1,4-丁二基)。杂烃叉基为通过从烃叉基去除至少一个碳原子且任选地其连接的氢原子且用至少一个杂原子置换其形成的二价基团,所述杂烃叉基的自由价键形成双键,例如ch3och2ch=(甲氧基亚乙基)、c6h3cl2ch=(二氯苯亚甲基)、(ch3)2nch=(二甲基氨基亚甲基)、c6h5ch2n=(苯甲基亚胺)。杂次烃基为通过从次烃基去除至少一个碳原子且任选地其连接的氢原子且用至少一个杂原子置换其形成的三价基团,所述杂次烃基的自由价键形成三键,例如ch3och2c≡(2-甲氧基次乙基)、(ch3)2nc6h4c≡(二甲基氨基苯次甲基)。更一般来说,修饰语“杂”和“含有杂原子”,例如“杂烷基”、“杂芳基”、“杂烃衍生物”、“含有杂原子的烃基”是指其中一个或多个碳原子且任选地其连接的氢原子经杂原子置换的分子或分子片段。因此,举例来说,术语“杂烷基”是指含有杂原子的烷基取代基。当术语“含有杂原子”引出可能的含有杂原子的基团的清单时,意味着所述术语适用于所述基团的每一成件。即,短语“含有杂原子的烷基、烯基、炔基、芳基和芳基烷基”可理解为“含有杂原子的烷基、含有杂原子的烯基、含有杂原子的炔基、含有杂原子的芳基和含有杂原子的芳基烷基”。杂烃衍生物的自由价键可存在于杂原子上,如在甲氧基(ch3o-)、二乙氨基((ch3ch2)2n-)或丁硫基(ch3ch2ch2ch2s-)中,或其可存在于碳原子上,如在n,n-二甲氨基乙基((ch3)2nch2ch2-)、吡啶基甲基(c5h4nch2-)或甲氧基乙基(ch3och2ch2-)中。如本文所使用的术语“杂烃衍生物”是指含有1到50个碳原子,优选1到30个碳原子,更优选1到20个碳原子,最优选1到16个碳原子的杂烃衍生物自由基,包括支链或非支链、环状或非环状、饱和或不饱和物质,例如杂烃基、杂烷基、杂烯基和杂芳基。术语“杂原子基团”是指包含至少一个杂原子且不包含碳原子的原子或分子片段,例如硝基(-no2)、侧氧基(=o)和磺酸基(-so3h)。杂原子基团含有1到40个原子,优选1到10个原子,更优选1到6个原子。如本文所使用,杂原子可选自由以下组成的群组:b、si、ge、n、p、as、sb、bi、o、s、se、f、cl、br、i和过渡金属,优选选自由以下组成的群组:b、si、ge、n、p、o、s、se、f、cl、br、i和过渡金属。如本文所使用,除非尤其陈述另一种类型的取代,如“经烷基取代的”或“经芳基取代的”,否则术语“经取代的”,例如“经取代的烃衍生物”、“经取代的杂烃衍生物”、“经取代的烃基”、“经取代的杂烃基”、“经取代的芳基”、“经取代的芳基烷基”、“经取代的烷基”意指在相关基团(例如烃衍生物、杂烃衍生物、烃基、杂烃基、芳基、芳基烷基、烷基或术语“经取代的”之后的其它部分)中,键结到碳原子或杂原子的至少一个氢原子经一个或多个杂原子置换。当术语“经取代的”引出可能经取代的基团的清单时,意味着所述术语适用于所述基团中的每一成员。即,短语“经取代的烷基、烯基、炔基、芳基和芳基烷基”可理解为“经取代的烷基、经取代的烯基、经取代的炔基、经取代的芳基和经取代的芳基烷基”。类似地,“任选地经取代的烷基、烯基、炔基、芳基烷基”可理解为“任选地经取代的烷基、任选地经取代的烯基、任选地经取代的炔基和任选地经取代的芳基烷基”。“经取代的烃衍生物”和“杂烃衍生物”的定义方面存在一些重叠。举例来说,‘2-氟乙基’为经一个氟原子取代的‘乙基’烃衍生物。同时,其可归类为通过获取丙基(ch3ch2ch2)且用氟杂原子置换甲基(ch3)碳和其连接的氢原子形成的杂烃衍生物。在任一情况下,所属领域的技术人员将清楚任一分类为可操作的。在另一实例中,‘吡啶基甲基’为经吡啶基取代的‘甲基’烃衍生物。同时,其可归类为通过获取苯甲基(c6h5ch2)且用氮杂原子置换环碳和其连接的氢原子中的一个形成的杂烃衍生物。在任一情况下,所属领域的技术人员将清楚任一分类为可操作的。如本文所使用的术语“烷基”是指典型地,但不一定含有1到50个碳原子,更优选1到25个碳原子,最优选1到16个碳原子,例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基、辛基、癸基以及环烷基,例如环丙基、环丁基、环戊基、环己基、环戊基甲基和环己基乙基的支链或非支链、环状或非环状饱和烃基。如本文所使用的术语“烯基”是指含有至少一个双键且典型地,但不一定含有2到50个碳原子,更优选2到25个碳原子,最优选2到16个碳原子,例如乙烯基、正丙烯基、异丙烯基、正丁烯基、异丁烯基、4-辛烯基、2-癸烯基、环戊烯基环戊二烯基、环己烯基和环己二烯基的支链或非支链、环状或非环状烃基。如本文所使用的术语“烯烃”是指具有一个或多个碳-碳双键(除芳香族化合物中的缩甲醛外)且典型地,但不一定含有2到50个碳原子,更优选2到25个碳原子,最优选2到16个碳原子的支链或非支链非环状或环状烃,例如乙烯(ethene或ethylene)、丙烯(propene或propylene)、1-丁烯、2-丁烯、异丁烯、1-己烯、3-己烯、1-辛烯、2-癸烯、环戊烯、环戊二烯、环己烯和环己二烯。如本文所使用的术语“α-烯烃”是指具有封端双键和典型地,但不一定含有2到50个碳原子,更优选2到25个碳原子,最优选2到16个碳原子的烯烃,例如乙烯、丙烯、1-丁烯、1-戊烯、1-己烯、1-庚烯、1-辛烯和1-癸烯。如本文所使用的术语“炔基”是指含有至少一个三键且典型地,但不一定含有2到50个碳原子,更优选2到25个碳原子,最优选2到16个碳原子的支链或非支链、环状或非环状烃基,例如乙炔基、正丙炔基、异丙炔基、正-2-丁炔基、异丁炔基、辛炔基、3-癸炔基、环辛炔基。术语“芳香族”以其常见意义使用,包括横跨围绕环的若干键基本上离域的不饱和。如本文所使用的术语“芳香族”是指典型地,但不一定含有2到50个碳原子,优选2到25个碳原子,更优选2到16个碳原子的含有芳香族环或环系统的基团。典型的中性未经取代的芳香族化合物包括苯、萘、蒽、菲、吡啶、吡嗪、咪唑、吡唑、噁唑、噻吩、吡咯、三唑、吲哚和苯并咪唑。典型的带电未经取代的芳香族化合物包括环丙烯基阳离子和环戊二烯基阴离子。如本文所使用的术语“芳基”是指典型地,但不一定含有2到50个碳原子,优选2到25个碳原子,更优选2到16个碳原子的含有芳香族环或环系统的基团。本文中的芳基包括含有稠合在一起、共价连接或连接到共同基团(如亚甲基或亚乙基部分)的单一芳香族环或多个芳香族环的基团。更特定芳基含有一个芳香族环或两个或三个稠合或连接的芳香族环,例如苯基、萘基、联二苯、联三苯、蒽基、菲基、吡啶基、吡嗪基、咪唑基、吡唑基、噁唑基、噻吩基、吡咯基、三唑基、吲哚基和苯并咪唑基。芳基可为未经取代的或可经以下取代:卤素,优选氟、氯或溴,更优选氟或溴,甚至更优选氟;烃基,如烷基、烯基或炔基、杂烃基;或杂原子基团。在特定实施例中,芳基取代基(芳基上的取代基)包括1到40个除氢外的原子,优选1到20个除氢外的原子,且更优选1到10个除氢外的原子。经取代的芳基包括甲苯基(甲基苯基)、二甲苯基(二甲基苯基)、均三甲苯基(三甲基苯基)、乙基苯基、苯乙烯基、烯丙基苯基、丙炔基苯基、氯苯基、氟苯基、二氟苯基、三氟苯基、四氟苯基、五氟苯基、五氟联二苯、甲氧基苯基、乙氧基苯基、二甲氧基苯基、三氟甲基苯基、双(三氟甲基)苯基、二甲基氨基苯基、二甲基氨基乙基苯基、苯氧基苯基、甲基羧基苯基、乙基羧基苯基、甲氧基萘基、硝基苯基、二硝基苯基、氰基苯基、二氰基苯基、氯吡啶基、甲基咪唑基、苯基吡咯基和乙基噻吩基。如本文所使用的术语“芳基烷基”是指经取代的烷基、如上文所定义的烷基,其中取代基为一种或多种芳基的典型地,但不一定含有2到50个碳原子,更优选2到25个碳原子,最优选2到16个碳原子,例如苯甲基、甲苯基甲基、二甲苯基乙基、萘甲基、蒽甲基、1-苯乙基、2-苯乙基、二苯甲基、2,2-二苯基乙基、苯丁基、氟苯甲基、二氟苯甲基、三氟苯甲基、氯苯甲基、二氯苯甲基、三氯苯甲基、二甲氨基苯甲基、吡啶基甲基、二苯基丙基、甲氧基苯甲基和二硝基苯基乙基。“二价”,例如“二价烃衍生物”、“二价杂烃衍生物”、“二价部分”、“二价连接基团”、“二价基团”、“二价烃基”、“二价杂烃基”、“二价杂原子基团”、“二价烷基”、“二价芳基”、“二价芳基烷基”意指烃衍生物、杂烃衍生物、部分、连接基团、基团、烃基、杂烃基、杂原子基团、烷基、芳基、芳基烷基或其它部分在两个点(‘二基’)处键结到原子、分子或部分,其中两个键结点为共价单键,或替代地,在一个点(‘次基’)处键结到原子、分子或部分,其中键结点为共价双键。含有磷环的配位化合物在本发明的一个实施例中,本发明包含含有磷环的配位化合物(“配位化合物”)。配位化合物可适用于金属的配位、螯合和隔离且作为适用于如乙烯的烯烃的催化,尤其氢甲酰化、异构化、氢化、聚合工艺,尤其低聚的形成配位化合物-金属络合物过程中的前体。配位化合物可由以下表示:其中p为磷;x1选自氮、磷、氧或硫,优选氮或磷,更优选磷;m为0或1;每一l独立地选自硼、碳、硅、锗、氮、磷、氧或硫,优选碳、氮、磷、氧或硫,更优选碳或氮;r1和r2各自独立地选自经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或经取代或未经取代的杂原子基团;r1、p和r2一起形成磷环;当r3、r4和x1连接在一起时,其在x1为磷时形成磷环且在x1为氮时其形成氮杂环;两个或更多个r1、r2、r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构,其中键的任选的特征通过虚线连接描绘;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物)物质。r3、r4和r5各自独立地选自氢、卤素、经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或经取代或未经取代的杂原子基团;p为1到6,优选1到4,更优选1到3,最优选1到2的整数;q为0、1或2;限制条件为二价连接基团的[l]p子单元不包含脒基(n-c=n);其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;又另外,优选限制条件为包含p或x1,优选包含p、r1和r2或包含x1、r3和r4的一个或两个磷环在磷环的环部分内不含有p-n、p-o或p-s键。优选地,至少一个,优选两个磷环不含有超过一个每一磷环中的碳-碳不饱和键,优选不超过一个每一磷环中的不饱和键。磷环或氮杂环为分别在环(ring或cycle)中包含至少一个磷或氮原子的环或环状化合物。每一r1和r2独立地含有1到50个非氢原子;每一r3、r4和r5独立地含有0到50个非氢原子;优选地,每一r5独立地含有0到40个非氢原子,更优选0到20个非氢原子,且最优选0到12个非氢原子;任选地,至少一个r5基团为经由双键键结到l的二价基团。优选地,配位化合物由以下表示其中q为0、1或2;p为1、2、3或4;t为0、1、2、3或4;v为0、1、2、3或4;m为0或1;l、r3、r4、r5和x1如上文所定义;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。优选地,x1为氮或磷;p=1、2、3或4;q=0、1或2;v和t各自独立地为1、2、3或4;r5各自独立地为氢;卤素;c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子的杂原子基团;r3和r4各自独立地为c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子,更优选一个原子的杂原子基团;当x1和其两个连接的r3和r4基团形成表示为的环时,所述环在x1为氮时为氮杂环且在x1为磷时为磷环;p和其两个连接的r1和r2基团形成表示为的磷环。优选地,磷环或氮杂环的l原子各自独立地为碳、氮或氧;[l(r5)q]p如上文所定义。优选地,直接连接到磷环的磷的磷环的所有l原子为碳;[l(r5)q]p如上文所定义。正如所属领域的技术人员所知,当碳原子连接到四种不同类型的原子或原子基团时,碳原子为手性的,因此当环碳原子连接到四种不同类型的原子或原子基团时,即,当其两个连接的r5基团和其两个连接的环取代基彼此不同时,4到7元磷环或氮杂环中的每一环碳原子分别为手性的。手性原子周围的构型被视为s或r且取决于原子或连接到所述原子的原子基团的布置。在t和v各自独立地为1、2、3或4的情况下,l为碳或氮;且磷环或氮杂环的至少一个l原子为碳,为4元、5元、6元和7元环中的每一个中的碳的至少一个l潜在地为手性的。如果环含有手性碳原子,那么环自身可或可不为手性的;正如所属领域的技术人员所知,此取决于对称性。本发明的磷环或氮杂环的构型可能性为:a)无环的碳原子为手性的且环不视为手性的;b)环的碳原子中的至少一个为手性的,即,r构型或s构型和对应环视为具有每一手性碳的r或s构型。在环中的恰好一个碳原子为手性的情况下,碳可具有r构型或s构型且环的构型分别被视为r或s。在环中的恰好两个碳原子为手性的情况下,碳原子具有r,r;r,s;s,r;或s,s构型,且环的构型可能性被视为r,r;r,s;s,r;或s,s。在环中的恰好三个碳原子为手性的情况下,碳原子可具有r,r,r;r,r,s;r,s,r;s,r,r;r,s,s;s,r,s;s,s,r;或s,s,s构型,且环的构型可能性被视为r,r,r;r,r,s;r,s,r;s,r,r;r,s,s;s,r,s;s,s,r;以及s,s,s。所属领域的技术人员将认识到如何测定原子的r和s构型和具有四个、五个、六个或更多个手性碳原子的环的构型可能性。除了r和s指定符指示特定碳原子的构型之外,数值指定符也可用于指示特定碳原子的环中的位置。按照定则,连接到y或代表y的[l(r5)q]p基团的各别磷环或氮杂环的磷原子或氮原子被视为在1位处。举例来说,在以下具有名称(2r,5s)-2-甲基-5-苯基已内磷酰氧基的六元磷环中:p在1位处,在2位处具有连接的甲基的碳原子具有如2r所指示的r构型,同时在5位处具有连接的苯基的碳原子具有如5s所指示的s构型。磷环的磷原子为潜在手性的,其中电子的孤电子对为对于反转来说相对稳定的,且因此,计数为磷原子上四个取代基中的一个。配位化合物、配位化合物-铬络合物和催化剂系统的磷原子的r、s和非手性构型为本发明的实施例,但在本申请中,磷原子将不给出特定r和s构型指定。上述r和s构型指定符以及上文所描述的数值指定符称述本发明的磷环或氮杂环中的所选原子的构型和位置。所有可能的r和s对映异构体被视为本发明的目标,包括构型不为已知时的情况。除非另外如此指定特定r或s构型名称,例如以名称或标题形式,似乎向原子输入特定立体定向的任何图式将认为表示所有可能的立体定向且配位化合物、配位化合物-铬络合物和催化剂系统的任何和所有r或s构型对映异构体或立体异构体被视为本发明的实施例。举例来说,在描述配位化合物的以下片段时,在2位处具有连接的甲基的碳原子指定具有r构型且在5位处具有连接的苯基的碳原子指定具有s构型且因此片段具有(2r,5s)构型,同时描绘相同片段:其不尤其以r或s描述词指定2和5位处的构型,且视为意指构型未指定且意指片段的所有可能的构型,即,(2r,5r)、(2r,5s)、(2s,5r)和(2s,5s)。优选的配位化合物由以下表示:其中独立选择的磷环或氮杂环的[l(r5)q]为c(r5)、o、n、n(r5)或c(r5)2;[l(r5)q]p如上文所定义;q为0、1或2;p为1、2、3或4;t为1、2、3或4;v为1、2、3或4;m为0或1,x1为氮、磷或氧,优选氮或磷,更优选磷;r5各自独立地为氢;卤素;c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子的杂原子基团;r3和r4各自独立地为c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子,更优选一个原子的杂原子基团;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。更优选地,p=1或2。更优选地,直接连接到磷环的磷的磷环的所有[l(r5)q]基团独立地为c(r5)或c(r5)2。配位化合物中的4元、5元、6元和7元磷环或氮杂环中的每一个中的手性环原子的数目(不包括连接到[l(r5)q]p的p或x1)可在零(无)到比每一环中的环原子的数目少一个范围内。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的任一个中无碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中仅一个碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中仅一个碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少一个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少一个为手性的。在一些实施例中,4元、5元、6元和7元磷环或氮杂环中的任一个中的碳原子中的至少两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中恰好两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的任一个中恰好两个碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的任一个中的碳原子中的至少三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中恰好三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中恰好三个碳原子为手性的。在一些实施例中,5元、6元和7元磷环或氮杂环中的任一个中的碳原子中的至少四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中恰好四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的每一个中恰好四个碳原子为手性的。配位化合物可或可不为光学活性的。优选地,当配位化合物仅含有一个4元、5元、6元和7元磷环且不含有连接到[l(r5)q]p的氮杂环时,连接到磷环(其连接到[l(r5)q]p)中的p原子的磷环中的一个,优选两个l原子为碳,且这些l原子中的一个,更优选两个为手性的。优选地,当配位化合物含有两个连接到[l(r5)q]p的4元、5元、6元和7元磷环或氮杂环时,连接到磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的磷环或氮杂环中的一到四个l原子为碳原子,且这些l原子中的一个,优选两个,更优选三个,最优选四个为手性的。在一些实施例中,本发明的4元、5元、6元和7元磷环或氮杂环中无一者为手性的,优选一个或多个4元环在2和4位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型;一个或多个5元环在2和5位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型;一个或多个6元环在2和6位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型;且一个或多个7元环在2和7位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型。优选地,一个,更优选两个4元、5元、6元和7元磷环或氮杂环在每一环中具有恰好两个手性碳原子。配位化合物可包含单一异构体或各种异构体,包括立体异构体的混合物,无论构型、构形、几何或光学为何。包含外消旋、对映体增浓或对映异构纯的手性配位化合物的配位化合物的混合物为优选的。仅具有一个4元、5元、6元和7元磷环且不具有氮杂环且其中磷环具有两个手性碳的配位化合物可具有以下构型异构体:r,r;r,s;s,r;以及s,s。在本发明的一个实施例中,配位化合物为实质上包含任何比例的单一配位化合物的r,s和s,r异构体的配位化合物的混合物,更优选配位化合物为实质上包含任何比例的单一配位化合物的r,r和s,s异构体的配位化合物的混合物。当配位化合物具有一个4元、5元、6元或7元磷环和一个额外4元、5元、6元或7元磷环或氮杂环(其中每一环具有两个手性碳)时,所述配位化合物可具有以下构型异构体:r,r,r,r;r,r,r,s;r,r,s,r;r,s,r,r;s,r,r,r;r,r,s,s;r,s,r,s;s,r,r,s;r,s,s,r;s,r,s,r;s,s,r,r;r,s,s,s;s,r,s,s;s,s,r,s;s,s,s,r;以及s,s,s,s;配位化合物的构型异构体为两个磷环和氮杂环的构型异构体的组合,各自具有r,r;r,s;s,r;以及s,s的构型选项;前述中的每一个为本发明的一个实施例。优选地,配位化合物的两个磷环或氮杂环具有同一构型,例如两者为r,r或r,s或s,r或s,s,从而配位化合物的优选的异构体构型为r,r,r,r;r,s,r,s;s,r,s,r;以及s,s,s,s。在本发明的一个优选实施例中,配位化合物为实质上包含任何比例的单一配位化合物的r,s,r,s和s,r,s,r异构体的混合物,更优选配位化合物为实质上包含任何比例的单一配位化合物的r,r,r,r和s,s,s,s异构体的混合物。优选地,独立选择的磷环或氮杂环的[l(r5)q]为c(r5)、n、n(r5)或c(r5)2;x1为磷或氮;t和v各自独立地为1、2、3或4。优选地,每一4元、5元、6元和7元磷环或氮杂环的一个到六个[l(r5)q]基团为c(r5)或c(r5)2,更优选c(r5)2。优选地,每一磷环或氮杂环的至少一个,更优选两个,甚至更优选三个,更优选四个[l(r5)q]基团为c(r5)2。每一磷环或氮杂环的优选至少一个,更优选两个[l(r5)q]基团为c(r5)。至少一个磷环或氮杂环的优选一个,更优选两个c(r5)或c(r5)2基团连接到磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子。连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的一个,更优选两个c(r5)2基团的优选两个r5基团为相同的;更优选其为不相同的。优选地,连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的至少一个,优选两个c(r5)或c(r5)2基团的恰好一个r5基团为氢,更优选地,连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的至少一个,优选两个c(r5)或c(r5)2基团的恰好一个r5基团不为氢。优选地,连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的两个c(r5)或c(r5)2基团彼此相同。更优选地,两个c(r5)q基团连接到每一磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子。更优选地,磷环或氮杂环(其直接连接到每一磷环或氮杂环中的p或n原子)的所有[l(r5)q]基团独立地为如以下所表示的c(r5)q:和其对映异构体,其中c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h;x1为磷或氮;优选地,连接到每一磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的c(r5)h基团的r5基团不为氢,且其中,如上文所提及,r构型和s构型两者意指c(r5)h;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。优选地,连接到磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的两个c(r5)h基团相同。优选地,连接到磷环(其连接到[l(r5)q]p)中的p原子的两个c(r5)h基团具有相同r或s构型。优选地,当x1为p原子且x1、r3和r4形成磷环时,磷环与p、r1和r2形成的磷环相同。优选地,磷环或氮杂环的l原子独立地为碳或氮。优选地,每一磷环或氮杂环中的至少两个l原子为碳。优选地。t和v各自独立地为1、2或3,优选1或2。优选地,t和v中的至少一个为2,更优选t为2。在优选实施例中,t为2;且磷环中的至少一个,优选两个l为碳。在优选实施例中,t为2;且磷环中的至少一个,优选两个l为氮。在优选实施例中,v为2;且包含x1的环中的至少一个,优选两个l为碳。在优选实施例中,v为2;且包含x1的环中的至少一个,优选两个l为氮。更优选地,x1为磷。更优选地,t和v各自为2。更优选地,t和v各自为2且x1为磷。在优选实施例中,x1r3(r4)m的x1、r3和r4基团并不形成环,m为0或1,优选地,m为1;优选地,x1为氮,更优选地,x1为磷。在优选的配位化合物中,x1为磷且5元配位化合物由以下表示:其中q为1或2;优选地,磷环的l(r5)q为c(r5)、n(r5)或c(r5)2,优选地,[l(r5)q]p为c(r5)、n(r5)、c(r5)2、c(r5)c(r5)或c(r5)2c(r5)2,更优选n(r5)或c(r5)c(r5);连接到p的c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。优选地,至少一个,更优选两个磷环含有至少一个,优选两个[l(r5)q]基团,其各自为c(r5)或c(r5)2。至少一个磷环中的至多一个键为不饱和键,优选至少一个磷环中的所有键为饱和键。优选地,至少一个,优选两个5元磷环为饱和的,意指其不含有不饱和键。优选地,一个5元磷环为饱和的,且一个磷环,优选一个5元磷环具有两个不饱和键,优选恰好一个不饱和键。优选地,一个5元磷环具有恰好一个不饱和键,且一个磷环,优选一个5元磷环具有两个不饱和键,优选恰好一个不饱和键,更优选不具有不饱和键。优选地,不饱和键为碳-碳不饱和键。优选地,不饱和键为碳-氮不饱和键。饱和5元磷环已知为磷杂环戊烷(当除磷外的所有四个环原子为碳时);氮杂磷杂环戊烷(当除磷外的三个环原子为碳且一个环原子为氮时);二氮杂磷杂环戊烷(当除磷外的两个环原子为碳且除磷外的两个环原子为氮时)。具有恰好一个不饱和键的不饱和5元磷环已知为二氢磷杂环戊二烯(当除磷外的所有四个环原子为碳时);二氢氮杂磷杂环戊二烯(当除磷外的三个环原子为碳且一个l原子为氮时);二氢二氮杂磷杂环戊二烯(当除磷外的两个环原子为碳且除磷外的两个环原子为氮时)。具有两个不饱和键的不饱和5元磷环已知为磷杂环戊二烯。用于命名5元磷环的本文所使用的定则将磷放置在1位处,连接到磷的两个环原子在2和5位处,而未连接到磷的其余两个环原子在3和4位处。独立地选择配位化合物的优选的5元磷环,如以下所表示:和其对映异构体。可通过从上述独立地选择一个优选的5元磷环,将其连接到[l(r5)q]p二价连接基团的一个价键且将二价连接基团的其余自由价键连接到第二独立选择的磷环,优选上述优选的5元磷环或连接到x1r3r4(其中x1为磷或氮,优选磷)来建立优选的含有5元环磷环的配位化合物。优选的含有非5元环磷环的配位化合物的非限制性实例由以下表示:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r5基团连接在一起形成聚(配位化合物)物质。优选地,[l(r5)q]p二价连接基团为nr5、c(r5)、c(r5)c(r5)、c(r5)2或c(r5)2c(r5)2,优选n(r5)。优选的含有5元环磷环的配位化合物的非限制性实例由以下表示:和其对映异构体,其中两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。优选地,[l(r5)q]p二价连接基团为nr5、c(r5)、c(r5)c(r5)、c(r5)2或c(r5)2c(r5)2,优选n(r5)。优选地,连接到至少一个,优选两个磷环中的p原子的至少一个,优选两个c(r5)或c(r5)2基团中的恰好一个r5基团为氢。代表性(但非限制性)实例为:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。优选地,连接到5元磷环中的氮原子的任何r5基团不为氢,优选地,连接到5元磷环中的氮原子的任何r5基团为烃基,优选c1-4烷基、c6-10芳基或c7-10芳基烷基,更优选甲基、乙基、苯基、苯甲基或甲苯基;优选地,在5元磷环上在3和4位处连接到c(r5)或c(r5)2基团的环碳原子的r5基团为氢原子;优选连接到c(r5)基团的环碳原子中的至少一个的r5基团,其中c(r5)基团的环碳原子借助于不饱和键键结到另一环原子,优选碳-碳不饱和键为氢原子或稠合到磷环的芳香族环的部分。.代表性(但非限制性)实例为:和其对映异构体。优选地,至少一个,优选两个在5元磷环上在2和5位处连接到c(r5)或c(r5)2基团的环碳原子的r5基团独立地为烷基、经取代的烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,优选芳基或经取代的芳基;优选地,在5元磷环上,在每一2位处且在每一5位处连接到c(r5)或c(r5)2基团的环碳原子的恰好一个r5基团为烷基、经取代的烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,更优选芳基或经取代的芳基;优选在5元磷环上,在每一2位处且在每一5位处连接到任何c(r5)2基团的环碳原子的恰好一个r5基团独立地为氢、甲基、乙基、丙基、丁基或戊基,优选氢或甲基,更优选氢;优选地,r3和r4独立地为烷基、经取代的烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,更优选芳基或经取代的芳基;优选地,在5元磷环上,在每一2位处且在每一5位处连接到c(r5)或c(r5)2基团的环碳原子的恰好一个r5基团独立地为芳基或经取代的芳基,在5元磷环上,在每一2位处且在每一5位处连接到任何c(r5)2基团的环碳原子的恰好一个r5基团为氢,且r3和r4独立地为烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,更优选芳基或经取代的芳基。优选地,在5元磷环上,在2位和5位处的芳基、经取代的芳基、杂芳基或经取代的杂芳基为相同的。优选地,r3、r4和r5各自独立地为c1-40经取代或未经取代的烷基,优选c1-20经取代或未经取代的烷基,更优选c1-12经取代或未经取代的烷基;c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基;c2-40经取代或未经取代的芳基烷基,优选c2-20经取代或未经取代的芳基烷基,更优选c2-12经取代或未经取代的芳基烷基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基;优选地,当r5连接到5元环磷环的环氮原子时,r5独立地为c1-4烷基、c6-10芳基或c7-10芳基烷基;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。在优选实施例中,连接到5元环磷环的环氮原子的r3、r4和r5为ar,连接到5元环磷环的环氮原子的r5为ar',其中ar独立地为c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基;c2-40经取代或未经取代的芳基烷基,优选c2-20经取代或未经取代的芳基烷基,更优选c2-12经取代或未经取代的芳基烷基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基,且ar'独立地为c1-4烷基、c6-10芳基或c7-10芳基烷基。在优选的配位化合物中,磷环的l为碳且5元配位化合物由以下表示:其中q为1或2;优选地,[l(r5)q]p为c(r5)、n(r5)、c(r5)2、c(r5)c(r5)或c(r5)2c(r5)2,更优选n(r5)或c(r5)c(r5);连接到p的c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h。在优选的配位化合物中,二价连接基团的[l(r5)q]p为nr5且5元配位化合物由以下表示:其中q为1或2;连接到p的c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h。在优选的配位化合物中,在磷环的3和4位处的[l(r5)q]为ch2;在磷环的2和5位置处的[l(r5)q]为cr5h;二价连接基团的[l(r5)q]p为nr5,且5元配位化合物由以下表示:在优选的配位化合物中,在磷环的2和5位处的[l(r5)q]为cr5h;在2和5位处的碳原子为手性的;优选地,每一磷环中的2和5位处的两个碳原子具有相同r或s构型;二价连接基团的[l(r5)q]p为nr5;优选地,在磷环的3和4位处的[l(r5)q]为ch2,且5元配位化合物由以下表示:和其对映异构体。配位化合物的非限制性实例为:和其对映异构体。在优选的配位化合物中,在磷环的2和5位处的ar为任选地经r5取代的苯基;二价连接基团的[l(r5)q]p为nr5;优选地,在磷环的3和4位处的[l(r5)q]为ch2,且5元配位化合物由以下表示:和其对映异构体,其中独立选择的n为零到五,优选零到三的整数。优选地,ar独立地为c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基。优选地,ar独立地为苯基、经取代的苯基、呋喃基、经取代的呋喃基、噻吩基、经取代的噻吩基、吡咯基、经取代的吡咯基、吡啶基和经取代的吡啶基,更优选苯基、经取代的苯基和呋喃基。在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个ar、ar'或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的ar、ar'或r5基团连接在一起形成聚(配位化合物)物质。出于编号r3或r4基团中的原子或取代基的位置的目的,当pr3r4为非环状(即,其不形成磷环)时,直接连接到磷原子的每一r3或r4基团的原子被视为在特定基团的1位处。在配位化合物(其中pr3r4基团为非环状的)的优选实施例中,r3和r4独立地由烷基、经取代的烷基、苯基、经取代的苯基、呋喃基、经取代的呋喃基、噻吩基、经取代的噻吩基、吡咯基、经取代的吡咯基、吡啶基和经取代的吡啶基表示;优选地,配位化合物由以下表示:和其对映异构体,其中ar独立地为卤素;c1-40经取代或未经取代的烷基,优选c1-20经取代或未经取代的烷基,更优选c1-12经取代或未经取代的烷基,甚至更优选c1-6经取代或未经取代的烷基,尤其甲基、三氟甲基、甲氧基、乙基、乙氧基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基;c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基,尤其苯基、氟苯基、二氟苯基、三氟苯基、甲苯基、二甲基苯基、叔丁基苯基、二叔丁基苯基、甲氧基苯基、乙氧基苯基、二叔丁基甲氧基苯基、氰基苯基、硝基苯基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基,尤其经取代或未经取代的吡啶基、噻吩基、呋喃基、吡咯基;x″独立地为氢;卤素,优选氟、氯或溴,更优选氟或氯,甚至更优选氟;c1-40经取代或未经取代的烷基,优选c1-20经取代或未经取代的烷基,更优选c1-12经取代或未经取代的烷基,甚至更优选c1-6经取代或未经取代的烷基,尤其甲基、三氟甲基、甲氧基、乙基、乙氧基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基;c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基,尤其苯基、氟苯基、二氟苯基、三氟苯基、甲苯基、二甲基苯基;c2-40经取代或未经取代的芳基烷基,优选c2-20经取代或未经取代的芳基烷基,更优选c2-12经取代或未经取代的芳基烷基,尤其苯甲基、苯乙基和甲基苯甲基;硝基或氰基;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个ar、x″或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物)物质。x″'独立地为n、o或s,优选o。优选的x″独立地为氢、氟、氯、甲基、甲氧基、叔丁基、苯基、硝基或氰基。优选地,r3和r4独立地为经取代或未经取代的苯基或未经取代的呋喃基。优选地,r3或r4独立地为经取代的苯基,且至少一个,优选每一经取代的苯基上的至少一个x″为卤素,优选氟或氯;c1-4烷基或经取代的烷基,优选甲基、三氟甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基;甚至更优选氟;优选地,至少一个,更优选每一经取代的苯基在2位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代,且在3、4、5、6位中的一个或多个处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代;优选地,至少一个,更优选每一经取代的苯基独立地在2位和4位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代;优选地,至少一个,更优选每一经取代的苯基在2位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代;优选地,至少一个,更优选每一经取代的苯基在6位处经氢、氟或氯,优选氢或氟,更优选氢取代;优选地,至少一个,更优选每一经取代的苯基在2位处经氟取代,在4位处经氢或氟取代,且在6位处经氢取代。优选地,r3和r4独立地为经取代或未经取代的吡啶基。优选地,r3或r4独立地为经取代的吡啶基,且至少一个,优选每一经取代的吡啶基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选氟;优选地,至少一个,更优选每一经取代的吡啶基在2位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代。优选地,r3和r4独立地为经取代或未经取代的吡啶基。优选地,r3或r4独立地为经取代的吡啶基,且至少一个,优选每一经取代的吡啶基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选氟。优选地,r3和r4独立地为经取代或未经取代的吡咯基。优选地,r3或r4独立地为经取代的吡咯基,至少一个,优选每一经取代的吡咯基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选甲基。优选地,r3和r4独立地为经取代或未经取代的呋喃基。优选地,r3或r4独立地为经取代的呋喃基,且至少一个,优选每一经取代的呋喃基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选甲基。优选地,r3和r4独立地为经取代或未经取代的噻吩基。优选地,r3或r4独立地为经取代的噻吩基,且至少一个,优选每一经取代的噻吩基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选甲基。配位化合物的非限制性实例为:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个ar或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的ar或r5基团连接在一起形成聚(配位化合物)物质。在优选的配位化合物中,在磷环的2和5位处的ar为任选地经r5取代的苯基;二价连接基团的[l(r5)q]p为nr5,且5元配位化合物由以下表示:和其对映异构体,其中独立选择的n为零到五,优选零到三,更优选零到一的整数;r5为卤素、c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选氟、氯、溴、c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选氟、氯、c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;r3为c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;x″为氢、卤素、c1-4烷基或经取代的烷基、c6-10芳基或经取代的芳基、氰基或硝基,优选氢、氟、氯、溴、甲基、乙基、丙基、丁基、苯基、甲苯基、二甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基或叔丁基、氰基,更优选氢、氟、氯、甲基、乙基、丙基、丁基、苯基、甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基、氰基,甚至更优选氢、氟、甲基或甲氧基。在优选的配位化合物中,在连接到p的苯环的2位处的x″为氟,在连接到p的苯环的6位处的x″为氢,且5元配位化合物由以下表示:和其对映异构体,其中独立选择的n为零到五,优选零到三,更优选零到一的整数;r5为卤素、c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选氟、氯、溴、c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选氟、氯、c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;r3为c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;x″为氢、卤素、c1-4烷基或经取代的烷基、c6-10芳基或经取代的芳基、氰基或硝基,优选氢、氟、氯、溴、甲基、乙基、丙基、丁基、苯基、甲苯基、二甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基或叔丁基、氰基,更优选氢、氟、氯、甲基、乙基、丙基、丁基、苯基、甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基、氰基,甚至更优选氢、氟、甲基或甲氧基。在配位化合物中将p和x1连接在一起的基团y为二价连接基团[l(r5)q]p,其中p为1到6,优选1到4,优选1、2或3,更优选1或2的整数;q为0、1或2;由连接部分[l]p和r5侧基组成,其中独立选择的r5侧基连接到[l]p连接部分的l原子。连接部分[l]p由1到6,优选1到4,优选1、2或3,更优选1或2个l原子组成;l独立地选自由以下组成的群组:硼、碳、硅、锗、氮、磷、氧和硫。优选地,l独立地选自碳、氮、磷、氧和硫。优选的连接部分[l]p(独立地选择每一l)为b、c、n、o、p、s、si、c-c、c=c、c-n、c=n、c-si、n-n、c-c-c、c-c=c、c-n-c、c-p-c、c-n=c、c-si-c、n-c-n、c-n-n、c=n-n、c-n=n、c-o-c以及c-s-c,优选地,限制条件为连接部分[l]p不为脒、n-c=n。在本发明的一个实施例中,每一l(r5)q基团独立地为-n-、-n(r5)-、-p(r5)-、-p(o)(r5)-、-p(s)(r5)-、-c(o)-、-c(r5)-、-c(r5)2-、-si(r5)2-、-o-、-s-、s(o)-和-so2-,优选n、n(r5)、c(r5)或c(r5)2。在一些实施例中,连接部分[l]p由c组成且二价连接基团为[c(r5)q],其中q为1或2。代表性(但非限制性)[c(r5)q]连接基团包括:特定(但非限制性)[c(r5)q]连接基团包括:在一些实施例中,连接部分[l]p不为c且二价连接基团不为[c(r5)q],其中q为1或2。在一些实施例中,连接部分[l]p由c-c组成且二价连接基团为[c(r5)q]2,其中q独立地为1或2且至少一个q为2。代表性(但非限制性)[c(r5)q]2连接基团包括:特定(但非限制性)[c(r5)q]2连接基团包括:在一些实施例中,连接部分[l]p不为c-c且二价连接基团不为[c(r5)q]2,其中q独立地为1或2且至少一个q为2。在一些实施例中,连接部分[l]p由c-c组成且二价连接基团为[c(r5)]2,其中两个碳原子与碳-碳不饱和键相连接,或两个碳原子用不饱和键连接到其分别r5基团。代表性(但非限制性)[c(r5)]2连接基团包括:特定(但非限制性)[c(r5)]2连接基团包括:在一些实施例中,连接部分[l]p不为c-c且二价连接基团不为[c(r5)]2,其中两个碳原子与碳-碳不饱和键相连接,或两个碳原子用不饱和键连接到其分别r5基团。在一些实施例中,连接部分[l]p由n或n-n组成且二价连接基团为[nr5]或[nr5]2。代表性(但非限制性)[nr5]或[nr5]2连接基团包括:特定(但非限制性)[nr5]或[nr5]2连接基团包括:在一些实施例中,连接部分[l]p既不为n也不为n-n且二价连接基团既不为[nr5]也不为[nr5]2。优选地,[nr5]不包含应了解,形式r1r2p-p(=nr5)r3(r4)('ρ-ρ=ν')的二膦基亚胺化合物为如dyson等人在《无机化学学报(inorganicachimicaacta)》359(2006)2635-2643中所示的本发明中所要求的二膦基胺化合物r1r2p-nr5-pr3(r4)('ρ-ν-ρ')的重排异构体且可在如本申请中的铬的过渡金属存在下异构化成p-n-p形式。类似地,可能有可能的是,形式r1r2p-y-x1r3(r4)m或r1r2p-[l(r5)q]p-x1r3(r4)m的配位化合物以其异构'ρ-ρ=ν'形式存在,其中y或[l(r5)q]p为-n(r5)-且x1r3(r4)m为pr3r4。不管其纯和分离形式的配位化合物的结构配方为何,其和其用途为本发明的实施例,尤其如果其以'p-n-p'形式存在,当用于低聚方法时,更尤其当其在低聚方法中键结到铬时。在一些实施例中,连接部分[l]p由c-n组成且二价连接基团为[c(r5)qn(r5)q],其中q独立地为1或2(针对c(r5)q)和0或1(针对n(r5)q)。代表性(但非限制性)[c(r5)qn(r5)q]连接基团包括:特定(但非限制性)[c(r5)qn(r5)]连接基团包括:在一些实施例中,连接部分[l]p不为c-n且二价连接基团不为[c(r5)qn(r5)q],其中q独立地为1或2(针对c(r5)q)和0或1(针对n(r5)q)。优选地,[c(r5)qn(r5)q]不包含在一些实施例中,连接部分[l]p的l原子选自由以下组成的群组:b、o、s、si和c,其中至少一个l不为c;p为1、2、3或4;且二价连接基团为[(c(r5)2)kx'r(c(r5)2)k'],其中独立选择的x'为br5、o、s、so、so2或si(r5)2;k为0或1;k'为0或1;r为1、2或3。优选地,r+k+k'为1、2或3。代表性(但非限制性)[(c(r5)2)kx'r(c(r5)2)k']连接基团包括:特定(但非限制性)[(c(r5)2)kx'r(c(r5)2)k']连接基团包括:在一些实施例中,连接部分[l]p的l原子不选自由以下组成的群组:b、o、s、si和c,其中至少一个l不为c;p为1、2、3或4;且二价连接基团不为[(c(r5)2)kx'r(c(r5)2)k'],其中独立选择的x'为br5、o、s、so、so2或si(r5)2;k为0或1;k'为0或1;r为1、2或3。在由以下表示的优选的配位化合物中:l原子彼此连接,独立于单键或不饱和键各自连接,其限制条件为在配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;优选地,至少一个磷环不含有超过一个碳-碳不饱和键,优选不超过一个不饱和键,更优选至少一个,优选两个磷环不含有不饱和键;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物)物质。在本发明的一个实施例中,无两个r5、r3或r4基团连接在一起形成环状结构。在本发明的一个实施例中,至少两个r5基团连接在一起形成环状结构。优选地,第一l(r5)q基团上的至少一个r5基团与邻接第二l(r5)q基团上的至少一个r5基团连接在一起,与来自第一l(r5)q基团的l原子和来自邻接第二l(r5)q基团的l原子连接在一起以在环状结构的环部分中形成含有4到10个原子,优选4到7个原子的环状结构。优选地,环为经取代或未经取代的饱和或不饱和的烃基,如环戊烷二基、环己烷二基、二氧戊环二基、四氢呋喃二基、吡咯烷二基、哌啶烷二基、哌嗪烷二基、吡唑烷二基。优选地,环为经取代或未经取代的烯基或芳香族基团,如环戊烯二基、环己烯二基、环戊二烯二基、亚苯基、萘二基、吡啶二基、吡咯二基、咪唑二基、哒嗪二基、哒嗪二酮二基、喹喏啉二基、噻唑二基、噻吩二基、呋喃二基或环戊二烯基-二基,其中优选地,环戊二烯基为η5键结过渡金属络合物的部分,其中优选地,η5键结过渡金属络合物包含fe、ti、zr或hf。在本发明的一个实施例中,同一l(r5)q基团上的两个r5基团(其中q=2)连接在一起在环状结构的环部分中形成含有3到10个原子,优选3到7个原子的环状结构。优选地,环为经取代或未经取代的饱和或不饱和的烃基,如环丁烷二基、环戊烷二基、环己烷二基、四氢呋喃二基或环戊烯二基。在本发明的优选的配位化合物中,来自基团中的至少一个的l(r5)q基团上的至少一个r5基团或基团上的至少一个r5基团(其中r3或r4基团可表示为l(r5)q(r5))与来自p与x1之间的[l(r5)q]p二价桥连基团的至少一个r5基团连接在一起以分别在环状结构的环部分中形成含有5到10个原子,优选5到7个原子的环状结构。独立选择的r3、r4和r5为氢、氟基、氯基、溴基、氰基;经取代或未经取代的烃衍生物,优选具有1-20个,优选1-12个,更优选1-6个非氢原子的经取代或未经取代的烷基,优选甲基、三氟甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基、环戊基、环己基;优选经取代或未经取代的不饱和基团,包括具有2-20个,优选2-12个,更优选2-8个,更优选2-6个非氢原子的亚烷基、烯基、芳基或芳基烷基,优选乙烯基、亚甲基、亚乙基、烯丙基、苯基、2-甲基苯基、3-甲基苯基、4-甲基苯基、2,4-二甲基苯基、2,6-二甲基苯基、2,4,6-三甲基苯基、2-异丙基苯基、2,6-二异丙基苯基、2,6-二异丙基-4-甲基苯基、2-氟苯基、4-氟苯基、2-三氟甲基苯基、萘基、蒽基、联二苯、苯甲基、萘甲基苯乙基、联二苯甲基;具有1-20个,优选1-12个,更优选1-6个非氢原子的经取代或未经取代的杂烃衍生物,优选甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、苯氧基、甲硫基、乙硫基、乙酰基、二甲基氧硼基、二苯基氧硼基、双(二甲基氨基)氧硼基、二甲基氨基、二乙基氨基、2-二甲氨基乙基、2-甲氧基苯基、3-甲氧基苯基、4-甲氧基苯基、2,6-二甲氧基苯基、2,6-二甲氧基-4-甲基苯基、2-二甲氨基苯基、苯基氨基、苯基甲基氨基、乙酰胺、甲酰基氨基、苯甲酰氨基、苯甲酰基、甲基甲酰胺、二甲基甲酰胺、甲氧基甲基、乙氧基甲基、苯氧基甲基、甲氧基乙基、乙氧基乙基、苯氧基乙基、膦甲基、二乙基膦甲基、2-呋喃基、3-呋喃基、吡咯基、咪唑基、吡咯啶基、哌啶基、吡啶基、哒嗪基、吡唑啶基、吡嗪基、噻吩基、噻唑基、三甲基硅烷基、三甲基硅烷基甲基、二甲基苯基硅烷基、甲亚磺酰基、乙亚磺酰基、甲磺酰基、乙磺酰基;或具有1-6个非氢原子(优选硝基)、一个氧原子或一个硫原子的经取代或未经取代的杂原子基团。r3和r4优选为经取代或未经取代的芳基或芳基烷基,更优选经取代或未经取代的芳基。当独立选择的两个或更多个r3、r4或r5基团连接在一起时,其形成的部分为二价或多价的,取决于多少个r3、r4或r5基团连接在一起。举例来说,如果两个r3、r4或r5基团连接在一起,那么部分为二价的;如果三个r3、r4或r5基团连接在一起,那么部分为三价的。当独立选择的两个或更多个r3、r4或r5基团连接在一起时,连接的r3、r4或r5基团不为氢、氟基、氯基、溴基或氰基。在一些实施例中,本发明的配位化合物包括以下组合物:和其对映异构体。任选地两到十个,优选两到六个独立选择的配位化合物可经由其各别独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物)物质。聚(配位化合物)物质可呈配位化合物的树状体、低聚物或聚合物形式。聚(配位化合物)物质可为直链、支链或环状树状体、低聚物或聚合物,其中每一单体单元为个别独立选择的配位化合物。在一个实施例中,所有个别配位化合物彼此相同。在一个实施例中,个别配位化合物不全部彼此相同。配位化合物可通过从每一配位化合物的各别独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团中的一个或多个去除一个或多个独立选择的原子,优选一个原子而连接形成聚(配位化合物)物质以在每一配位化合物上提供一个或多个自由价键,且随后在自由价键位点处使具有一个或多个自由价键的配位化合物彼此连接以形成聚(配位化合物)。在一个实施例中,配位化合物经由其对应独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团(例如来自一个配位化合物的r1与来自另一配位化合物的r1连接或来自一个配位化合物的y与来自另一配位化合物的y连接)连接。在一个实施例中,连接配位化合物,但不经由其对应独立选择的ar、ar'、s″、y、r1、r2、r3、r4或r5基团(例如来自一个配位化合物的r2与除r2外来自另一配位化合物的基团连接)。聚(配位化合物)的特定(但非限制性)实例包括:和其对映异构体。制备配位化合物根据本发明的甚至其它方面,提供一种制备表示为以下的配位化合物的方法:以及如上文所描述,方法步骤包含a)使大约一当量或其硅烷基衍生物与大约一当量环状或非环状前驱体接触,或b)使大约一当量或其硅烷基衍生物与大约一当量环状前驱体接触;任选地在至少一当量质子清除剂存在下;x为离去基;以及任选地分离产物。出于简洁起见,在无描绘键的任选的特征的虚线连接的情况下,可通过若干方法中的任一种来制备如此章节(“制备配位化合物”)中所表示的配位化合物和其次单元和前体材料。一般来说,基于配位化合物的次单元的性质,即和以及适合的前体材料的可用性(商购或通过合成),选择制备方法。一般来说,可通过任选地在如胺的质子清除剂存在下,使的氢、卤化物或其它离去基衍生物或碱金属、碱土金属或碱土金属-卤化物衍生物与的适合的氢、卤化物或其它离去基衍生物或碱金属、碱土金属或碱土金属-卤化物衍生物接触来实现制备。卤化物或其它离去基优选为氯化物、溴化物、碘化物、硫酸酯、磺酸酯(如甲烷磺酸酯(甲磺酸酯))、对甲苯磺酸酯(甲苯磺酸酯)或三氟甲烷磺酸酯(三氟甲磺酸酯)或羧酸酯,如乙酸酯或苯甲酸酯。碱金属优选为锂、钠或钾。碱土金属为镁或钙,优选镁。碱土金属-卤化物优选为氯化镁、溴化镁或碘化镁。优选地,分别碱金属、碱土或碱土金属-卤化物衍生物可通过将与包含m的强碱(如氢化钠、氢化钾、甲基锂、丁基锂、叔丁醇钾、叔戊酸钾、二丁基镁、丁基辛基镁、甲基溴化镁、碘化乙基镁或氯化异丙基镁)组合制备,其中m为碱金属-卤化物、碱土金属-卤化物或碱土金属-卤化物。质子清除剂优选为三氢胩,如三乙胺或乙基二异丙基胺或芳香族胺,如吡啶或二甲基吡啶。在为r5n的情况下,且r5nh2用作的氢衍生物,在制备配位化合物的方法中,质子清除剂可适宜地为r5nh2。在一个实施例中,本发明提供一种制备配位化合物的方法,其类似于nifant'ev等人(“磷(iii)-磷酸化2-氨基吡啶和其衍生物的合成和结构”,nifant'ev,e.e.;negrebetskii,v.v.;gratchev,m.k.;kurochkina,g.i.;bekker,a.r.;vasyanina,l.k.;sakharov,s.g.,《磷、硫和硅以及相关元素(phosphorus,sulfurandsiliconandtherelatedelements)》1992,66,261-71)的方式,步骤包含使环状或非环状基团前体(如的卤化物、磺酸酯或其它离去基衍生物,如)接触,其中x为离去基,优选氯化物、溴化物、碘化物、甲磺酸酯、甲苯磺酸酯或三氟甲磺酸酯,更优选氯化物或碘化物,甚至更优选碘化物,且进一步其中根据待获得的所需配位化合物,选择其中(其中l-h)独立地为nh、ph、oh或sh,且独立选择的r'为氢、c1-6烃基或卤化物,优选在质子清除剂存在下进行。此实施例允许制备不对称配位化合物,其中以及对称配位化合物,其中不希望受任何特定方法束缚,对称配位化合物可通过在优选至少两当量质子清除剂存在下使大约两当量环状前体与大约一当量接触来制备。不希望受任何特定方法束缚,通过首先优选在至少一当量,优选至少五当量,更优选至少十当量第一反应中的质子清除剂存在下,使优选大约一当量环状前体或一当量环状或非环状前体与优选大约一当量或多当量连接基团前体或其硅烷基衍生物(表示为)接触以得到表示为的第一产物或表示为的其硅烷基衍生物,随后优选在至少一当量,更优选五当量,甚至更优选十当量质子清除剂存在下,使此第一产物与优选大约一当量其它所选择的环状或非环状前体接触,来获得不对称配位化合物,其中优选地,连接基团前体可充当第一反应中的质子清除剂以得到第一产物,其中使用至少一额外当量,优选至少额外五当量,更优选至少十额外当量连接基团前体,任选地在质子清除剂,优选三氢胩或芳香族胺存在下进行。在用于产生不对称配位化合物的次优选的(归因于形成对称配位化合物的更大统计可能性)实施例中,环状前体和环状或非环状前体可在优选至少两当量质子清除剂存在下同时与接触。优选地,环状前体分别表示为优选更优选其中x为离去基,优选卤化物,更优选氯化物或碘化物,更优选其中l优选为氮或碳,更优选碳;非环状前体表示为优选连接基团前体分别表示为r5nh2和r5nh(sir'3);以及或其硅烷基衍生物,表示为的表示为或其硅烷基衍生物,其分别表示为优选分别为以及以及其中r1、r2、r3、r4、r5、l、t、p、q和n如上文所描述;独立选择的r'为氢、c1-6烃基或卤化物;更优选以及其中l为氮或碳,优选地,l为碳,优选地,磷环为5元磷杂环戊烷,其中直接键结到p的两个原子为sp3杂交的,且磷杂环戊烷不为8-氮杂-1-磷三环[3.3.0.02,6]辛烷,更优选表示为其中r5、r'和n如上文所描述。在一个实施例中,本发明提供一种用于制备第一产物的方法,所述方法的步骤包含任选地在至少一当量,优选至少五当量,更优选至少十当量质子清除剂存在下,使优选大约一当量环状前体与优选大约一当量或多当量连接基团前体接触,且任选地分离产物。优选地,连接基团前体可充当第一反应中的质子清除剂以得到第一产物,其中使用至少一额外当量,优选至少额外五当量,更优选至少十额外当量连接基团前体,任选地在质子清除剂,优选三氢胩或芳香族胺存在下进行。优选地,环状前体表示为其中x为离去基,优选更优选更优选甚至更优选优选地,连接基团前体表示为r5nh2或r5nh(sir'3);表示为优选为更优选甚至更优选最优选为在一个实施例中,本发明提供一种用于制备配位化合物的方法,所述方法的步骤包含任选地在至少一当量,更优选五当量,甚至更优选十当量质子清除剂存在下,使优选大约一当量与优选大约一当量环状或非环状前体,优选非环状前体接触,且任选地分离产物。优选地,环状前体表示为其中x为离去基,优选更优选更优选更优选甚至更优选优选地,非环状前体表示为在一个实施例中,本发明提供一种用于制备第一产物的方法,所述方法的步骤包含任选地在至少一当量,优选至少五当量,更优选至少十当量质子清除剂存在下,使优选大约一当量非环状环状前体与优选大约一当量或多当量连接基团前体接触,且任选地分离产物。优选地,连接基团前体可充当第一反应中的质子清除剂以得到第一产物,其中使用至少一额外当量,优选至少额外五当量,更优选至少十额外当量连接基团前体,任选地在质子清除剂,优选三氢胩或芳香族胺存在下进行。优选地,非环状前体表示为优选地,连接基团前体表示为r5nh2或r5nh(sir'3);优选地,表示为在一个实施例中,本发明提供一种用于制备配位化合物的方法,所述方法的步骤包含任选地在至少一当量,更优选五当量,甚至更优选十当量质子清除剂存在下,使优选大约一当量与优选大约一当量环状前体(其中x为离去基)接触,且任选地分离产物。优选地,环状前体表示为优选更优选更优选甚至更优选在非限制性特定实例中,在三乙胺存在下,使1-氯-2,5-二苯基磷烷与异丙胺接触以得到对称产物n-异丙基-[双(2,5-二苯基磷烷)胺]。在非限制性特定实例中,使1-氯-2,5-二苯基磷烷与十当量正丁胺接触以得到n-丁基-(2,5-二苯基磷烷)胺作为第一产物,使其与氯二苯膦在三乙胺存在下接触以得到n-丁基-(2,5-二苯基磷烷)(二苯基膦基)胺。在制备配位化合物的方法的一个实施例中,表示为的中间物环状前体的5元环类似物可在如特定实例中所公开的总7步方法中,通过组合fox等人(“具有sp2碳连接子的双-(2,5-二苯基磷烷):不对称氢化中的合成和应用”,fox,m.e.;jackson,m.;lennon,i.c.;klosin,j.;abboud,k.a.《有机化学杂志(j.org.chem.)》2008,73,775-784.)和guillen等人(“手性单膦配体:2,5-二苯基磷烷的新家族的合成和首次应用”,guillen,f.;rivard,m.;toffano,m.;legros,j.-y.;daran,j.-c.;fiaud,j.-c.《四面体(tetrahedron)》2002,58,5895-5904)来制备,其中1,4-二苯基丁二烯用cl2pnme2环化以得到第一产物,其氢化得到n,n-二甲基-2,5-二苯基-1-棉安磷胺-1-氧化物作为第二产物,所述第二产物经异构化以得到呈大约r,r和s,s产物的外消旋混合物形式的第三产物。其需要四个步骤(水解,步骤4;氯化,步骤5;降低,步骤6;以及氯化,步骤7)以将第三产物转化成第七产物,环状氯化膦:在一个实施例中,本发明提供一种制备表示为的环状卤化膦的改进方法,所述方法的步骤包含在一种或多种碱存在下,使表示为的环状膦酰胺与至少一种表示为r'3sih的氢-硅化合物和至少一种表示为r'3six的硅卤化物化合物接触,且任选地分离产物。改进方法在如以下所表示的一个化学步骤中由环状膦酰胺提供环状卤化膦:中间物环状膦酰胺前体(针对5元环状膦酰胺,可根据guillen等人,由对应1,3-丁二烯化合物获得)表示为:优选更优选甚至更优选其中r5=氢、芳基、经取代的芳基、芳基烷基或经取代的芳基烷基,优选氢、芳基或经取代的芳基,更优选至少两个r5为芳基或经取代的芳基且至少两个r5为氢;且r"=烷基,优选c1-6烷基,更优选甲基或乙基;更优选甚至更优选其中r5=芳基、经取代的芳基、芳基烷基或经取代的芳基烷基,优选芳基或经取代的芳基;且r"为甲基或乙基,甚至更优选甚至更优选对应于上述当前技术发展水平方法的步骤3的产物;环状卤化膦,优选氯化物表示为优选更优选其中x为卤化物,优选氯化物、溴化物或碘化物,更优选氯化物或溴化物,甚至更优选氯化物;独立选择的r'为氢、c1-6烃基或卤化物;r5独立地为氢、c1-20芳基、c1-20经取代的芳基、c1-20芳基烷基或c1-20经取代的芳基烷基,优选氢、c1-12芳基、c1-12经取代的芳基、c1-12芳基烷基或c1-12经取代的芳基烷基,更优选c1-12芳基或c1-12经取代的芳基,更优选至少两个r5为c1-12芳基或c1-12经取代的芳基且至少两个r5为氢,更优选其中r5=c1-12芳基、c1-12经取代的芳基、c1-12芳基烷基或经取代的c1-12芳基烷基,优选c1-12芳基或c1-12经取代的芳基,甚至更优选对应于上述当前技术发展水平方法的步骤7的产物;至少一种氢-硅化合物表示为r'3sih且至少一种硅卤化物化合物表示为r'3six,其中l、r5和t如上文所描述;独立选择的r"为氢;c1-20,优选c1-12,更优选c1-6烃衍生物,优选地,r"为c1-20,优选c1-12,更优选c1-6烃基,更优选c1-12,更优选c1-6烷基或c2-20,更优选c2-12芳基或芳基烷基,更优选甲基、乙基、丙基、异丙基、丁基、苯基,优选甲基、乙基、异丙基;独立选择的r'为氢、c1-20,优选c1-12,更优选c1-6烃基,c1-20,优选c1-12,更优选c1-6杂烃基或卤化物,例如氯化物、溴化物、碘化物,优选氯化物或溴化物,更优选氯化物;更优选地,r'为氢、甲基、乙基、丙基、丁基、烯丙基、乙烯基、叔丁基、苯基、甲苯基、氯化物、溴化物、碘化物、二甲基氨基((ch3)2n)、二乙酰氨基((ch3ch2)2n)、甲氧基、乙氧基、丙氧基、苯氧基,更优选氢、氯化物、甲基、乙基、苯基;x为氯化物、溴化物、碘化物,优选氯化物;一种或多种碱的每一碱独立地为烃基胺,优选不具有实质上干扰中间物环状膦酰胺转化成环状卤化膦的n-h键的烃基胺,优选三烃基胺或芳香族胺,优选c1-12三烃基胺或c1-12芳香族胺,更优选三乙胺、乙基二异丙胺、吡啶、2-甲基吡啶、3-甲基吡啶、4-甲基吡啶、二甲基吡啶、嘧啶、吡唑、二甲基苯基胺、n,n-二甲氨基吡啶、1,8-二氮杂二环[5.4.0]十一-7-烯或甲基咪唑,甚至更优选吡啶。在优选实施例中,至少一种氢-硅化合物和至少一种硅卤化物化合物为至少一种氢-硅卤化物化合物,优选表示为r'2sihx的一种氢-硅卤化物化合物。优选地,r'3sih为ch3sih3、ch3ch2sih3、(c2h3)sih3、((ch3)2ch)sih3、(ch3ch2ch2)sih3、(ch2chch2)sih3、(ch3ch2ch2ch2)sih3、((ch3)3c)sih3、c6h5sih3、ch3ch2ch2ch2ch2ch2ch2ch2sih3、h3sich2ch2sih3、(ch3)2sih2、(ch3ch2)2sih2、(ch3)(c2h3)sih2、((ch3)2ch)2sih2、(ch3ch2ch2)2sih2、(ch3ch2ch2ch2)2sih2、((ch3)3c)2sih2、((ch3)3c)(ch3)sih2、(c6h5)(ch3)sih2、(c6h5)2sih2、(ch3c6h4)2sih2、h2(ch3)sich2ch2si(ch3)h2、(ch3)3sih、(ch3ch2)3sih、((ch3)2ch)3sih、(ch3ch2)(ch3)2sih、((ch3)2ch)(ch3)2sih、(ch2chch2)(ch3)2sih、(ch3ch2ch2)3sih、(ch3ch2ch2ch2)3sih、(c6h5ch2)(ch3)2sih、(c6h5)3sih、(ch3c6h4)3sih、(c6h5)(ch3)2sih、(c6h5)2(ch3)sih、(ch3)2(ch2cl)sih、(ch3)2(c2h3)sih、(ch2ch2)((ch3)2sih)2、((ch3)3c)(ch3)2sih、((ch3)3c)2(ch3)sih、((ch3)3c)(c6h5)2sih、h(ch3)2sich2ch2si(ch3)2h((ch3)2sih)2o、((ch3ch2)2sih)2o、((ch3)(c6h5)sih)2o、((c6h5)2sih)2o、(((ch3)2ch)2sih)2o或h3sisih3,更优选ch3sih3、ch3ch2sih3、((ch3)2ch)sih3、((ch3)3c)sih3、c6h5sih3、(ch3)2sih2、(ch3ch2)2sih2、((ch3)2ch)2sih2、((ch3)3c)2sih2、((ch3)3c)(ch3)sih2、(c6h5)(ch3)sih2、(c6h5)2sih2、(ch3c6h4)2sih2、(ch3)3sih、(ch3ch2)3sih、((ch3)2ch)3sih、(c6h5)3sih、(ch3c6h4)3sih、(c6h5)(ch3)2sih、(c6h5)2(ch3)sih、((ch3)3c)(ch3)2sih或((ch3)3c)2(ch3)sih,甚至更优选ch3sih3、ch3ch2sih3、((ch3)2ch)sih3、c6h5sih3、(ch3)2sih2、(ch3ch2)2sih2、((ch3)2ch)2sih2、((ch3)3c)2sih2、(c6h5)2sih2、(ch3)3sih、(ch3ch2)3sih、((ch3)2ch)3sih或(c6h5)3sih,更优选ch3sih3、c6h5sih3、(ch3)2sih2、(c6h5)2sih2、(ch3)3sih或(c6h5)3sih;优选地,r'3six为ch3sicl3、ch3ch2sicl3、(c2h3)sicl3、((ch3)2ch)sicl3、(ch3ch2ch2)sicl3、(ch2chch2)sicl3、(ch3ch2ch2ch2)sicl3、((ch3)3c)sicl3、c6h5sicl3、ch3ch2ch2ch2ch2ch2ch2ch2sicl3、cl3sisicl3、cl3sich2ch2sicl3、(ch3)2sicl2、(ch3ch2)2sicl2、(ch3)(c2h3)sicl2、((ch3)2ch)2sicl2、(ch3ch2ch2)2sicl2、(ch3ch2ch2ch2)2sicl2、((ch3)3c)2sicl2、((ch3)3c)(ch3)sicl2、(c6h5)(ch3)sicl2、(c6h5)2sicl2、(ch3c6h4)2sicl2、cl2(ch3)sich2ch2si(ch3)cl2、(ch3)3sicl、(ch3)3sii、(ch3ch2)3sicl、((ch3)2ch)3sicl、(ch3ch2)(ch3)2sicl、((ch3)2ch)(ch3)2sicl、(ch2chch2)(ch3)2sicl、(ch3ch2ch2)3sicl、(ch3ch2ch2ch2)3sicl、(c6h5ch2)(ch3)2sicl、(c6h5)3sicl、(ch3c6h4)3sicl、(c6h5)(ch3)2sicl、(c6h5)2(ch3)sicl、(ch3)2(ch2cl)sicl、(ch3)2(c2h3)sicl、(ch2ch2)((ch3)2sicl)2、((ch3)3c)(ch3)2sicl、((ch3)3c)2(ch3)sicl、((ch3)3c)(c6h5)2sicl、cl(ch3)2sich2ch2si(ch3)2cl((ch3)2sicl)2o、((ch3ch2)2sicl)2o、((ch3)(c6h5)sicl)2o、((c6h5)2sicl)2o或(((ch3)2ch)2sicl)2o,更优选ch3sicl3、ch3ch2sicl3、((ch3)2ch)sicl3、((ch3)3c)sicl3、c6h5sicl3、(ch3)2sicl2、(ch3ch2)2sicl2、((ch3)2ch)2sicl2、((ch3)3c)2sicl2、((ch3)3c)(ch3)sicl2、(c6h5)(ch3)sicl2、(c6h5)2sicl2、(ch3c6h4)2sicl2、(ch3)3sicl、(ch3)3sii、(ch3ch2)3sicl、((ch3)2ch)3sicl、(c6h5)3sicl、(ch3c6h4)3sicl、(c6h5)(ch3)2sicl、(c6h5)2(ch3)sicl、((ch3)3c)(ch3)2sicl或((ch3)3c)2(ch3)sicl,甚至更优选ch3sicl3、(ch3)3sii、ch3ch2sicl3、((ch3)2ch)sicl3、c6h5sicl3、(ch3)2sicl2、(ch3ch2)2sicl2、((ch3)2ch)2sicl2、((ch3)3c)2sicl2、(c6h5)2sicl2、(ch3)3sicl、(ch3ch2)3sicl、((ch3)2ch)3sicl或(c6h5)3sicl,更优选ch3sicl3、(ch3)3sii、c6h5sicl3、(ch3)2sicl2、(c6h5)2sicl2、(ch3)3sicl、(c6h5)3sicl;优选地,r'2sihx为hsicl3、h2sicl2、h3sicl、(ch3)2sihcl、(ch3ch2)2sihcl、(ch2ch)2sihcl、((ch3)2ch)2sihcl、(ch3ch2ch2)2sihcl、(ch3ch2ch2ch2)2sihcl、((ch3)3c)2sihcl、((ch3)3c)(ch3)sihcl、(c6h5)(ch3)sihcl、(c6h5)2sihcl、(ch3c6h4)2sihcl、cl(ch3)hsich2ch2sih(ch3)cl、ch3sihcl2、ch3ch2sihcl2、(c2h3)sihcl2、((ch3)2ch)sihcl2、(ch3ch2ch2)sihcl2、(ch2chch2)sihcl2、(ch3ch2ch2ch2)sihcl2、((ch3)3c)sihcl2、c6h5sihcl2、cl2hsich2ch2sihcl2、cl2hsisihcl2、ch3sih2cl、ch3ch2sih2cl、(c2h3)sih2cl、((ch3)2ch)sih2cl、(ch3ch2ch2)sih2cl、(ch2chch2)sih2cl、(ch3ch2ch2ch2)sih2cl、((ch3)3c)sih2cl、c6h5sih2cl、clh2sich2ch2sih2cl或clh2sisih2cl,更优选hsicl3、h2sicl2、(ch3)2sihcl、(ch3ch2)2sihcl、((ch3)2ch)2sihcl、((ch3)3c)2sihcl、((ch3)3c)(ch3)sihcl、(c6h5)(ch3)sihcl、(c6h5)2sihcl、ch3sihcl2、ch3ch2sihcl2、((ch3)2ch)sihcl2、((ch3)3c)sihcl2、c6h5sihcl2、ch3sih2cl、ch3ch2sih2cl、((ch3)2ch)sih2cl、((ch3)3c)sih2cl或c6h5sih2cl,甚至更优选hsicl3、h2sicl2、(ch3)2sihcl、(c6h5)(ch3)sihcl、(c6h5)2sihcl、ch3sihcl2、c6h5sihcl2、ch3sih2cl或c6h5sih2cl,更优选hsicl3、h2sicl2、(ch3)2sihcl、(c6h5)2sihcl或ch3sihcl2,hsicl3为最高度优选的。也可使用前述的混合物。在使用r'3sih\r'3six或r'2sihx化合物将中间物环状膦酰胺转化成环状卤化膦产物的单步改进方法的一个实施例中,可从通过将环状卤化膦萃取或分配到较高极性溶剂/较低极性二相溶剂混合物的较高极性溶剂相中且将含硅副产物萃取或分配到二相较高极性溶剂/较低极性溶剂混合物的较低极性溶剂相中产生的含硅副产物分离或纯化环状卤化膦产物,优选地,其中较高极性溶剂相包含选自以下的一种或多种溶剂:c2-8腈,如乙腈、丙腈、丁腈、苯腈;c1-10酰胺,如甲酰胺、n,n-二甲基甲酰胺、n,n-二乙基甲酰胺、n,n-二甲基乙酰胺、n,n-二乙基乙酰胺、n,n-二甲基苯甲酰胺;c1-8羧酸,如甲酸、乙酸、丙酸、丁酸、丙二酸;c1-8醇,如甲醇、乙醇、丙醇、异丙醇、正丁醇、叔丁醇;二甲亚砜;优选乙腈、丙腈、甲酰胺、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙酸或二甲亚砜,更优选乙腈,且较低极性溶剂相包含选自以下的一种或多种溶剂:c6-12芳香族烃、c4-12饱和烃或c4-10醚,优选c4-8饱和烃、c6-8芳香族烃或c6-8醚,更优选丁烷、戊烷环戊烷、己烷、环己烷、甲基环戊烷、庚烷、甲基环庚烷、辛烷、2,2,4,-三甲基戊烷、苯、甲苯、二异丙醚或二丁醚,甚至更优选丁烷、戊烷、己烷,更优选戊烷。优选地,选择二相较高极性溶剂/较低极性溶剂混合物组分以使得较高极性溶剂和较低极性溶剂彼此不可混溶,以提供二相溶剂混合物,例如戊烷/乙腈、二乙醚/二甲亚砜、己烷/二甲基甲酰胺。在较高极性溶剂/较低极性溶剂混合物中萃取或分配环状卤化膦和含硅副产物混合物且已分离较高极性和较低极性溶剂相之后,可通过所属领域的一般技术人员已知的方法,如蒸发出溶剂回收环状卤化膦。替换地,可通过用一种或多种较低极性溶剂,优选戊烷、己烷、庚烷或环己烷,更优选戊烷洗涤环状卤化膦/含硅副产物混合物来从含硅副产物分离或纯化环状卤化膦产物。优选地,通过在二相乙腈/己烷溶剂混合物中分配环状氯化膦和反应副产物来纯化环状卤化膦产物。用于将中间物环状膦酰胺转化成环状卤化膦的此改进方法使所需步数从四个减少到一个。在制备配位化合物的方法的一个实施例中,类似于fox等人的方式,使的卤化物或其它离去基衍生物,如(其中x为离去基)与接触,其中l-h独立地为ch、nh、ph、oh或sh,以分别制备所需配位化合物此实施例允许制备不对称配位化合物,其中以及对称配位化合物,其中不希望受任何特定方法束缚,对称配位化合物可通过以下步骤获得:将大约两当量环状前体与大约一当量组合来制备;而不对称配位化合物(其中)优选通过首先将大约一当量环状前体或大约一当量环状或非环状前体与大约一当量组合,随后将刚刚提及的第一反应的产物与包含m的强碱组合以分别形成其随后与大约一当量不同环状前体或大约一当量不同环状或非环状前体接触。中间物也可通过将大约一当量与大约一当量环状前体或大约一当量环状或非环状前体组合而形成。在制备配位化合物的方法的另一非限制性实施例中,可在优选至少两当量质子清除剂存在下,使(其中可根据待获得的所需配位化合物选择)与的卤化物或其它离去基衍生物(如)接触以得到配位产物。如上所述,可通过选择化学计量和前体获得对称或不对称产物。此类化学方法类似于montag等人(“通过阳离子铑(i)络合物的c-h氧化性加成中co的出人意料的作用”,montag,m.;schwartsburd,l.;cohen,r.;leitus,g;ben-david,y.;martin,j.m.l.;milstein,d.,《德国应用化学(angew.chem.,int.ed.)》2007,46,1901-1904)中所公开,其中使1,3-双(溴甲基)苯和二异丙基膦与三乙胺接触以制备1,3-双(二异丙基膦甲基)苯。在制备配位化合物的方法的另一非限制性实施例中,优选当离去基连接到l(当l为p、c、si、ge或b时)时,可使的卤化物或其它离去基衍生物,如或与的碱金属、碱土金属或碱土金属-卤化物衍生物,如接触以得到配位产物。如上所述,可通过选择化学计量和前体获得对称或不对称产物。制备配位化合物的方法的此实施例的非限制性特定实例公开于coleman等人(“顺式,顺式和反式,反式1,1'-[1,2-亚苯基双(亚甲基)]双(2,2,3,4,4-五甲基磷杂环丁烷的配位化学”coleman,d.;edwards,p.g.;kariuki,b.m.;newman,p.d.《道尔顿汇刊(daltontrans.)》2010,39,3842-3850)中,其中使2,2,3,4,4-五甲基磷杂环丁烷甲硼烷的锂衍生物与1,2-双(氯甲基)苯接触且依次用hbf4和nahco3处理所得产物以得到1,1'-[1,2-亚苯基双(亚甲基)]双-(2,2,3,4,4-五甲基磷杂环丁烷)。在制备配位化合物的方法的另一非限制性实施例中,的硅烷基衍生物,如可与环状或非环状前体接触,其中x为离去基,优选氯化物、溴化物、碘化物、甲磺酸酯甲苯磺酸酯或三氟甲磺酸酯,优选氯化物或碘化物;优选至少一个l为n或o,优选n,以使得l-sir'3为n-sir'3或o-sir'3,优选n-sir'3。在bettermann等人(“利用磷(iii)-卤素化合物的n-三甲基甲烷硅基化或o-三甲基甲烷硅基化乙醇胺衍生物的反应.化合物ch3och2ch2n(ch3)pcl2、(ch3)2nch2ch2opcl2、(ch3)2nch2ch2n(ch3)p(c6h5)2、(ch3)2nch2ch2n(ch3)p(c6h5)cl和(ch3)2nch2ch2n(ch3)pcl2中的分子内供体-受体相互作用”bettermann,g.;schomburg,d.;schmutzler,《磷硫相关元素(r.phosphorussulfurrelatedelements)》1986,28,327-336)中公开了通过将含有p-cl键的化合物与含有n-硅烷基键的化合物组合形成p-n键的反应的非限制性特定实例,其中使n1n1n2-三甲基-n2-(三甲基硅烷基)-1,2-乙二胺与氯二苯膦接触以得到(2-(二甲氨基)乙基(甲基)氨基)二苯基膦。在本发明的一个实施例中,提供一种方法,表示为以及其硅烷基衍生物,表示为如上文所描述的更优选表示为或其硅烷基衍生物,分别表示为优选分别为其中r1、r2、r3、r4、r5、l、t、p、q和n如上文所描述;独立选择的r'为氢、c1-6烃基或卤化物;更优选且磷环不为8-氮杂-1-磷三环[3.3.0.02,6]辛烷;优选地,l为氮或碳,更优选l为碳;甚至更优选以及磷环不为8-氮杂-1-磷三环[3.3.0.02,6]辛烷;优选地,l为氮,优选地,磷环为5元磷杂环戊烷,其中直接键结到p的两个原子为sp3杂交的且磷杂环戊烷不为8-氮杂-1-磷三环[3.3.0.02,6]辛烷,更优选表示为其中r5、r'和n如上文所描述。在制备配位化合物的方法的一个实施例中,环状或非环状膦前体的离去基为氯化物、溴化物、碘化物、甲磺酸酯、甲苯磺酸酯或三氟甲烷磺酸酯,优选氯化物或碘化物,更优选氯化物。在产生配位化合物或中间物化合物中的任一种的上述方法的一个实施例中,环状或非环状膦前体为环状或非环状氯化膦,其归因于其简便的可用性(商购或通过合成)而有利地采用。在产生配位化合物或中间物化合物中的任一种的上述方法的另一实施例中,环状或非环状膦前体为环状或非环状膦碘化物,其归因于与n-h或n-si键的更大反应性,在一些实施例中优于对应的环状或非环状氯化膦。在制备配位化合物的方法的一个实施例中,环状或非环状氯化膦可转化成对应环状或非环状碘化膦,所述方法包含使环状氯化膦与碘化物来源接触,其中碘化物来源选自包含lii、nai、ki、mgi2、cai2、smi2(thf)2、r″′4ni、r″′3sii、r″′2sii2、r″′sii3和sii4的群组,其中thf为四氢呋喃,独立选择的r″′为氢;c1-20,优选c1-12,更优选c1-6烃基,优选c1-12,更优选c1-6烷基或c2-20,更优选c2-12芳基或芳基烷基,更优选甲基、乙基、异丙基、叔丁基、苯基、甲苯基、苯甲基,优选甲基、叔丁基和苯基,且分离环状或非环状碘化膦产物。优选地,碘化物来源为三甲基硅烷基碘化物。在制备配位化合物的方法的另一非限制性实施例中,可通过以下步骤实现配位化合物的制备,将(其中x1h2为ph2或nh2)与a)包含m的强碱和b)r3或r4的含有离去基的衍生物,如环状硫酸酯衍生物,如或磺酸酯衍生物,如r3-磺酸酯或r4-磺酸酯组合,优选地,其中磺酸酯为甲磺酸酯、甲苯磺酸酯或三氟甲磺酸酯;或卤化物衍生物,如r3-卤化物或r4-卤化物,其中所述卤化物为cl、br或i;为二价部分,其中r1和r2连接在一起,且为二价部分,其中r3和r4连接在一起。在bonnaventure等人(“探测铜催化的二乙基锌加成n-膦酰基亚胺中的双(膦)一氧化物配体半不稳定位点的重要性:发现新有效手性配体”bonnaventure,i.;charette,a.b.《有机化学杂志》,2008,73,6330-6340)中公开了制备配位化合物的方法的此实施例的非限制性特定实例,其中使1,2-双(膦基)苯与丁基锂和2,5-二甲基-1,3,2-二氧杂硫杂环戊烷2,2-二氧化物接触以得到1,1'-(1,2-亚苯基)双[2,5-二甲基磷杂环戊烷]。正如熟习此项技术者所知,配位化合物的产率和纯度可在一定程度上取决于反应条件,如温度、所采用的溶剂和添加顺序,其中前体彼此接触。对于产率和纯度的最佳化,如熟习此项技术者已知进行的一些少量实验可为合意的,例如在一些情况下,可能需要使用过量,如0.01到0.5倍过量或0.5-5倍过量,甚至高达,或高于5-20倍过量的反应物组分中的任何一种或多种,以便提高反应速率且改进转化。在本发明的一个实施例中,可使用偶合反应将两种或更多种配位化合物连接一起来制备聚(配位化合物)。举例来说,铃木交叉偶合反应可偶合具有有机硼酸基团的配位化合物与具有有机卤化物基团的配位化合物。具有芳基硼酸基团的化合物与具有芳基卤化物基团的化合物之间的偶合反应的一个实例描述于song等人(“使用庞大菲基n-杂环碳烯配位体,钯催化的芳基氯化物铃木-宫浦偶合”,song,c.;ma,y.;chai,q.;ma,c.;jiang,w.;andrus,m.b.《四面体(tetrahedron)》,2005,61,7438-7446)中。如上文所描述,在一个实施例中,可以二氢碳基膦卤化物化合物为起始物质制备配位化合物。在一个实施例中,具有芳基卤化物基团的配位化合物可以具有芳基膦卤化物基团的二芳基膦卤化物为起始物质制备,其自身可如所depater等人(“(全氟)烷基硅烷基-经取代的2-[双(4-芳基)膦基]吡啶:普通溶剂和超临界co2中的苯基乙炔的甲氧基羰基化中的其钯络合物的合成和比较”,depater,j.j.m.;maljaars,c.e.p.;dewolf,e.;lutz,m.;spek,a.l.;deelman,b.-j.;elsevier,c.j.;vankoten,《有机金属化合物(g.organometallics)》2005,24,5299-5310)描述制备。在一个实施例中,具有芳基硼酸基团的配位化合物可通过使具有芳基卤化物基团的配位化合物与丁基锂,随后硼酸酯接触来制备。moleele等人(“由α-四氢萘酮合成1,2-二取代芳基萘的方法”,moleele,s.s.;michael,j.p.;dekoning,c.b.《四面体》2006,62,2831-2844)已描述以此方式由芳基卤化物制备芳基硼酸化合物的一般反应。如上文所描述,在一个实施例中,配位化合物可通过使伯胺与环状和/或非环状卤化膦前体接触来制备。在与其相关的一个实施例中,聚(配位化合物)物质可通过使具有两个或更多个伯氨基的化合物(如1,6-二氨基己烷)与环状或非环状卤化膦前体接触来制备。配位化合物-铬络合物在一些实施例中,本发明提供适用于催化,尤其氢甲酰化、异构化、氢化、聚合工艺,尤其如乙烯的烯烃的低聚的配位化合物-金属络合物。在一些实施例中,本发明提供适用于如乙烯的烯烃的低聚的配位化合物-铬络合物。配位化合物-铬络合物为包含如本文所描述的a)铬源和b)含有磷环的配位化合物的组合物。不希望受络合物的任何特定理论或物理描述束缚,据相信,配位化合物以双齿方式键结到配位化合物-铬络合物中的铬原子,但设想除双齿配体键结的其它键结模式外在本发明的范围内。配位化合物-铬络合物r1r2p-y-x1r3(r4)m[cr]可表示为其中:p为磷;x1选自氮、磷、氧或硫;r1和r2中的每一个独立地为经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或具有一到50个非氢原子的经取代或未经取代的杂原子基团;m为0或1;r1和r2连接在一起形成表示为的二价部分,其与p一起形成含有3到10个环原子的环状结构(磷环);r3和r4中的每一个独立地为氢、卤素、经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或具有一到50个非氢原子的经取代或未经取代的杂原子基团;r3和r4任选地连接在一起形成表示为的二价部分,其中键的任选的特征通过虚线连接描绘,其与x1一起形成含有3到10个环原子的环状结构;[cr]包含来自铬源的铬原子以及任何辅助性配体,即,连接到铬原子的配体不包括配位化合物;y任选地与r1、r2、r3或r4中的一个或多个连接在一起形成含有4到10个环原子的环状结构,如以下所表示:其中键的任选的特征通过虚线连接描绘,其为含有一到50个非氢原子的p与x1之间的二价连接基团[l(r5)q]p;[l(r5)q]p由以下表示:其中每一l独立地选自由以下组成的群组:硼、碳、硅、锗、氮、磷、氧和硫;p为1到6,优选1到4的整数;r5独立地为氢、卤素、经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或经取代或未经取代的杂原子基团;q为0、1或2;限制条件为二价连接基团[l(r5)q]p的[l]p子单元不包含脒基(n-c=n);其它限制条件为在含有磷环的配位化合物-铬络合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;又另外,优选地,限制条件为包含p或x1,优选包含p、r1和r2或包含x1、r3和r4的一个或两个磷环p-n、p-o或p-s键;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;两到十个,优选两到六个独立选择的配位化合物-铬络合物可任选地经由其各别独立选择的y、r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,至少一个,优选两个磷环不含有超过一个每一磷环中的碳-碳不饱和键,优选不超过一个每一磷环中的不饱和键。含有磷环的配位化合物-铬络合物可以表示为以下的单体形式存在:或表示为以下的二聚体形式存在:其中[cr]----[cr]表示两个[cr]基团和配位化合物-铬络合物的二聚体形式中其间的键。在本发明的一个实施例中,本发明包含含有磷环的配位化合物-铬络合物(“配位化合物-铬络合物”),如以下所表示:其中p为磷;x1选自氮、磷、氧或硫,优选氮或磷,更优选磷;m为0或1;每一l独立地选自硼、碳、硅、锗、氮、磷、氧或硫,优选碳、氮、磷、氧或硫,更优选碳或氮;r1和r2各自独立地选自经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或经取代或未经取代的杂原子基团;r1、p和r2一起形成磷环;当r3、r4和x1连接在一起时,其形成磷环(当x1为磷时)且其形成氮杂环(当x1为氮时);两个或更多个r1、r2、r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构,其中键的任选的特征通过虚线连接描绘;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质;r3、r4和r5各自独立地选自氢、卤素、经取代或未经取代的烃衍生物、经取代或未经取代的杂烃衍生物或经取代或未经取代的杂原子基团;p为1到6,优选1到4,更优选1到3,最优选1到2的整数;q为0、1或2;限制条件为二价连接基团的[l]p子单元不包含脒基(n-c=n);其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;又另外,优选限制条件为包含p或x1,优选包含p、r1和r2或包含x1、r3和r4的一个或两个磷环在磷环的环部分内不含有p-n、p-o或p-s键。优选地,至少一个,优选两个磷环不含有超过一个每一磷环中的碳-碳不饱和键,优选不超过一个每一磷环中的不饱和键。磷环或氮杂环为分别在环(ring或cycle)中包含至少一个磷或氮原子的环或环状化合物。每一r1和r2独立地含有1到50个非氢原子;每一r3、r4和r5独立地含有0到50个非氢原子;优选地,每一r5独立地含有0到40个非氢原子,更优选0到20个非氢原子,且最优选0到12个非氢原子;任选地,至少一个r5基团为经由双键键结到l的二价基团。优选地,含有磷环的配位化合物-铬络合物由以下表示其中q为0、1或2;p为1、2、3或4;t为0、1、2、3或4;v为0、1、2、3或4;m为0或1;l、r3、r4、r5和x1如上文所定义;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,x1为氮或磷;p=1、2、3或4;q=0、1或2;v和t各自独立地为1、2、3或4;r5各自独立地为氢;卤素;c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子的杂原子基团;r3和r4各自独立地为c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子,更优选一个原子的杂原子基团;当x1和其两个连接的r3和r4基团形成表示为的环时,所述环在x1为氮时为氮杂环且在x1为磷时为磷环;p和其两个连接的r1和r2基团形成表示为的磷环。优选地,磷环或氮杂环的l原子各自独立地为碳、氮或氧;[l(r5)q]p如上文所定义。优选地,直接连接到磷环的磷的磷环的所有l原子为碳;[l(r5)q]p如上文所定义。优选的含有磷环的配位化合物-铬络合物由以下表示:其中独立选择的磷环或氮杂环的[l(r5)q]为c(r5)、o、n、n(r5)或c(r5)2;[l(r5)q]p如上文所定义;q为0、1或2;p为1、2、3或4;t为1、2、3或4;v为1、2、3或4;m为0或1,x1为氮、磷或氧,优选氮或磷,更优选磷;r5各自独立地为氢;卤素;c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子的杂原子基团;r3和r4各自独立地为c1-40经取代或未经取代的烃衍生物,优选c1-20经取代或未经取代的烃衍生物,更优选c1-12经取代或未经取代的烃衍生物;c1-40经取代或未经取代的杂烃衍生物,优选c1-20经取代或未经取代的杂烃衍生物,更优选c1-12经取代或未经取代的杂烃衍生物;或具有一到四个原子,优选一到三个原子,更优选一个原子的杂原子基团;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。更优选地,p=1或2。更优选地,直接连接到磷环的磷的磷环的所有[l(r5)q]基团独立地为c(r5)或c(r5)2。配位化合物-铬络合物中的4元、5元、6元和7元磷环或氮杂环中的每一个中的手性环原子的数目(不包括连接到[l(r5)q]p的p或x1)可在零(无)到比每一环中的环原子的数目少一个范围内。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的任一个中无碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中仅一个碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中仅一个碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少一个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少一个为手性的。在一些实施例中,4元、5元、6元和7元磷环或氮杂环中的任一个中的碳原子中的至少两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中恰好两个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的任一个中恰好两个碳原子为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的任一个中的碳原子中的至少三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中恰好三个为手性的。在一些实施例中,一个或两个4元、5元、6元和7元磷环或氮杂环中的每一个中恰好三个碳原子为手性的。在一些实施例中,5元、6元和7元磷环或氮杂环中的任一个中的碳原子中的至少四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中的至少四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的每一个中的碳原子中的至少四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的至少一个中的碳原子中恰好四个为手性的。在一些实施例中,一个或两个5元、6元和7元磷环或氮杂环中的每一个中恰好四个碳原子为手性的。配位化合物-铬络合物可或可不为光学活性的。优选地,当配位化合物-铬络合物仅含有一个4元、5元、6元和7元磷环且不含有连接到[l(r5)q]p的氮杂环时,连接到磷环(其连接到[l(r5)q]p)中的p原子的磷环中的一个,优选两个l原子为碳,且这些l原子中的一个,更优选两个为手性的。优选地,当配位化合物-铬络合物含有两个连接到[l(r5)q]p的4元、5元、6元和7元磷环或氮杂环时,连接到磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的磷环或氮杂环中的一到四个l原子为碳原子,且这些l原子中的一个,优选两个,更优选三个,最优选四个为手性的。在一些实施例中,本发明的4元、5元、6元和7元磷环或氮杂环中无一者为手性的,优选一个或多个4元环在2和4位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型;一个或多个5元环在2和5位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型;一个或多个6元环在2和6位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型;且一个或多个7元环在2和7位处具有手性碳原子,优选两个手性碳原子具有r构型或两个具有s构型。优选地,一个,更优选两个4元、5元、6元和7元磷环或氮杂环在每一环中具有恰好两个手性碳原子。配位化合物-铬络合物可包含单一异构体或各种异构体,包括立体异构体的混合物,无论构型、构形、几何或光学为何。包含外消旋、对映体增浓或对映异构纯的手性配位化合物-铬络合物的配位化合物-铬络合物的混合物为优选的。仅具有一个4元、5元、6元和7元磷环且不具有氮杂环且其中磷环具有两个手性碳的配位化合物-铬络合物可具有以下构型异构体:r,r;r,s;s,r;以及s,s。在本发明的一个实施例中,配位化合物-铬络合物为实质上包含任何比例的单一配位化合物-铬络合物的r,s和s,r异构体的配位化合物-铬络合物的混合物,更优选配位化合物-铬络合物为实质上包含任何比例的单一配位化合物-铬络合物的r,r和s,s异构体的配位化合物-铬络合物的混合物。当配位化合物-铬络合物含有具有一个4元、5元、6元或7元磷环和一个额外4元、5元、6元或7元磷环或氮杂环(其中每一环具有两个手性碳)的配位化合物时,所述配位化合物-铬络合物可具有以下构型异构体:r,r,r,r;r,r,r,s;r,r,s,r;r,s,r,r;s,r,r,r;r,r,s,s;r,s,r,s;s,r,r,s;r,s,s,r;s,r,s,r;s,s,r,r;r,s,s,s;s,r,s,s;s,s,r,s;s,s,s,r;以及s,s,s,s;配位化合物-铬络合物的构型异构体为两个磷环和氮杂环的构型异构体的组合,各自具有r,r;r,s;s,r;以及s,s的构型选项;前述中的每一个为本发明的一个实施例。优选地,配位化合物-铬络合物的两个磷环或氮杂环具有同一构型,例如两者为r,r或r,s或s,r或s,s,从而配位化合物-铬络合物的优选的异构体构型为r,r,r,r;r,s,r,s;s,r,s,r;以及s,s,s,s。在本发明的一个优选实施例中,配位化合物-铬络合物为实质上包含任何比例的单一配位化合物-铬络合物的r,s,r,s和s,r,s,r异构体的混合物,更优选配位化合物-铬络合物为实质上包含任何比例的单一配位化合物-铬络合物的r,r,r,r和s,s,s,s异构体的混合物。优选地,独立选择的磷环或氮杂环的[l(r5)q]为c(r5)、n、n(r5)或c(r5)2;x1为磷或氮;t和v各自独立地为1、2、3或4。优选地,每一4元、5元、6元和7元磷环或氮杂环的一个到六个[l(r5)q]基团为c(r5)或c(r5)2,更优选c(r5)2。优选地,每一磷环或氮杂环的至少一个,更优选两个,甚至更优选三个,更优选四个[l(r5)q]基团为c(r5)2。优选地,每一磷环或氮杂环的至少一个,更优选两个[l(r5)q]基团为c(r5)。至少一个磷环或氮杂环的优选一个,更优选两个c(r5)或c(r5)2基团连接到磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子。连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的一个,更优选两个c(r5)2基团的优选两个r5基团为相同的;更优选其为不相同的。优选地,连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的至少一个,优选两个c(r5)或c(r5)2基团的恰好一个r5基团为氢,更优选地,连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的至少一个,优选两个c(r5)或c(r5)2基团的恰好一个r5基团不为氢。优选地,连接到至少一个磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的两个c(r5)或c(r5)2基团彼此相同。更优选地,两个c(r5)q基团连接到每一磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子。更优选地,磷环或氮杂环(其直接连接到每一磷环或氮杂环中的p或n原子)的所有[l(r5)q]基团独立地为如以下所表示的c(r5)q:和其对映异构体,其中c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h;x1为磷或氮;优选地,连接到每一磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的c(r5)h基团的r5基团不为氢,且其中,如上文所提及,r构型和s构型两者意指c(r5)h;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,连接到磷环或氮杂环(其连接到[l(r5)q]p)中的p或n原子的两个c(r5)h基团相同。优选地,连接到磷环(其连接到[l(r5)q]p)中的p原子的两个c(r5)h基团具有相同r或s构型。优选地,当x1为p原子且x1、r3和r4形成磷环时,磷环与p、r1和r2形成的磷环相同。优选地,磷环或氮杂环的l原子独立地为碳或氮。优选地,每一磷环或氮杂环中的至少两个l原子为碳。优选地。t和v各自独立地为1、2或3,优选1或2。优选地,t和v中的至少一个为2,更优选t为2。在优选实施例中,t为2;且磷环中的至少一个,优选两个l为碳。在优选实施例中,t为2;且磷环中的至少一个,优选两个l为氮。在优选实施例中,v为2;且包含x1的环中的至少一个,优选两个l为碳。在优选实施例中,v为2;且包含x1的环中的至少一个,优选两个l为氮。更优选地,x1为磷。更优选地,t和v各自为2。更优选地,t和v各自为2且x1为磷。在优选实施例中,x1r3(r4)m的x1、r3和r4基团并不形成环,m为0或1,优选地,m为1;优选地,x1为氮,更优选地,x1为磷。在优选的含有磷环的配位化合物-铬络合物中,x1为磷且5元配位化合物-铬络合物由以下表示:其中q为1或2;优选地,磷环的l(r5)q为c(r5)、n(r5)或c(r5)2,优选地,[l(r5)q]p为c(r5)、n(r5)、c(r5)2、c(r5)c(r5)或c(r5)2c(r5)2,更优选n(r5)或c(r5)c(r5);连接到p的c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,至少一个,更优选两个磷环含有至少一个,优选两个[l(r5)q]基团,其各自为c(r5)或c(r5)2。至少一个磷环中的至多一个键为不饱和键,优选至少一个磷环中的所有键为饱和键。优选地,至少一个,优选两个5元磷环为饱和的,意指其不含有不饱和键。优选地,一个5元磷环为饱和的,且一个磷环,优选一个5元磷环具有两个不饱和键,优选恰好一个不饱和键。优选地,一个5元磷环具有恰好一个不饱和键,且一个磷环,优选一个5元磷环具有两个不饱和键,优选恰好一个不饱和键,更优选不具有不饱和键。优选地,不饱和键为碳-碳不饱和键。优选地,不饱和键为碳-氮不饱和键。独立地选择含有磷环的配位化合物-铬络合物的优选的5元磷环,如以下所表示:和其对映异构体。可通过从上述独立地选择一个优选的5元磷环,将其连接到[l(r5)q]p二价连接基团的一个价键且将二价连接基团的其余自由价键连接到第二独立选择的磷环,优选上述优选的5元磷环或连接到x1r3r4(其中x1为磷或氮,优选磷)以形成配位化合物,且随后将配位化合物与铬源组合以引入[cr]基团来建立优选的含有5元环磷环的配位化合物。优选的含有非5元环磷环的配位化合物-铬络合物的非限制性实例由以下表示:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,[l(r5)q]p二价连接基团为nr5、c(r5)、c(r5)c(r5)、c(r5)2或c(r5)2c(r5)2,优选n(r5)。优选的含有5元环磷环的配位化合物-铬络合物的非限制性实例由以下表示:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,[l(r5)q]p二价连接基团为nr5、c(r5)、c(r5)c(r5)、c(r5)2或c(r5)2c(r5)2,优选n(r5)。优选地,连接到至少一个,优选两个磷环中的p原子的至少一个,优选两个c(r5)或c(r5)2基团中的恰好一个r5基团为氢。代表性(但非限制性)实例为:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。优选地,连接到5元磷环中的氮原子的任何r5基团不为氢,优选地,连接到5元磷环中的氮原子的任何r5基团为烃基,优选c1-4烷基、c6-10芳基或c7-10芳基烷基,更优选甲基、乙基、苯基、苯甲基或甲苯基;优选地,在5元磷环上在3和4位处连接到c(r5)或c(r5)2基团的环碳原子的r5基团为氢原子;优选连接到c(r5)基团的环碳原子中的至少一个的r5基团,其中c(r5)基团的环碳原子借助于不饱和键键结到另一环原子,优选碳-碳不饱和键为氢原子或稠合到磷环的芳香族环的部分。代表性(但非限制性)实例为:和其对映异构体。优选地,至少一个,优选两个在5元磷环上在2和5位处连接到c(r5)或c(r5)2基团的环碳原子的r5基团独立地为烷基、经取代的烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,优选芳基或经取代的芳基;优选地,在5元磷环上,在每一2位处且在每一5位处连接到c(r5)或c(r5)2基团的环碳原子的恰好一个r5基团为烷基、经取代的烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,更优选芳基或经取代的芳基;优选在5元磷环上,在每一2位处且在每一5位处连接到任何c(r5)2基团的环碳原子的恰好一个r5基团独立地为氢、甲基、乙基、丙基、丁基或戊基,优选氢或甲基,更优选氢;优选地,r3和r4独立地为烷基、经取代的烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,更优选芳基或经取代的芳基;优选地,在5元磷环上,在每一2位处且在每一5位处连接到c(r5)或c(r5)2基团的环碳原子的恰好一个r5基团独立地为芳基或经取代的芳基,在5元磷环上,在每一2位处且在每一5位处连接到任何c(r5)2基团的环碳原子的恰好一个r5基团为氢,且r3和r4独立地为烷基、芳基、经取代的芳基、芳基烷基、经取代的芳基烷基、杂芳基或经取代的杂芳基,优选芳基、经取代的芳基、杂芳基或经取代的杂芳基,更优选芳基或经取代的芳基。优选地,在5元磷环上,在2位和5位处的芳基、经取代的芳基、杂芳基或经取代的杂芳基为相同的。优选地,r3、r4和r5各自独立地为c1-40经取代或未经取代的烷基,优选c1-20经取代或未经取代的烷基,更优选c1-12经取代或未经取代的烷基;c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基;c2-40经取代或未经取代的芳基烷基,优选c2-20经取代或未经取代的芳基烷基,更优选c2-12经取代或未经取代的芳基烷基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基;优选地,当r5连接到5元环磷环的环氮原子时,r5独立地为c1-4烷基、c6-10芳基或c7-10芳基烷基;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。在优选实施例中,连接到5元环磷环的环氮原子的r3、r4和r5为ar,连接到5元环磷环的环氮原子的r5为ar',其中ar独立地为c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基;c2-40经取代或未经取代的芳基烷基,优选c2-20经取代或未经取代的芳基烷基,更优选c2-12经取代或未经取代的芳基烷基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基,且ar'独立地为c1-4烷基、c6-10芳基或c7-10芳基烷基。在优选的配位化合物-铬络合物中,磷环的l为碳且5元配位化合物-铬络合物由以下表示:其中q为1或2;优选地,[l(r5)q]p为c(r5)、n(r5)、c(r5)2、c(r5)c(r5)或c(r5)2c(r5)2,更优选n(r5)或c(r5)c(r5);连接到p的c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h。在优选的配位化合物-铬络合物中,二价连接基团的[l(r5)q]p为nr5且含有5元磷环的配位化合物-铬络合物由以下表示:其中q为1或2;连接到p的c(r5)q为c(r5)、c(r5)2或c(r5)h,优选c(r5)h。在优选的配位化合物-铬络合物中,在磷环的3和4位处的[l(r5)q]为ch2;在磷环的2和5位处的[l(r5)q]为cr5h;二价连接基团的[l(r5)q]p为nr5,且含有5元磷环的配位化合物-铬络合物由以下表示:在优选的配位化合物-铬络合物中,在磷环的2和5位处的[l(r5)q]为cr5h;在2和5位处的碳原子为手性的;优选地,每一磷环中的2和5位处的两个碳原子具有相同r或s构型;二价连接基团的[l(r5)q]p为nr5;优选地,在磷环的3和4位处的[l(r5)q]为ch2,且含有5元磷环的配位化合物-铬络合物由以下表示:和其对映异构体。含有磷环的配位化合物-铬络合物的非限制性实例为:和其对映异构体。在优选的含有磷环的配位化合物铬络合物中,在磷环的2和5位处的ar为任选地经r5取代的苯基;二价连接基团的[l(r5)q]p为nr5;优选地,在磷环的3和4位处的[l(r5)q]为ch2,且含有5元磷环的配位化合物铬络合物由以下表示:和其对映异构体,其中独立选择的n为零到五,优选零到三的整数。优选地,ar独立地为c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基;优选ar独立地为苯基、经取代的苯基、呋喃基、经取代的呋喃基、噻吩基、经取代的噻吩基、吡咯基、经取代的吡咯基、吡啶基和经取代的吡啶基,更优选苯基、经取代的苯基和呋喃基;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个ar、ar'或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的ar、ar'或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。出于编号r3或r4基团中的原子或取代基的位置的目的,当pr3r4为非环状(即,其不形成磷环)时,直接连接到磷原子的每一r3或r4基团的原子被视为在特定基团的1位处。在配位化合物-铬络合物(其中pr3r4基团为非环状的)的优选实施例中,r3和r4独立地由烷基、经取代的烷基、苯基、经取代的苯基、呋喃基、经取代的呋喃基、噻吩基、经取代的噻吩基、吡咯基、经取代的吡咯基、吡啶基和经取代的吡啶基表示;优选地,含有磷环的配位化合物铬络合物由以下表示和其对映异构体,其中ar独立地为卤素;c1-40经取代或未经取代的烷基,优选c1-20经取代或未经取代的烷基,更优选c1-12经取代或未经取代的烷基,甚至更优选c1-6经取代或未经取代的烷基,尤其甲基、三氟甲基、甲氧基、乙基、乙氧基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基;c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基,尤其苯基、氟苯基、二氟苯基、三氟苯基、甲苯基、二甲基苯基、叔丁基苯基、二叔丁基苯基、甲氧基苯基、乙氧基苯基、二叔丁基甲氧基苯基、氰基苯基、硝基苯基;c2-40经取代或未经取代的杂芳基,优选c2-20经取代或未经取代的杂芳基,更优选c2-12经取代或未经取代的杂芳基,尤其经取代或未经取代的吡啶基、噻吩基、呋喃基、吡咯基;x″独立地为氢;卤素,优选氟、氯或溴,更优选氟或氯,甚至更优选氟;c1-40经取代或未经取代的烷基,优选c1-20经取代或未经取代的烷基,更优选c1-12经取代或未经取代的烷基,甚至更优选c1-6经取代或未经取代的烷基,尤其甲基、三氟甲基、甲氧基、乙基、乙氧基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基;c2-40经取代或未经取代的芳基,优选c2-20经取代或未经取代的芳基,更优选c2-12经取代或未经取代的芳基,尤其苯基、氟苯基、二氟苯基、三氟苯基、甲苯基、二甲基苯基;c2-40经取代或未经取代的芳基烷基,优选c2-20经取代或未经取代的芳基烷基,更优选c2-12经取代或未经取代的芳基烷基,尤其苯甲基、苯乙基和甲基苯甲基;硝基或氰基;其它限制条件为在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个ar、x″或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的ar、x″或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。x″'独立地为n、o或s,优选o。优选的x″独立地为氢、氟、氯、甲基、甲氧基、叔丁基、苯基、硝基或氰基。优选地,r3和r4独立地为经取代或未经取代的苯基或未经取代的呋喃基。优选地,r3或r4独立地为经取代的苯基,且至少一个,优选每一经取代的苯基上的至少一个x″为卤素,优选氟或氯;c1-4烷基或经取代的烷基,优选甲基、三氟甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基;甚至更优选氟;优选地,至少一个,更优选每一经取代的苯基在2位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代,且在3、4、5、6位中的一个或多个处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代;优选地,至少一个,更优选每一经取代的苯基独立地在2位和4位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代;优选地,至少一个,更优选每一经取代的苯基在2位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代;优选地,至少一个,更优选每一经取代的苯基在6位处经氢、氟或氯,优选氢或氟,更优选氢取代;优选地,至少一个,更优选每一经取代的苯基在2位处经氟取代,在4位处经氢或氟取代,且在6位处经氢取代。优选地,r3和r4独立地为经取代或未经取代的吡啶基。优选地,r3或r4独立地为经取代的吡啶基,且至少一个,优选每一经取代的吡啶基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选氟;优选地,至少一个,更优选每一经取代的吡啶基在2位处经氰基、硝基、氟、氯、溴或碘,优选氟或氯,更优选氟取代。优选地,r3和r4独立地为经取代或未经取代的吡啶基。优选地,r3或r4独立地为经取代的吡啶基,且至少一个,优选每一经取代的吡啶基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选氟。优选地,r3和r4独立地为经取代或未经取代的吡咯基。优选地,r3或r4独立地为经取代的吡咯基,至少一个,优选每一经取代的吡咯基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选甲基。优选地,r3和r4独立地为经取代或未经取代的呋喃基。优选地,r3或r4独立地为经取代的呋喃基,且至少一个,优选每一经取代的呋喃基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选甲基。优选地,r3和r4独立地为经取代或未经取代的噻吩基。优选地,r3或r4独立地为经取代的噻吩基,且至少一个,优选每一经取代的噻吩基上的至少一个x″为卤素,优选氟或氯;c1-4烷基,优选甲基或叔丁基;c1-4烷氧基,优选甲氧基或乙氧基;c6-10芳基,优选苯基或甲苯基;氰基或硝基,更优选氟、氯或甲基,甚至更优选甲基。含有磷环的配位化合物铬络合物的非限制性实例为:和其对映异构体,其中在含有磷环的配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;两个或更多个ar或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的ar或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。在优选的配位化合物-铬络合物中,在磷环的2和5位处的ar为任选地经r5取代的苯基;二价连接基团的[l(r5)q]p为nr5,且含有5元磷环的配位化合物铬络合物由以下表示:和其对映异构体,其中独立选择的n为零到五,优选零到三,更优选零到一的整数;r5为卤素、c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选氟、氯、溴、c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选氟、氯、c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;r3为c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;x″为氢、卤素、c1-4烷基或经取代的烷基、c6-10芳基或经取代的芳基、氰基或硝基,优选氢、氟、氯、溴、甲基、乙基、丙基、丁基、苯基、甲苯基、二甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基或叔丁基、氰基,更优选氢、氟、氯、甲基、乙基、丙基、丁基、苯基、甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基、氰基,甚至更优选氢、氟、甲基或甲氧基。在优选的配位化合物-铬络合物中,在连接到p的苯环的2位处的x″为氟,在连接到p的苯环的6位处的x″为氢,且含有5元磷环的配位化合物铬络合物由以下表示:和其对映异构体,其中独立选择的n为零到五,优选零到三,更优选零到一的整数;r5为卤素、c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选氟、氯、溴、c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选氟、氯、c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;r3为c1-40经取代或未经取代的烷基、c1-40经取代或未经取代的芳基;优选c1-20经取代或未经取代的烷基、c1-20经取代或未经取代的芳基;更优选c1-12经取代或未经取代的烷基、c1-12经取代或未经取代的芳基;x″为氢、卤素、c1-4烷基或经取代的烷基、c6-10芳基或经取代的芳基、氰基或硝基,优选氢、氟、氯、溴、甲基、乙基、丙基、丁基、苯基、甲苯基、二甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基或叔丁基、氰基,更优选氢、氟、氯、甲基、乙基、丙基、丁基、苯基、甲苯基、甲氧基、乙氧基、丙氧基、三氟甲基、氰基,甚至更优选氢、氟、甲基或甲氧基。在配位化合物-铬络合物中将p和x1连接在一起的基团y为二价连接基团[l(r5)q]p,其中p为1到6,优选1到4,优选1、2或3,更优选1或2的整数;q为0、1或2;由连接部分[l]p和r5侧基组成,其中独立选择的r5侧基连接到[l]p连接部分的l原子。连接部分[l]p由1到6,优选1到4,优选1、2或3,更优选1或2个l原子组成;l独立地选自由以下组成的群组:硼、碳、硅、锗、氮、磷、氧和硫。优选地,l独立地选自碳、氮、磷、氧和硫。优选的连接部分[l]p(独立地选择每一l)为b、c、n、o、p、s、si、c-c、c=c、c-n、c=n、c-si、n-n、c-c-c、c-c=c、c-n-c、c-p-c、c-n=c、c-si-c、n-c-n、c-n-n、c=n-n、c-n=n、c-o-c以及c-s-c,优选地,限制条件为连接部分[l]p不为脒、n-c=n。在本发明的一个实施例中,每一l(r5)q基团独立地为-n-、-n(r5)-、-p(r5)-、-p(o)(r5)-、-p(s)(r5)-、-c(o)-、-c(r5)-、-c(r5)2-、-si(r5)2-、-o-、-s-、s(o)-和-so2-,优选n、n(r5)、c(r5)或c(r5)2。在一些实施例中,连接部分[l]p由c组成且二价连接基团为[c(r5)q],其中q为1或2。代表性(但非限制性)[c(r5)q]连接基团包括:特定(但非限制性)[c(r5)q]连接基团包括:在一些实施例中,连接部分[l]p不为c且二价连接基团不为[c(r5)q],其中q为1或2。在一些实施例中,连接部分[l]p由c-c组成且二价连接基团为[c(r5)q]2,其中q独立地为1或2且至少一个q为2。代表性(但非限制性)[c(r5)q]2连接基团包括:特定(但非限制性)[c(r5)q]2连接基团包括:在一些实施例中,连接部分[l]p不为c-c且二价连接基团不为[c(r5)q]2,其中q独立地为1或2且至少一个q为2。在一些实施例中,连接部分[l]p由c-c组成且二价连接基团为[c(r5)]2,其中两个碳原子与碳-碳不饱和键相连接,或两个碳原子用不饱和键连接到其分别r5基团。代表性(但非限制性)[c(r5)]2连接基团包括:特定(但非限制性)[c(r5)]2连接基团包括:在一些实施例中,连接部分[l]p不为c-c且二价连接基团不为[c(r5)]2,其中两个碳原子与碳-碳不饱和键相连接,或两个碳原子用不饱和键连接到其分别r5基团。在一些实施例中,连接部分[l]p由n或n-n组成且二价连接基团为[nr5]或[nr5]2。代表性(但非限制性)[nr5]或[nr5]2连接基团包括:特定(但非限制性)[nr5]或[nr5]2连接基团包括:在一些实施例中,连接部分[l]p既不为n也不为n-n且二价连接基团既不为[nr5]也不为[nr5]2。优选地,[nr5]不包含应了解,形式r1r2p-p(=nr5)r3(r4)('ρ-ρ=ν')的二膦基亚胺化合物为如dyson等人在《无机化学学报》359(2006)2635-2643中所示的本发明中所要求的二膦基胺化合物r1r2p-nr5-pr3(r4)('ρ-ν-ρ')的重排异构体且可在如本申请中的铬的过渡金属存在下异构化成p-n-p形式。类似地,可能有可能的是,形式r1r2p-y-x1r3(r4)m或r1r2p-[l(r5)q]p-x1r3(r4)m的配位化合物以其异构'ρ-ρ=ν'形式存在,其中y或[l(r5)q]p为-n(r5)-且x1r3(r4)m为pr3r4。不管其纯和分离形式的配位化合物的结构配方为何,其和其用途为本发明的实施例,尤其如果其以'p-n-p'形式存在,当用于低聚方法时,更尤其当其在低聚方法中键结到铬时。在一些实施例中,连接部分[l]p由c-n组成且二价连接基团为[c(r5)qn(r5)q],其中q独立地为1或2(针对c(r5)q)和0或1(针对n(r5)q)。代表性(但非限制性)[c(r5)qn(r5)q]连接基团包括:特定(但非限制性)[c(r5)qn(r5)]连接基团包括:在一些实施例中,连接部分[l]p不为c-n且二价连接基团不为[c(r5)qn(r5)q],其中q独立地为1或2(针对c(r5)q)和0或1(针对n(r5)q)。优选地,[c(r5)qn(r5)q]不包含在一些实施例中,连接部分[l]p的l原子选自由以下组成的群组:b、o、s、si和c,其中至少一个l不为c;p为1、2、3或4;且二价连接基团为[(c(r5)2)kx'r(c(r5)2)k'],其中独立选择的x'为br5、o、s、so、so2或si(r5)2;k为0或1;k'为0或1;r为1、2或3。优选地,r+k+k'为1、2或3。代表性(但非限制性)[(c(r5)2)kx'r(c(r5)2)k']连接基团包括:特定(但非限制性)[(c(r5)2)kx'r(c(r5)2)k']连接基团包括:在一些实施例中,连接部分[l]p的l原子不选自由以下组成的群组:b、o、s、si和c,其中至少一个l不为c;p为1、2、3或4;且二价连接基团不为[(c(r5)2)kx'r(c(r5)2)k'],其中独立选择的x'为br5、o、s、so、so2或si(r5)2;k为0或1;k'为0或1;r为1、2或3。在由以下表示的优选的含有磷环的配位化合物铬络合物中:l原子彼此连接,独立于单键或不饱和键各自连接,其限制条件为在配位化合物的至少一个磷环中,直接键结到p或x1的两个原子为sp3杂交的;优选地,至少一个磷环不含有超过一个碳-碳不饱和键,优选不超过一个不饱和键,更优选至少一个,优选两个磷环不含有不饱和键;两个或更多个r3、r4或r5基团任选地连接在一起形成含有4到10个环原子,优选4到7个环原子的环状结构;两个或更多个r5基团独立地与至少一个l原子连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;连接到同一l原子的两个r5基团可任选地连接在一起形成含有3到10个环原子,优选3到7个环原子的环状结构;任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。在本发明的一个实施例中,无两个r5、r3或r4基团连接在一起形成环状结构。在本发明的一个实施例中,至少两个r5基团连接在一起形成环状结构。优选地,第一l(r5)q基团上的至少一个r5基团与邻接第二l(r5)q基团上的至少一个r5基团连接在一起,与来自第一l(r5)q基团的l原子和来自邻接第二l(r5)q基团的l原子连接在一起以在环状结构的环部分中形成含有4到10个原子,优选4到7个原子的环状结构。优选地,环为经取代或未经取代的饱和或不饱和的烃基,如环戊烷二基、环己烷二基、二氧戊环二基、四氢呋喃二基、吡咯烷二基、哌啶烷二基、哌嗪烷二基、吡唑烷二基。优选地,环为经取代或未经取代的烯基或芳香族基团,如环戊烯二基、环己烯二基、环戊二烯二基、亚苯基、萘二基、吡啶二基、吡咯二基、咪唑二基、哒嗪二基、哒嗪二酮二基、喹喏啉二基、噻唑二基、噻吩二基、呋喃二基或环戊二烯基-二基,其中优选地,环戊二烯基为η5键结过渡金属络合物的部分,其中优选地,η5键结过渡金属络合物包含fe、ti、zr或hf。在本发明的优选的配位化合物-铬络合物中,同一l(r5)q基团上的两个r5基团(其中q=2)连接在一起在环状结构的环部分中形成含有3到10个原子,优选3到7个原子的环状结构。优选地,环为经取代或未经取代的饱和或不饱和的烃基,如环丁烷二基、环戊烷二基、环己烷二基、四氢呋喃二基或环戊烯二基。在本发明的优选的配位化合物-铬络合物中,来自基团中的至少一个的l(r5)q基团上的至少一个r5基团或基团上的至少一个r5基团(其中r3或r4基团可表示为l(r5)q(r5))与来自p与x1之间的[l(r5)q]p二价桥连基团的至少一个r5基团连接在一起以分别在环状结构的环部分中形成含有5到10个原子,优选5到7个原子的环状结构。独立选择的r3、r4和r5为氢、氟基、氯基、溴基、氰基;经取代或未经取代的烃衍生物,优选具有1-20个,优选1-12个,更优选1-6个非氢原子的经取代或未经取代的烷基,优选甲基、三氟甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、己基、环戊基、环己基;优选经取代或未经取代的不饱和基团,包括具有2-20个,优选2-12个,更优选2-8个,更优选2-6个非氢原子的亚烷基、烯基、芳基或芳基烷基,优选乙烯基、亚甲基、亚乙基、烯丙基、苯基、2-甲基苯基、3-甲基苯基、4-甲基苯基、2,4-二甲基苯基、2,6-二甲基苯基、2,4,6-三甲基苯基、2-异丙基苯基、2,6-二异丙基苯基、2,6-二异丙基-4-甲基苯基、2-氟苯基、4-氟苯基、2-三氟甲基苯基、萘基、蒽基、联二苯、苯甲基、萘甲基苯乙基、联二苯甲基;具有1-20个,优选1-12个,更优选1-6个非氢原子的经取代或未经取代的杂烃衍生物,优选甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、苯氧基、甲硫基、乙硫基、乙酰基、二甲基氧硼基、二苯基氧硼基、双(二甲基氨基)氧硼基、二甲基氨基、二乙基氨基、2-二甲氨基乙基、2-甲氧基苯基、3-甲氧基苯基、4-甲氧基苯基、2,6-二甲氧基苯基、2,6-二甲氧基-4-甲基苯基、2-二甲氨基苯基、苯基氨基、苯基甲基氨基、乙酰胺、甲酰基氨基、苯甲酰氨基、苯甲酰基、甲基甲酰胺、二甲基甲酰胺、甲氧基甲基、乙氧基甲基、苯氧基甲基、甲氧基乙基、乙氧基乙基、苯氧基乙基、膦甲基、二乙基膦甲基、2-呋喃基、3-呋喃基、吡咯基、咪唑基、吡咯啶基、哌啶基、吡啶基、哒嗪基、吡唑啶基、吡嗪基、噻吩基、噻唑基、三甲基硅烷基、三甲基硅烷基甲基、二甲基苯基硅烷基、甲亚磺酰基、乙亚磺酰基、甲磺酰基、乙磺酰基;或具有1-6个非氢原子(优选硝基)、一个氧原子或一个硫原子的经取代或未经取代的杂原子基团。r3和r4优选为经取代或未经取代的芳基或芳基烷基,更优选经取代或未经取代的芳基。当独立选择的两个或更多个r3、r4或r5基团连接在一起时,其形成的部分为二价或多价的,取决于多少个r3、r4或r5基团连接在一起。举例来说,如果两个r3、r4或r5基团连接在一起,那么部分为二价的;如果三个r3、r4或r5基团连接在一起,那么部分为三价的。当独立选择的两个或更多个r3、r4或r5基团连接在一起时,连接的r3、r4或r5基团不为氢、氟基、氯基、溴基或氰基。在一些实施例中,本发明的含有磷环的配位化合物铬络合物包括以下组合物:和其对映异构体。配位化合物-铬络合物的二聚体形式中的两个[cr]基团之间的[cr]----[cr]键不限于表示cr-cr键,而且还表示两个独立选择的[cr]单元通过键结相互作用连接或缔合,例如cr-cr键;铬原子之间的桥连阴离子配体,如桥连卤化物配体,尤其氯化物、溴化物和碘化物;桥连氢化物配体;桥连烃基配体,尤其甲基、乙基、乙二基、丁烷二基、己烷二基、辛烷二基;桥连羧酸酯配体,尤其乙酸酯、辛酸酯、2-乙基己烷酸酯;桥连磺酸酯配体,尤其甲烷磺酸酯、苯磺酸酯、甲苯磺酸酯、三氟甲基磺酸酯;桥连氧化物或硫化物配体;桥连氢氧化物配体;桥连醇盐配体,尤其甲醇盐、乙醇盐、丙醇盐、丁醇盐;桥连氰化物配体;或桥连酰氨基配体,尤其二甲基氨基、二乙酰氨基、二异丙基氨基;铬原子之间的桥连中性路易斯碱,如桥连羰基(co);桥连膦,尤其三甲基膦、三乙基膦、三苯基膦;桥连醚,尤其二乙醚、四氢呋喃;或桥连硫醚;具有连接铬原子的多个阴离子和/或中性位点的桥连配体,其中一个铬原子连接到一个位点且另一铬原子连接到另一位点,如酰氨基-亚胺配体、二膦配体、二羧酸酯配体;离子性键结相互作用,如当带有正电荷的配位化合物-铬络合物与带有负电荷的配位化合物-铬络合物缔合时。在一个实施例中,二聚体可通过其各别r1、r2、r3、r4、r5或l基团之间的共价键结相互作用连接两个独立选择的配位化合物-铬络合物而形成。连接到[cr]中的铬原子的辅助配体,即,连接到铬原子的配体(不包括配位化合物)可包括阴离子或中性配体。连接到[cr]中的铬原子的阴离子或中性配体可由铬源、任选的至少一种溶剂(其中配位化合物和铬源可接触形成配位化合物-铬络合物)、配位化合物、至少一种活化剂或可添加的其它任选的组分产生。连接到[cr]中的铬原子的阴离子配体选自包含以下的群组:卤化物阴离子,尤其氯化物、溴化物或碘化物;β-酮酸盐,如乙酰基丙酮酸盐、六氟乙酰基丙酮酸盐、甲基乙酰基丙酮酸盐、3-乙酰基戊烷-2,4-二酮;羧酸酯阴离子,如甲酸酯、乙酸酯、丙酸酯、苯甲酸酯、2-乙基己酸酯或三氟乙酸酯;磺酸酯,如甲烷磺酸酯、苯磺酸酯、对甲苯磺酸酯、三氟甲烷磺酸酯;烃基以及其衍生物,如甲基、乙基、丙基、丁基、烯丙基、新戊基、苯基、均三甲苯基、苯甲基或三甲基硅烷基甲基;以及酰胺阴离子,如二甲酰胺、二乙酰胺、二异丙酰胺;醇盐阴离子,如甲醇盐、乙醇盐或苯氧化物;氧化物或硫化物。连接到[cr]中的铬原子的中性配体选自包含以下的群组:中性路易斯碱,包括(但不限于)醚,如thf(四氢呋喃)或二乙醚;醇,如甲醇或乙醇;腈,如乙腈或苯甲腈;胺,如三乙胺或乙二胺;膦,如三甲基膦、三乙基膦、三苯基膦或双(二甲基膦基)乙烷;亚胺,如n-亚乙基-苯胺或n-(1-甲基亚乙基)-2-丙胺;水;羰基(co);优选羰基和thf。任选地两到十个,优选两到六个独立选择的配位化合物-铬络合物可经由其各别独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团连接在一起形成聚(配位化合物-铬络合物)物质。聚(配位化合物-铬络合物)物质可呈配位化合物-铬络合物的树状体、低聚物或聚合物形式。聚(配位化合物-铬络合物)物质可为直链、支链或环状树状体、低聚物或聚合物,其中每一单体单元为个别独立选择的配位化合物-铬络合物。在一个实施例中,所有个别配位化合物-铬络合物彼此相同。在一个实施例中,个别配位化合物-铬络合物不全部彼此相同。配位化合物-铬络合物可通过从每一配位化合物-铬络合物的各别独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团中的一个或多个去除一个或多个独立选择的原子,优选一个原子以在每一配位化合物-铬络合物上提供一个或多个自由价键而连接形成聚(配位化合物-铬络合物)物质,且随后在自由价键位点处使具有一个或多个自由价键的配位化合物-铬络合物彼此连接以形成聚(配位化合物-铬络合物)物质。在一个实施例中,配位化合物-铬络合物经由其对应独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团连接(例如来自一种配位化合物-铬络合物的r1与来自另一配位化合物-铬络合物的r1连接或来自一种配位化合物-铬络合物的y与来自另一配位化合物-铬络合物的y连接)。在一个实施例中,连接配位化合物-铬络合物,但不经由其对应独立选择的ar、ar'、x″、y、r1、r2、r3、r4或r5基团(例如来自一种配位化合物-铬络合物的r2与来自另一配位化合物-铬络合物除r2外的基团连接)。在一个实施例中,聚(配位化合物-铬络合物)物质可通过将聚(配位化合物)与铬源组合而形成。在一个实施例中,聚(配位化合物-铬络合物)物质可通过与个别配位化合物-铬络合物接触形成,由此每一个别配位化合物-铬络合物在可与另一个别配位化合物-铬络合物的官能基组合形成一键的至少一个ar、ar'、x″、y、r1、r2、r3、r4或r5基团上具有至少一个官能基。在一个实施例中,聚(配位化合物-铬络合物)物质可通过使用辅助配体(其为[cr]的部分)连接配位化合物-铬络合物而形成,例如经由桥连氯化物配体二聚合的配位化合物-铬络合物。不希望受任何特定理论束缚,据相信,使用辅助配体(其为[cr]的部分)通过连接配位化合物-铬络合物形成的聚(配位化合物-铬络合物)物质在低聚条件下易于分解,而据相信,其中经由其各别ar、ar'、x″、y、r1、r2、r3、r4或r5基团连接个别配位化合物-铬络合物的聚(配位化合物-铬络合物)物质在低聚条件下不会分解成其个别配位化合物-铬络合物。聚(配位化合物-铬络合物)物质的特定(但非限制性)实例包括:和其对映异构体。制备配位化合物-铬络合物在一些实施例中,本发明提供一种制备适用于如乙烯的烯烃的低聚的配位化合物-铬络合物的方法。可通过任选地在至少一种溶剂存在下,以任何顺序组合a)铬源和b)如本文所描述的含有磷环的配位化合物来制备配位化合物-铬络合物。通过组合铬源和b)含有磷环的配位化合物形成的配位化合物-铬络合物任选地可或可不分离;任选地配位化合物-铬络合物可例如在低聚反应器中原位形成。配位化合物-铬络合物的制备可在-100℃到250℃,优选-78℃到150℃,更优选0℃到110℃,甚至更优选20℃到80℃范围内的温度下进行。任选的至少一种溶剂(在其中配位化合物和铬源接触以形成配位化合物-铬络合物)可为任何惰性溶剂,尤其选自包含以下的群组的惰性溶剂:戊烷、己烷、庚烷、辛烷、壬烷、癸烷、环己烷、环庚烷、甲基环戊烷、甲基环己烷、1-己烯、1-辛烯、苯、甲苯、二甲苯、乙苯、枯烯、均三甲苯、商购饱和烃混合物(如isopar-etm)、thf、二乙醚、氯仿、二氯甲烷、二氯乙烷、三氯乙烷、四氯乙烷、氯苯、1,2-二氯苯、氯苯和1,2-二氯苯或其混合物。优选地,制备配位化合物-铬络合物的方法在惰性氛围条件下进行。取决于反应条件,配位化合物-铬络合物可以单体或二聚体形式形成。举例来说,1,2-双[(2s,5s)-2,5-二甲基磷烷]苯(me-duphos)与crcl3(thf)3(三氯三(四氢呋喃)铬)于thf中的反应产生单体配位化合物-铬络合物me-duphos-crcl3(thf),同时在热甲苯中形成二聚配位化合物-铬络合物(me-duphos-crcl3)2。在一些情况下,配位化合物-铬络合物的二聚体形式可在单体形式再结晶后获得。铬源和配位化合物可按比例接触以提供1000:1到1:1000,优选100:1到1:100,更优选10:1到1:10,甚至更优选1.3:1到1:1.3,甚至更优选1.1:1到1:1.1的cr:配位化合物比率。术语‘惰性溶剂’和‘惰性氛围’分别意指溶剂氛围不会实质上干扰配位化合物-铬络合物形成;优选地,这意味着溶剂氛围分别基本上不含可能干扰配位化合物-铬络合物形成或可能导致配位化合物或配位化合物-铬络合物分解的氧和/或其它组分。配位化合物-铬络合物的制备可任选地在活化剂存在下进行。配位化合物-铬络合物的制备可作为制备用于烯烃低聚的催化剂系统的方法的一部分而存在。从dyson等人《无机化学学报》359(2006)2635-2643应了解,含有磷环的配位化合物的异构'ρ-ρ=ν'形式r1r2p-y-x1r3(r4)m或r1r2p-[l(r5)q]p-x1r3(r4)m(其中y或[l(r5)q]p为-n(r5)-且x1r3(r4)m为pr3r4)可用于任何方法以制备配位化合物-铬络合物,包括用于上文所论述的方法,尤其如果其以'p-n-p'形成存在,当在低聚方法中使用时,更尤其当其在低聚方法中键结到铬时。铬源有时称为“铬前体”的铬源在文献中为已知的。说明性公开案包括美国专利(us)7,378,537和us7,425,661。这些参考文献以美国法律所允许的最大程度并入本文中。在一个实施例中,铬源选自包含以下的群组:crcl3(thf)3(三氯三(四氢呋喃)铬)、crbr3(thf)3、cri3(thf)3、crcl3、crbr3、cri3、crcl2、crcl2(thf)2、cr(acac)3(乙酰基丙酮酸铬(iii))、cr(乙酸盐)3(乙酸铬(iii))、cr(2-乙基己酸盐)3(2-乙基己酸铬(iii))、(thf)3crmecl2、(mes)3cr(thf)、((tfa)2cr(oet)2)2、(thf)3crph3、cr(nme3)2cl3、cr(新戊基)3(thf)3、cr(ch2-c6h4-o-nme)3、cr(tfa)3、cr(ch(sime3)2)3、cr(mes)2(thf)3、cr(mes)2(thf)cr(mes)2(thf)2、cr(mes)cl(thf)2、cr(mes)cl(thf)0.5、cr(对甲苯基)cl2(thf)3、cr(二异丙基酰胺)3、cr(吡啶甲酸盐)3、crcl2(thf)2、cr(no3)3、cr(六氟乙酰基丙酮根)3、(thf)3cr(η2-2,2″联二苯)br、cr(co)6、cr(co)3(thf)3、cr(co)3(ncch3)3、(苯)cr(co)3、(甲苯)cr(co)3以及其混合物。铬源优选选自由以下组成的群组:crcl3(thf)3、crcl3、cr(acac)3、cr(乙酸盐)3、cr(2-乙基己酸盐)3、crcl2、crcl2(thf)2、cr(co)6以及其混合物。在前述式中,“mes”意指均三甲苯基或2,4,6-三甲基苯基,“tfa”意指三氟乙酸酯且“acac”意指乙酰丙酮根。催化剂系统在一些实施例中,本发明提供一种用于烯烃低聚的低聚催化剂系统,其中所述催化剂系统为包含a)铬源、b)一种或多种活化剂和c)如本文所描述的至少一种,优选一种含有磷环的配位化合物的组合物。优选地,催化剂系统为包含一种或多种活化剂和至少一种,优选一种含有磷环的配位化合物-铬络合物的组合物,其中至少一种,优选一种配位化合物-铬络合物包含铬源和至少一种,优选一种含有磷环的配位化合物。用于烯烃低聚的催化剂系统的另一实施例为通过任选地在至少一种溶剂存在下,在进行本发明的低聚工艺的反应器中或不在反应器中,在至少一种烯烃存在或不存在下,优选在至少一种烯烃,优选待低聚的乙烯存在下,以任何顺序将a)铬源、b)一种或多种活化剂和c)至少一种,优选一种含有磷环的配位化合物组合在一起来制备组合物,任选地含有磷环的配位化合物-铬络合物通过组合含有磷环的配位化合物和铬源原位形成,任选地原位组合含有磷环的配位化合物和铬源。用于烯烃低聚的催化剂系统的另一实施例为通过a)将一种或多种活化剂与至少一种,优选一种配位化合物组合和b)将所得组合与铬源组合来制备组合物。用于烯烃低聚的催化剂系统的另一实施例为通过a)将一种或多种活化剂与铬源组合和b)将所得组合与至少一种,优选一种配位化合物组合来制备组合物。用于烯烃低聚的催化剂系统的另一实施例为通过将铬源、一种或多种活化剂和至少一种,优选一种配位化合物同时组合来制备组合物。用于烯烃低聚的催化剂系统的另一实施例为通过a)将铬源与至少一种,优选一种配位化合物组合和b)不分离所得组合,和c)将组合与一种或多种活化剂组合来制备组合物。用于烯烃低聚的催化剂系统的另一实施例为通过a)将铬源与至少一种,优选一种配位化合物组合和b)分离所得组合来制备组合物。用于烯烃低聚的催化剂系统的另一实施例为通过a)将铬源与至少一种,优选一种配位化合物组合和b)不分离所得组合来制备组合物。用于烯烃低聚的催化剂系统的更优选实施例为任选地在一种或多种溶剂存在下,通过将a)至少一种,优选一种分离的配位化合物-铬络合物(如上文所描述)(其通过任选地在至少一种溶剂存在下,将铬源与至少一种,优选一种配位化合物组合且分离产物来制备)与b)一种或多种活化剂组合来制备组合物。在一些实施例中,本发明提供一种制备用于烯烃低聚的催化剂系统的方法,其中催化剂系统为包含a)铬源、b)一种或多种活化剂和c)如本文所描述的至少一种含有磷环的配位化合物的组合物。优选地,催化剂系统为包含一种或多种活化剂和至少一种,优选一种含有磷环的配位化合物-铬络合物的组合物,其中配位化合物-铬络合物包含铬源和至少一种,优选一种含有磷环的配位化合物。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含任选地在至少一种溶剂存在下,在进行本发明的低聚工艺的反应器中或不在反应器中,在至少一种烯烃存在或不存在下,优选在至少一种烯烃,优选待低聚的乙烯存在下,以任何顺序将a)铬源、b)一种或多种活化剂和c)至少一种含有磷环的配位化合物组合在一起。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含a)将一种或多种活化剂与至少一种配位化合物组合和b)将所得组合与铬源组合。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含a)将一种或多种活化剂与铬源组合和b)将所得组合与至少一种配位化合物组合。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含将铬源、一种或多种活化剂和至少一种配位化合物同时组合。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含a)任选地原位将铬源与至少一种,优选一种配位化合物组合,和b)不分离所得组合,和c)将组合与一种或多种活化剂组合。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含a)任选地原位将铬源与至少一种,优选一种配位化合物组合,和b)分离所得组合。本发明的另一实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含a)任选地原位将铬源与至少一种,优选一种配位化合物组合,和b)不分离所得组合。本发明的更优选实施例提供一种制备用于烯烃低聚的催化剂系统的方法,方法步骤包含a)任选地在至少一种溶剂存在下,将铬源与至少一种配位化合物组合,b)分离配位化合物-铬络合物,c)将分离的配位化合物-铬络合物与一种或多种活化剂组合。在一个实施例中,本发明提供一种在低聚反应器(原位)或低聚反应器外部(非原位)中,任选地在至少一种低聚溶剂存在下,且任选地在至少一种烯烃存在下,优选在至少一种烯烃,优选待低聚的乙烯存在下,制备用于烯烃低聚的催化剂系统的方法。优选地,在低聚反应器中以任何顺序使铬源、一种或多种活化剂和至少一种含有磷环的配位化合物接触。更优选地,在低聚反应器中使至少一种,优选一种配位化合物-铬络合物和一种或多种活化剂接触。在本发明的组合物和方法中,铬(来自铬源或配位化合物-铬络合物)、一种或多种活化剂和含有磷环的配位化合物(包括来自配位化合物-铬络合物)可相对于彼此呈此类比例以提供10:1到1:10,更优选1.3:1到1:1.3,更优选1.1:1到1:1.1的铬:配位化合物摩尔比;以及100:1到1:10,000,优选1:1到1:3000,更优选1:1到1:1000,更优选1:1到1:500的铬:活化剂(例如铝、硼、镓化合物)摩尔比。典型地,使铬(来自铬源或配位化合物-铬络合物)、一种或多种活化剂和含有磷环的配位化合物(包括来自配位化合物-铬络合物)接触(原位和非原位)以提供10:1到1:10,更优选1.3:1到1:1.3,更优选1.1:1到1:1.1的铬:配位化合物摩尔比;以及100:1到1:10,000,优选1:1到1:3000,更优选1:1到1:1000,更优选1:1到1:500的铬:活化剂(例如铝、硼、镓化合物)摩尔比。催化剂系统的制备可在-80℃到110℃,优选0℃到80℃,更优选20℃到70℃范围内的温度下进行。任选的至少一种溶剂可为任何惰性溶剂,尤其选自由以下组成的群组的惰性溶剂:烃,例如戊烷、己烷、庚烷、辛烷、壬烷、癸烷、环己烷、环庚烷、甲基环戊烷、甲基环己烷、1-己烯、1-辛烯、苯、甲苯、二甲苯、乙苯、枯烯、均三甲苯或商购饱和烃混合物,如isopar-etm;中性路易斯碱,例如thf、二乙醚、醇,如甲醇或乙醇、乙腈;氯化烃,例如氯仿、二氯甲烷、二氯乙烷、三氯乙烷、四氯乙烷、氯苯、1,2-二氯苯;以及离子性液体,或其混合物。优选地,至少一种溶剂选自由以下组成的群组:饱和烃和氯化烃或其混合物。尤其优选的为甲基环己烷、氯苯和1,2-二氯苯。活化剂在一些实施例中,本发明提供一种用于选择性地低聚烯烃的方法,其包含活化的催化剂系统,所述系统包含组合a)铬源、b)一种或多种活化剂和c)至少一种含有磷环的配位化合物。本发明的一个实施例包含一种用于形成活化的催化剂系统的方法,其包含组合a)铬源、b)一种或多种活化剂和c)至少一种含有磷环的配位化合物。如下文所描述,可以任何顺序使铬源、一种或多种活化剂和配位化合物接触。在一些实施例中,铬源和配位化合物可在任何活化剂不存在下接触,且可或可不分离的所得配位化合物-铬络合物与一种或多种活化剂接触。在一些实施例中,配位化合物可与一种或多种活化剂接触且所得组合可与铬源接触。在本发明的一个实施例中,活化技术可用于放置一种或多种活化剂。活化剂(“活化共催化剂”)和活化技术如与基于金属的烯烃聚合反应一起使用的所属领域中已知的那些。用于本文中的适合的活化剂包括中性路易斯酸,尤其第13组金属和类金属化合物;聚合或低聚铝氧烷(也称为铝氧烷);非聚合、非配位、离子形成化合物(包括在氧化条件下使用此类化合物);以及铝酸盐。适合的活化技术为如us6,465,384中所公开的本体电解。优选的中性路易斯酸活化剂为含有1到3种烃衍生物,优选烃基,如本文所描述的取代基的第13组金属和类金属化合物,尤其其中第13组金属和类金属化合物选自硼、铝和镓的化合物。更优选的第13组金属化合物为(烃基)铝、(烃基)镓、(烃基)硼、(经取代的烃基)铝、(经取代的烃基)镓和(经取代的烃基)硼化合物,尤其单(烃基)取代的铝、二(烃基)取代的铝、三(烃基)取代的铝、(烃基)取代的镓、二(烃基)取代的镓、三(烃基)镓或三(烃基)-硼化合物,更尤其烷基铝、烷基镓、芳基和芳基烷基硼化合物或其混合物。术语“烷基铝”意指单烷基二氢化铝、单烷基二卤化铝或单烷基二醇铝、二烷基氢化铝、二烷基卤化铝或二烷基醇铝或三烷基铝。术语“烷基镓”意指单烷基二氢化镓、单烷基二卤化镓或单烷基二醇镓、二烷基氢化镓、二烷基卤化镓或二烷基醇镓或三烷基镓。术语“芳基硼”意指单芳基二氢化硼、单芳基二卤化硼、单芳基二醇硼、单芳基硼二烷基、二芳基硼烷基、二芳基硼氢化物、二芳基卤化硼、二芳基醇硼或三烷基硼。术语“芳基烷基硼”意指单芳基烷基二氢化硼、单芳基烷基二卤化硼、单芳基烷基二醇硼、单芳基烷基硼二烷基、二芳基烷基硼烷基、二芳基烷基硼氢化物、二芳基烷基卤化硼、二芳基烷基醇硼或三芳基烷基硼。还更优选大为((c1-10)烷基)二氢化铝、((c1-10)烷基)二卤化铝、((c1-10)烷基)二醇铝、二((c1-10)烷基)氢化铝、二((c1-10)烷基)醇铝、二((c1-10)烷基)卤化铝、三((c1-10)烷基)铝、((c1-10)烷基)二氢化镓、((c1-10)烷基)二卤化镓、((c1-10)烷基)二醇镓、二((c1-10)烷基)氢化镓、二((c1-10)烷基)醇镓、二((c1-10)烷基)卤化镓、三((c1-10)烷基)镓、((c6-18)芳基)二氢化硼、((c6-18)芳基)硼二烷基、((c6-18)芳基)二卤化硼、((c6-18)芳基)二醇硼、二((c6-18)芳基)氢化硼、二((c6-18)芳基)硼烷基、二((c6-18)芳基)卤化硼、二((c6-18)芳基)醇硼、三((c6-18)芳基)铝、三((c6-18)芳基)硼、((c6-18)芳基烷基)二氢化硼、((c6-18)芳基烷基)硼二烷基、((c6-18)芳基烷基)二卤化硼、((c6-18)芳基烷基)二醇硼、二((c6-18)芳基烷基)氢化硼、二((c6-18)芳基烷基)硼烷基、二((c6-18)芳基烷基)卤化硼、二((c6-18)芳基烷基)醇硼、三((c6-18)芳基烷基)铝、三((c6-18)芳基烷基)硼或三((c6-18)芳基)镓化合物和其卤化(包括全卤化)衍生物,甚至更尤其三(氟基取代的苯基)甲硼烷化合物、三(氟基取代的苯基)铝化合物和三(氟基取代的苯基)镓化合物,甚至更尤其三(五氟苯基)甲硼烷、三(五氟苯基)铝和三(五氟苯基)镓或其混合物。优选的烷基铝活化剂包括三甲基铝(tma)、三乙基铝、三丙基铝、三异丙基铝、三丁基铝、三异丁基铝(tiba)、三己基铝、三辛基铝、乙基二异丙基铝甲基铝二氯化物、乙基二氯化铝、异丁基二氯化铝、二甲基氯化铝、二乙基氯化铝、二异丁基氯化铝、二乙基氢化铝、二异丁基氢化铝、甲基倍半氯化铝、乙基倍半氯化铝、异丁基倍半氯化铝、甲基铝二(2,6-叔丁基-4-甲基苯酚盐)、二甲基异丙醇铝、二乙基乙醇铝、二异丁基铝(2,6-叔丁基-4-甲基苯酚盐)以及其混合物。优选的烷基镓化合物包括三甲基镓、三乙基镓、三丙基镓、三异丙基镓氯化物和二甲基(2,4-戊二酮基)镓。铝氧烷和其制备在例如美国专利编号(uspn)us6,103,657处为已知的。铝氧烷、(烃基)铝化合物的子组为所属领域中众所周知的,如典型地为聚合或低聚,通常低聚化合物,其可通过控制向(烃基)铝化合物,尤其烷基铝化合物,例如三甲基铝中添加水来制备。优选的聚合或低聚铝氧烷的实例为甲基铝氧烷(mao)(mao在文献中也称为甲铝氧烷和甲基铝氧烷)、经三异丁基铝改性的甲基铝氧烷和异丁基铝氧烷以及四乙基-μ-氧基二铝和四异丁基-μ-氧基二铝。优选的铝氧烷为可商购的那些以便降低成本。所属领域的技术人员将认识到,可商购的烷基铝氧烷可含有一定比例的三烷基铝。举例来说,商购mao通常含有大约10wt%三甲基铝(tma),且商购“经改性的mao”(或“mmao”)含有tma和tiba两者。优选的铝氧烷包括mao和mmao。优选的非配位、离子形成化合物(其中一些描述在wo2007/039851中)可包括阳离子和阴离子组分,且可由下式表示:(cat)d'+ad'-其中(cat)d'+为具有电荷d'+的阳离子;ad'-为具有电荷d'-的非配位阴离子且d'为1到3的整数。ad'-优选可为硼酸根阴离子,尤其有机硼酸根阴离子、铝酸根阴离子、没食子酸根阴离子或钽酸根阴离子。优选地,d'为1;ad'-为[a'(r9)4]-,其中a'为硼、铝或镓;且r9在每次出现时独立地选自由以下组成的群组:氢化物、卤化物、二(c1-18)烷基酰胺基、(c1-18)烃基、经卤基取代的(c1-18)烃基、(c1-18)醇盐、(c2-18)芳基氧化物和(c2-18)芳基烷基氧化物。优选地,r9选自(c1-18)卤基取代的烷基、(c2-18)卤基取代的芳基、(c2-18)卤基取代的芳基烷基、(c1-18)卤基取代的醇盐、(c2-18)卤基取代的芳基氧化物和(c2-18)卤基取代的芳基烷基氧化物。更优选地,r9选自(c1-18)氟基取代的烷基、(c2-18)氟基取代的芳基、(c2-18)氟基取代的芳基烷基、(c1-18)氟基取代的醇盐、(c2-18)氟基取代的芳基氧化物和(c2-18)氟基取代的芳基烷基氧化物。优选地,r9选自h、f、(ch3)2n、(ch3ch2)2n、((ch3)2ch)2n、甲基、乙基、丙基、异丙基、丁基、异丁基、苯基、苯甲基、三氟甲基、2,2,2-三氟乙基、五氟乙基、1,1,1,3,3,3-六氟-2-丙基、七氟-异丙基、九氟-叔丁基、四氟苯基、五氟苯基、3,5-双(三氟甲基)苯基、甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、苯氧基、三氟甲氧基、2,2,2-三氟乙氧基、五氟乙氧基、1,1,1,3,3,3-六氟-2-丙氧基、七氟-异丙氧基、九氟-叔丁氧基、四氟苯氧基、五氟苯氧基,或两个r9基团结合在一起为儿茶酚或四氟儿茶酚。优选地,a'为硼;r9为h、氟基、七氟-异丙基、九氟-叔丁基、四氟苯基、五氟苯基或3,5-双(三氟甲基)苯基;优选至少一个r9为氟基,优选至少一个r9为五氟苯基,更优选至少两个r9为五氟苯基,甚至更优选至少三个r9为五氟苯基,最优选四个r9为五氟苯基。优选地,a'为铝或镓;r9为氟基、五氟苯基、3,5-双(三氟甲基)苯基、1,1,1,3,3,3-六氟-2-丙氧基、七氟-异丙氧基、九氟-叔丁氧基、五氟苯氧基,或两个r9基团结合在一起为四氟儿茶酚。阴离子组分ad'-的说明性(但非限制性)实例为[b{oc(cf3)3}4]-、[b(oc6f5)4]-、[b(c6f4o2)2]-、[bf{oc(cf3)3}3]-、[bh{oc(cf3)3}3]-、[b{oc(cf3)3}6]-、[b(oc6f5)6]-、[b(c6f5)4]-、[b{3,5-(cf3)2c6h3}4]-、[bf(c6f5)3]-、[bf{3,5-(cf3)2c6h3}3]-、[al{och(cf3)2}4]-、[al{ocf(cf3)2}4]-、[al{oc(cf3)3}4]-、[al(oc6f5)4]-、[al(c6f4o2)2]-、[alf{och(cf3)2}3]-、[alf{ocf(cf3)2}3]-、[alf{oc(cf3)3}3]-、[alh{oc(cf3)3}3]-、[al2f{och(cf3)2}6]-、[al2f{oc(cf3)3}6]-、[alf(c6f5)3]-、[alf{3,5-(cf3)2c6h3}3]-、[al(c6f5)4]-、[al{3,5-(cf3)2c6h3}4]-、[ga{och(cf3)2}4]-、[ga{ocf(cf3)2}4]-、[ga{oc(cf3)3}4]-、[ga(oc6f5)4]-、[ga(c6f4o2)2]-、[gaf{och(cf3)2}3]-、[gaf{ocf(cf3)2}3]-、[gaf{oc(cf3)3}3]-、[ga2f{och(cf3)2}6]-、[ga2f{oc(cf3)3}6]-、[gaf(c6f5)3]-、[gaf{3,5-(cf3)2c6h3}3]-、[ga(c6f5)4]-、[ga{3,5-(cf3)2c6h3}4]-和[ta(oc6f5)6]-。优选地,(cat)d’+可由(l'-h)d'+表示,其中l'为中性路易斯碱;h为氢;(l'-h)d'+为具有电荷d'+的布朗斯特酸(acid);且d'为1到3的整数;优选地,d'为1。更优选地,(cat)d'+可由以下表示[(r)x'l*-h]+或[(r10)3c]+或[m]+。其中阳离子[(r)x'l*-h]+为具有+1正电荷的布朗斯特酸;h为氢;每一独立选择的r为h、卤化物、c2-20二烷基酰胺基、c1-20烃基或c1-20杂烃基;l*为选自由以下组成的群组的原子:n、p和s;x'为3(针对l*=n或p)且x'为2(针对l*=s);阳离子[(r10)3c]+为具有+1正电荷的碳阳离子;每一独立选择的r10为h、c1-20烃基或c1-20杂烃基;阳离子[m]+为具有+1正电荷的含有金属的阳离子。优选地,r独立地为c1-20烃衍生物或c1-20杂烃衍生物,优选c1-20烃基或c1-20杂烃基。优选地,l*为氮;x'为3;r中的至少一个包含至少6个碳原子且其它限制条件为(r)x'中的碳原子总数总共超过12。更优选地,r中的至少一个为c6-12芳基、c6-12芳基烷基或c14-20烷基。优选地,[(r)x'l*-h]+为双((c1-20)烃基)铵或三((c1-20)烃基)铵。如本文所使用,术语“铵”意指氮阳离子,其为((c1-20)烃基)4n+(四((c1-20)烃基)铵阳离子)、((c1-20)烃基)3n(h)+(三((c1-20)烃基)铵阳离子)、((c1-20)烃基)2n(h)2+(双((c1-20)烃基)铵阳离子)、((c1-20)烃基)n(h)3+(单((c1-20)烃基)铵阳离子)或n(h)4+(铵阳离子),其中每一独立选择的(c1-20)烃基可相同或不同。阳离子组分[(r)x'l*-h]+的说明性(但非限制性)实例为二(十八烷基)铵、二甲基苯铵、二己基苯铵、二(十八烷基)铵、甲基二(十八烷基)铵、(十六烷基)(甲基)十八烷基铵、二甲基咪唑鎓盐、乙基甲基咪唑鎓盐、二-叔丁基咪唑鎓盐。优选地,r10为c1-12烷基、c6-16芳基、c6-16芳基烷基或c6-16杂芳基。优选至少一个r10为经取代或未经取代的c6-20芳基,更优选两个独立选择的r10为经取代或未经取代的c6-20芳基,甚至更优选所有三个独立选择的r10为经取代或未经取代的c6-20芳基。优选地,r10为苯基、4-甲基苯基、2,4-二甲基苯基、2,4,6-三甲基苯基、4-甲氧基苯基、4-二甲氨基苯基或2,6-二甲氧基苯基。优选地,[(r10)3c]+为三苯基碳正离子(三苯甲基)。优选地,含有[m]+金属的阳离子为ag+或经取代或未经取代的二茂铁阳离子。优选的非配位、离子形成化合物(cat)d'+ad'-,其中可通过与所需a-配对所需(cat)+选择d'=1,以得到[(r)x'l*-h]+a-、[(r10)3c]+a-或[m]+a-。这些非配位、离子形成化合物的说明性(但非限制性)实例包括甲基二(十八烷基)铵四(五氟苯基)硼酸盐、二甲基苯铵四(九氟-叔丁氧基)铝酸盐、三辛基铵四(五氟苯基)硼酸盐、(十六烷基)(甲基)(十八烷基)铵四(五氟苯基)硼酸盐、(十六烷基)(甲基)(十八烷基)铵[b{3,5-(cf3)2c6h3}4]-、乙基甲基咪唑鎓盐[al{och(cf3)2}4]-、三苯基碳正离子四(四氟苯基)硼酸盐、二茂铁[ga(oc6f5)4]-、三(4-甲氧基苯基)碳[bf(c6f5)3]-和ag+[ta(oc6f5)6]-。在一些实施例中,表示为[(r)x'l*-h]+[b(r9)4]-的有机硼活化剂描述在wo2010/092554中。一种或多种活化剂用于形成具有配位化合物和铬源的催化剂系统。优选地,至少两种活化剂组合使用。也优选的为此类中性路易斯酸混合物与聚合或低聚铝氧烷的组合,以及单一中性路易斯酸(尤其三(五氟苯基)硼烷)与聚合或低聚铝氧烷的组合。在一些实施例中,至少两种活化剂来自同一类别(中性路易斯酸与中性路易斯酸;聚合或低聚铝氧烷与聚合或低聚铝氧烷;非聚合、非配位、离子形成化合物非聚合、非配位、离子形成化合物),例如三乙基铝与三(五氟苯基)甲硼烷;mao与mmao;甲基二(十八烷基)铵四(五氟苯基)硼酸盐与三苯基碳正离子四(九氟-叔丁氧基)铝酸盐;ag+[al(oc6f5)4]-与二茂铁[b{3,5-(cf3)2c6h3}4]-。更优选地,至少两种活化剂来自至少两种不同类别,例如三乙基铝与mmao;二乙基氯化铝与三苯基碳正离子[al{ocf(cf3)2}4]-;mmao与二甲基己基铵[al{ocf(cf3)2}4]-;mao与甲基二(十八烷基)铵[b{3,5-(cf3)2c6h3}4]-;三乙基铝与mmao和四(五氟苯基)硼酸盐。优选的活化剂组合包括包含三((c1-4)烷基)铝和卤化三((c6-16)芳基)硼化合物,尤其三(五氟苯基)甲硼烷的组合的中性路易斯酸的混合物。还涵盖了一种或多种前述活化剂与活化技术的组合。活化剂或活化剂的组合可在任何时间,在添加催化剂系统或其任何组分之前或与催化剂系统或其任何组分或与催化剂系统的部分同时或在已添加催化剂系统或其任何组分之后添加到反应物介质(例如乙烯和/或稀释剂和/或溶剂)中。此类技术为低聚领域中已知的且更详细地公开于例如美国专利第5,491,272号、第5,750,817号、第5,856,257号、第5,910,619号和第5,919,996号以及wo2008/146215和wo2007/007272中。这些参考文献以美国法律所允许的最大程度并入本文中。先前在以下uspn中已经关于不同金属-配体络合物教示多种活化剂和活化技术:us5,064,802;us5,153,157;us5,296,433;us5,321,106;us5,350,723;us5,425,872;us5,625,087;us5,721,185;us5,783,512;us5,883,204;us5,919,983;us6,696,379;以及us7,163,907。这些参考文献以美国法律所允许的最大程度并入本文中。适合的烃基氧化物的实例公开于us5,296,433中。适用于加成聚合催化剂的布朗斯特酸盐的实例在us5,064,802、us5,919,983、us5,783,512中公开。适用作加成聚合催化剂的活化剂的阳离子氧化剂和非配位相容性阴离子的盐的实例公开于us5,321,106中。适用作加成聚合催化剂的活化剂的碳离子盐的实例公开于us5,350,723中。适用作加成聚合催化剂的活化剂的碳离子盐的实例公开于us5,625,087中。醇、硫醇、硅醇以及肟与三(五氟苯基)甲硼烷的适合的络合物的实例公开于us5,296,433中。这些活化剂中的一些也描述于从第50列第39行开始且直到第56列第55行的us6,515,155b1的一部分中,其中仅部分以引用的方式并入本文中。用于烯烃低聚的活化剂可选自上文针对烯烃聚合教示的活化剂。在本发明的组合物中,铬(来自铬源或配位化合物-铬络合物)、一种或多种活化剂和含有磷环的配位化合物(包括来自配位化合物-铬络合物)可相对于彼此呈此类比例以提供约10:1到1:10,更优选约1.3:1到1:1.3,更优选约1.1:1到1:1.1的铬:配位化合物摩尔比;以及约100:1到1:50,000,优选约1:1到1:10,000,优选约1:1到1:3000,更优选约1:1到1:1000,更优选约1:1到1:500的铬:活化剂(例如铝化合物,包括铝氧烷;硼化合物,包括硼酸盐;镓化合物、非配位、离子形成化合物))摩尔比。在特别优选的实施例中,当活化剂选自硼化合物或非配位、离子形成化合物时,铬:活化剂摩尔比在约1:1到1:100,优选约1:1到1:10,更优选约1:1到1:2范围内。在特别优选的实施例中,当活化剂选自铝化合物,包括铝氧烷化合物时,铬:活化剂摩尔比在约1:1到1:10,000,优选约1:1到1:3000,更优选约1:1到1:1000,甚至更优选约1:1到1:500范围内。当一种或多种铝氧烷单独或一种或多种三((c1-4)烃基)铝化合物单独或组合用作活化剂时,优选地,一种或多种铝氧烷或一种或多种三((c1-4)烃基)铝化合物或所采用的组合使用的一种或多种铝氧烷和一种或多种三((c1-4)烃基)铝化合物的摩尔数目为一种或多种铬源或配位化合物-铬络合物的摩尔数目的至少100倍。当三(五氟苯基)甲硼烷单独用作活化剂时,优选地,所采用的三(五氟苯基)甲硼烷的摩尔数目比一种或多种铬源或配位化合物-铬络合物的摩尔总数目为0.5:1到10:1,更优选1:1到6:1,更优选1:1到5:1。其余活化剂一般以等于或高达一种或多种铬源或配位化合物-铬络合物的总摩尔数量的十倍的大约摩尔数量采用。活化剂化合物可任选地为固体材料或负载在不溶性固体材料上,例如如mao的铝氧烷和硼酸盐活化剂可负载在如氧化铝、二氧化硅、mgcl2等无机氧化物上。所述方法可进一步包括使用可充当还原或氧化试剂的活化剂化合物,如钠或锌金属等,(烃基)锌或(经取代的烃基)锌化合物、(烃基)镁或(经取代的烃基)镁化合物、烃基或经取代的烃基锂化合物等,或含氧化合物,例如氧等,或含有氯化物的化合物,例如二氯甲烷、氯仿等。烃基和经取代的烃基锌化合物包括单烃基锌卤化物或醇盐化合物和二烃基锌化合物,如甲基氯化锌、乙基氯化锌、异丙基溴化锌、2-氰基乙基溴化锌、烯丙基氯化锌、环戊基氯化锌、苯甲基溴化锌、苯基氯化锌、异丁基乙醇锌和丙基甲醇锌、4-二甲氨基苯基溴化锌、溴(2-乙氧基-2-氧代乙基)溴化锌、二甲基锌、二乙基锌、二乙烯基锌、二烯丙基锌、二丙基锌、二异丙基锌、二丁基锌、二辛基锌、二苯基锌和二苯甲基锌。所述方法还包括任选使用锌物质作为添加剂,如以引用的方式并入本文中的wo2011/048527中所描述。烃基和经取代的烃基镁化合物包括单烃基镁卤化物或醇盐化合物和二烃基镁化合物,如甲基氯化镁、乙基溴化镁、丁基碘化镁、丙基氯化镁、异丙基氯化镁、苯基溴化镁、4-二甲基氨基苯基溴化镁、苯甲基丁醇镁、二丁基镁、二辛基镁、丁基乙基镁、二异丙基镁、二己基镁和二苯甲基镁。烃基和经取代的烃基锂化合物包括甲基锂、乙基锂、丙基锂、异丙基锂、正丁基锂、仲丁基锂、异丁基锂、叔丁基锂、戊基锂、2,2-甲基丙基锂、己基锂、辛基锂、2-乙基己基锂、烯丙基锂、丙炔基锂、乙烯基锂、苯基锂、环戊基锂、环己基锂、苯甲基锂、4-二甲氨基苯基锂和4-甲氧基苯基锂。还预想前述烃基和经取代的烃基锌化合物、烃基和经取代的烃基镁化合物和烃基和经取代的烃基锂化合物的混合物,尤其与烷基铝化合物组合。活化剂化合物的另一有利的用途为发挥清除污染物的有益作用,所述污染物如可能存在的外源氧或水。低聚方法在一些实施例中,本发明提供一种用于选择性地低聚烯烃的方法,其包含在足以将至少一种烯烃的至少一部分转化成至少一种烯烃的至少一种低聚物的条件下,使至少一种烯烃与如上文所描述的催化剂系统操作性接触,所述催化剂系统包含:a)铬源、b)一种或多种活化剂以及c)如本文所描述的至少一种含有磷环的配位化合物。如上文所描述,催化剂系统可包含分离的配位化合物-铬络合物。催化剂系统的组分可以任何顺序接触。低聚方法包括用于至少一种烯烃,优选至少一种α-烯烃的三聚和/或四聚的方法。在一个实施例中,可使用两种或更多种不同类型的配体改变所产生的1-己烯和1-辛烯的相对量。举例来说,主要产生1-己烯的一种或多种配体可与主要产生1-辛烯的一种或多种配体组合使用以便实现特定1-己烯:1-辛烯产生比率。待低聚的至少一种烯烃可包含单一烯烃或烯烃的混合物。在本发明的一个实施例中,其可包含单一烯烃。烯烃可包括多个碳-碳双键,但优选地,其包含单一碳-碳双键。至少一种烯烃可包含具有2到30个碳原子,优选2到10个碳原子的α-烯烃。.在本发明的方法中,待低聚的至少一种烯烃可选自包含以下的群组:乙烯(ethene或ethylene)、丙烯(propene或propylene)、1-丁烯、异丁烯、1-戊烯、1-己烯、1-庚烯、1-辛烯、1-壬烯、1-癸烯、1-十二烯、2-甲基-1-丙烯、3-甲基-1-丁烯、3-甲基-1-戊烯、4-甲基-1-戊烯、苯乙烯、对甲基苯乙烯或其混合物。优选地,至少一种烯烃包含乙烯、丙烯、1-己烯或1-辛烯,更优选乙烯。烯烃的混合物可用于形成混合的低聚产物,优选乙烯以及1-己烯和/或1-辛烯。产物流包含根据本发明形成的低聚产物。优选地,至少一种低聚物包含己烯或辛烯,优选1-辛烯与1-己烯的混合物。在低聚方法中形成的己烯或辛烯,优选1-辛烯与1-己烯的混合物的质量与低聚方法的反应产物(产物流)的总质量比率(重量分率)在10重量%到100重量%,优选50重量%到100重量%,更优选70重量%到100重量%,甚至更优选80重量%到100重量%,还甚至更优选85重量%到100重量%,最优选90重量%到100重量%范围内。可通过选择催化剂系统和低聚条件选择1-己烯:1-辛烯重量比率且在1000:1到1:1000,优选100:1到1:100,更优选10:1到1:10,甚至更优选4:1到1:10,甚至更优选2:1到1:5范围内。1-己烯:1-辛烯重量比率可在1000:1到100:1;100:1到10:1;以及10:1到3:1;优选3:1到2:1;2:1到1:1;以及1:1到1:2;更优选1:2到1:3;以及1:3到1:4;甚至更优选1:4到1:10;1:10到1:100;以及1:100到1:1000范围内。低聚方法的反应产物可取决于催化剂系统性质和反应条件,除了1-己烯和1-辛烯之外,也包含聚合物副产物(“聚合物”,例如烯烃蜡、聚乙烯);环状物和c6和c8异构体(例如甲基环戊烷、亚甲基环戊烷、烯丙基环戊烷、丙基环戊烷或己二烯);特定更高级低聚物,尤其c10-18烯烃低聚物(其可由乙烯、1-己烯或1-辛烯的混合低聚产生)的不同数量。使用本发明的方法,在乙烯的三聚和四聚中产生的聚合物副产物的量典型地为至多约10wt%。在商业操作中需要乙烯的三聚和四聚中产生的低水平的固体烯烃蜡和聚乙烯(包括低到无),因为此可减少反应器设备积垢量,减少废弃物副产物量且减少操作“停工时间”量,归因于反应器设备的维持和清洁。优选地,相对于反应产物的总质量,聚合物副产物的总质量分数在零重量%到10重量%,优选零到5重量%,且更优选零重量%到2重量%,甚至更优选零重量%到1重量%,最优选零重量%到二分之一重量%范围内。在一个实施例中,可在添加剂存在下进行低聚以控制选择率、增强活性和减少低聚方法中形成的聚合物量。在一个实施例中,氢气(h2)、硅烷、卤化物来源(尤其公开于zhang等人的美国专利第7,786,336号中的卤化物源)等可用于催化组合物或另外引入方法中。在一些实施例中,烯烃低聚方法中产生的聚合物的量可通过提供和/或控制烯烃生产方法的氢气、硅烷和/或卤化物源的分压或浓缩而减小。同时应注意,氢气、硅烷和/或卤化物源的存在不一定需要产生具有可接受的数量的聚合物的低聚产物,通过低聚方法产生的聚合物的量可进一步通过氢气、硅烷和/或卤化物源的存在而减少。其它(任选的)添加剂包括抗静电剂(如以商标出售的聚砜聚合物)和/或碳氟化合物以缓和反应积垢。使用氢气为尤其优选的。如本文所描述的低聚物产物可使用所公开的催化剂系统,在均匀液相反应中,在惰性溶剂存在或不存在下,和/或在浆料反应物中制备,其中催化剂系统呈显示较小或无溶解度的形式,和/或在二相液体/液体反应物中,和/或在本体相反应物中,其中纯反应剂和/或产物烯烃充当主导介质,和/或在气相反应物中,使用常规设备和接触技术。低聚方法可在惰性溶剂或惰性溶剂的混合物中进行。惰性溶剂或惰性溶剂的混合物有时称为组成溶剂。惰性溶剂为实质上不干扰低聚方法的一种溶剂,尤其惰性溶剂选自由以下组成的群组:烃,例如丁烷、戊烷、己烷、庚烷、辛烷、壬烷、癸烷、环己烷、甲基环戊烷、甲基环己烷、1-己烯、1-辛烯、苯、甲苯、二甲苯、乙苯、均三甲苯、枯烯或商业饱和烃混合物,如isopar-etm,尤其饱和c6-c20(非环状和环状)烃,如戊烷、己烷、庚烷、辛烷、isopar-etm、环戊烷、环己烷、甲基环己烷;中性路易斯碱,例如thf、二乙醚、乙腈;氯化烃,例如氯仿、二氯甲烷、二氯乙烷、三氯乙烷、四氯乙烷、氯苯、1,2-二氯苯;以及离子性液体。优选地,惰性溶剂或惰性溶剂的混合物选自由以下组成的群组:饱和烃和氯化烃或其混合物。尤其优选的为环己烷、甲基环己烷、氯苯和1,2-二氯苯。前述的混合物也为适合的。组成溶剂可以包含待低聚烯烃的馈料流形式引入低聚反应器中或可单独地添加。根据本发明的另一方面,提供一种用于烯烃低聚的方法,其中低聚方法的产物为烯烃或烯烃的混合物,尤其1-己烯与1-辛烯的混合物,且以产物流的重量计构成超过30wt%方法的产物流。在本发明的方法的一个方面中,提供包含至少一种待低聚烯烃的烯烃馈料流(“馈料流”),其中至少一种烯烃选自包含以下的群组:乙烯(ethene或ethylene)、丙烯(propene或propylene)、1-丁烯、异丁烯、1-戊烯、1-己烯、1-庚烯、1-辛烯、1-壬烯、1-癸烯、1-十二烯、2-甲基-1-丙烯、3-甲基-1-丁烯、3-甲基-1-戊烯、4-甲基-1-戊烯、苯乙烯、对甲基苯乙烯或其混合物。优选地,至少一种烯烃包含乙烯、丙烯、1-己烯或1-辛烯,更优选乙烯。根据本发明的另一方面,低聚方法包括以下步骤:使包含待低聚烯烃的馈料流与如上文所描述的催化剂系统接触,且其中低聚方法的产物或产物流包含烯烃或烯烃的混合物,尤其1-己烯和/或1-辛烯,且烯烃或烯烃的混合物,尤其1-己烯和/或1-辛烯构成方法的形成的总产物或产物流的10wt%到100wt%,优选20wt%到100wt%,优选30wt%到100wt%,优选40wt%到100wt%,优选50wt%到100wt%,优选60wt%到100wt%,优选85wt%到100wt%,其中方法的产物流包含低聚方法的反应产物、催化剂系统残余物、任选的溶剂和所述方法中采用的任何任选的添加剂。包含待低聚烯烃的馈料流可以连续或分批方式引入根据本发明的方法中。馈料流可以液体或气态形式引入方法中。除了待低聚烯烃之外,馈料流可包含组成溶剂和再循环物料流的组分。再循环物料流可包含再循环溶剂、再循环烯烃以及各种再循环低聚产物,包括1-己烯、1-辛烯、甲基环戊烷、亚甲基环戊烷、更高级低聚物,其可由乙烯、1-己烯或1-辛烯和聚合物的混合低聚产生。优选地,再循环物料流不包含聚合物或仅包含微量允许量的聚合物。必要时,可与馈料流分开,将来自再循环物料流的组分中的至少一些引入方法中,或替代地,可与馈料流一起,将来自再循环物料流的组分中的至少一些引入方法中。优选地,以不包括溶剂的馈料流的总重量计,至少一种待低聚烯烃构成5wt%到100wt%馈料流,优选20wt%到100wt%馈料流,更优选50wt%到100wt%馈料流,甚至更优选75wt%到100wt%馈料流,更优选90wt%到100wt%馈料流,且甚至更优选95wt%到100wt%馈料流。低聚方法可在大气压到50000kpa(500巴)的压力下进行。在1000-7000kpa(10-70巴)范围内的乙烯压力为优选的。尤其优选的压力在3000-5000kpa(30-50巴)范围内。低聚方法可在-100℃到250℃的温度下,优选在15℃到130℃的温度下,更优选在35℃到100℃,更优选40℃到90℃,甚至更优选50℃到80℃的温度下进行。尽管可在单程基础上采用催化剂系统、其个别组分、反应剂、溶剂和反应产物,但这些材料中的任一种可且实际上优选在一定程度上再循环以便使生产成本降到最低,尤其在溶剂和待低聚的未反应烯烃方面。在本发明的一个实施例中,根据本发明的催化剂系统或其个别组分也可通过将其负载在负载材料上固定化,所述负载材料例如二氧化硅、氧化铝、氧化锆、二氧化钛、mgcl2、nacl、沸石、粘土,包括人造锂蒙脱石或蒙脱石粘土,如laponitetmrd、碳,例如石墨、石墨烯或碳黑或其混合物;或负载在例如聚乙烯、聚丙烯、聚苯乙烯或聚(氨基苯乙烯)的聚合物上。固定化催化剂系统的优势为可进行低聚方法以使得馈料流和产物流连续地或半连续地流动通过反应器,同时催化剂系统实质上保留在反应器中。催化剂系统可在负载材料存在下原位形成,或负载物可用催化剂系统或低聚催化剂的组分中的一种或多种同时或依次预浸渍或预混合。在一些情况下,负载材料也可充当活化剂组分。此途径将也促进催化剂系统或来自反应混合物的其组分中的任一种的回收以便再使用。举例来说,t.monoi和y.sasaki,《分子催化杂志a:化学(j.mol.cat.a:chem.)》,2002,187,135-141用基于铬的乙烯三聚催化剂成功地证明了这一概念。在一些情况下,负载物也可充当催化剂系统组分,例如其中此类负载物含有铝氧烷官能团或其它活化剂或其中负载能够进行与活化剂类似的化学功能。在本发明的一个实施例中,固定在负载物上可包括例如经由官能基,含有磷环的配位化合物与负载物的化学键结。含有磷环的配位化合物可包括聚合部分以使得催化剂系统或铬源的反应产物和所述配位化合物在较高温度下为可溶的且在例如25℃的较低温度下为不可溶的。此途径可实现从反应混合物回收络合物以供再使用且已用于其它催化剂,如d.e.bergbreiter等人,《美国化学学会杂志(j.am.chem.soc.)》,1987,109,177-179所描述。按同样的方式,催化剂系统或配位化合物也可通过使催化剂系统或配位化合物与二氧化硅、硅胶、聚硅氧烷或氧化铝主链键结来固定化,如例如用于固定铂络合物的c.yuanyin等人,《中国反应方针杂志(chinesej.react.pol.)》,1992,1(2),152-159所证明。本发明的一个实施例为含有含有磷环的配位化合物的聚合负载物(例如聚苯乙烯(ps)、聚(甲基丙烯酸甲酯)(pmma)、聚(丙烯酸甲酯)(pma)),其具有存在的氨基或膦基官能基,借助于所述官能基含有磷环的配位化合物以化学方式键合到聚合负载物。在非限制性实例中,可形成含有含有磷环的配位化合物的聚合负载物,因为二氢氨基烷基官能化ps、ppm或pma负载物的二氢氨基烷基的氮原子并入含有磷环的配位化合物的y基团中。在其它非限制性实例中,含有含有磷环的配位化合物的聚合负载物在用含有磷环的配位化合物官能化的乙烯基芳基、甲基丙烯酸酯或丙烯酸酯单体的聚合后形成。本发明的一个实施例为包含含有含磷环的配位化合物的聚合负载物、铬源和至少一种活化剂的负载型催化剂系统。在本发明的一个实施例中,负载型催化剂系统可通过使含有含磷环的配位化合物的聚合负载物与铬源和至少一种活化剂接触形成。在一些实施例中,本发明提供串联低聚,优选三聚和/或四聚和聚合方法,其中呈乙烯形式的烯烃使用本发明的催化剂系统低聚以产生包含选自1-己烯和1-辛烯的单体的单体混合物,且来自混合物的至少一种单体使用聚合催化剂与乙烯原位共聚且其中低聚和聚合在相同反应介质中进行。在一些实施例中,本发明提供聚合方法,其中聚合方法的馈料流包含低聚方法的低聚物产物的至少一部分。本发明的低聚方法可在包括任何类型的反应器,尤其混合反应器的工厂中进行。此类反应器的实例包括(但不限于)分批反应器、半分批反应器和连续反应器。工厂可组合包括a)反应器,b)至少一个进入此反应器的入口管线,其用于烯烃反应物和催化剂系统,c)此反应器的流出管线,其用于低聚反应产物,和d)至少一个分离器,以分离所需低聚反应产物,其中催化剂系统包含如本文所描述的铬源、含有磷环的配位化合物和至少一种活化剂。术语“混合反应器”意指传达其常规意义,即,含有搅动器或混合系统的反应器。连续搅拌槽反应器(“cstr”)一般为优选的。然而,通过循环泵提供混合的环管反应器也为适合的(且所属领域的技术人员熟知此类反应器且用于商业用途)。使用cstr一般为优选的,因为需要维持基本上均匀的反应器条件,即,如所属领域的技术人员将了解,充分混合的cstr将提供均匀反应器条件(相比于活塞流或管状反应器,其中反应器条件在入口和排放口典型地极不同)。可使用超过一个cstr。尽管单一cstr为优选的,但(任选地)使用额外管状反应器也在本发明的范围内。如果采用管状反应器,那么其将放置于cstr下游。管状反应器(如果使用的话)将提供一些额外乙烯转化率,从而减少从排放口回收/再循环乙烯的需要。术语“连续流”意指传达其常规意义,即,将反应物连续地添加到反应器中且连续地抽取产物。在所述方法的另一实施例中,反应器和分离器可接触以促进反应产物同时形成和从反应器分离这些化合物。此方法原理通常已知为反应性蒸馏。当催化剂系统在溶剂或反应产物中不展现溶解度且固定在反应器中以使得其不随着反应器产物、溶剂和未反应烯烃退出反应器时,方法原理通常已知为催化性蒸馏。如本文所描述,催化剂系统可在反应器中原位形成或可在反应器外部预先形成,且随后添加到反应器中。有利地,低聚方法可在惰性条件下进行,即,在实质上氧和/或干扰低聚方法的其它物质不存在下进行。尽管不希望受理论束缚,但据相信,在反应期间产生的1-己烯和/或1-辛烯可自身变成次级反应的反应物,所述次级反应可产生在方法条件下形成的c10+低聚物。在本发明的一个实施例中,低聚方法可形成特定更高级c10-18烯烃低聚物,其由乙烯、1-己烯或1-辛烯的混合低聚产生。尽管此类c10-18低聚物可用于制得水性洗涤剂调配物的表面活性剂,但大部分c10+低聚物具有相对较低价值,因此需要限制其产生量。在本发明的方法的一个实施例中,可在连续方法中使用某些特定条件改进产物选择率。更具体来说,可通过使用较低铬浓度且通过维持反应器中的较低1-己烯和/或1-辛烯浓度来提高选择率。可使用更低低聚温度实现进一步改进,因此低温为优选的(即使低温对于连续方法来说为“不够的”)。低温为优选的以便提高1-辛烯:1-己烯比率。在这个实施例中,本发明提供:用于乙烯低聚的连续流方法,所述方法包含i)将乙烯和溶剂添加到混合反应器中且在低聚条件下使所述乙烯与如上文所描述的催化剂系统接触;ii)从所述反应器移出包含1-己烯、1-辛烯、c10+低聚物、溶剂和任选的聚合物的产物排放物料流;以及iii)控制所述溶剂流动到所述反应器中以使得产物排放物料流含有以产物排放物料流(低聚方法的反应产物、催化剂系统残余物、溶剂和方法中采用的任何任选的添加剂)的重量计1到30组合重量%1-己烯和1-辛烯,优选2到25组合重量%1-己烯和1-辛烯,更优选3到20组合重量%1-己烯和1-辛烯,其中所述方法的另一个特征为在0.01到50微摩尔cr,优选0.05到20微摩尔cr,更优选0.1到5微摩尔cr的催化剂浓度下进行。本发明的此实施例的其它优选的元素为基于蒸汽-液体平衡,使用3到15重量%,尤其5到10重量%的乙烯浓度。如上文所提及,本发明的方法的此实施例需要控制/限制反应器中的1-辛烯浓度。在连续流方法中,可通过调节溶剂流速和反应速率来控制反应器中的1-辛烯浓度。举例来说,提高溶剂流速将稀释1-辛烯浓度且降低催化剂浓度将降低反应速率。在此方法中需要较低催化剂浓度(小于每升50×10-6摩尔cr,优选小于每升5×10-6摩尔cr),且低温为优选的,其中反应器温度优选为25到100℃,更优选为35到85℃,甚至更优选为40到70℃。适合的溶剂包括上文所描述的溶剂,尤其饱和c6-c20(非环状和环状)烃,如戊烷、己烷、庚烷、辛烷、isopar-etm、环戊烷、环己烷、甲基环己烷;以及未经取代和经取代的芳香族烃,如甲苯、二甲苯、乙苯、枯烯、均三甲苯、氯苯和二氯苯。出于安全性和或产品质量原因,通常需要在低聚方法中的一定时间点,例如在完成所需低聚水平之后或在失控反应的情况下,使催化剂系统去活。在本发明的一个实施例中,催化剂系统将在反应器中的低聚完成后,在其离开反应器时或其后不久去活。一般来说,多种极性化合物(如水、醇和羧酸)将使催化剂去活。使用醇、胺和/或羧酸为优选的且涵盖这些的组合。优选的去活化剂包括水、甲醇、乙醇、丙醇、丁醇、甲胺、二甲胺、乙胺、二乙胺、丙胺、二丙胺、丁胺、二丁胺、甲酸、乙酸、丙酸或丁酸。一般发现,用以使催化剂去活的数量足以提供约0.1到约4,尤其1到2之间的去活化剂与金属(来自催化剂+活化剂)摩尔比(因此,当mao为活化剂时,基于cr摩尔+al摩尔的比率,提供去活化剂)。去活化剂可在挥发性未反应反应剂/稀释剂和产物组分分离之前或之后添加到低聚产物流中。如果发生失控反应(例如温度快速升高),可立刻将去活化剂馈入到低聚反应器中以终止反应。去活化系统还可包括碱性化合物(如氢氧化钠)以使产物的异构化降到最低(因为去活化条件可促进所需α烯烃异构化成非所需内烯烃)。聚合物去除(且任选地,催化剂去除)优选在催化剂去活化之后。可存在两种类型的聚合物,即溶解于方法溶剂中的聚合物和以固体或“浆料”形式存在的不溶解的聚合物。固体/不溶解聚合物可使用以下类型设备中的一个或多个分离:离心机;旋流器(或水力旋流器)、装备有撇渣器或过滤器的倾析器。优选的设备包括以名称v-自动粗滤器出售的所谓的“自洁过滤器”;自洁筛网,如明尼苏达州新布莱顿的约翰逊筛网公司(johnsonscreensinc.ofnewbrighton,minn.)出售的那些;以及离心机,如弗吉尼亚州里士满的阿法拉伐公司(alfalavalinc.ofrichmond,va.)出售的那些(包括以商标出售的那些)。可溶性聚合物可通过两个相异的操作与最终产物分离。首先,保持可溶于最重产物部分(c20+)中的低分子量聚合物可留在所述部分中。此部分将从蒸馏操作(下文所描述)回收为“底部残留物”。此溶液可用作发电系统的燃料。替代聚合物分离包含由从溶液去除溶剂引起的聚合物沉淀,继而使用常规挤压机回收沉淀的聚合物。溶液聚合领域的技术人员熟知此类分离/回收所需的技术且广泛公开于文献中。在另一实施例中,残余催化剂用使得催化剂中的一些或全部沉淀的添加剂处理。沉淀的催化剂优选与去除副产物聚合物同时(且任选地使用相同设备)从产物中去除。上文列出的催化剂去活化剂中的多种也将使催化剂沉淀。在优选实施例中,将固体吸附剂(如粘土、二氧化硅或氧化铝)添加到去活化操作中以促进通过过滤或离心去除失活的催化剂。反应器积垢(由聚合物和/或催化剂残余物沉积引起)可能(如果足够严重)导致过程中断以便清洁。可通过已知的手段,尤其使用高压喷水口或使用热溶剂冲刷去除沉积物。对于溶剂冲刷,使用芳香族溶剂(如氯苯)一般为优选的,因为其为聚乙烯的良好溶剂。现将借助于以下非限制性实例进一步描述本发明。实例在惰性氛围下,使用希莱克管线(schlenkline)技术,在手套箱外部进行在低于-50℃的温度下进行的所有制备反应。在高压下进行的所有制备反应在手套箱外部进行。取决于高压制备反应,所涉及的反应器可在手套箱中装载。除非另外规定,否则所有其它反应在惰性(氮气或氩气)氛围手套箱中进行。所有商购化学物质获自西格玛-阿尔德里奇公司(sigma-aldrichcorporation)、安可乐斯有机物公司(acrosorganics)、施特雷姆公司(stremcorporation)、奥克伍德化学公司(oakwoodchemical)、奥克斯化学公司(oxchemcorporation)或赛默飞世尔科技公司(thermofisherscientific,inc.)。如下纯化制备反应中使用的溶剂:非氯化溶剂(例如四氢呋喃(thf)、甲苯、己烷、二乙醚)以类似于pangborn等人(“用于溶剂纯化的安全和适宜程序”pangborn,a.b.;giardello,m.a.;grubbs,r.h.;rosen,r.k.;timmers,f.j.《有机金属化合物(organometallics)》1996,15,1518-1520)的方法的方式,通过将脱气溶剂传送通过活化a204氧化铝和负载的铜基反应性清除剂(q5反应物)的管柱以分别去除水和痕量氧来纯化。通过储存在活化分子筛上或通过传送通过活化a2氧化铝来干燥其它溶剂(戊烷、二氯甲烷、氯仿、氯苯)。溶剂储存在活化分子筛上。a2氧化铝和a204氧化铝通过在干燥氮物料流下在300℃下加热8小时来活化。通过在干燥氮物料流下在250℃下加热4小时来活化分子筛。手套箱内的环境温度可在25摄氏度(℃)到30℃范围内改变。除非另外规定,否则nmr数据在室温下用瓦里安(varian)400mhz或500mhz设备获得。基于外观和通过一级分析获得的nmr光谱峰的多重性和偶合常数报导如下:s,单重峰;d,二重峰;t,三重峰;q,四重峰;p,五重峰。在一些情况下,光谱可为二级的。“克”的单位缩写为“g”;“毫摩尔”的单位缩写为“mmol”。磷环配体和其cr络合物的实验信息配位化合物制备实例制备((外消旋)-n-(二苯基磷烷基)-n-甲基-2,5-二苯基磷烷-1-胺),l553步骤1.制备1-[(n,n)-二甲基氨基]-1-r-氧代-2-t,5-t-二苯基-环磷-3-烯在手套箱中,向氯化铝(22.84g,171.3mmol)和50ml无水二氯甲烷中装入200ml罐。将所述罐放置于-30℃下的冷冻器中15分钟,随后移出。将二甲基亚磷酰胺二氯化物(25.00g,171.3mmol)添加到经搅拌的悬浮液中。在所有事物溶解后,从手套箱中移出罐且将内含物转移到500ml装备有加料漏斗和氮气入口的三颈圆底烧瓶中。在冰浴中冷却烧瓶和其内含物。在手套箱中,历经45分钟时间段,使1,4-二苯基丁二烯(32.12g,155.7mmol)溶解于无水二氯甲烷(约200ml)中,转移到加料漏斗中,在氮气氛围下缓慢添加到反应混合物中。在1小时之后,通过31pnmr光谱分析显示反应完成。将溶液转移到加料漏斗中且缓慢添加到经冷却的nta(氮基三乙酸)(37.21g,194.6mmol)于300ml水性饱和nahco3溶液中的混合物。在0℃下剧烈搅拌两相混合物1小时,同时在氮气下通过31pnmr光谱分析检查完成。在完成后,使混合物过滤通过硅藻土且转移到分液漏斗中。分离有机层。用二氯甲烷(2×100ml)萃取水层。有机层用饱和nahco3(100ml)、1mhcl(100ml)和盐水(100ml)洗涤,经mgso4干燥,浓缩且干燥以产生呈淡橙色固体状的产物。产率(42.2g,91.3%)。将产物储存于干燥箱中。1hnmr(400mhz,c6d6)δ7.23(ddt,j=8.1,2.3,1.2hz,4h),7.09(tq,j=6.8,0.8hz,4h),7.04-6.98(m,2h),6.09(dd,j=27.9,1.0hz,2h),4.26-4.14(m,2h),1.81(d,j=8.1hz,6h).13cnmr(101mhz,c6d6)δ136.91(d,j=8.2hz),131.05(d,j=15.8hz),129.01(d,j=2.6hz),127.71(d,j=4.7hz),127.15(d,j=2.7hz),50.09,49.38,36.47(d,j=1.5hz).31pnmr(162mhz,c6d6)δ66.51。步骤2.制备1-[(n,n)-二甲基氨基]-1-r-氧代-2-t,5-t-二苯基-磷杂环戊烷在不在手套箱中进行的反应中,向装备有底部过滤器的干净的通过泄漏测试的250ml压力反应器中中装入1-[(n,n)-二甲基氨基]-1-r-氧代-2-t,5-t-二苯基-环磷-3-烯(37.00g,124.4mmol)、5%pd-c(3.973g,37.33mmol)和甲醇(约150ml)。用氢气将反应器加压到700磅/平方英寸(psi)(4.83兆帕(mpa))且用700rpm搅拌加热到60℃。在2.5小时之后,对反应物进行取样且通过31pnmr光谱分析来分析出转化率为91%。用氢气将反应器再加压到708psi(4.88mpa)且使反应持续过夜。在22小时再次检查反应混合物且测定为完成。通过底部过滤器,使反应器清空到圆底烧瓶中,产生透明淡黄色溶液。用甲醇(2×20ml)洗涤反应器且同样采集那些洗涤液。浓缩组合溶液以产生呈淡黄色固体状的产物。产率(35.6g,95.4%)。1hnmr(400mhz,c6d6)δ7.25-7.21(m,4h),7.15-7.08(m,4h),7.02(tt,j=7.3,1.5hz,2h),3.55(dt,j=22.7,7.5hz,2h),2.20-1.87(m,4h),1.76(dd,j=8.1,1.6hz,6h).13cnmr(101mhz,c6d6)δ138.15(d,j=5.5hz),128.92(d,j=2.0hz),127.68(d,j=4.9hz),126.76(d,j=2.4hz),46.53,45.81,35.82(d,j=2.3hz),26.80(d,j=12.9hz).31pnmr(162mhz,c6d6)δ63.80。步骤3.制备(外消旋)-1-(二甲氨基)-2,5-二苯基磷烷1-氧化物向400ml罐中装入1-[(n,n)-二甲基氨基]-1-r-氧代-2-t,5-t-二苯基-磷杂环戊烷(35.00g,116.9mmol)、甲醇(250ml)和搅拌棒且放置于冷冻器中几小时。从冷冻器中移出冷罐,将热电偶添加到罐中,且缓慢添加25wt%甲醇钠于甲醇(63.16g,292.3mmol)(2.5当量)中的溶液,同时监测温度以避免大量放热。反应温度在-12℃下开始且在添加结束之前上升到-3℃。在反应物溶解(5分钟)之后,移出等分试样以用于分析。用几滴1mhcl处理样品且用甲苯萃取。浓缩溶液且通过31pnmr进行分析,其显示33%反应物转化成所需产物。在2小时之后再次检查反应物且测定出75%转化成所需产物。在4小时总反应时间之后,再次取样反应物且测定为完成。从手套箱中移出反应混合物,用hcl(1m,150ml)缓慢水解,且用甲苯萃取。有机层用水和盐水洗涤,经无水硫酸镁干燥,过滤且浓缩以产生呈淡黄色固体状的产物。产率(28.7g,82.0%)。1hnmr(400mhz,c6d6)δ7.42(dddd,j=8.3,1.8,1.2,0.5hz,2h),7.25-7.21(m,2h),7.18-7.09(m,4h),7.10-7.01(m,2h),3.49(ddd,j=24.5,12.9,7.5hz,1h),2.91-2.80(m,1h),2.05(d,j=8.8hz,6h),1.99-1.84(m,3h),1.62-1.48(m,1h).13cnmr(101mhz,c6d6)δ137.82(dd,j=30.4,4.9hz),129.56(d,j=5.1hz),128.57(dd,j=5.9,1.9hz),127.44(d,j=5.0hz),126.82(d,j=2.0hz),126.46(d,j=2.6hz),48.07,47.33,43.08,42.31,35.69(d,j=2.4hz),30.36(d,j=11.8hz),27.30(d,j=9.0hz).31pnmr(162mhz,c6d6)δ56.39。步骤4.制备(外消旋)-1-氯-2,5-二苯基磷烷在甲苯(125ml)中混合(外消旋)-1-(二甲氨基)-2,5-二苯基磷烷1-氧化物(12.0g,40.1mmol)。添加吡啶(4.05ml,50.1mmol)和三氯硅烷(4.50ml,44.1mmol)且在环境温度下搅拌混合物过夜(约24小时)。将戊烷(20ml)添加到所得浆料中且使混合物过滤通过一次性烧结过滤器。将滤液浓缩到干燥。使所得黄色油溶解于乙腈(无水级别,储存在分子筛上,140ml)中且用戊烷(2×30ml)洗涤。随后将乙腈层浓缩到干燥。随后使液体溶解于己烷(50ml)中且传送通过较小酸性氧化铝塞。用另外40ml己烷冲洗氧化铝。浓缩滤液以产生呈黄色液体状的产物。产率(6.1g,84%)。1hnmr(400mhz,c6d6)δ7.21-6.91(m,10h),3.69(td,j=8.8,2.3hz,1h),3.06(ddd,j=33.4,12.3,5.7hz,1h),2.44-2.18(m,2h),2.05-1.90(m,1h),1.58-1.43(m,1h).13cnmr(101mhz,c6d6)δ141.93(d,j=19.6hz),137.09,129.06,128.55,128.27(d,j=44.7hz),126.80(d,j=2.3hz),58.18(d,j=32.2hz),53.66(d,j=32.9hz),34.70(d,j=2.7hz),31.93(d,j=3.2hz).31pnmr(162mhz,c6d6)δ137.59。步骤5.制备(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺将(外消旋)-1-氯-2,5-二苯基磷烷(5.30g,19.2mmol)于己烷(50ml)中的溶液添加到含正丁胺(5.72ml,57.8mmol)的150ml己烷中。在搅拌30分钟之后,移出样品以用于nmr光谱分析。分析显示完全转化成所需产物。使所得浆料过滤通过中性氧化铝塞。用额外25ml己烷冲洗氧化铝。在真空下浓缩滤液以产生呈淡黄色油状的产物。产率(5.9g,98%)。1hnmr(400mhz,c6d6)δ7.26(dt,j=8.0,1.6hz,2h),7.20-7.06(m,6h),7.06-6.96(m,2h),3.00(ddd,j=21.7,12.5,6.0hz,1h),2.87(dt,j=12.6,6.6hz,1h),2.43-2.26(m,1h),2.22-2.04(m,2h),2.01(qd,j=7.2,5.5hz,1h),1.78(qdd,j=12.5,5.1,2.6hz,1h),1.52(qdd,j=12.6,5.1,2.5hz,1h),1.03-0.93(m,1h),0.92-0.74(m,4h),0.61(t,j=7.1hz,3h).13cnmr(101mhz,c6d6)δ144.33(d,j=18.3hz),140.20,128.69(d),128.45(d,j=1.3hz),128.20(d,j=3.4hz),127.92,125.74(dd,j=37.2,2.2hz),55.75(d,j=14.3hz),50.39(d,j=23.1hz),47.67(d,j=22.6hz),35.43(d,j=6.6hz),34.18(d,j=2.7hz),31.71(d,j=2.2hz),19.98,14.05.31pnmr(162mhz,c6d6)δ73.36。步骤6.制备(外消旋)-n-(二苯基磷烷基)-n-甲基-2,5-二苯基磷烷-1-胺,l553使(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.25g,0.93mmol)和三乙胺(142μl,1.02mmol)溶解于甲苯(5ml)中。同样使碘代联苯基膦(0.29g,0.93mmol)溶解于甲苯(5ml)中。在冷冻器中使两种溶液冷却到-30℃。将碘代联苯基膦溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺和三乙胺的溶液中,使得固体立即形成。通过31p-nmr分析样品,其显示完全转化成产物。过滤溶液且在减压下浓缩滤液。使残余物溶解于乙醚(15ml)中且在浓缩成粘稠的黄色油之前再次过滤。将戊烷(5ml)添加到油中,搅拌溶液1分钟,且随后再次浓缩,产生呈白色固体状的所需产物。产率(3.8g,94%)。1hnmr(400mhz,c6d6)δ7.53-7.38(m,4h),7.37-7.20(m,4h),7.20-7.04(m,8h),7.04-6.84(m,5h),4.08(ddt,j=12.1,7.5,4.5hz,1h),3.35(ddd,j=23.9,13.2,5.6hz,1h),3.23-2.85(m,3h),2.56-2.34(m,1h),2.32-2.10(m,1h),1.76-1.46(m,1h),0.83-0.51(m,3h),0.43(d,j=14.2hz,3h).13cnmr(101mhz,c6d6)δ144.40(d,j=21.0hz),140.58(d,j=22.2hz),139.18(d,j=2.4hz),138.55(d,j=16.6hz),133.10(d,j=20.2hz),132.07(d,j=20.1hz),128.84(dd,j=3.5,1.7hz),128.46,128.32(t,j=4.8hz),128.21-128.03(m),127.60,127.54,55.48(dd,j=21.9,18.5hz),54.29(dd,j=31.8,4.8hz),51.82(dd,j=22.9,3.4hz),36.64(d,j=2.3hz),33.58(d,j=6.5hz),32.87(dd,j=7.7,3.4hz),19.59,13.40.31pnmr(162mhz,c6d6)δ98.98(d,j=23.5hz),57.64(d,j=23.4hz)。hrms(esi-tof)m/z:对于c32h35np2,[m+h]+计算值为496.2318;实验值为496.2327。制备(外消旋)-n-丁基-n-(二乙基膦基)-2,5-二苯基磷烷-1-胺,l565制备(外消旋)-n-丁基-n-(二乙基膦基)-2,5-二苯基磷烷-1-胺,l565将(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.25g,0.80mmol)和三乙胺(112μl,0.80mmol)与甲苯(3ml)组合。添加氯二乙膦(98μl,0.80mmol)且在室温下搅拌混浊混合物2小时。31pnmr光谱分析指定完全转化成产物。在真空下去除挥发物且将残余物与乙醚混合且传送通过较小活化中性氧化铝塞。从滤液中去除挥发物以产生呈无色油状的产物。产率(0.27g,84%)。1hnmr(400mhz,c6d6)δ7.47-7.32(m,4h),7.22(dt,j=15.8,7.7hz,4h),7.15-7.00(m,2h),3.88(ddt,j=11.8,7.8,4.1hz,1h),3.29(ddd,j=24.4,13.1,5.8hz,1h),2.97-2.58(m,3h),2.51-2.32(m,1h),2.12(tt,j=10.6,5.3hz,1h),1.75-1.50(m,1h),1.50-1.28(m,2h),1.27-0.90(m,8h),0.86-0.63(m,6h),0.64-0.44(m,1h).13cnmr(101mhz,c6d6)δ144.65(d,j=21.2hz),140.45(d,j=2.6hz),128.86(dd,j=3.5,1.7hz),128.73,128.64,128.36,126.09(d,j=2.4hz),125.60(d,j=1.9hz),54.29(dd,j=21.5,13.6hz),51.73(dd,j=24.4,1.9hz),50.90(dd,j=23.3,3.4hz),36.39(d,j=3.5hz),35.32(dd,j=5.8,2.5hz),32.86(dd,j=6.4,3.1hz),23.63-22.02(m),20.44,14.19,10.48(d,j=17.1hz),9.53(d,j=24.0hz).31pnmr(162mhz,c6d6)δ92.21(s,br),60.09(d,j=19.2hz)。hrms(esi-tof)m/z:对于c24h35np2,[m+h]+计算值为400.2318;实验值为400.2310。制备外消旋-n-丁基-n-(双(4-甲基苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l592步骤1.制备双(4-甲基苯基)碘膦将三甲基碘硅烷(0.50g,2.5mmol)添加到双(4-甲基苯基)氯基膦(0.50g,2.0mmol)于甲苯(5.0ml)中的溶液中。在环境条件下搅拌橙色混合物过夜。过滤反应混合物以去除深色沉淀物,其在反应之后悬浮于溶液中。在真空下移出溶剂和未反应的三甲基碘硅烷且获得呈微黄色液体状的产物。产率(0.50g,73%)。1hnmr(400mhz,c6d6)δ7.53(t,4h),6.76(m,4h),1.91(d,j=0.9hz,6h).13cnmr(101mhz,c6d6)δ140.37,134.08(d,j=23.3hz),129.60(d,j=6.5hz),21.07.31pnmr(162mhz,c6d6)δ43.08(s)。步骤2.制备外消旋-n-丁基-n-(双(4-甲基苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l592将三乙胺(0.089g,0.88mmol)于甲苯-d8(2.0ml)中的冷溶液(-30℃)添加到外消旋-n-丁基-2,5-二苯基磷烷-1-胺(0.28g,0.88mmol)于甲苯-d8(2.0ml)中的冷(-30℃)溶液中且搅拌所得反应混合物10分钟。将反应混合物放置于-30℃下的冷冻器中30分钟。向此经冷却的反应混合物中添加双(4-甲基苯基)碘膦(0.30g,0.88mmol)于2.0ml甲苯-d8中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。挥发物为在真空下去除的挥发物。使粗产物溶解于甲苯(10ml)中。将溶液传送通过5cm活化中性氧化铝塞且在真空下去除挥发物,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.20g(43%)。1hnmr(400mhz,c6d6)δ7.45(dt,j=7.1,1.2hz,2h),7.37-7.31(m,2h),7.29(dt,j=8.0,1.4hz,2h),7.23-7.10(m,5h),7.04(ddt,j=7.9,6.8,1.3hz,2h),6.98-6.92(m,2h),6.87-6.77(m,3h),4.09(m,1h),3.41-3.26(m,1h),3.16-2.87(m,3h),2.52-2.32(m,1h),2.16(m,1h),2.05(s,3h),2.00(s,3h),1.66-1.43(m,1h),0.94(m,1h),0.61(m,3h),0.40(t,j=7.0hz,3h).13cnmr(101mhz,c6d6)δ144.89(d,j=21.3hz),139.65(d,j=2.2hz),138.21(d,j=13.5hz),137.76(d,j=21.0hz),135.79(d,j=15.6hz),133.61(d,j=20.5hz),132.45(d,j=20.1hz),129.35-129.08(m),128.75(d,j=4.3hz),128.71-128.58(m),128.46,125.97(d,j=2.5hz),125.61(d,j=1.8hz),55.62(dd,j=21.8,18.7hz),54.48(dd,j=31.9,4.9hz),52.29(dd,j=22.9,3.3hz),36.97(d,j=2.2hz),34.33-33.06(m),21.15(d,j=3.4hz),19.99,13.75.31pnmr(162mhz,c6d6)δ99.33(d,j=22.8hz),57.72(d,j=22.8hz)。制备n-丁基-n-((2s,5s)-2,5-二苯基磷烷-1-基)-10,11-二氢-5h-二苯并[b,f]-膦-5-胺,l593步骤1.制备1,2-双(2-溴苯基)乙烷在干冰浴中使2-溴苯甲基溴化物(33.36g,133.5mmol)于thf(200ml)中的溶液冷却到-78℃。历经40分钟缓慢逐滴添加正丁基锂(1.42m,47.0ml,66.7mmol)。将溶液搅拌约3小时,随后逐渐升温。当温度达到约-20℃时,缓慢添加水(40ml)且使反应混合物升温到环境温度。处理:有机溶液用水(3×250ml)和nacl饱和水溶液(125ml)洗涤。合并的有机物经无水硫酸镁干燥。过滤溶液,浓缩(旋转蒸发器)得到白色固体。此粗产物的质子和碳nmr光谱与文献一致。由热己烷再结晶产物以在第一批中得到18.48g,81.4%。第二批:2.62g。总计:21.10g,92.97%。1hnmr(400mhz,cdcl3)δ7.55(dd,j=7.8,1.1hz,2h),7.24-7.17(m,4h),7.07(ddd,j=8.0,6.7,2.4hz,2h),3.05(s,4h).13cnmr(101mhz,cdcl3)δ140.54,132.77,130.60,127.79,127.41,124.46,36.42。步骤2.制备1,2-双(2-锂苯基)乙烷-二乙醚加合物将正丁基锂(16.5ml,2.44m,40.3mmol)缓慢添加到1,2-双(2-溴苯基)乙烷(6.540,19.23mmol)于干冰浴中冷却的乙醚(80ml)中的溶液中(沉淀物形式)。使反应混合物升温到环境温度且搅拌过夜。滤出所得白色沉淀物,用乙醚洗涤且干燥得到白色粉末(4.5606g,88.4%,基于单乙醚加合物,如1hnmr光谱所示)。1hnmr(500mhz,thf-d8)δ7.86(dd,j=6.2,1.2hz,2h),6.80(d,j=7.2hz,2h),6.72(td,j=7.2,1.8hz,2h),6.67(ddd,j=7.3,6.3,1.3hz,2h),3.39(q,j=7.0hz,4h),3.07(s,4h),1.15-1.09(m,6h).13cnmr(126mhz,thf-d8)δ185.70,158.67,143.91,125.48,124.03,122.34,66.30,43.46,15.68。步骤3.制备n,n-二甲基-10,11-二氢-5h-二苯并[b,f]膦-5-胺使二锂盐1,2-双(2-锂苯基)乙烷-二乙醚加合物(4.000g,14.86mmol)悬浮于乙醚(60ml)中且在冷冻器中冷却到-30℃。缓慢逐滴添加二甲基亚磷酰胺二氯化物(2.17g,14.86mmol)且使反应混合物升温到环境温度且搅拌过夜。31pnmr光谱显示极少的起始nme2pcl2化合物与75ppm下的主要峰一起存在,这可能归因于所需产物。在减压下去除挥发物。用大量己烷萃取白色残留物,过滤且在减压下去除挥发物以得到在己烷中具有较低溶解度的白色固体。使固体溶解于热己烷中且在环境温度下静置的同时进行冷却。形成较大晶体。用移液管去除上清液,用3ml己烷洗涤残余物,且在减压下干燥固体(2.231g,58.8%)。通过31pnmr,化合物为约85%纯,其中存在约15%的其它磷物质。1hnmr(400mhz,cdcl3)δ7.38(td,j=7.3,1.6hz,2h),7.24(tt,j=7.5,1.5hz,2h),7.19(tdd,j=7.2,1.6,0.6hz,2h),7.12(ddd,j=7.3,3.8,1.0hz,2h),3.41-3.29(m,2h),3.06-2.97(m,2h),2.96(d,j=8.0hz,6h).13cnmr(101mhz,cdcl3)δ143.14(d,j=13.8hz),139.86(d,j=18.0hz),129.59(d,j=2.3hz),129.34(d,j=11.0hz),127.22(d,j=1.0hz),125.51(d,j=3.2hz),43.23(d,j=16.7hz),34.20(d,j=7.2hz).31pnmr(162mhz,cdcl3)δ72.90。步骤4.制备5-氯-10,11-二氢-5h-二苯并[b,f]膦将无水hcl(15ml,2.0m,乙醚溶液,30.0mmol)添加到上文紧接着的步骤3的固体溶液中,所述固体溶液主要包含溶解于己烷(60ml)和乙醚(40ml)的混合物中的n,n-二甲基-10,11-二氢-5h-二苯并[b,f]膦-5-胺,同时立即形成沉淀物。搅拌混合物若干小时。1h和31pnmr光谱显示反应尚未完全完成,然而,混合物与开始时相比更干净:15%的其它物质消失且仅存在所需p-cl产物和起始p-n。添加额外hcl溶液(5ml)。过滤反应混合物且在减压下去除挥发物以得到用己烷洗涤且在减压下干燥的白色固体。通过nmr,其为约85%纯,因此其由沸腾乙醚再结晶。使溶液冷却到环境温度过夜。从已形成的结晶材料用移液管移取上清液且在减压下干燥产物。95%纯材料的无色晶体/粉末的产率为约1.24g,33.84%。额外较不纯的批次获自上清液。1hnmr(500mhz,cdcl3)δ7.87(ddd,j=13.3,7.6,1.5hz,1h),7.37(td,j=7.5,1.4hz,1h),7.28(tt,j=7.5,1.5hz,1h),7.22(dt,j=7.6,1.7hz,1h),3.64-3.55(m,1h),3.28-3.19(m,1h).13cnmr(126mhz,cdcl3)δ144.71(d,j=4.8hz),135.80(d,j=37.2hz),134.17(d,j=46.4hz),131.07,130.15,126.13(d,j=13.3hz),34.03(d,j=5.1hz).31pnmr(202mhz,cdcl3)δ92.26。步骤5.制备5-碘基-10,11-二氢-5h-二苯并[b,f]膦将三甲基碘硅烷(1.30g,6.54mmol)快速地逐滴添加到5-氯-10,11-二氢-5h-二苯并[b,f]膦(1.24g,5.03mmol)于甲苯(50ml)中的溶液中。反应物溶液立即变黄。搅拌溶液若干小时。通过31pnmr,反应完成。在减压下去除挥发物以得到呈亮黄色粉末状的产物,产物的产率:1.7641g,103.8%,通过31pnmr为97%纯。1hnmr(500mhz,cdcl3)δ7.83(dd,j=17.2,7.6hz,2h),7.37(t,j=7.3hz,3h),7.28-7.16(m,4h),3.76(s,2h),3.28(s,3h).13cnmr(126mhz,cdcl3)δ147.26(d,j=2.3hz),135.67(d,j=63.7hz),132.67(d,j=41.5hz),131.86,130.43,125.93(d,j=18.5hz),34.65.31pnmr(202mhz,cdcl3)δ38.80。步骤6.制备n-丁基-n-((2s,5s)-2,5-二苯基磷烷-1-基)-10,11-二氢-5h-二苯并[b,f]-膦-5-胺,l593在冷冻器中冷却n-丁基-2,5-二苯基磷烷-1-胺(0.186g,0.60mmol)和三乙胺(0.301g,2.98mmol)于甲苯(10ml)中的溶液若干小时。逐滴添加5-碘基-10,11-二氢-5h-二苯并[b,f]膦(0.201g,0.60mmol)。5-碘基-10,11-二氢-5h-二苯并[b,f]膦的黄色快速消失且逐渐形成沉淀物。搅拌反应混合物过夜。过滤混合物且在减压下去除挥发物以得到黏性油,其在减压下静置过夜而固化。产率为0.3195g,103%。基于其31pnmr光谱,产物看起来良好。1hnmr(400mhz,cdcl3)δ7.45(d,j=7.4hz,2h),7.40-7.29(m,4h),7.28-7.22(m,4h),7.22-7.15(m,2h),7.14-6.96(m,4h),6.71(dt,j=14.9,1.7hz,1h),6.34(t,j=7.4hz,1h),4.08-3.96(m,1h),3.56(dddd,j=24.6,14.3,5.8,2.0hz,1h),3.36(ddd,j=16.2,9.4,7.0hz,2h),2.99(tdd,j=15.0,7.4,4.4hz,4h),2.66-2.50(m,2h),2.35(tq,j=10.7,5.3,4.5hz,1h),1.84-1.64(m,2h),1.09(dq,j=16.8,6.7,5.0hz,1h),1.01-0.90(m,1h),0.90-0.79(m,1h),0.66(t,j=7.3hz,3h).13cnmr(101mhz,cdcl3)δ144.80(d,j=21.8hz),143.45(d,j=14.7hz),142.88(d,j=14.1hz),138.79(d,j=2.0hz),138.42(d,j=27.0hz),136.97(d,j=23.0hz),130.98(d,j=3.0hz),130.87(d,j=2.2hz),129.38(d,j=1.6hz),129.14(d,j=1.9hz),128.74(dd,j=3.3,1.6hz),128.64(d,j=9.5hz),128.44,128.38(d,j=1.4hz),127.58(d,j=1.3hz),126.84,125.79(d,j=2.6hz),125.73(d,j=1.9hz),125.47(d,j=2.3hz),124.96(d,j=2.8hz),54.89(d,j=2.6hz),54.74(d,j=12.5hz),.54.58(dd,j=15.2,7.7hz),52.63(dd,j=22.1,3.1hz),37.77(d,j=1.8hz),34.42(dd,j=10.6,7.3hz),33.73(d,j=14.0hz),32.84(dd,j=8.0,3.4hz),20.23,13.80.31pnmr(162mhz,cdcl3)δ97.48,72.33。高分辨率质量光谱:预期值(m+1)为522.2473;实验值(m+1)为522.2494制备(外消旋)-n-(双(4-(三氟甲基)苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l594步骤1.制备双(4-(三氟甲基)苯基)碘膦使双(4-(三氟甲基)苯基)氯膦(0.55g,1.5mmol)溶解于甲苯(3.0ml)中。添加三甲基碘硅烷(0.26ml,1.9mmol)且在环境温度下搅拌橙色溶液2小时。在反应期间,形成深色油性材料。倾析反应混合物以去除深色材料且去除挥发物以产生呈淡黄色油状的产物。产率(0.42g,61%)。1hnmr(400mhz,c6d6)δ7.32-7.20(m,4h),7.19-7.09(m,4h).13cnmr(101mhz,c6d6)δ139.55(d,j=40.6hz),134.24(d,j=23.6hz),132.24(d,j=32.7hz),131.96(d,j=10.7hz),125.66(dd,j=6.2,3.6hz).31pnmr(162mhz,c6d6)δ29.46-29.26(m)。步骤2.制备(外消旋)-n-(双(4-(三氟甲基)苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l594将(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.14g,0.45mmol)和三乙胺(69μl,0.50mmol)组合且溶解于甲苯(2.0ml)中。使双(4-(三氟甲基)苯基)碘膦(0.20g,0.45mmol)单独地溶解于甲苯(2.0ml)中。在冷冻器中使两种溶液冷却到-30℃。将双(4-(三氟甲基)苯基)碘膦溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺和三乙胺的溶液中,使得固体立即形成。在30分钟之后,在真空下去除挥发物。用乙醚萃取材料且过滤通过较小氧化铝塞。去除溶剂以产生粗产物。将戊烷添加到固体中且将混合物放置于-30℃下的冷冻器中。在1.5小时之后,从固体产物倾析戊烷且用冷戊烷重复所述方法。在减压下去除残余溶剂以产生呈白色固体状的产物。产率(0.16g,56%)。1hnmr(400mhz,c6d6)δ7.28-7.17(m,6h),7.16-6.87(m,10h),6.71-6.55(m,2h),3.88-3.66(m,1h),3.20(ddd,j=24.9,13.2,5.8hz,1h),3.01-2.61(m,3h),2.43-2.18(m,1h),2.05(tt,j=10.8,5.3hz,2h),1.58-1.34(m,1h),1.07-0.76(m,1h),0.76-0.50(m,3h),0.44-0.31(m,3h).13cnmr(101mhz,c6d6)δ144.87(d,j=24.5hz),143.78(d,j=20.7hz),143.16(d,j=19.8hz),139.10(d,j=2.7hz),133.35(d,j=20.8hz),132.77(d,j=20.7hz),130.82(dd,j=38.3,32.4hz),129.08-128.96(m),128.92,128.69,128.59,126.56(d,j=2.5hz),126.07(d,j=1.8hz),125.27(dd,j=5.4,3.9hz),124.83(dd,j=6.1,3.7hz),123.49(d,j=8.1hz),56.68-55.17(m),54.82(d,j=26.0hz),51.45(dd,j=23.1,3.6hz),36.83(d,j=3.4hz),34.50-33.77(m),33.19(dd,j=6.1,3.4hz),19.96,13.69.31pnmr(162mhz,c6d6)δ98.44(d,j=20.9hz),57.13(d,j=20.5hz).19fnmr(376mhz,c6d6)δ-62.56(d,j=20.7hz)。hrms(esi-tof)m/z:对于c34h33f6np2,[m+h]+计算值为632.2065;实验值为632.2080。制备外消旋-(2r,5r)-n-丁基-n-((2r,5r)-2,5-二苯基磷烷-1-基)-2,5-二苯基磷烷-1-胺,l596步骤1.制备外消旋-(2r,5r)-1-碘基-2,5-二苯基磷烷使(2s,5s)-1-氯-2,5-二苯基磷烷(2.0g,7.28mmol)溶解于无水乙醚(30ml)中。添加三甲基碘硅烷(1.24ml,8.74mmol)且搅拌溶液1小时。使溶液传送通过过滤器且在真空下浓缩滤液以产生呈黄色油状的产物。1hnmr(400mhz,c6d6)δ7.35-6.69(m,10h),3.61(s,2h),2.10(h,j=6.6hz,2h),1.89(s,2h).13cnmr(101mhz,c6d6)δ128.44(d,j=1.4hz),127.41,127.35,126.48(d,j=2.6hz),51.47,34.70.31pnmr(162mhz,c6d6)δ111.51。步骤2.制备外消旋-(2r,5r)-n-丁基-n-((2r,5r)-2,5-二苯基磷烷-1-基)-2,5-二苯基磷烷-1-胺,l596使n-丁基-2,5-二苯基磷烷-1-胺(0.68g,2.18mol)溶解于二氯甲烷(35ml)和三乙胺(0.61ml,4.37mmol)中。同样使(外消旋)-1-碘基-2,5-二苯基磷烷(0.80g,0.2.18mmol)溶解于二氯甲烷(10ml)中。在缓慢组合之前,将两种溶液冷却到-30℃。通过31pnmr光谱分析来分析样品,其显示完全反应成主要一种产物。在真空下将反应物溶液浓缩到干燥。在己烷(40ml)中将残余物制成浆料且过滤。用额外己烷(10ml)冲洗固体。在真空下将滤液浓缩到约20ml,之后大量白色固体从冷溶液中沉淀。通过过滤采集固体且在高度真空下干燥。1hnmr(400mhz,c6d6)δ7.14(m,8h),7.07-6.99(m,8h),6.95(d,j=7.6hz,4h),3.25-3.00(m,4h),2.58-2.38(m,2h),2.31-2.13(m,1h),2.13-1.95(m,6h),1.62-1.43(m,2h),1.07-0.88(m,1h),0.68-0.51(m,2h),0.48(t,3h).13cnmr(101mhz,c6d6)δ144.32(d,j=19.0hz),140.86,128.84-128.56(m),128.49,126.04,125.66,52.78(t,j=11.8hz),49.32(d,j=21.0hz),35.22-34.24(m),30.91(t,j=4.4hz),20.16,13.77.31pnmr(162mhz,c6d6)δ91.12。hrms(esi-tof)m/z:对于c36h41np2,[m+h]+计算值为550.2787;实验值为550.2797。制备(外消旋)-n-(二(呋喃-2-基)磷基)-n-异丙基-2,5-二苯基磷烷-1-胺,l601步骤1.制备(外消旋)-n-异丙基-2,5-二苯基磷烷-1-胺将(外消旋)-1-氯-2,5-二苯基磷烷(0.80g,2.9mmol)于己烷(5ml)中的溶液添加到异丙胺(2.5ml,29mmol)于己烷(5ml)中的溶液中,使得立即沉淀出白色固体。在搅拌1小时之后,通过31pnmr光谱分析检查混合物,其显示完全转化成新产物。过滤混合物且在真空下去除挥发物以产生呈黄色油状的产物。产率(0.81g,94%)。1hnmr(400mhz,c6d6)δ7.38-7.32(m,2h),7.29-7.17(m,4h),7.14-7.02(m,4h),3.07(ddd,j=22.2,12.5,6.0hz,1h),2.96-2.78(m,1h),2.59(m,1h),2.23-1.98(m,2h),1.79(m,j=12.5,5.1,2.6hz,1h),1.58(m,1h),1.00(dd,j=10.6,7.2hz,1h),0.80(d,j=6.3hz,3h),0.46(d,j=6.4hz,3h).13cnmr(101mhz,c6d6)δ144.42(d,j=18.7hz),140.39(d,j=1.4hz),128.76,128.45(d,j=1.4hz),128.41(d,j=3.4hz),127.96(d,j=8.1hz),126.00(d,j=2.6hz),125.68(d,j=1.9hz),57.01(d,j=14.8hz),50.20(d,j=22.1hz),49.12(d,j=25.3hz),34.09(d,j=3.0hz),31.83(d,j=2.1hz),25.92(dd,j=50.4,5.8hz).31pnmr(162mhz,c6d6)δ67.37。步骤2.制备二(呋喃-2-基)碘膦使氯二(呋喃-2-基)膦(2.0ml,13mmol)溶解于甲苯(10ml)中。添加三甲基碘硅烷(2.19ml,15.4mmol)且在环境温度下搅拌橙色溶液。在2小时之后,通过31pnmr光谱分析检查反应物,其显示完全转化成新产物。在真空下去除溶剂以产生呈红色油状的产物。产率(3.5g,92%)。1hnmr(400mhz,c6d6)δ7.27(dd,j=1.8,0.8hz,2h),6.73(dt,j=3.5,0.9hz,2h),5.99(dd,j=3.5,1.8hz,2h).13cnmr(101mhz,c6d6)δ149.03(d,j=3.9hz),146.66(d,j=37.9hz),122.81(d,j=28.1hz),111.85(d,j=5.5hz).31pnmr(162mhz,c6d6)δ-39.35。步骤3.制备(外消旋)-n-(二(呋喃-2-基)磷基)-n-异丙基-2,5-二苯基磷烷-1-胺,l601使(外消旋)-n-异丙基-2,5-二苯基磷烷-1-胺(0.30g,1.0mmol)和三乙胺(0.155ml,1.11mmol)溶解于甲苯(2ml)中。同样使二(呋喃-2-基)碘膦(0.315g,1.01mmol)溶解于甲苯(2ml)中。在冷冻器中使两种溶液冷却到-30℃。将二(呋喃-2-基)碘膦溶液逐滴添加到(外消旋)-n-异丙基-2,5-二苯基磷烷-1-胺和三乙胺的溶液中,使得沉淀物立即形成。通过31pnmr光谱分析来分析样品,其显示完全转化成产物。去除溶剂。残余物用醚萃取且传送通过氧化铝短塞。去除溶剂以产生呈白色固体状的产物。产率(0.36g,77%)。1hnmr(400mhz,c6d6)δ7.41-7.25(m,4h),7.26-7.16(m,3h),7.09-7.00(m,4h),7.00-6.90(m,1h),6.42(dd,j=3.3,0.7hz,1h),6.09-5.98(m,2h),5.95(dt,j=3.4,1.8hz,1h),4.40-4.12(m,1h),3.90-3.64(m,1h),3.33(ddd,j=25.9,13.2,5.6hz,1h),3.15-2.90(m,1h),2.53-2.34(m,1h),2.26-2.07(m,1h),1.79-1.48(m,1h),0.75(dd,j=25.9,6.6hz,6h).13cnmr(101mhz,c6d6)δ146.28(d,j=4.3hz),146.03(d,j=2.7hz),144.41(d,j=20.9hz),129.14(t,j=3.0hz),128.70(d,j=1.3hz),128.45(d,j=8.1hz),128.38(d,j=1.2hz),125.79(dd,j=49.0,2.3hz),119.74(d,j=26.2hz),119.13(d,j=16.4hz),110.86(d,j=2.7hz),110.47(d,j=5.7hz),53.88(dd,j=23.9,6.9hz),50.27(dd,j=21.3,4.8hz),36.01(d,j=3.2hz),33.23(dd,j=8.1,3.4hz),24.05(d,j=14.3hz),23.61(d,j=11.7hz).31pnmr(162mhz,c6d6)δ75.57,10.79(d,j=38.6hz)。hrms(esi-tof)m/z:对于c27h29no2p2,[m+h]+计算值为462.1747;实验值为462.1730。制备外消旋-n-丁基-n-(双(4-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l603步骤1.制备双(4-甲基苯基)碘膦将三甲基碘硅烷(0.49g,2.5mmol)添加到双(4-氟苯基)氯膦(0.50g,1.9mmol)于甲苯(5.0ml)中的溶液中,同时快速形成橙色。在室温下搅拌反应混合物过夜,随后过滤以去除深色沉淀物,其在反应之后悬浮于溶液中。在真空下去除挥发物且获得微黄色液体。产率(0.52g,76%)。1hnmr(400mhz,c6d5cd3)d7.27(m,4h),6.70-6.51(m,4h).13cnmr(101mhz,c6d5cd3)d165.04(d,j=1.0hz),162.54,137.05,135.54(dd,j=24.9,8.3hz),130.85(dd,j=38.9,3.5hz),115.57(dd,j=21.3,7.1hz).31pnmr(162mhz,c6d5cd3)d36.68(t,j=5.0hz)。19fnmr(376mhz,c6d6)δ-109.22--109.69(m)。步骤2.制备外消旋-n-丁基-n-(双(4-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l603。将三乙胺(0.068g,0.67mmol)于甲苯-d8(1.4ml)中的冷溶液(-30℃)添加到外消旋-n-丁基-2,5-二苯基磷烷-1-胺(0.21g,0.67mmol)于甲苯-d8(2.1ml)中的冷(-30℃)溶液中且搅拌所得混合物10分钟。将混合物放置于-30℃下的冷冻器中30分钟。向此经冷却的混合物中添加双(4-氟苯基)碘膦(0.23g,0.67mmol)于甲苯-d8(2.3ml)中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。在真空下去除挥发物。使粗产物再溶解于甲苯(10ml)中。将溶液传送通过5cm活化中性氧化铝塞且在真空下蒸发溶剂,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.22g(61%)。1hnmr(400mhz,c6d5cd3)δ7.33-7.26(m,2h),7.22-7.02(m,9h),6.98(t,j=7.3hz,1h),6.80-6.70(m,2h),6.70-6.49(m,4h),3.87(m,1h),3.24(m,1h),3.04-2.72(m,2h),2.47-2.27(m,1h),2.15(m,1h),1.54(ddt,j=12.8,4.6,2.1hz,1h),1.02-0.81(m,1h),0.65(m,2h),0.47(t,j=7.1hz,3h).13cnmr(101mhz,c6d5cd3)δ143.83(d,j=20.8hz),139.02(d,j=2.7hz),137.05,134.85(d,j=7.9hz),134.63(d,j=7.8hz),134.09(d,j=7.7hz),133.87(d,j=7.8hz),128.32,128.27,128.12,125.83(d,j=2.5hz),125.39(d,j=1.9hz),115.28(d,j=6.0hz),115.07(d,j=6.0hz),114.56(d,j=6.6hz),53.83(d,j=28.7hz),51.29(d,j=19.9hz),36.45,33.65(d,j=5.4hz),32.79,13.38.31pnmr(162mhz,c6d5cd3)δ98.19(d,j=22.4hz),58.38-54.20(m).19fnmr(376mhz,c6d5cd3)δ-112.24--112.40(m),-112.71(m)。制备(2s,5s)-n-(双(2-氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,配体604步骤1.制备双(2-氟苯基)二甲基氨基膦1-将溴-2-氟苯(18.50g,105.7mmol)缓慢逐滴添加到正丁基锂(42.0ml,2.38m,99.9mmol)于醚(200ml)中的冷却(-85到-80℃(液氮/丙酮浴))溶液以使得温度不超过-78℃。使温度提高到-78℃与-75℃之间持续一小时,同时形成白色沉淀物。使反应混合物冷却到-85℃。极缓慢地逐滴添加二甲基亚磷酰胺二氯化物(7.295g,49.98mmol)于醚(10ml)中的溶液以使得温度不超过-80℃。将干冰添加到浴中且使反应混合物搅拌过夜,同时加热到环境温度。31p和19fnmr光谱显示产物为约99.5%所需产物。过滤反应混合物且在减压下去除挥发物。用己烷萃取残余物,过滤且在减压下去除挥发物以得到呈浅黄色油状的产物,12.72g,95.95%。1hnmr(400mhz,cdcl3)δ7.34(ddddd,j=8.3,7.3,5.5,1.9,1.0hz,1h),7.23(tddd,j=5.6,4.6,2.4,1.3hz,1h),7.15(tt,j=7.5,1.0hz,1h),7.05(dddd,j=9.4,8.2,4.1,1.1hz,1h).13cnmr(101mhz,cdcl3)δ163.47(dd,j=244.5,16.1hz),132.23(t,j=5.9hz),130.65(d,j=8.2hz),124.85(td,j=20.2,2.0hz),124.17(d,j=3.4hz),115.10(d,j=23.3hz).31pnmr(162mhz,cdcl3)δ44.59(t,j=45.7hz).19fnmr(376mhz,cdcl3)δ-105.77(ddt,j=45.6,11.6,6.2hz)。步骤2和3.制备双(2-氟苯基)氯膦和双(2-氟苯基)碘膦将三甲基碘硅烷(tmsi)(7.11g,34.5mmol)添加到双(2-氟苯基)二甲基氨基膦(8.100g,30.54mmol)于己烷(40ml)中的溶液中。紧接在混合之后获取的31p和19fnmr光谱显示与起始材料相比轻微(几ppm)化学位移。历经若干天搅拌反应混合物。去除且去挥发等分试样:nmr光谱显示反应未发生。在形成大量沉淀物的情况下,添加hcl溶液(35ml,2.0m,70mmol)。nmr光谱显示起始材料全部消耗。过滤反应混合物。nmr光谱仅显示双(2-氟苯基)氯膦,但不显示任何双(2-氟苯基)碘膦。在减压下去除挥发物,使残余物溶解于醚中且添加三甲基碘硅烷(7.00g,34.98mmol)。在搅拌若干小时之后,在减压下去除挥发物。用己烷萃取残余物,过滤且在减压下去除挥发物以得到呈黄橙色油状的双(2-氟苯基)碘膦。产率为10.17g,95.65%。双(2-氟苯基)氯膦的nmr光谱:1hnmr(400mhz,cdcl3)δ7.57(tdd,j=7.5,5.6,1.7hz,1h),7.44(ddddd,j=8.0,7.2,5.3,1.8,0.6hz,1h),7.22(tt,j=7.6,0.9hz,1h),7.06(dddd,j=9.5,8.3,4.4,1.1hz,1h).13cnmr(101mhz,cdcl3)δ163.57(dd,j=247.9,19.0hz),132.96(d,j=8.9hz),132.83(tdd,j=10.2,3.2,1.3hz),124.69(dt,j=3.3,1.5hz),124.50-123.86(m),115.51(d,j=23.0hz).31pnmr(162mhz,cdcl3)δ61.33(t,j=64.9hz).19fnmr(376mhz,cdcl3)δ-105.22(dm,j=65.5hz)。双(2-氟苯基)碘膦的nmr光谱:1hnmr(400mhz,cdcl3)δ7.59(tdd,j=7.4,5.0,1.7hz,1h),7.44(ddddd,j=8.1,7.3,5.4,1.8,0.8hz,1h),7.19(tt,j=7.5,1.0hz,1h),7.06(dddd,j=9.5,8.2,4.4,1.1hz,1h).13cnmr(101mhz,cdcl3)δ163.31(dd,j=248.2,18.8hz),136.30(dd,j=8.8,3.1hz),133.08(d,j=8.6hz),124.87-124.72(m),120.54(ddd,j=45.4,17.1,1.9hz),115.46(d,j=22.8hz).31pnmr(162mhz,cdcl3)δ11.95(t,j=63.7hz).19fnmr(376mhz,cdcl3)δ-101.52(ddt,j=63.5,9.5,6.2hz)。步骤4.制备(2s,5s)-n-(双(2-氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,配体604将双(2-氟苯基)碘膦(0.229,0.660mmol)于cdcl3(2ml)中的溶液缓慢添加到n-丁基-2,5-二苯基磷烷-1-胺(0.205g,0.66mmol)和三乙胺(0.500g,4.94mmol)于cdcl3(5ml)中的溶液中。在减压下去除溶剂以得到固体。用己烷和醚萃取残余物且过滤且在减压下去除挥发物。用己烷洗涤固体且在减压下干燥以得到呈无色固体状的产物。1hnmr(400mhz,c6d6)δ7.43(dt,j=8.0,1.5hz,2h),7.36(dt,j=7.1,1.6hz,2h),7.24(t,j=7.8hz,2h),7.09(tq,j=7.3,1.3hz,1h),7.04(ddd,j=5.9,4.1,1.7hz,1h),6.99(dd,j=8.3,6.9hz,2h),6.91-6.79(m,3h),6.73(dddd,j=9.6,8.2,4.2,1.2hz,1h),6.70-6.63(m,3h),6.60(td,j=7.4,1.2hz,1h),4.40(ddt,j=12.3,8.4,4.6hz,1h),3.36-3.16(m,1h),3.16-2.94(m,3h),2.66-2.48(m,1h),2.10(tt,j=10.5,5.2hz,1h),1.59(qd,j=12.6,5.0hz,1h),1.08-0.94(m,1h),0.70-0.45(m,3h),0.36(t,j=7.2hz,3h).13cnmr(101mhz,c6d6)δ164.56(dd,j=245.2,18.7hz),162.79(dd,j=244.5,16.6hz),144.84(d,j=21.1hz),139.02(d,j=1.9hz),133.54(dd,j=7.4,5.1hz),133.38(t,j=4.8hz),131.62(d,j=8.5hz),130.01(d,j=8.1hz),128.83(dd,j=3.9,1.9hz),128.73,128.63,128.35(d,j=1.1hz),126.60(ddd,j=27.1,18.7,1.6hz),125.96(ddd,j=23.1,18.6,2.4hz),125.95(dd,j=15.9,2.3hz),124.39(d,j=3.1hz),124.26(d,j=3.3hz),115.51(d,j=23.9hz),114.79(d,j=23.1hz),55.31(td,j=9.1,3.1hz),55.00(d,j=3.5hz),52.62(dd,j=22.4,4.4hz),37.04,34.14(d,j=7.3hz),32.81(dd,j=8.6,3.5hz),19.91,13.64.31pnmr(162mhz,c6d6)δ103.28(d,j=28.9hz),32.93(ddd,j=54.9,42.6,28.7hz).19fnmr(376mhz,c6d6)δ-103.52(dm,j=41.8hz),-104.72(dm,j=54.7hz)。hrms:预期值(m+1):532.2128。实验值(m+1):532.2137。制备(外消旋)-n-(二苯基磷烷基)-n-乙基-2,5-二苯基磷烷-1-胺,l606步骤1.制备(外消旋)-n-乙基-2,5-二苯基磷烷-1-胺将(外消旋)-1-氯-2,5-二苯基磷烷(0.40g,1.5mmol)于己烷(5.0ml)中的溶液添加到乙胺(2m)于thf(3.6ml,7.3mmol)中的溶液中,使得立即沉淀出白色固体。在搅拌过夜之后,在真空下去除挥发物。用己烷将残余物制成浆料且过滤。在真空下去除挥发物以产生呈黄色油状的产物。产率(0.40,96%)。1hnmr(400mhz,c6d6)δ7.32-7.24(m,2h),7.23-6.97(m,8h),2.99(ddd,j=21.7,12.6,6.0hz,1h),2.91-2.78(m,1h),2.48-2.29(m,1h),2.28-1.92(m,3h),1.87-1.65(m,1h),1.63-1.40(m,1h),0.90(q,j=7.0hz,1h),0.46(t,j=7.1hz,3h).13cnmr(101mhz,c6d6)δ144.08,143.89,139.83,128.34,128.06(d,j=1.4hz),127.75(d,j=11.7hz),125.60(d,j=2.6hz),125.22(d,j=1.9hz),55.43(d,j=14.1hz),50.08(d,j=23.2hz),42.11(d,j=23.7hz),33.97(d,j=2.6hz),31.33(d,j=2.1hz),18.10(d,j=7.2hz).31pnmr(162mhz,c6d6)δ72.81。步骤2.制备(外消旋)-n-(二苯基磷烷基)-n-乙基-2,5-二苯基磷烷-1-胺,l606使(外消旋)-n-乙基-2,5-二苯基磷烷-1-胺(0.15g,0.53mmol)和三乙胺(81μl,0.58mmol)溶解于甲苯(5.0ml)中。同样使碘代联苯基膦(0.17g,0.53mmol)溶解于甲苯(5ml)中。在冷冻器中使两种溶液冷却到-30℃。将碘代联苯基膦溶液逐滴添加到(外消旋)-n-乙基-2,5-二苯基磷烷-1-胺和三乙胺的溶液中,使得沉淀物立即形成。在环境温度下搅拌30分钟之后,在真空下去除挥发物。用醚萃取残余物且使混合物过滤通过活化中性氧化铝塞。在真空下去除溶剂以产生最终产物。产率(0.19g,77%)。1hnmr(400mhz,c6d6)δ7.43-7.28(m,4h),7.28-7.13(m,4h),7.13-6.86(m,10h),6.85-6.70(m,2h),4.01(ddt,j=12.1,7.5,4.5hz,1h),3.49-3.19(m,1h),3.10-2.79(m,3h),2.53-2.24(m,1h),2.13(tt,j=10.7,5.3hz,1h),1.73-1.39(m,1h),0.45-0.27(m,3h).13cnmr(101mhz,c6d6)δ144.28(d,j=21.0hz),140.54(d,j=22.2hz),139.18(d,j=2.5hz),138.61(d,j=16.4hz),132.91(d,j=20.0hz),132.10(d,j=20.3hz),128.77(dd,j=3.6,1.8hz),128.38,128.34,128.21,128.12(d,j=5.6hz),128.03,127.59,125.73(d,j=2.6hz),125.35(d,j=1.9hz),55.15(dd,j=21.9,18.4hz),51.53(dd,j=22.8,3.4hz),48.71(dd,j=32.0,4.2hz),36.44(d,j=2.7hz),32.83(dd,j=7.5,3.3hz),16.64(d,j=7.3hz).31pnmr(162mhz,c6d6)δ97.75(d,j=19.7hz),58.57(d,j=19.9hz)。hrms(esi-tof)m/z:对于c30h31np2,[m+h]+计算值为468.2005;实验值为468.1999。制备(外消旋)-n-丁基-n-(双([1,1':3',1″-联三苯]-5'-基)磷基)-2,5-二苯基磷烷-1-胺,l607步骤1.制备双(3,5-二苯基苯基)碘膦将三甲基碘硅烷(0.16ml,1.1mmol)添加到双(3,5-二苯基苯基)氯膦(0.50g,0.95mmol)于甲苯(2.0ml)中的溶液中。在环境温度下搅拌2小时之后,过滤橙色溶液且去除挥发物以产生黄色固体。用戊烷洗涤产物,过滤且在减压下干燥。粗产物原样用于下一步骤中。产率(0.45g,59%)。1hnmr(400mhz,苯-d6)δ8.13(dd,j=7.7,1.7hz,3h),7.68-7.55(m,3h),7.40-7.28(m,7h),7.25-6.89(m,13h).31pnmr(162mhz,c6d6)δ39.07。步骤2.制备(外消旋)-n-丁基-n-(双([1,1':3',1″-联三苯]-5'-基)磷基)-2,5-二苯基磷烷-1-胺,l607使(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.15g,0.48mmol)和三乙胺(0.74μl,0.53mmol)溶解于甲苯(5.0ml)中。同样使双(3,5-二苯基苯基)碘膦(0.30g,0.48mmol)溶解于甲苯(5.0ml)中。在冷冻器中使两种溶液冷却到-30℃。将双(3,5-二苯基苯基)碘膦溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.15g,0.48mmol)和三乙胺的溶液中,使得沉淀物立即形成。在真空下去除挥发物且用醚萃取残余物。使混合物过滤通过中性活性氧化铝塞。在真空下去除乙醚以产生白色固体。用戊烷湿磨固体且干燥以产生呈白色固体状的纯产物。产率(0.2g,52%)。1hnmr(400mhz,c6d6)δ7.91(dd,j=6.5,1.7hz,2h),7.81-7.71(m,1h),7.70-7.59(m,1h),7.48(dd,j=7.2,1.8hz,4h),7.46-7.34(m,8h),7.32-7.24(m,2h),7.21-6.89(m,17h),6.63(t,j=7.4hz,1h),4.31(ddt,j=12.3,7.4,4.7hz,1h),3.49-3.07(m,4h),2.57-2.29(m,1h),2.31-2.05(m,1h),1.74-1.35(m,1h),1.22-0.97(m,1h),0.67-0.43(m,2h),0.35(t,j=7.2hz,3h).13cnmr(101mhz,c6d6)δ144.46(d,j=21.3hz),142.51(d,j=5.3hz),142.10(d,j=6.1hz),141.33(d,j=20.0hz),140.22(d,j=19.0hz),139.07(d,j=2.2hz),131.41(d,j=21.0hz),130.01(d,j=20.2hz),129.09(d,j=15.6hz),128.85,128.78,128.53,127.71(d,j=8.0hz),127.63,127.21(d,j=25.6hz),126.15(dd,j=5.5,2.1hz),56.05(dd,j=21.8,19.9hz),55.37(d,j=6.7hz),55.04(d,j=6.8hz),52.66(dd,j=22.6,3.2hz),37.19,34.51(d,j=7.6hz),33.57(d,j=5.7hz),19.99,13.90.31pnmr(162mhz,c6d6)δ98.25(d,j=24.2hz),59.04(d,j=24.6hz)。hrms(esi-tof)m/z:对于c56h51np2,[m+h]+计算值为800.3570;实验值为800.3557。制备外消旋-n-环丙基-n-(二苯基磷烷基)-2,5-二苯基磷烷-1-胺,l608步骤1.制备外消旋-n-环丙基-2,5-二苯基磷烷-1-胺将环丙胺(0.43ml,6.6mmol)于己烷(5.00ml)中的溶液添加到外消旋-1-氯-2,5-二苯基-磷杂环戊烷(0.60g,2.2mmol)于己烷(5.00ml)中的溶液中。在室温下搅拌混合物过夜。通过使用一次性过滤器漏斗过滤去除固体且使溶液传送通过5cm活化中性氧化铝塞。在真空下蒸发溶剂以产生白色固体。产率0.27g(41.5%)。1hnmr(400mhz,c6d5cd3)δ7.24(dt,j=8.0,1.6hz,2h),7.17(td,j=7.3,1.7hz,4h),7.13-7.08(m,2h),7.08-7.00(m,2h),2.96(ddd,j=22.2,12.6,5.9hz,1h),2.78(ddd,j=12.4,7.3,5.7hz,1h),2.13(ddddd,j=14.4,12.6,7.2,5.1,1.5hz,1h),2.07-1.97(m,1h),1.75(qdd,j=12.5,5.1,2.4hz,1h),1.62-1.44(m,3h),0.11-0.00(m,3h),-0.06(tdt,j=6.3,3.5,2.4hz,1h).13cnmr(101mhz,c6d5cd3)δ143.88(d,j=19.1hz),139.70,128.28(d,j=1.1hz),128.03(d,j=1.2hz),127.83(d,j=3.4hz),127.55,127.46,125.55(d,j=2.5hz),125.28(d,j=1.9hz),55.11(d,j=14.2hz),50.16(d,j=24.0hz),34.12(d,j=1.9hz),31.18(d,j=2.3hz),27.50(d,j=22.3hz),9.22(d,j=11.6hz),8.05(d,j=8.0hz)。31pnmr(162mhz,c6d5cd3)δ67.73。步骤2.制备外消旋-n-环丙基-n-(二苯基磷烷基)-2,5-二苯基磷烷-1-胺,l608。将三乙胺(0.034g,0.34mmol)于甲苯-d8(0.69ml)中的冷溶液(-30℃)添加到外消旋-n-环丙基-2,5-二苯基磷烷-1-胺(2)(0.10g,0.34mmol)于甲苯-d8(1.00ml)中的冷(-30℃)溶液中且搅拌所得反应混合物10分钟。将反应混合物放置于-30℃下的冷冻器中30分钟。向此冷却的反应混合物中添加碘代联苯基膦(0.11g,0.34mmol)于1.06ml甲苯-d8中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。在真空下去除溶剂。使粗产物再溶解于二乙醚和甲苯(50/50v/v)溶剂混合物(5ml)中且过滤通过5cm活化中性氧化铝塞且在真空下蒸发溶剂,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.059g(36.3%)。1hnmr(400mhz,c6d6)δ7.39-7.28(m,4h),7.23(dt,j=8.1,1.5hz,2h),7.17(dd,j=8.5,6.8hz,2h),7.12-6.91(m,12h),4.13(dddd,j=11.5,7.7,6.0,3.3hz,1h),3.38-3.10(m,1h),3.07-2.86(m,1h),2.36(ddddd,j=14.1,12.8,7.7,5.0,1.2hz,1h),2.23-1.93(m,2h),1.66-1.39(m,1h),0.68-0.44(m,1h),0.13--0.09(m,1h),-0.13--0.42(m,2h).13cnmr(101mhz,c6d6)δ144.56(d,j=22.6hz),140.01(d,j=21.1hz),139.48(d,j=1.8hz),137.10(dd,j=17.5,1.5hz),135.04(d,j=22.5hz),131.25(d,j=18.3hz),128.72,128.63,128.53,128.49(d,j=1.4hz),128.33,128.17,127.95,127.72,127.32,125.77(d,j=2.5hz),125.33(d,j=1.8hz),53.70(t,j=22.2hz),52.18(dd,j=25.6,2.5hz),37.28(d,j=2.3hz),35.18(dd,j=27.8,6.3hz),33.04(dd,j=7.5,2.9hz),9.21(d,j=12.6hz),8.42(d,j=21.1hz).31pnmr(162mhz,c6d6)δ95.14(d,j=16.2hz),61.52(d,j=16.2hz)。制备外消旋-n-环丁基-n-(二苯基磷烷基)-2,5-二苯基磷烷-1-胺,l613步骤1.制备外消旋-n-环丁基-2,5-二苯基磷烷-1-胺将环丁胺(0.54ml,6.6mmol)于己烷(5.00ml)中的溶液添加到外消旋-1-氯-2,5-二苯基-磷杂环戊烷(0.60g,2.2mmol)于己烷(5.00ml)中的溶液中。在室温下搅拌反应混合物过夜。使反应混合物过滤通过一次性过滤器漏斗,且随后通过5cm活化中性氧化铝塞。在真空下蒸发溶剂以得到白色固体。产率0.40g(58.8%)。1hnmr(400mhz,c6d6)δ7.25(dt,j=8.0,1.7hz,2h),7.15(qd,j=7.5,1.6hz,4h),7.09-6.94(m,4h),3.09-2.89(m,2h),2.89-2.78(m,1h),2.12(dddd,j=20.3,11.0,7.1,5.3hz,1h),2.06-1.93(m,1h),1.77(dddd,j=19.7,9.3,4.8,2.1hz,2h),1.61-1.43(m,1h),1.42-1.24(m,3h),1.14(qd,j=9.6,9.0,4.9hz,1h),1.08-0.78(m,2h).13cnmr(101mhz,c6d6)δ143.96(d,j=18.7hz),139.79,127.92,127.65,127.62,127.54,127.41,125.60(d,j=2.4hz),125.24(d,j=1.9hz),55.71(d,j=14.1hz),53.95(d,j=22.7hz),50.00(d,j=22.9hz),34.30(d,j=3.4hz),34.20(d,j=7.9hz),33.89(d,j=2.4hz),31.32(d,j=2.3hz),13.49.31pnmr(162mhz,c6d6)δ69.19。步骤2.制备外消旋-n-环丁基-n-(二苯基磷烷基)-2,5-二苯基磷烷-1-胺,l613。将三乙胺(0.049g,0.48mmol)于甲苯-d8(0.98ml)中的冷溶液(-30℃)添加到外消旋-n-环丁基-2,5-二苯基磷烷-1-胺(3)(0.15g,0.48mmol)于甲苯-d8(1.50ml)中的冷(-30℃)溶液中。搅拌所得混合物10分钟,随后放置于-30℃下的冷冻器中30分钟。向此冷却的混合物中添加碘代联苯基膦(0.15g,0.48mmol)于甲苯-d8(1.51ml)中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。在真空下去除溶剂。用二乙醚和甲苯(50/50v/v)溶剂混合物(5ml)萃取粗产物且过滤通过5cm活化中性氧化铝塞。在真空下蒸发溶剂,得到在-30℃下由冷戊烷再结晶的固体材料以产生纯产物。产率0.19g(79.4%)。1hnmr(400mhz,c6d6)δ7.41(td,j=7.0,3.4hz,2h),7.30(d,j=7.6hz,2h),7.14(dq,j=19.9,5.9,4.8hz,4h),7.09-6.87(m,10h),6.63(q,j=6.2hz,2h),4.05(tt,j=8.0,4.0hz,1h),3.62(dq,j=16.2,8.7,8.1hz,1h),3.36(ddd,j=25.9,13.1,4.9hz,1h),3.00(d,j=13.2hz,1h),2.37(dt,j=23.9,13.9hz,2h),2.11(dtd,j=17.9,10.1,4.6hz,2h),1.73-1.43(m,3h),1.32(d,j=10.4hz,1h),1.01(t,j=10.0hz,1h).13cnmr(101mhz,c6d6)δ143.78(d,j=21.0hz),140.85(d,j=24.2hz),139.11-138.57(m),132.32(d,j=21.8hz),131.81(d,j=18.9hz),128.66(t,j=2.7hz),128.42,128.20,128.12,128.07,128.01,127.92,127.47,125.59(d,j=2.6hz),125.23(d,j=1.9hz),57.37(d,j=25.4hz),55.28-53.43(m),50.15(d,j=21.8hz),35.69(d,j=3.5hz),33.26(d,j=13.4hz),33.00-32.76(m),32.52(d,j=12.5hz),14.41.31pnmr(162mhz,c6d6,60℃)δ77.62,59.27。hrms:预期值(m+1):494.216;实验值(m+1):494.2169制备2s,5s)-n-(双(3,4,5-三氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l615步骤1.制备双(3,4,5-三氟苯基)二甲基氨基膦将5-溴-1,2,3-三氟苯(19.855g,94.110mmol)缓慢逐滴添加到正丁基锂(9.10ml,2.38m,21.7mmol以及45.5ml,1.57m,71.4mmol;总计:93.1mmol)于醚(200ml)中的冷却(-85到-80℃(液氮/丙酮))溶液以使得温度不超过-89℃。使温度提高到-78℃与-75℃之间持续2.5小时(干冰浴),同时形成白色沉淀物。使反应混合物冷却到-85℃。极缓慢地逐滴添加二甲基亚磷酰胺二氯化物(6.791g,46.53mmol)于醚(10ml)中的溶液以使得温度不超过-80℃。将干冰添加到浴中且使反应混合物搅拌过夜,同时加热到环境温度。31p和19fnmr光谱显示产物为约99.5%所需产物。过滤反应混合物且在减压下去除挥发物。用己烷萃取残余物,过滤且在减压下去除挥发物以得到呈浅黄色油状的5,13.50g,86.04%。1hnmr(500mhz,cdcl3)δ6.95(dt,j=7.5,6.4hz,4h),2.64(d,j=9.7hz,6h).13cnmr(101mhz,cdcl3)δ151.35(dddd,j=254.1,10.0,8.2,3.0hz),140.00(dtd,j=254.5,15.5,2.2hz),134.44(dq,j=21.9,3.7hz),115.41(ddd,j=21.7,15.1,5.5hz),41.47(d,j=16.3hz).31pnmr(202mhz,cdcl3)δ65.05.19fnmr(376mhz,cdcl3)δ-133.39--133.55(m),-159.17(ttd,j=20.3,6.7,3.4hz)。步骤2.制备双(3,4,5-三氟苯基)氯膦将含无水hcl的乙醚(55.0ml,2.0m,110mmol)添加到双(3,4,5-三氟苯基)二甲基氨基膦(13.30g,39.44mmol)于二氯甲烷(125ml)中的冷却(-35到-30℃)溶液中(以两个部分-第一部分后的nmr光谱显示反应不完全),同时形成一些沉淀物。搅拌反应混合物两小时。第二部分后的nmr光谱显示反应完成。添加己烷(100ml)且过滤反应混合物。在减压下去除挥发物以得到含有油的沉淀物。用己烷萃取残余物且过滤。在减压下去除挥发物以得到透明黄色油,12.74g,98.3%。1hnmr(400mhz,cdcl3)δ7.19(dtd,j=7.1,6.3,1.0hz,1h).13cnmr(101mhz,cdcl3)δ151.45(dtd,j=256.3,10.1,3.1hz),141.38(dtd,j=258.1,15.2,2.0hz),133.93(dq,j=37.9,4.8hz),115.64(ddd,j=26.9,15.6,6.2hz).31pnmr(162mhz,cdcl3)δ74.93(t,j=3.1hz).19fnmr(376mhz,cdcl3)δ-131.41(dd,j=20.2,6.7hz),-155.11(ttd,j=20.0,6.5,3.0hz)。步骤3.制备双(3,4,5-三氟苯基)碘膦将三甲基碘硅烷(tmsi)(9.960g,49.78mmol)快速地逐滴添加到双(3,4,5-三氟苯基)氯膦(12.50g,38.04mmol)于甲苯中的溶液中以得到黄色溶液。搅拌反应混合物过夜。在减压下去除挥发物以得到呈黄色油状的产物。添加己烷导致沉淀,然而,沉淀物的量似乎小于约一克或两克。己烷母液为极黄的,指示大量溶解产物的存在。在减压下去除挥发物以得到呈黄色油状的产物,其为双(3,4,5-三氟苯基)碘膦(94%)和二碘(3,4,5-三氟苯基)膦(6%)的混合物。产率为13.006g,81.39%。1hnmr(400mhz,cdcl3)δ7.28(伪四重峰,j=7.2hz,4h).13cnmr(101mhz,cdcl3)δ151.10(dddd,j=256.3,10.3,9.2,3.3hz),141.09(dtd,j=258.4,15.2,2.3hz),130.29(dq,j=43.0,4.8hz),117.75(ddd,j=25.5,15.5,6.1hz).31pnmr(162mhz,cdcl3)δ30.25(t,j=3.1hz).19fnmr(376mhz,cdcl3)δ-131.52(dd,j=20.3,6.8hz),-155.14(ttd,j=20.0,6.3,2.9hz)。步骤4.制备(2s,5s)-n-(双(3,4,5-三氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l615将双(3,4,5-三氟苯基)碘膦(0.302g,0.720mmol)于乙醚(5ml)中的溶液缓慢添加到n-丁基-2,5-二苯基磷烷-1-胺(0.224g,0.72mmol)和三乙胺(0.728g,7.19mmol)于乙醚(5ml)中的溶液中。在添加约80%的双(3,4,5-三氟苯基)碘膦后,获取nmr光谱,其显示存在过量磷杂环戊烷。添加额外双(3,4,5-三氟苯基)碘膦。nmr光谱显示反应还不完全。添加其余的双(3,4,5-三氟苯基)碘膦且使混合物搅拌过夜。过滤反应混合物且在减压下去除挥发物。由己烷两次再结晶残余物且在减压下干燥以得到呈无色粉末状的产物,0.1322g,30.5%。1hnmr(400mhz,cdcl3)δ7.68-7.48(m,10h),7.17(qd,j=6.3,1.1hz,2h),6.57(dt,j=7.5,6.4hz,2h),4.00(ddt,j=12.7,7.6,3.9hz,1h),3.87(ddd,j=25.1,13.2,5.9hz,1h),3.34-3.18(m,1h),3.18-3.05(m,1h),2.94-2.81(m,1h),2.74(tt,j=11.0,5.3hz,1h),2.10(dtdd,j=13.2,11.1,5.2,2.6hz,1h),1.66-1.55(m,1h),1.30-1.09(m,3h),1.02-0.92(m,1h),0.90(t,j=7.2hz,3h).13cnmr(126mhz,cdcl3)δ151.15(dddd,j=255.0,10.5,8.4,2.9hz),150.71(dddd,j=253.6,18.5,8.8,3.0hz),142.64(d,j=20.2hz),140.97(dtd,j=40.1,15.4,2.1hz),138.94(dtd,j=39.4,15.4,2.3hz),138.17(d,j=2.9hz),135.56(d,j=28.1hz),133.97(dq,j=21.5,4.1hz),128.65,128.55-128.42(m),127.88(d,j=9.0hz),126.24(d,j=2.4hz),126.18(d,j=1.9hz),116.05,115.93(dddd,j=27.5,21.5,15.8,4.9hz),55.54(dd,j=22.1,14.1hz),54.11(d,j=24.0hz),50.87(dd,j=22.5,4.2hz),36.27(d,j=3.7hz),33.69(dd,j=5.9,2.5hz),32.92(dd,j=6.0,3.2hz),19.66,13.50.31pnmr(162mhz,cdcl3)δ98.98(d,j=15.9hz),58.18(d,j=15.7hz).19fnmr(376mhz,cdcl3)δ-132.78(m),-133.64(m),-157.93(m),-159.15(m)。hrms:预期值(m+1):604.1751。实验值(m+1):604.1754。制备外消旋-n-丁基-2,5-双(3,5-二甲基苯基)-n-(二苯基磷烷基)磷烷-1-胺,l618步骤1.制备(3,5-二甲基苯基)溴化镁。向装备有搅拌棒和史蒂文斯(stevens)(螺旋管型)冷凝器的两颈烧瓶中装入镁屑(8.94g,368.0mmol)和thf(20ml)。将1,2-二溴乙烷(2滴)添加到所得混合物中。将混合物搅拌5分钟以活化镁屑。在单独容器中,用thf(100ml)稀释1-溴-3,5-二甲苯(50.0ml,368.0mmol)且吸进注射器中。将少量(大约0.5ml)1-溴-3,5-二甲苯溶液添加到镁屑中且搅拌直到观测到颜色改变为止。在风扇循环史蒂文斯冷凝器上方空气的情况下,历经几分钟缓慢添加其余的1-溴-3,5-二甲苯溶液且使反应混合物搅拌几分钟直到回流停止为止。将额外thf(17.5ml)添加到溶液中。将反应混合物加热到65℃且搅拌过夜。形成大量沉淀物。添加thf(229.5ml)的其余部分,且使反应混合物过滤通过塑料熔块进入烘干的罐中。使用水杨醛苯腙,遵循love等人(love,b.e.;jones,e.g.《有机化学杂志(j.org.chem.)》1999,64,3755)的程序滴定所得格林纳溶液,保证浓度为1.0m。格林纳溶液原样用于后续反应中。步骤2.制备(e,e)-1,4-双(3,5-二甲基苯基)-1,3-丁二烯。根据由hintermann等人(hintermann,l.;schmitz,m.;chen,y.《高级合成与催化(adv.synth.catal.)》2010,352,2411)调节的程序制备(e,e)-1,4-双(3,5-二甲基苯基)-1,3-丁二烯。将甲苯(200ml)添加到含有nicl2(三环己基膦)2(3.80g,5.51mmol,3mol%)的较小小瓶中。搅拌混合物且依次添加噻吩(14.7ml,183.6mmol)和(3,5-二甲基苯基)溴化镁(367.2ml,1.0m,367.2mmol)。将反应物小瓶加热到86℃,同时继续搅拌。通过gc/ms监测反应。在完成后,反应混合物冷却,用2-4个体积的甲苯稀释,且通过小心添加相等体积的nh4cl饱和水溶液(注意:产生h2s气体)淬灭。用相等体积的hcl(2.4m)、naoh(2m)和水洗涤有机相且随后经无水mgso4干燥。过滤溶液且在旋转式蒸发器上浓缩。通过硅胶色谱法,使用乙酸乙酯/己烷的混合物作为洗提剂获得材料的纯化。在真空下去除挥发物,产生淡黄色粉末(11.00g,23%)。1hnmr(400mhz,cdcl3)δ7.07(s,4h),6.93(d,j=12.2hz,2h),6.89(s,2h),6.60(d,j=14.0hz,2h),2.33(s,12h).1hnmr(400mhz,c6d6)δ7.07(s,2h),7.01-6.90(m,1h),6.76(s,1h),6.66-6.55(m,1h),2.18(s,6h).13cnmr(101mhz,c6d6)δ138.07,137.95,133.33,129.72,129.62,124.95,21.38。步骤3.制备(1s,2r,5s)-1-(二甲氨基)-2,5-双(3,5-二甲基苯基)-2,5-二氢磷杂环戊二烯1-氧化物在不在手套箱中进行的反应中,在用氮气净化的较大加套的多颈烧瓶中,将二甲基亚磷酰胺二氯化物(4.30g,37.4mmol)添加到氯化铝(4.72g,35.4mmol)于二氯甲烷(50ml)中的经搅拌的悬浮液中。在45分钟之后,将已形成的无色溶液和(e,e)-1,4-双(3,5-二甲基苯基)-1,3-丁二烯(8.00g,34.1mmol)于二氯甲烷(125ml)中的溶液各自冷却到0℃。在冷却之后,将1,4-(3,5-二甲基苯基)丁二烯溶液缓慢添加到二甲基亚磷酰胺二氯化物和氯化铝的混合物中。在0℃下将混合物搅拌过夜。随后将水性edta(乙二胺四乙酸,0.2m,200ml)和在冰水中冷却的饱和nahco3(100ml)的悬浮液添加到反应混合物中。在0℃下搅拌混合物4小时,过滤通过硅藻土,倾析且用二氯甲烷萃取水层。用nahco3、1.0mhcl、盐水洗涤有机层且经无水mgso4干燥。在真空下去除挥发物以产生黄色固体。用二乙醚湿磨黄色固体,通过过滤采集固体,用额外二乙醚洗涤且干燥。(产率:6.63g,50%)。1hnmr(400mhz,cdcl3)δ6.94(s,4h),6.86(s,2h),6.49(d,j=29.0hz,1h),4.22(d,j=18.7hz,1h),2.29(s,12h),1.93(d,j=8.3hz,6h).13cnmr(101mhz,cdcl3)δ138.02(d,j=2.5hz),135.79(d,j=8.2hz),130.84(d,j=16.9hz),128.39(d,j=2.9hz),125.06(d,j=4.8hz),77.36,49.13(d,j=71.7hz),36.22(d,j=1.8hz),21.39.31pnmr(162mhz,cdcl3)δ69.13.步骤4.制备外消旋-1-(二甲氨基)-2,5-双(3,5-二甲基苯基)磷杂环戊烷1-氧化物在不在手套箱中进行的反应中,向800ml不锈钢压力反应器中装入(1s,2r,5s)-1-(二甲氨基)-2,5-双(3,5-二甲基苯基)-2,5-二氢磷杂环戊二烯1-氧化物(6.10g,17.25mmol)、10%pd/c(918mg,0.086mmol,5mol%)和甲醇(200ml)。用氮气和氢气净化反应器,且随后加压到500psi(3.45mpa)氢气且在室温下搅拌8小时。在氮气氛围下,使溶液过滤通过硅藻土塞(危险:甲醇和pd/c可在氧气存在下起火;在惰性氛围下进行),且在真空下去除挥发物。使固体再溶解于ch2cl2中,过滤通过硅藻土,且在真空下去除挥发物。(产率:5.8g,94%;纯度:99.4%)。在塑料过滤器漏斗上,用丙酮洗涤固体以去除痕量杂质。在真空下干燥固体,且随后通过nmr光谱分析分析,确证去除杂质(产率:4.2g,68%)。1hnmr(400mhz,c6d6)δ7.13(s,2h),6.97(s,2h),6.76(s,1h),6.72(s,1h),3.53(ddd,j=24.4,13.0,7.5hz,1h),2.99-2.84(m,1h),2.20(s,6h),2.15(s,6h),2.15(s,3h),2.12(s,3h),2.09-1.99(m,2h),1.95(ddt,j=14.0,7.5,3.1hz,1h),1.76-1.53(m,1h).13cnmr(101mhz,c6d6)δ137.90(d,j=4.6hz),137.73(d,j=2.2hz),137.70(d,j=1.7hz),137.55(d,j=5.0hz),128.60(d,j=2.1hz),128.18(d,j=2.5hz),127.53,127.48,125.37(d,j=5.0hz),47.72(d,j=74.1hz),42.75(d,j=77.6hz),35.92(d,j=2.2hz),30.57(d,j=11.9hz),27.50(d,j=9.1hz),21.51,21.40.31pnmr(162mhz,c6d6)δ56.62。步骤5.制备外消旋-1-氯-2,5-双(3,5-二甲基苯基)磷杂环戊烷。在乙醚(总反应体积为30ml)中混合外消旋-1-(二甲氨基)-2,5-双(3,5-二甲基苯基)磷杂环戊烷-1-氧化物(2.36g,6.64mmol)。依次添加吡啶(0.59ml,7.30mmol)和三氯硅烷(0.38ml,7.30mmol)且在环境温度下搅拌混合物过夜(约18小时)。去除挥发物且将戊烷(10ml)添加到所得浆料中,其搅拌几分钟,且随后过滤通过活化酸性氧化铝塞。滤液浓缩,在-35℃下放置于冷冻器中过夜以形成白色沉淀物。倾析溶剂且使固体再溶解于戊烷中且再次放置于冷冻器中以在几分钟之后沉淀出白色固体。通过过滤分离固体,且在真空下干燥(产率:1.95g,83%)。1hnmr(400mhz,c6d6)δ7.00(s,2h),6.80(s,2h),6.75(s,1h),6.72(s,1h),3.84(td,j=8.9,2.3hz,1h),3.24(ddd,j=33.3,12.5,5.7hz,1h),2.56(qdd,j=12.2,6.8,3.4hz,1h),2.43(dtdd,j=13.4,8.3,6.7,1.6hz,1h),2.16(d,j=6.9hz,12h),1.80-1.63(m,1h).13cnmr(101mhz,c6d6)δ141.82,141.62,138.12,137.44,136.64,128.30(d,j=2.4hz),126.14,125.66,57.84(d,j=32.1hz),53.52(d,j=31.1hz),34.50,31.69,21.03.31pnmr(162mhz,cdcl3)δ137.06。步骤6.制备外消旋-n-丁基-2,5-双(3,5-二甲基苯基)磷烷-1-胺向40ml烘干的小瓶中装入外消旋-1-氯-2,5-双(3,5-二甲基苯基)磷杂环戊烷(376mg,1.14mmol)和戊烷(20ml)。向单独小瓶中装入正丁胺(0.83ml,11.4mmol)和戊烷(10ml)。将反应剂冷却到-30℃,且将正丁胺溶液缓慢添加(同时搅拌)到外消旋-1-氯-2,5-双(3,5-二甲基苯基)磷杂环戊烷的溶液,使其达到室温。在搅拌30分钟之后,通过nmr光谱分析来分析等分试样,其确证完全转化。使产生的浆料过滤通过中性氧化铝塞。随后用额外10ml戊烷冲洗氧化铝。在真空下干燥滤液1小时,随后溶解于最少量戊烷中且放置于-35℃下的冷冻器中。过夜,形成白色沉淀物,其随后使用塑料过滤器漏斗分离。通过nmr光谱分析揭示残余正丁胺的存在。由戊烷再结晶固体。在真空下干燥白色粉末且通过nmr光谱分析确证残余正丁胺完成去除(产率:306mg,73%)。1hnmr(400mhz,c6d6)δ7.09(s,2h),6.91(s,2h),6.76(s,1h),6.75(s,1h),3.14(ddd,j=21.6,12.6,6.0hz,1h),3.04-2.93(m,1h),2.55(ddq,j=12.6,10.4,6.9hz,1h),2.41-2.25(m,1h),2.23(s,12h),2.22-2.08(m,1h),1.91(qdd,j=12.5,5.1,2.6hz,1h),1.70(qdd,j=12.6,5.1,2.5hz,1h),1.11(m,1h),1.07-0.85(m,4h),0.69(t,j=6.9hz,3h).13cnmr(101mhz,c6d6)δ144.41(d,j=17.8hz),140.13,137.87,137.65-137.46(m),127.41(d,j=1.8hz),126.29(d,j=3.2hz),126.15,126.07,56.17(d,j=14.3hz),50.55(d,j=22.3hz),47.95(d,j=23.1hz),35.56(d,j=6.9hz),34.68,31.93(d,j=2.2hz),21.55(d,j=2.0hz),20.11,14.05.31pnmr(162mhz,c6d6)δ72.65。步骤7.制备外消旋-n-丁基-2,5-双(3,5-二甲基苯基)-n-(二苯基磷烷基)-磷烷-1-胺,l618将碘代联苯基膦(0.212g,0.680mmol)于戊烷(3ml)中的冷(-35℃)溶液逐滴添加到外消旋-n-丁基-2,5-双(3,5-二甲基苯基)磷烷-1-胺(250mg,0.680mmol)和三乙胺(0.072g,0.71mmol)于戊烷(3ml)中的冷(-35℃)溶液,使得立即沉淀出白色粉末。通过nmr光谱分析来分析等分试样,确证完全转化成所需产物。使戊烷浆料过滤通过较小氧化铝塞,且在真空下去除溶剂。将最少量戊烷添加到固体中且将材料放置于冷冻器(-35℃)中。过夜,沉淀出白色固体。倾析溶液,且在真空下干燥所得固体(产率:260mg,69%)。1hnmr(400mhz,c6d6)δ7.48(tt,j=6.5,1.6hz,2h),7.23(s,2h),7.19-7.10(m,4h),7.01(s,3h),7.00-6.93(m,3h),6.87(ddd,j=8.4,6.8,1.6hz,2h),6.78(d,j=10.8hz,2h),4.08(ddt,j=12.3,7.3,4.7hz,1h),3.46(ddd,j=24.2,13.3,5.5hz,1h),3.29-3.13(m,1h),3.11-2.88(m,1h),2.57-2.39(m,1h),2.31(td,j=10.2,4.9hz,1h),2.24(s,6h),2.18(s,6h),1.71(qdt,j=12.9,4.7,2.1hz,1h),1.04-0.84(m,1h),0.74-0.49(m,2h),0.43(t,j=7.0hz,3h).13cnmr(101mhz,c6d6)δ144.61(d,j=20.6hz),141.12(d,j=22.9hz),139.37(d,j=2.5hz),139.23,139.07,137.79(d,j=2.9hz),133.30(d,j=19.8hz),132.77(d,j=20.2hz),128.68,128.49(d,j=5.3hz),128.37,127.89,127.55-127.44(m),127.29(d,j=1.7hz),127.26(d,j=1.7hz),126.86,126.78,56.45-55.86(m),54.81(dd,j=34.0,6.8hz),52.74-51.81(m),36.79,34.46(d,j=6.6hz),33.24(d,j=3.4hz),33.16(d,j=3.3hz),21.48,20.04,13.97。31pnmr(162mhz,c6d6)δ100.18-98.20(宽峰d,1p),56.83(d,j=26.5hz,1p)。制备外消旋-n-环己基-n-(二苯基磷烷基)-2,5-二苯基磷烷-1-胺,l619步骤1.制备外消旋-n-环己基-2,5-二苯基磷烷-1-胺将环己胺(0.38ml,3.3mmol)于己烷(5.00ml)中的溶液添加到外消旋-1-氯-2,5-二苯基-磷杂环戊烷(0.30g,1.1mmol)于己烷(5.00ml)中的溶液中。在室温下搅拌反应混合物过夜。通过过滤去除固体且使所得溶液传送通过5cm活化中性氧化铝塞。在真空下蒸发溶剂以得到白色固体。产率0.35g(94.6%)。1hnmr(400mhz,c6d5cd3)δ7.30(dt,j=8.0,1.6hz,2h),7.19(dt,j=17.0,7.6hz,4h),7.11-7.02(m,4h),3.03(ddd,j=22.3,12.4,6.0hz,1h),2.83(ddd,j=12.6,7.1,5.9hz,1h),2.28-2.12(m,1h),2.04(m,1h),1.80(m,1h),1.72-1.51(m,3h),1.51-1.21(m,3h),1.03(dd,j=10.8,7.3hz,2h),0.98-0.73(m,4h),0.58-0.36(m,1h).13cnmr(101mhz,c6d5cd3)δ144.00(d,j=17.8hz),140.05,128.24,127.99(d,j=3.3hz),127.94,127.43,125.47(d,j=2.4hz),125.13(d,j=1.8hz),56.81(d,j=15.3hz),56.15(d,j=24.6hz),49.78(d,j=22.1hz),36.80(d,j=5.9hz),36.08(d,j=5.2hz),33.59(d,j=3.2hz),31.39(d,j=2.1hz),25.67,25.11(d,j=13.9hz)。31pnmr(162mhz,c6d5cd3)δ71.46。步骤2.制备外消旋-n-环己基-n-(二苯基磷烷基)-2,5-二苯基磷烷-1-胺,l619将三乙胺(0.058g,0.57mmol)溶解于ch2cl2(0.576ml)中的冷溶液(-30℃)添加到外消旋-n-环己基-2,5-二苯基磷烷-1-胺(0.16g,0.47mmol)溶解于ch2cl2(1.60ml)中的冷(-30℃)溶液中。搅拌所得混合物10分钟,且放置于-30℃下的冷冻器中30分钟。将溴二苯基膦(0.13g,0.47mmol)于1.26mlch2cl2中的冷(-30℃)溶液添加到冷混合物中。在环境温度下搅拌溶液过夜。在真空下去除溶剂。使粗产物再溶解于二乙醚和甲苯(50/50v/v)溶剂混合物(5ml)中且过滤通过5cm活化中性氧化铝塞。在真空下蒸发溶剂,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.16g(63.9%)。1hnmr(400mhz,c6d6,70℃)δ7.49(d,j=7.0hz,2h),7.22(d,j=7.6hz,3h),7.16-7.07(m,2h),7.07-6.93(m,11h),6.86(h,j=6.3hz,2h),4.09(s,1h),3.34(ddd,j=25.7,13.1,5.7hz,1h),2.98(s,1h),2.86(qdd,j=11.3,7.6,3.4hz,1h),2.42(td,j=15.4,14.0,6.4hz,1h),2.14(tt,j=11.1,5.5hz,1h),1.78(q,j=12.0hz,1h),1.69-1.51(m,1h),1.48-1.30(m,2h),1.30-1.14(m,3h),1.11-0.92(m,1h),0.79(tq,j=23.4,12.4hz,3h).13cnmr(101mhz,c6d6)δ144.08(d,j=20.7hz),141.19(d,j=24.0hz),139.72,139.23(d,j=2.8hz),133.10(d,j=23.6hz),132.51,128.69(d,j=3.1hz),128.53,128.23-127.96(m),127.85,127.37,127.32,125.51(d,j=2.5hz),125.15(d,j=1.8hz),61.24(d,j=14.7hz),50.42(d,j=23.3hz),36.18(d,j=3.9hz),35.69(d,j=10.2hz),34.77,33.02-32.64(m),26.19,25.96,25.24.31pnmr(162mhz,c6d6,70℃)δ83.47,58.30。hrms:预期值(m+1):522.2473;实验值(m+1):522.2483。制备(外消旋)-n-(双(3,5-二-叔丁基-4-甲氧基苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l620步骤1.制备双(3,5-二-叔丁基-4-甲氧基苯基)碘膦使双(3,5-二-叔丁基-4-甲氧基苯基)氯膦(0.90g,1.8mmol)溶解于甲苯(4.0ml)中。添加三甲基碘硅烷(0.30ml,2.1mmol)且在环境温度下搅拌橙色溶液过夜。一些黄色固体已形成。过滤混合物以去除黄色固体且在真空下浓缩滤液以产生产物。产率(1.0g,97%)。1hnmr(400mhz,c6d6)δ7.90(d,j=7.7hz,4h),3.31(s,6h),1.37(s,36h).13cnmr(101mhz,c6d6)δ161.96,144.37(d,j=6.1hz),133.06,132.81,64.21,36.20,32.12.31pnmr(162mhz,c6d6)δ47.18。步骤2.制备(外消旋)-n-(双(3,5-二-叔丁基-4-甲氧基苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l620将双(3,5-二-叔丁基-4-甲氧基苯基)碘膦(0.29g,0.48mmol)于甲苯(5.0ml)中的冷(-30℃)溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.15g,0.48mmol)和三乙胺(0.074μl,0.53mmol)于甲苯(5.0ml)中的冷(-30℃)溶液,使得固体立即形成。在混合之后,在真空下去除挥发物。用乙醚萃取残余物且过滤通过活化中性氧化铝塞。去除挥发物以产生呈白色固体状的产物。产率(0.31g,81%)。1hnmr(400mhz,c6d6)δ7.77(t,j=3.1hz,2h),7.56-7.44(m,2h),7.40(d,j=6.7hz,2h),7.33-7.23(m,2h),7.21-7.11(m,4h),7.08-7.00(m,1h),7.00-6.91(m,1h),4.59-4.16(m,1h),3.38(d,j=10.9hz,6h),3.31(s,5h),3.24-3.04(m,3h),1.49(d,j=3.0hz,3h),1.33(s,36h),0.40(d,j=7.3hz,3h).13cnmr(101mhz,c6d6)δ160.36-160.07(m),144.84(d,j=21.4hz),143.48-143.22(m),142.73(d,j=6.6hz),139.20(d,j=1.7hz),135.18(d,j=19.5hz),133.33(t,j=13.5hz),131.88(d,j=23.1hz),130.84(t,j=4.4hz),130.31(d,j=21.2hz),128.80(t,j=2.8hz),128.39(d,j=9.8hz),128.31,127.93(d,j=1.4hz),125.50(dd,j=15.7,2.2hz),63.88(d,j=5.6hz),63.58,36.82,35.68,35.56(d,j=4.6hz),34.24(d,j=7.3hz),31.93,31.86(d,j=4.6hz),19.77,13.52.31pnmr(162mhz,c6d6)δ100.55(d,j=25.7hz),57.14(d,j=25.7hz)。hrms(esi-tof)m/z:对于c50h71no2p2,[m+h]+计算值为780.5033;实验值为780.5048。制备(2s,5s)-n-(双(2,6-二氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l627步骤1.制备双(2,6-二氟苯基)二甲基氨基膦1-将溴-3,5-二氟苯(19.00g,98.45mmol)缓慢逐滴添加到正丁基锂(42.0ml,2.34m于己烷中,98.3mmol)于乙醚(250ml)中的冷却(-90到-85℃(液氮/丙酮))溶液以使得温度不超过-85℃。使温度提高到-78℃与-74℃之间持续2小时(干冰浴),而无白色沉淀物形成,即使在加热到-65℃持续1小时之后。使混合物冷却到-78℃且以使得温度不超过-65℃的速率缓慢逐滴添加二甲基亚磷酰胺二氯化物(7.161g,49.06mmol)于乙醚(总计20ml)中的溶液。在添加期间形成沉淀物且无色混合物变成淡棕色。使反应混合物升温到环境温度,同时搅拌过夜。颜色变成红色。过滤反应混合物且在减压下去除挥发物以得到深红色固体。用己烷萃取固体,过滤且在减压下去除挥发物以得到涂布有红色液体的较大无色晶体。倾析液体。在熔块上采集晶体,用己烷洗涤,且在减压下干燥以得到本体结晶材料,其归因于一些表面红色液体而为粉色的。产率=7.135g(48.3%)。1hnmr(400mhz,cdcl3)δ7.32-7.21(m,1h),6.89-6.73(m,2h),2.73(dp,j=10.5,0.7hz,3h).13cnmr(101mhz,cdcl3)δ163.16(dt,j=246.7,10.2hz),130.82(t,j=10.9hz),115.15(dtt,j=34.4,23.7,3.1hz),111.69-111.06(m),42.46(dt,j=17.3,2.1hz).31pnmr(162mhz,cdcl3)δ25.62(p,j=31.8hz).19fnmr(376mhz,cdcl3)δ-104.67(dt,j=31.7,7.0hz)。步骤2.制备双(2,6-二氟苯基)氯膦将含无水hcl的乙醚(35.0ml,2m,70.0mmol)添加到双(2,6-二氟苯基)二甲基氨基膦(7.00g,23.24mmol)于二氯甲烷(20ml)中的溶液中,使得红色-橙色反应混合物脱色且形成沉淀物。搅拌反应混合物30分钟。过滤混合物且在减压下去除挥发物。用乙醚萃取残余物且过滤。在减压下去除挥发物以得到呈淡黄色固体状的产物,6.492g,95.5%。1hnmr(500mhz,cdcl3)δ7.42-7.41(m,1h),6.91(td,j=8.2,2.5hz,2h).13cnmr(126mhz,cdcl3)δ163.69(dm,j=252.0hz),133.73-133.33(m),113.50-112.37(m),112.15-111.48(m).31pnmr(162mhz,cdcl3)δ39.58(p,j=43.5hz).19fnmr(376mhz,cdcl3)δ-100.55(dt,j=43.5,7.0hz)。步骤3.制备双(2,6-二氟苯基)碘膦将三甲基碘硅烷(5.308g,26.53mmol)缓慢添加到双(2,6-二氟苯基)氯膦(6.40g,21.9mmol)于二氯甲烷(20ml)中的溶液中。反应混合物即刻变成深黄色。搅拌混合物1小时。在减压下去除挥发物。用乙醚萃取残余物,过滤,且在减压下去除挥发物以得到呈橙色-黄色结晶固体状的产物,8.3852g,99.8%。1hnmr(500mhz,cdcl3)δ7.46-7.33(m,1h),6.91(dtd,j=10.6,8.1,7.4,3.3hz,2h).13cnmr(126mhz,cdcl3)δ163.85(dm,j=251.8hz),133.41-132.88(m),111.99-111.35(m),110.35-108.83(m).31pnmr(202mhz,cdcl3)δ-29.81(p,j=36.9hz).19fnmr(470mhz,cdcl3)δ-96.87(dt,j=36.4,6.8hz)。步骤4.制备(2s,5s)-n-(双(2,6-二氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l627将约90%的双(2,6-二氟苯基)碘膦(0.394g,1.03mmol)于二乙醚(6ml)中的溶液缓慢添加到n-丁基-2,5-二苯基磷烷-1-胺(0.3198g,1.03mmol)和三乙胺(1.34g,13.2mmol)于二乙醚(6ml)中的溶液中,同时形成沉淀物。31pnmr光谱显示存在轻微过量的磷杂环戊烷。添加额外双(2,6-二氟苯基)碘膦溶液。搅拌反应混合物过夜。31pnmr光谱还显示存在约3%磷杂环戊烷。添加双(2,6-二氟苯基)碘膦溶液的其余部分。搅拌反应混合物若干小时,随后过滤,且在减压下去除挥发物。用乙醚萃取残余物,过滤,且在减压下去除挥发物以得到米色固体。用己烷湿磨残余物,过滤,且在减压下干燥以得到呈米色粉末状的产物,0.4365g,74.89%。1hnmr(500mhz,cdcl3)δ7.38-7.26(m,7h),7.21-7.17(m,1h),7.15(ddt,j=8.2,6.4,1.5hz,1h),7.00(t,j=7.7hz,2h),6.89(t,j=7.4hz,1h),6.85(td,j=8.2,2.2hz,1h),6.63(td,j=8.2,2.5hz,2h),4.11(ddt,j=12.2,7.9,4.5hz,1h),3.50(dddd,j=24.9,13.4,5.3,1.7hz,1h),3.24-3.01(m,2h),2.71(ddddd,j=14.4,13.0,7.8,5.1,1.1hz,1h),2.40(dq,j=17.0,5.3hz,1h),1.82(tdd,j=12.9,11.2,5.2hz,1h),0.71(dddd,j=21.0,15.0,9.3,3.7hz,3h),0.42(t,j=7.2hz,3h),0.41-0.28(m,1h).13cnmr(101mhz,cdcl3)δ163.51(ddd,j=247.8,11.4,8.8hz),162.57(dt,j=247.4,j=10.2hz),143.97(d,j=20.7hz),138.02(d,j=2.3hz),131.82(t,j=11.0hz),129.88(t,j=10.8hz),128.30(dm,j=3.0hz),128.01(d,j=8.4hz),127.66(d,j=1.3hz),125.63(d,j=2.6hz),125.43(d,j=1.9hz),116.27-114.92(m),111.91-111.49(m),111.49-111.07(m),58.69(dm,j=33.5hz),55.44(dd,j=21.9,17.7hz),52.16(dd,j=21.4,7.0hz),36.42,33.87(d,j=6.9hz),32.57(dd,j=9.0,3.7hz),19.60,13.42.31pnmr(202mhz,cdcl3)δ109.47(d,j=29.8hz),15.41(pd,j=39.5,30.0hz).19fnmr(470mhz,cdcl3)δ-101.75(dt,j=39.7,7.6hz),-103.51(dt,j=39.2,7.4hz)。hrms:预期值(m+1):568.1868。实验值(m+1):568.1940。制备(2s,5s)-n-(双(3,5-二氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l628步骤1.制备双(3,5-二氟苯基)二甲基氨基膦将1-溴-3,5-二氟苯(19.469g,100.9mmol)缓慢逐滴添加到正丁基锂于己烷(42.0ml,2.39m,总计100mmol)于乙醚(250ml)中的冷却(-100到-93℃(液氮/丙酮))溶液中以使得温度不超过-88℃。使温度提高到-78℃与-74℃之间持续1小时(干冰浴),同时形成白色沉淀物。以使得温度不超过-64℃的速率缓慢逐滴添加二甲基亚磷酰胺二氯化物(7.030g,48.17mmol)于乙醚(总计20ml)中的溶液。使反应混合物升温,同时搅拌过夜。到早晨,温度达到14℃且混合物颜色为红紫色。将烧瓶放入手套箱中。在高度真空下去除挥发物以得到红褐色固体。用己烷萃取固体,过滤,且在减压下去除挥发物以得到红色油。用己烷再萃取油,从痕量灰色固体过滤且在减压下去除挥发物以得到呈红色油状的产物,6.532g,44.3%。1hnmr(400mhz,cdcl3)δ6.89(tdd,j=6.4,2.3,1.5hz,4h),6.77(ttd,j=8.8,2.3,0.9hz,2h),2.65(d,j=9.6hz,6h).13cnmr(101mhz,cdcl3)δ163.00(ddd,j=252.1,11.3,8.0hz),142.66(dt,j=20.9,5.5hz),114.05(ddd,j=20.5,18.2,6.4hz),104.28(td,j=25.4,1.6hz),41.78(d,j=16.0hz).31pnmr(162mhz,cdcl3)δ65.58.19fnmr(376mhz,cdcl3)δ-109.14(m)。步骤2.制备双(3,5-二氟苯基)氯膦将含无水hcl的乙醚(35.0ml,2m,70.0mmol)添加到双(3,5-二氟苯基)二甲基氨基膦(8.00g,26.6mmol)于二氯甲烷(20ml)中的冷却(冰浴)溶液中,使得黄橙色反应混合物脱色且形成沉淀物。搅拌反应混合物若干天。在减压下去除挥发物。用乙醚萃取残余物且过滤。在减压下去除挥发物以得到呈淡黄色液体状的产物。产率为7.5385g,94.8%。1hnmr(400mhz,cdcl3)δ7.10(dddd,j=7.8,5.6,2.3,1.5hz,4h),6.87(tt,j=8.7,2.3hz,2h).13cnmr(101mhz,cdcl3)δ163.00(ddd,j=254.0,11.4,9.6hz),141.96(dt,j=37.0,6.5hz),114.51-113.89(m),106.42(td,j=25.2,1.4hz).31pnmr(162mhz,cdcl3)δ75.35.19fnmr(376mhz,cdcl3)δ-107.44--107.51(m)。步骤3.制备双(3,5-二氟苯基)碘膦将三甲基碘硅烷(6.081g,30.39mmol)添加到双(3,5-二氟苯基)氯膦(7.410g,25.32mmol)于乙醚(10ml)中的溶液中。反应混合物即刻变成深黄色。搅拌混合物过夜。过滤反应混合物且在减压下去除挥发物以得到7.3738g粗产物。用乙醚萃取残余物,过滤,且在减压下去除挥发物以得到呈暗黄色油状的产物。存在一些固体粒子。nmr光谱显示约88%纯度。使产物溶解于乙醚中,从一些淡棕色固体过滤,且在减压下去除挥发物以得到黄色油。对产物进行阱到阱蒸馏:在罐端部处水浴温度为85℃且液氮在接收器端部。在油扩散泵真空管线(0.6毫托)上实现真空。仅蒸馏出极少量(0.1-0.2g)暗黄色油。罐材料似乎黄色较浅。通过31pnmr,馏出物在48.1ppm(69%,非所需产物)、33.8ppm(9%,所需产物)、0.6ppm(22%,新的非所需产物)处具有峰,同时罐中富集所需产物:48.1ppm(4.3%,非所需产物)、33.8ppm(91.6%,所需产物)、-9.3ppm(4.1%,旧的非所需产物)。在第二蒸馏中,在90℃的略微更高温度下蒸馏此第一蒸馏的罐残余物以得到呈完全纯黄色油状的产物,3.5184g,35.18%。1hnmr(400mhz,cdcl3)δ7.18-7.13(m,2h),6.83(tt,j=8.6,2.3hz,1h).13cnmr(101mhz,cdcl3)δ162.73(ddd,j=254.0,11.5,8.8hz),138.28(dt,j=42.1,6.7hz),116.77-116.10(m),106.28(td,j=25.2,1.5hz).31pnmr(162mhz,cdcl3)δ30.22.19fnmr(376mhz,cdcl3)δ-107.32--107.42(m)。步骤4.制备(2s,5s)-n-(双(3,5-二氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l628将双(3,5-二氟苯基)碘膦(0.518g,1.35mmol)于二乙醚(6ml)中的溶液缓慢添加到n-丁基-2,5-二苯基磷烷-1-胺(0.400g,1.28mmol)和三乙胺(1.300g,12.84mmol)于二乙醚(6ml)中的溶液中,同时形成沉淀物。搅拌反应混合物过夜。31pnmr光谱显示反应完成。过滤反应混合物且在减压下去除挥发物。用乙醚萃取残余物,过滤,且在减压下去除挥发物以得到黄色油。用己烷湿磨残余物,但除了痕量白色固体以外,产物全部溶解。过滤溶液且在减压下去除挥发物以得到固化成黄色固体的黄色油。产率:0.6745g,92.5%。1hnmr(500mhz,cdcl3)δ7.39(d,j=7.6hz,2h),7.36-7.30(m,2h),7.29-7.21(m,5h),7.20(d,j=7.4hz,1h),6.87-6.76(m,3h),6.66(tm,j=8.8hz,1h),6.18(td,j=6.2,2.0hz,2h),3.77(tt,j=7.9,3.9hz,1h),3.60(ddd,j=25.0,13.2,5.8hz,1h),2.93(dddt,j=13.3,11.3,9.0,3.6hz,2h),2.83(dddd,j=15.6,9.4,5.3,1.7hz,1h),2.60(tdd,j=12.7,9.9,4.8hz,1h),2.44(dq,j=11.0,5.5hz,1h),1.82(dddd,j=15.5,13.2,7.8,5.4hz,1h),0.93-0.69(m,3h),0.64-0.55(m,1h),0.52(td,j=7.2,1.6hz,3h).13cnmr(126mhz,cdcl3)δ163.62(ddd,j=63.0,11.3,8.2hz),161.61(ddd,j=61.7,11.4,8.3hz),143.90(dt,j=27.8,5.4hz),143.00(d,j=20.5hz),141.92(dt,j=21.1,6.0hz),138.10(d,j=2.6hz),128.56-128.47(m),128.48(d,j=26.5hz),127.95(d,j=8.8hz),126.15(d,j=2.0hz),126.07(d,j=2.5hz),114.58(dddd,j=21.0,19.6,15.5,5.6hz),104.60(td,j=25.3,1.8hz),104.03(td,j=25.3,1.8hz),56.02(dd,j=21.9,16.3hz),54.37(dd,j=28.6,3.8hz),51.01(dd,j=21.9,4.4hz),36.26(d,j=3.3hz),33.55(d,j=6.7hz),32.71(dd,j=6.7,3.6hz),19.57,13.42.31pnmr(202mhz,cdcl3)d100.26(d,j=16.7hz),58.12(d,j=16.7hz).19fnmr(470mhz,cdcl3)d-108.73--108.86(m),-109.51--109.69(m)。制备外消旋-n-环丁基-n-(双(2-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l629步骤1.制备外消旋-n-环丁基-n-(双(2-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l629。将三乙胺(0.063g,0.62mmol)溶解于甲苯(1.3ml)中的冷溶液(-30℃)添加到外消旋-n-环丁基-2,5-二苯基磷烷-1-胺(0.16g,0.52mmol)溶解于甲苯(1.6ml)中的冷(-30℃)溶液中且搅拌所得混合物10分钟。将混合物放置于-30℃下的冷冻器中30分钟。将双(2-氟苯基)碘膦(0.18g,0.52mmol)于1.8ml甲苯中的冷(-30℃)溶液添加到三乙胺和外消旋-n-环丁基-2,5-二苯基磷烷-1-胺的冷却混合物中,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟,随后过滤通过5cm活化中性氧化铝塞。在真空下去除挥发物,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.25g(92%)。1hnmr(400mhz,c6d6,70℃)δ7.34(d,j=7.5hz,2h),7.15(q,j=7.3hz,4h),7.05-6.74(m,7h),6.68-6.46(m,5h),4.47-4.30(m,1h),3.65(dt,j=16.2,8.0hz,1h),3.23(m,2.89(d,j=13.6hz,1h),2.71-2.42(m,2h),2.15-1.99(m,1h),1.90(s,1h),1.74-1.51(m,2h),1.28(d,j=9.9hz,2h),1.01(m,1h).13cnmr(101mhz,c6d6,70℃)δ165.39(d,j=17.9hz),163.96(d,j=17.2hz),162.95(d,j=18.1hz),161.53(d,j=16.9hz),144.44(d,j=21.7hz),138.71(d,j=2.3hz),133.15(t,j=5.5hz),130.95(d,j=8.6hz),129.59(d,j=8.1hz),128.34(d,j=3.9hz),128.25,128.10,128.01,127.86,125.43(dd,j=20.0,2.3hz),123.80(dd,j=20.1,3.2hz),115.04(d,j=24.1hz),114.38(d,j=23.2hz),57.83(d,j=23.3hz),53.73-51.41(m),51.00(dd,j=22.6,3.7hz),36.16(d,j=1.8hz),32.85(dd,j=22.9,8.6hz),31.94(d,j=14.6hz),14.37.31pnmr(162mhz,c6d6,70℃)δ81.24,32.49。19fnmr(376mhz,c6d6)δ-103.57(m)。制备外消旋-n-环戊基-n-(双(2-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l630步骤1.制备外消旋-n-环戊基-2,5-二苯基磷烷-1-胺将环戊胺(0.64ml,6.5mmol)于己烷(5.0ml)中的溶液添加到外消旋-1-氯-2,5-二苯基-磷杂环戊烷(0.60g,2.2mmol)于己烷(5.0ml)中的溶液中。在室温下搅拌反应混合物过夜。通过使用一次性过滤器漏斗过滤去除固体且使所得溶液传送通过5cm活化中性氧化铝塞。在真空下去除挥发物以产生白色固体。产率0.58g(78%)。1hnmr(400mhz,c6d6)δ7.29(dt,j=8.0,1.7hz,2h),7.17(m,j=17.1,7.5,1.6hz,4h),7.11-6.98(m,4h),3.13-2.95(m,1h),2.92-2.71(m,2h),2.22-1.92(m,2h),1.75(m,1h),1.53(m,1h),1.46-1.19(m,2h),1.19-0.96(m,4h),0.68-0.50(m,1h).13cnmr(101mhz,c6d6)δ144.03(d,j=18.3hz),139.99(d,j=1.3hz),128.34(d,j=1.2hz),128.05(d,j=1.1hz),127.94(d,j=3.4hz),127.54(d,j=8.1hz),125.58(d,j=2.4hz),125.24(d,j=1.8hz),59.24(d,j=22.4hz),56.25(d,j=15.0hz),49.74(d,j=22.3hz),36.01-34.91(m),33.58(d,j=3.0hz),31.45(d,j=2.1hz),23.03(d,j=3.4hz).31pnmr(162mhz,c6d6)δ68.29。步骤2.制备外消旋-n-环戊基-n-(双(2-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l630将三乙胺(0.049g,0.48mmol)于甲苯(0.98ml)中的冷溶液(-30℃)添加到外消旋-n-环戊基-2,5-二苯基磷烷-1-胺(0.13g,0.40mmol)于甲苯(1.3ml)中的冷(-30℃)溶液中且搅拌所得反应混合物10分钟。将反应混合物放置于-30℃下的冷冻器中30分钟。向此经冷却的反应混合物中添加双(2-氟苯基)碘膦(0.14g,0.40mmol)于1.4ml甲苯中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。使反应混合物过滤通过5cm活化中性氧化铝塞且在真空下去除挥发物,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.11g(50.3%)。1hnmr(400mhz,c6d6,70℃)δ7.37(d,j=7.5hz,2h),7.16(t,j=7.2hz,4h),7.02(q,j=7.8,5.7hz,2h),6.97-6.75(m,5h),6.66(dt,j=13.3,4.5hz,4h),6.55(d,j=6.6hz,1h),4.40(d,j=11.5hz,1h),3.58-3.39(m,1h),3.26(m,1h),2.97(s,1h),2.52(m,1h),2.05(m,2h),1.50(m,3h),1.35-0.75(m,5h).13cnmr(101mhz,c6d6,70℃)δ144.45(d,j=21.4hz),138.75(d,j=2.4hz),133.58,133.09,131.11(d,j=8.8hz),129.39(d,j=8.2hz),128.39(d,j=3.0hz),128.23(d,j=3.6hz),128.12,127.87,125.45(dd,j=15.9,2.4hz),123.75(d,j=3.4hz),115.08(d,j=24.4hz),114.36(d,j=23.1hz),63.81(d,j=19.5hz),51.01(d,j=23.6hz),36.68(d,j=2.4hz),35.75-34.84(m),33.70(d,j=14.6hz),32.84,24.02.31pnmr(162mhz,c6d6,70℃)δ83.83,33.05.19fnmr(376mhz,c6d6)δ-105.88(m)。制备(2s,5s)-n-(双(2,4,6-三氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l636步骤1.制备双(2,4,6-三氟苯基)二甲基氨基膦1-将溴-2,4,6-三氟苯(21.022g,99.64mmol)缓慢逐滴添加到正丁基锂(42.0ml,2.35m,98.7mmol)于含己烷的乙醚(250ml)的冷却(-99到-89℃(液氮/丙酮))溶液中以使得温度不超过-89℃。使温度提高到-78℃与-74℃之间持续2小时(干冰浴),而无沉淀物形成。以使得温度不超过-65℃的速率缓慢逐滴添加二甲基亚磷酰胺二氯化物(6.860g,47.00mmol)于乙醚(总计20ml)中的溶液。在添加期间形成沉淀物且无色反应混合物变成淡棕色。使反应混合物升温到环境温度,同时搅拌过夜。颜色变成红棕色。过滤反应混合物且在减压下去除挥发物以得到棕红色油。用己烷萃取固体,过滤,且在减压下去除挥发物以得到红色油。产率为12.121g,76.479%。1hnmr(400mhz,cdcl3)δ6.61(tdd,j=8.9,1.8,1.1hz,4h),2.70(dt,j=10.6,0.8hz,6h)13cnmr(101mhz,cdcl3)δ165.09-164.35(m),162.60-161.89(m),111.53-110.41(m),100.48(ddd,j=30.7,24.9,3.3hz),42.32(dp,j=17.9,1.9hz).31pnmr(162mhz,cdcl3)δ24.73(td,j=31.0,2.9hz).19fnmr(376mhz,cdcl3)δ-101.74(dt,j=31.1,8.1hz),-107.33(pd,j=8.6,2.7hz)。步骤2.制备双(2,4,6-三氟苯基)氯膦将含无水hcl的乙醚(45.0ml,2m,90mmol)添加到双(2,4,6-三氟苯基)二甲基氨基膦(12.000g,35.590mmol)于二氯甲烷(100ml)中的冷却(-35℃)溶液中,同时橙红色反应混合物脱色且形成沉淀物。搅拌反应混合物过夜,随后过滤,且在减压下去除挥发物。用乙醚萃取残余物且过滤。在减压下去除挥发物以得到呈暗黄色液体状的产物。通过31pnmr,化合物主要含有所需产物(五重峰,δ37.34,91.7%)、二氯(2,4,6-三氟苯基)膦(三重峰,δ72.00,j=51.6hz,7.1%)和低场峰(单重峰,δ114.22,1.2%)。设置阱到阱蒸馏以去除二氯(2,4,6-三氟苯基)膦。水白色更具挥发性馏份由所需产物(80.4%)、二氯(2,4,6-三氟苯基)膦(16.3%)、低场峰(3.2%)构成。暗黄色罐残余物由所需产物(97.2%)、二氯(2,4,6-三氟苯基)膦(2.9%)构成且无低场峰。继续蒸馏(第2次蒸馏):馏出物:所需产物(97.5%)、二氯(2,4,6-三氟苯基)膦(2.3%)、低场峰(无一者)。馏出物为固化成白色固体的无色液体,3.924g白色固体,33.56%。1hnmr(400mhz,cdcl3)δ6.74-6.65(m,1h).13cnmr(126mhz,cdcl3)δ165.37(dtm,j=255.2,16.1hz),164.19(dddd,j=253.1,14.5,13.3,10.6hz),109.28-108.33(m),101.11(tm,j=25.1hz).31pnmr(162mhz,cdcl3)δ37.34(pt,j=43.1,2.1hz).19fnmr(376mhz,cdcl3)δ-97.32(dt,j=43.6,9.0hz),-102.19(pm,j=8.6hz)。步骤3.制备双(2,4,6-三氟苯基)碘膦将三甲基碘硅烷(3.205g,16.02mmol)缓慢添加到双(2,4,6-三氟苯基)氯膦(3.824g,11.64mmol)于乙醚(20ml)中的溶液中。反应混合物即刻变成深黄色。在添加10分钟内获取的31pnmr光谱显示反应完成。在减压下去除挥发物。用乙醚萃取残余物,过滤且在减压下去除挥发物以得到橙色油,5.0782g。用己烷和乙醚的混合物萃取残余物且过滤。在减压下去除挥发物以得到呈橙色油状的产物,4.83g,98.8%。1hnmr(500mhz,cdcl3)δ6.69(dddm,j=8.7,7.8,2.0hz,1h).13cnmr(126mhz,cdcl3)δ165.24(dt,j=255.1,16.0hz),165.29(dddd,j=252.8,15.2,13.2,10.4hz),105.40(dtm,j=58.2,21.4hz).31pnmr(202mhz,cdcl3)δ-31.87(pt,j=36.4,2.5hz).19fnmr(470mhz,cdcl3)δ-93.83(dtm,j=36.5,9.1hz),-102.58(pm,j=8.7hz)。步骤4.制备(2s,5s)-n-(双(2,4,6-三氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l636将双(2,4,6-三氟苯基)碘膦(0.446g,1.06mmol)于二乙醚(6ml)中的溶液缓慢添加到n-丁基-2,5-二苯基磷烷-1-胺(0.328g,1.05mmol)和三乙胺(1.530g,15.13mmol)于二乙醚(6ml)中的溶液中,同时形成沉淀物。搅拌反应混合物过夜。31pnmr光谱分析显示反应完成。过滤反应混合物,且在减压下去除挥发物以得到具有较小晶粒的淡黄色固体。用乙醚萃取固体,过滤,且在减压下去除挥发物以得到呈固体状的产物。用己烷湿磨残余物,过滤,且在减压下去除挥发物(在36℃下真空过夜)以得到呈灰白色固体状的产物,0.5740g,90.30%。1hnmr(400mhz,cdcl3)δ7.36-7.24(m,7h),7.20(tq,j=7.1,1.5hz,1h),7.02(t,j=7.6hz,2h),6.92(t,j=7.4hz,1h),6.63(ddd,j=9.2,7.9,1.8hz,2h),6.39(td,j=8.4,2.1hz,2h),4.00(ddt,j=12.1,8.2,4.4hz,1h),3.52(ddd,j=24.6,13.5,5.5hz,1h),3.16-2.95(m,3h),2.67(dddd,j=15.5,13.3,7.7,5.0hz,1h),2.39(tt,j=10.9,5.3hz,1h),1.79(qm,j=12.7hz,1h),0.82-0.70(m,3h),0.45(t,j=7.1hz,3h).13cnmr(101mhz,cdcl3)δ165.72-164.88(m),164.47-163.62(m),163.16-162.41(m),161.97-161.08(m),143.72,143.51,138.00(d,j=2.5hz),128.40,128.30(t,j=3.2hz),128.05,127.96,127.73,125.80(d,j=2.6hz),125.48(d,j=2.2hz),100.75(ddd,j=30.9,24.8,3.4hz),100.29(ddd,j=30.8,24.8,3.0hz),58.62(d,j=30.5hz),55.70(dd,j=22.3,16.2hz),51.76(dd,j=21.2,7.7hz),36.45(d,j=1.9hz),34.04(d,j=7.3hz),32.56(dd,j=8.8,3.8hz),19.65,13.45.31pnmr(162mhz,cdcl3)δ108.88(d,j=30.6hz),14.07(h,j=39.0hz).19fnmr(376mhz,cdcl3)δ-98.36(t,j=8.9hz),-98.47(t,j=8.8hz),-100.72(dt,j=38.6,8.4hz),-105.13(p,j=8.9hz),-108.85(pd,j=8.6,2.2hz)。制备(2s,5s)-n-(双(2,4-二氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l638步骤1.制备双(2,4-二氟苯基)二甲基氨基膦将1-溴-2,4-二氟苯(19.469g,100.9mmol)缓慢逐滴添加到正丁基锂于己烷(41.5ml,2.39m,总计99.19mmol)于乙醚(250ml)中的冷却(-96到-91℃(液氮/丙酮))溶液中以使得温度不超过-88℃。使温度提高到-78℃与-74℃之间持续1小时(干冰浴),同时形成白色沉淀物。以使得温度不超过-64℃的速率缓慢逐滴添加二甲基亚磷酰胺二氯化物(7.000g,47.96mmol)于乙醚(总计20ml)中的溶液。使反应混合物升温,同时搅拌过夜。到早晨,颜色为红紫色。将烧瓶放入手套箱中。31pnmr光谱分析显示来自所需产物的43.5ppm(88%)下的主要三重峰、在50.9ppm(8.5%)下的少量二重峰(假定为单芳基化合物、二甲基氨基(氯)(2,4-二氟苯基)膦)以及在约36ppm(3.5%)下的较小宽多重峰。在减压下去除挥发物到约150ml。添加己烷(约150ml)且过滤混合物。在减压下去除挥发物以得到深红色油。用己烷萃取固体,过滤且在减压下去除挥发物过夜以得到深红紫色油。将油阱到阱转移以得到淡黄色液体。大量液体在出现时为无色的,但少量溅泼液传送一些颜色,产率:9.8384g。产物含有9.3%的单芳基化合物和90.7%的所需双(2,4-二氟苯基)二甲基氨基膦化合物。将馏出物部分蒸馏成两个部分:馏出物,3.952g,其含有16.9%的单芳基化合物和83.1%的所需双(2,4-二氟苯基)二甲基氨基膦化合物,以及罐残余物,5.633g,39.28%,其含有2.7%的单芳基化合物和97.3%的所需双(2,4-二氟苯基)二甲基氨基膦化合物。1hnmr(500mhz,cdcl3)δ7.07-6.99(m,1h),6.73(td,j=8.3,2.5hz,1h),6.64(tdd,j=9.3,3.4,2.4hz,1h),2.49(d,j=9.8hz,3h).13cnmr(101mhz,cdcl3)δ163.88(dd,j=250.6,11.9hz),163.52(ddd,j=247.2,16.8,11.8hz),133.27(dt,j=9.5,7.4hz),120.41(dddd,j=22.1,20.3,3.7,2.3hz),111.55(ddd,j=20.3,3.4,1.2hz),103.76(dd,j=27.4,25.2hz),41.92(d,j=17.4hz).31p(162mhz,cdcl3)δ43.50(tt,j=42.4,3.5hz).19fnmr(376mhz,cdcl3)δ-101.86(dq,j=42.4,8.9hz),-109.38(pd,j=9.2,8.7,3.4hz)。二甲基氨基(氯)(2,4-二氟苯基)膦(162mhz,cdcl3)的31pnmr为δ50.87(dd,j=26.4,3.3hz)。步骤2.制备双(2,4-二氟苯基)氯膦将含无水hcl的乙醚(55.0ml,2m,110mmol)添加到双(2,4-二氟苯基)二甲基氨基膦(8.00g,26.6mmol)于二氯甲烷(50ml)中的溶液中,深红褐色反应混合物实质上脱色成淡橙色。31pnmr光谱显示在约10%的假定的二氯(2,4-二氟苯基)膦化合物以及所需产物存在的情况下反应完成。在减压下去除挥发物。用乙醚和己烷的混合物(50/50)萃取残余物且过滤。在减压下去除挥发物以得到呈橙色油状的产物。nmr光谱显示约8%的假定的二氯(2,4-二氟苯基)膦、3%的其它杂质和88%的双(2,4-二氟苯基)氯膦。在90℃下将油阱到阱真空转移(热水浴/液氮)。蒸馏出少量液体,其富集二氯(2,4-二氟苯基)膦杂质。使用加热枪提高温度继续蒸馏以获得呈水白色液体状的产物,4.561g,58.69%,其含有约3.7%的假定的2,4-二氟苯基膦二氯化物,这通过31pnmr光谱,δ86.39(d,j=54.9hz)中的二重峰鉴别。1hnmr(500mhz,cdcl3)δ7.57(tdd,j=8.3,6.3,5.3hz,1h),6.97(td,j=8.3,2.4hz,1h),6.82(tdd,j=9.1,3.5,2.4hz,1h).13cnmr(126mhz,cdcl3)δ165.26(dd,j=254.4,12.2hz),163.93(ddd,j=250.8,19.4,12.2hz),134.21(ddd,j=12.6,9.9,5.7hz),119.92(ddm,j=40.32,16.4hz),112.34(dt,j=21.0,3.1hz),104.34(t,j=26.0hz).31pnmr(202mhz,cdcl3)δ58.97(tt,j=60.5,2.9hz).19fnmr(470mhz,cdcl3)δ-101.04(dq,j=60.5,9.4hz),-105.13(pd,j=8.8,2.6hz)。步骤3.制备双(2,4-二氟苯基)碘膦将三甲基碘硅烷(2.000g,9.99mmol)缓慢添加到双(2,4-二氟苯基)氯膦(2.000g,6.84mmol)于乙醚(10ml)中的溶液中。反应混合物即刻变成深黄色。在添加10分钟内获取的31pnmr光谱显示反应完成。在减压下去除挥发物以得到黄色油。产率为2.543g,96.88%。1hnmr(500mhz,cdcl3)δ7.55(tdd,j=8.4,6.4,4.6hz,1h),6.93(td,j=8.3,2.5hz,1h),6.82(dddd,j=9.5,8.7,3.6,2.4hz,1h).13cnmr(126mhz,cdcl3)δ165.42(dd,j=254.7,12.0hz),163.56(ddd,j=251.2,19.3,12.3hz),137.63(td,j=10.4,4.8hz),116.22(dddd,j=46.3,17.4,4.1,1.8hz),112.50(ddd,j=21.0,3.6,2.1hz),104.33(dd,j=26.7,25.3hz).31pnmr(202mhz,cdcl3)δ8.27(tt,j=59.5,2.0hz).19fnmr(470mhz,cdcl3)δ-97.05(dq,j=59.7,9.6hz),-105.12(p,j=8.7hz)。步骤4.制备(2s,5s)-n-(双(2,4-二氟苯基)磷基)-n-丁基-2,5-二苯基磷烷-1-胺,l638将双(2,4-二氟苯基)碘膦(0.490g,1.28mmol)于二乙醚(6ml)中的溶液缓慢添加到n-丁基-2,5-二苯基磷烷-1-胺(0.394g,1.27mmol)和三乙胺(1.64g,16.2mmol)于二乙醚(6ml)中的溶液中,同时形成沉淀物。搅拌反应混合物过夜。31pnmr光谱显示反应完成。过滤反应混合物,且在减压下去除挥发物以得到具有较小晶粒的淡黄色固体。用乙醚萃取固体,过滤且在减压下去除挥发物。用己烷湿磨固体残余物,过滤,用己烷洗涤,且在减压下去除挥发物以得到呈无色粉末状的产物,0.5106g,71.11%。1hnmr(500mhz,cdcl3)δ7.37-7.28(m,7h),7.22(ddq,j=7.5,6.4,1.6hz,1h),7.10(tm,j=7.4hz,2h),7.07-7.00(m,1h),6.90-6.82(m,1h),6.79(tm,9.1hz,1h),6.70-6.60(m,2h),6.54(td,j=8.4,2.4hz,1h),6.44(qd,j=7.9,4.5hz,1h),4.06(ddd,j=12.1,7.8,4.1hz,1h),3.46(ddd,j=23.7,13.5,5.7hz,1h),3.04-2.86(m,4h),2.74-2.61(m,1h),2.38(tt,j=10.8,5.3hz,1h),1.78(qd,j=12.9,5.0hz,1h),0.94-0.82(m,1h),0.76(tt,j=14.2,7.2hz,2h),0.48(t,j=7.3hz,4h).13cnmr(126mhz,cdcl3)δ164.27(dd,j=252.0,12.2hz),164.06(ddd,j=247.8,19.2,11.9hz),163.35(dd,j=250.0,11.9hz),162.09(ddd,j=247.0,17.4,11.9hz),143.76(d,j=20.6hz),138.34(d,j=2.3hz),133.89(tt,j=12.3,6.8hz),128.46,128.35(dd,j=3.7,1.8hz),128.13,128.08,128.01,125.78(dd,j=11.4,2.3hz),121.44(ddd,j=26.3,18.8,3.2hz),120.54(ddt,j=22.1,18.9,3.0hz),111.51(dd,j=7.1,3.3hz),111.35(dd,j=7.4,3.3hz),103.87(dd,j=27.9,24.8hz),103.27(dd,j=27.2,24.9hz),54.64,54.43,51.84(dd,j=21.9,4.6hz),36.48(d,j=1.8hz),33.83(dd,j=6.7,2.1hz),32.62(dd,j=7.6,3.4hz),19.63,13.48.31pnmr(162mhz,cdcl3)δ102.16,31.55(ddd,j=53.8,41.6,22.0hz).19fnmr(376mhz,cdcl3)δ-100.50(dq,j=41.6,9.0hz),-100.97(dq,j=53.9,9.3hz),-108.02(t,j=8.9hz),-110.30(t,j=9.0hz)。制备外消旋-n-(双(2-氟苯基)磷基)-n-丁基-2,5-双(4-甲基苯基)磷烷-1-胺,l645步骤1.制备含4-甲基苯基溴化镁的thf向装备有搅拌棒和史蒂文斯(螺旋管型)冷凝器的两颈烧瓶中装入镁屑(7.46g,306.9mmol)和100mlthf。将两滴1,2二溴乙烷添加到所得混合物中。将混合物搅拌5分钟以活化镁屑。在单独的容器中,用60mlthf稀释4-溴甲苯(50.00g,321.6mmol)且抽入注射器中。在风扇循环冷凝器上方空气的情况下,小心地将4-溴甲苯溶液添加到5或10ml部分中,在添加之间搅拌混合物几分钟直到回流停止为止。此前含有4-溴甲苯的溶液的容器用162mlthf冲洗,用早先使用的同一注射器抽取冲洗溶剂且添加到反应混合物中。使产生的格林纳溶液过滤通过一次性塑料烧结漏斗以去除过量镁且使用水杨醛苯腙滴定以确认浓度为1.0m。格林纳溶液原样用于后续反应中。步骤2.制备(e,e)-1,4-双(4-甲基苯基)-1,3-丁二烯根据由hintermann等人(hintermann,l.;schmitz,m.;chen,y.《高级合成与催化》2010,352,2411)调节的程序制备(e,e)-1,4-双-(4-甲基苯基)-1,3-丁二烯。向1l三颈烘干的烧瓶中装入甲苯(300ml)、乙酰基丙酮酸镍(ii)(ni(acac)2)(1.02g,3.98mmol,3mol%)和1,3-双(2,4,6-三甲基苯基)咪唑氯化物(3.38g,9.96mmol,7.5mol%)。在搅拌时,将噻吩(12.8ml,159.4mmol)和4-甲基苯基溴化镁溶液(1.0m,321.6ml,321.6mmol)依次添加到反应混合物中。将反应混合物加热到80℃且搅拌过夜,随后通过nmr光谱分析监测。在反应完成后,冷却(用冰浴)反应混合物,用2-4个体积的甲苯稀释,且通过小心添加相等体积的nh4cl饱和水溶液(注意产生h2s气体)淬灭。用相等体积的hcl(2.4m)、naoh(2m)和水洗涤有机相且随后经无水mgso4干燥。随后使溶液过滤通过硅胶塞。所述塞用二氯甲烷冲洗若干次。在旋转式蒸发器上去除溶剂,用戊烷湿磨固体,在烧结塑料过滤器上采集且在减压下干燥。通过x射线荧光光谱分析(xfs)分析固体且测定含有大约4%硫。使用二氯甲烷作为洗提剂使样品传送通过碱性氧化铝,在真空下干燥,且通过xfs分析:观测到硫含量略微减少。使四种单独100mg样品溶解于二氯甲烷中且各自用h2o2(稀释于h2o中)、naocl(稀释于h2o中)或na2s2o3(固体)处理三种溶液。不处理其余的样品(对照)。搅拌样品过夜,与水层(在适用时)分离,过滤通过碱性氧化铝,在真空下干燥,且随后通过xfs进行分析。除了对照以外,所有样品显示硫显著减少。用硫代硫酸钠和碱性氧化铝纯化材料本体,且随后原样用于后续步骤中(产率:15.3g,49%)。1hnmr(400mhz,cdcl3)δ7.40-7.31(m,2h),7.15(d,j=7.8hz,2h),6.98-6.86(m,1h),6.69-6.58(m,1h),2.36(s,3h).13cnmr(100mhz,cdcl3):δ=137.3,134.6,132.2,129.3,128.4,126.2,21.4。步骤3.制备(1s,2s,5r)-1-(二甲氨基)-2,5-双(4-甲基苯基)-2,5-二氢磷杂环戊二烯1-氧化物在不在手套箱中进行的反应中,在用氮气净化的较大加套的多颈烧瓶中,将二甲基亚磷酰胺二氯化物(3.60g,31.3mmol)添加到氯化铝(3.95g,29.6mmol)于二氯甲烷(50ml)中的经搅拌的悬浮液中。在45分钟之后,将所得淡绿色溶液和(e,e)-1,4-双(4-甲基苯基)-1,3-丁二烯(6.70g,28.6mmol)于二氯甲烷(125ml)中的溶液各自冷却到0℃。在冷却之后,将(e,e)-1,4-双(4-甲基苯基)-1,3-丁二烯溶液缓慢添加到二甲基亚磷酰胺二氯化物-氯化铝溶液中。在0℃下将混合物搅拌过夜。随后将水性edta(乙二胺四乙酸,0.2m,200ml)和在冰水中冷却的饱和nahco3(100ml)的溶液添加到反应混合物中。在0℃下搅拌混合物4小时,过滤通过硅藻土,倾析且用二氯甲烷萃取水层。用nahco3、1mhcl、盐水洗涤有机层且经无水mgso4干燥。在旋转式蒸发器上浓缩溶液且用二乙醚湿磨所得黄色油以产生淡黄色固体(产率:7.5g,81%)。1hnmr(400mhz,c6d6)δ7.20(dd,j=8.2,2.2hz,4h),6.95(d,j=7.8hz,4h),6.11(d,j=27.9hz,2h),4.21(d,j=18.2hz,2h),2.09(s,6h),1.91(s,3h),1.89(s,4h).13cnmr(101mhz,c6d6)δ136.04(d,j=2.6hz),133.63(d,j=8.3hz),130.75(d,j=16.0hz),129.33(d,j=2.3hz),127.27(d,j=4.7hz),49.08(d,j=70.8hz),36.21,36.20,21.04.31pnmr(162mhz,c6d6)δ66.68。步骤4.制备外消旋-1-(二甲氨基)-2,5-双(4-甲基苯基)磷杂环戊烷1-氧化物在不在手套箱中进行的反应中,向压力反应器中装入(1s,2s,5r)-1-(二甲氨基)-2,5-双(4-甲基苯基)-2,5-二氢磷杂环戊二烯1-氧化物(6.69g,20.6mmol)、10%pd/c(438mg,0.41mmol)、碳酸钠(1.09g,10.28mmol)和甲醇(100ml)。用氢气净化反应器,且随后加压到500psi氢气。在2.5小时之后,获取等分试样且通过nmr光谱分析分析,确证完全氢化。使反应混合物过滤通过硅藻土,且随后在氮气氛围下加热到40℃持续1小时和40分钟。通过nmr光谱分析分析等分试样,确证不完全异构化。添加额外碳酸钠(150mg)且在室温下使反应混合物反应过夜;通过nmr光谱分析未观测到改变。将反应混合物加热2.5小时,且获取等分试样,确证完全转化。在真空下去除溶剂且用水处理固体。随后使用分液漏斗,用二氯甲烷萃取产物。使用无水mgso4干燥溶液,随后过滤通过硅藻土。在真空下去除溶剂。用几毫升丙酮湿磨固体2分钟,且使用一次性烧结漏斗分离未溶解的固体。在真空下干燥白色粉末(产率:4.02g,59.7%)。1hnmr(400mhz,cdcl3)δ7.26-7.18(m,4h),7.14(d,j=7.9hz,4h),3.57(ddd,j=23.4,12.4,7.7hz,1h),3.24(td,j=12.9,7.1hz,1h),2.57-2.41(m,1h),2.46-2.35(m,1h),2.34(s,3h),2.33(s,3h),2.31(s,3h),2.31(s,3h),2.31-2.14(m,1h),2.07(qdd,j=12.9,5.0,2.2hz,1h).13cnmr(101mhz,cdcl3)δ136.40(d,j=2.4hz),136.12(d,j=2.8hz),134.13(d,j=4.7hz),133.37(d,j=5.4hz),129.41(d,j=2.0hz),129.22(d,j=2.2hz),128.75(d,j=5.1hz),127.24(d,j=5.0hz),46.97(d,j=75.8hz),42.21(d,j=77.9hz),36.14,36.12,29.97(d,j=12.1hz),27.86(d,j=9.5hz),21.17(d,j=3.0hz).31pnmr(162mhz,cdcl3)δ59.51。步骤5.制备外消旋-1-氯-2,5-双(4-甲基苯基)磷杂环戊烷向烘干的小瓶中装入在乙醚(30ml的总反应体积)中混合的外消旋-1-(二甲氨基)-2,5-双(4-甲基苯基)磷杂环戊烷-1-氧化物(1.50g,4.60mmol)。依次添加吡啶(0.410ml,5.06mmol)和三氯硅烷(0.511ml,5.06mmol),且在室温下搅拌混合物过夜(大约18小时)。将戊烷(10ml)添加到所得浆料中且使其过滤通过一次性烧结过滤器。随后将滤液浓缩到干燥。使固体溶解于戊烷(20ml)中且传送通过酸性氧化铝塞。用另外20ml戊烷冲洗氧化铝。随后浓缩滤液且放置于-35℃下的冷冻器中。过夜,形成沉淀物,其随后经由过滤分离。在真空下干燥所得白色固体(产率:601mg,43%)。1hnmr(400mhz,c6d6)δ7.19(d,j=7.7hz,2h),7.02(d,j=7.9hz,2h),6.98(s,4h),3.80(td,j=8.7,2.2hz,1h),3.17(ddd,j=33.6,12.4,5.8hz,1h),2.55-2.39(m,1h),2.43-2.29(m,1h),2.13(s,6h),2.07(dddd,j=13.2,9.3,5.8,1.8hz,1h),1.71-1.54(m,1h).13cnmr(101mhz,c6d6)δ139.06(d,j=19.4hz),136.23(d,j=3.1hz),136.17(d,j=2.0hz),134.19,129.82,129.36,128.53,128.49,57.83(d,j=31.8hz),53.36(d,j=32.6hz),34.69(d,j=2.6hz),32.11(d,j=3.3hz),21.07,21.02.31pnmr(162mhz,c6d6)δ137.01。步骤6.制备外消旋-n-丁基-2,5-双(4-甲基苯基)磷烷-1-胺用含正丁胺(1.45g,19.8mmol)的5ml戊烷处理外消旋-1-氯-2,5-双(4-甲基苯基)磷杂环戊烷(601mg,1.98mmol)于戊烷(30ml)中的溶液。在搅拌30分钟之后,去除等分试样以用于nmr分析,其确证完全转化。使所得浆料过滤通过中性氧化铝塞。用额外10ml戊烷冲洗氧化铝。在真空下浓缩滤液以产生呈无色油状的产物。使油溶解于少量戊烷中且放置于-35℃下的冷冻器中。在几小时之后,形成沉淀物。通过过滤分离白色粉末且在真空下干燥(产率:550mg,82%)。1hnmr(400mhz,c6d6)δ7.31(dd,j=8.1,1.8hz,2h),7.15-7.02(m,7h),3.09(ddd,j=22.0,12.5,6.0hz,1h),2.95(dt,j=12.6,6.7hz,1h),2.60-2.40(m,1h),2.37-2.23(m,1h),2.19(s,3h),2.17(s,3h),2.15-2.05(m,1h),1.85(qdd,j=12.5,5.1,2.6hz,1h),1.62(qdd,j=12.6,5.1,2.5hz,1h),1.08-0.98(m,1h),1.01-0.87(m,4h),0.68(t,j=6.9hz,3h).13cnmr(101mhz,c6d6)δ141.47(d,j=18.3hz),137.32,135.13(d,j=2.6hz),134.77(d,j=2.4hz),129.50-129.45(d,j=5hz),129.27-129.20(d,j=5hz),128.22(d,j=3.4hz),127.97,55.67(d,j=14.3hz),50.04(d,j=22.6hz),47.88(d,j=23.1hz),35.59(d,j=6.8hz),34.43(d,j=2.8hz),31.95(d,j=2.1hz),21.08,20.06,14.01.31pnmr(162mhz,c6d6)δ72.29。步骤7.制备外消旋-n-(双(2-氟苯基)磷基)-n-丁基-2,5-双(4-甲基苯基)磷烷-1-胺,l645。将双(2-氟苯基)碘膦(200mg,0.574mmol)于戊烷(10ml)中的冷(-30℃)溶液添加到外消旋-n-丁基-2,5-双(4-甲基苯基)磷烷-1-胺(195mg,0.574mmol)和三乙胺(64mg,0.631mmol)于戊烷(20ml)中的冷(-30℃)溶液中,使得沉淀物立即形成。在1小时之后,通过31pnmr分析等分试样,其显示完全转化成所需产物。使反应混合物过滤通过较小中性氧化铝塞,额外戊烷用于洗涤氧化铝,且在真空下去除溶剂。添加少量戊烷且白色粉末开始沉淀。将材料放置于-35℃下的冷冻器中若干天。倾析溶液且在真空下干燥所得固体。获取较小样品且通过nmr光谱分析分析:观测到2%外消旋-n-丁基-2,5-双(4-甲基苯基)磷烷-1-胺。在戊烷中搅拌固体,倾析溶液且在真空下干燥固体。nmr光谱分析确证起始材料不存在(产率:230mg,72%)。1hnmr(400mhz,c6d6)δ7.41(dd,j=8.0,1.7hz,2h),7.31(d,j=7.7hz,2h),7.10(d,j=7.7hz,2h),7.09-6.99(m,1h),6.85(dddd,j=9.7,7.8,5.0,2.1hz,2h),6.79(d,j=7.9hz,2h),6.75(ddd,j=8.4,4.2,1.3hz,1h),6.72-6.56(m,4h),4.42(ddt,j=12.2,8.3,4.4hz,1h),3.33(ddd,j=24.2,13.5,5.4hz,1h),3.21-2.99(m,3h),2.69-2.52(m,1h),2.17(s,3h),2.15-2.10(m,1h),2.08(s,3h),1.64(qd,j=12.8,4.8hz,1h),1.13(ddt,j=16.5,13.7,7.1hz,1h),0.70-0.47(m,3h),0.36(t,j=7.2hz,3h).13cnmr(101mhz,c6d6)δ166.40-163.73(m),163.80-161.28(m),141.94,135.94(d,j=2.3hz),135.20(d,j=2.6hz),134.83(d,j=2.1hz),133.81-133.45(m),131.72(d,j=8.6hz),129.61,129.50,129.23,128.88-128.76(m),128.68(d,j=8.6hz),126.76(dd,j=27.2,18.7hz),126.29(dd,j=19.0,2.6hz),126.06(dd,j=18.8,2.4hz),124.31(d,j=3.3hz),124.14(d,j=3.2hz),115.58(d,j=24.2hz),114.75(d,j=23.0hz),55.27(dd,j=31.6,4.6hz),55.49(dd,j=13.5,3.8hz),55.38-55.16(m),52.09(dd,j=21.6,5.2hz),37.20,34.35(d,j=7.4hz),33.00(dd,j=8.7,3.5hz),21.11(d,j=3.0hz),20.00,13.69.31pnmr(162mhz,c6d6)δ102.13(d,j=30.8hz),31.82(ddd,j=57.1,42.1,30.5hz).19fnmr(376mhz,c6d6)δ-103.50(ddt,j=41.9,10.4,6.0hz),-104.52(dq,j=57.1,7.1hz)。制备外消旋-n-(双(2-氟苯基)磷基)-n-丁基-2,5-双(3,5-二甲基苯基)磷烷-1-胺,l647步骤1.制备外消旋-n-(双(2-氟苯基)磷基)-n-丁基-2,5-双(3,5-二甲基苯基)磷烷-1-胺,l647将双(2-氟苯基)碘膦(100mg,0.288mmol)于戊烷(10ml)中的冷(-30℃)溶液逐滴添加到外消旋-n-丁基-2,5-双(3,5-二甲基苯基)磷烷-1-胺(106mg,0.288mmol)和三乙胺于戊烷(20ml)中的冷(-30℃)溶液,使得固体立即形成。在30分钟之后,通过31p-nmr分析等分试样,其确证完全转化成所需产物。使反应混合物过滤通过较小氧化铝塞且在真空下去除溶剂。用戊烷萃取残余物,使所得溶液过滤通过硅藻土,且放置于冷冻器中。白色晶体形成过夜。倾析溶液,且在真空下干燥所得固体(产率:65mg,38%)。1hnmr(400mhz,c6d6)δ7.14(d,j=3.3hz,4h),7.14-7.06(m,1h),6.92-6.80(m,2h),6.83-6.74(m,2h),6.74-6.60(m,4h),6.53(s,1h),4.37(ddt,j=12.3,8.4,4.5hz,1h),3.38(ddd,j=23.7,13.5,5.3hz,1h),3.29-3.02(m,2h),2.73-2.56(m,1h),2.24(s,6h),2.07(s,6h),1.72(qd,j=12.6,4.9hz,1h),1.04(tdd,j=13.5,7.5,3.7hz,1h),0.69-0.48(m,3h),0.38(t,j=7.1hz,3h).13cnmr(101mhz,c6d6)δ166.27-163.84(m),163.84-161.19(m),144.71(d,j=20.6hz),138.89(d,j=2.2hz),137.94-137.74(m),137.70-137.50(m),133.68(t,j=5.2hz),133.50(dd,j=8.3,5.2hz),131.65(d,j=8.4hz),130.05(d,j=8.2hz),128.70,127.72,127.71,127.10-126.84(m),126.70(d,j=8.4hz),126.60-125.98(m),124.28(d,j=3.2hz),124.09(d,j=3.2hz),115.56(d,j=23.9hz),114.69(d,j=23.1hz),55.89-55.41(m),55.39(dd,j=32.3,5.2hz),52.67(dd,j=22.1,4.6hz),36.81,34.63(d,j=7.2hz),32.95(dd,j=8.5,3.5hz),21.53,21.39,20.01,13.80.31pnmr(162mhz,c6d6)δ103.43(d,j=31.1hz),32.16(ddd,j=55.9,38.8,31.4hz).19f{1h}nmr(376mhz,c6d6)δ-103.26(d,j=38.7hz),-104.27(d,j=55.6hz).19fnmr(376mhz,c6d6)δ-103.26(ddt,j=38.4,9.5,5.7hz),-104.27(dq,j=55.4,7.3hz)。制备外消旋-(2s,5s)-n-(双(2-氟苯基)磷基)-n-丁基-2,5-双(4-(叔丁基)苯基)磷烷-1-胺,l648步骤1.制备1,4-双(4-叔丁基苯基)-1,3-丁二烯将甲苯(100ml)添加到含有ni(乙酰基丙酮酸盐)2(0.193g,0.75mmol,3mol%)和1,3-双(2,4,6-三甲基苯基)咪唑氯化物(0.639g,1.87mmol,7.5mol%)的圆底烧瓶中。搅拌甲苯混合物,同时依次添加噻吩(2.0ml)和4-叔丁基苯基溴化镁(57.5ml,57.5mmol,1.0m)。将反应器加热到80℃。通过gc/ms监测反应。在完成后,反应混合物冷却,用4个体积的甲苯稀释,且通过小心添加相等体积的nh4cl饱和水溶液(注意:产生h2s气体)淬灭。用相等体积的hcl(2.4m)、naoh(2m)和水洗涤有机相且随后经无水mgso4干燥。过滤溶液且在旋转式蒸发器上浓缩。通过由己烷再结晶纯化的初始尝试为不成功的。通过在二氧化硅上用己烷和乙酸乙酯的混合物(25%)溶离的柱色谱纯化材料。采集两个部分且在减压下去除挥发物。馏份1(4.2g)含有所需产物(68%)和共偶联产物4,4`-二-叔丁基-联二苯(32%)的混合物。馏份2(1.1g)含有所需反式-反式二烯产物和杂质,我们尝试性地将其指定为产物的顺式-反式或顺式-顺式异构体。来自两个馏份的所需材料的总产率为大约4g(50%产率)。这些馏份为组合的且在不进一步纯化的情况下用于后续步骤中。1hnmr(400mhz,cdcl3)δ:7.41-7.32(m,8h),6.98-6.85(m,2h),6.71-6.57(m,2h),1.32(s,18h).13cnmr(101mhz,cdcl3)δ:150.61,134.72,132.15,128.76,126.06,125.58,34.62,31.29。步骤2.制备外消旋-(1s,2r,5s)-2,5-双(4-叔丁基苯基)-1-(二甲氨基)-2,5-二氢磷杂环戊二烯-1-氧化物在不在手套箱中进行的反应中,在用氮气净化的较大加套的多颈烧瓶中,将二甲基亚磷酰胺二氯化物(4.78g,41.6mmol)添加到氯化铝(5.25g,39.6mmol)于二氯甲烷(50ml)中的经搅拌的悬浮液中。在45分钟之后,将所得淡绿色溶液和1,4-双(4-叔丁基苯基)丁二烯(12.1g,38.0mmol)于二氯甲烷(125ml)中的溶液都冷却到0℃。在冷却之后,将1,4-双(4-叔丁基苯基)丁二烯溶液缓慢添加到二甲基亚磷酰胺二氯化物-氯化铝溶液中。在0℃下将混合物搅拌过夜。随后将水性edta(乙二胺四乙酸,0.2m,200ml)和在冰水中冷却的饱和nahco3(100ml)的溶液添加到反应混合物中。在0℃下搅拌混合物4小时,过滤通过硅藻土,倾析且用二氯甲烷萃取水层。用nahco3(100ml)、1mhcl(100ml)、盐水(100ml)洗涤有机层且经无水mgso4干燥。在旋转式蒸发器上浓缩溶液且用乙醚湿磨所得黄色油以产生白色固体(6g,38%)。第二批获自洗涤液(4.3g,27%)(总产率:10.3g,65%)。1hnmr(400mhz,cdcl3)δ:7.33(d,j=8.3hz,4h),7.24(dd,j=8.5,2.2hz,4h),6.51(d,j=29.3hz,2h),4.26(d,j=18.7hz,2h),1.88(d,j=8.3hz,6h),1.29(s,18h).13cnmr(101mhz,cdcl3)δ:149.78,149.75,132.76,132.68,130.75(d,2jc-p=17.0hz),126.81,126.76,125.31,125.28,48.83(d,1jc-p=71.9hz),35.89(d,2jc-n-p=2.0hz),34.45,31.36.31pnmr(162mhz,cdcl3)δ:67.72(ddp,j=45.6,25.4,9.7,9.2hz)。步骤3.制备外消旋-(1s,2r,5s)-2,5-双(4-叔丁基苯基)-1-(二甲氨基)磷杂环戊烷-1-氧化物在不在手套箱中进行的反应中,向压力反应器中装入外消旋-(1s,2r,5s)-2,5-双(4-叔丁基苯基)-1-(二甲氨基)-2,5-二氢磷杂环戊二烯-1-氧化物(2)(2.5g,6.1mmol)、10%钯/碳(0.065g,0.06mmol)、碳酸钠(0.32g,3.05mmol)和甲醇(100ml)。用氢气净化反应器,随后用氢气加压到500psi。在5小时之后,使反应混合物过滤通过硅藻土且在真空中去除溶剂以产生无色油,其在添加乙醚(1.24g,49%)后结晶。1hnmr(400mhz,cdcl3)δ:7.30(d,j=8.4hz,4h),7.26-7.21(m,4h),3.69-3.62(m,1h),3.62-3.55(m,1h),2.63-2.41(m,3h),1.83(d,j=8.2hz,6h),1.28(s,18h).31pnmr(162mhz,cdcl3)δ:66.56.13cnmr(101mhz,cdcl3)δ:149.34,149.31,133.86,133.81,126.65,126.60,125.16,125.14,45.22(d,1jc-p=72.7hz),35.28(d,2jc-n-p=2.4hz),34.37,31.35,26.78(d,2jc-p=13.3hz)。步骤4.制备外消旋-(1s,2s,5s)-2,5-双(4-叔丁基苯基)-1-(二甲氨基)磷杂环戊烷-1-氧化物将甲醇钠(0.33g,6.1mmol)于甲醇(20ml)中的溶液添加到含有(1s,2r,5s)-2,5-双(4-叔丁基苯基)-1-(二甲氨基)磷杂环戊烷1-氧化物(3)(1.25g,3.03mmol)和磁性搅拌棒的小瓶中。搅拌反应混合物5小时且在-35℃下放置于冷冻器中过夜。第二天早上,从冷冻器中获取小瓶且升温到室温,此后第二次添加甲醇钠(0.16g,3.0mmol)且搅拌反应混合物额外6小时。随后将溶液倒入含有甲苯(100ml)和1mhcl(100ml)的分液漏斗中。依次用hcl溶液、水、盐水洗涤合并的有机层且经无水mgso4干燥。在过滤后,在旋转式蒸发器上去除挥发物且由热丙酮(约40ml)再结晶所获得的白色固体以产生呈白色固体状的产物(0.9g,72%)。1hnmr(400mhz,cdcl3)δ:7.36(dd,j=8.3,3.5hz,4h),7.27(dt,j=8.3,1.8hz,4h),3.59(ddd,j=23.2,12.3,7.8hz,1h),3.26(td,j=12.8,7.1hz,1h),2.57-2.46(m,1h),2.46-2.38(m,1h),2.31(d,j=8.8hz,6h),2.28-2.16(m,1h),2.10(qdd,j=12.6,4.9,2.2hz,1h),1.32(s,9h),1.30(s,9h).13cnmr(101mhz,cdcl3)δ:149.55,149.52,149.31,149.28,134.08,134.03,133.27,133.21,128.47,128.42,126.97,126.92,125.54,125.52,125.25,125.23,46.90(d,1jc-p=75.8hz),41.91(d,1jc-p=78.1hz),36.06,36.04,34.44,34.41,31.39,31.36,30.03(d,2jc-p=12.3hz),27.68(d,2jc-p=9.5hz).31pnmr(162mhz,cdcl3)δ:58.87(m)。步骤5.制备外消旋-(2s,5s)-2,5-双(4-叔丁基苯基)-1-氯磷杂环戊烷将吡啶(0.74ml,9.0mmol)和三氯硅烷(0.93ml,0.89mmol)添加到外消旋-(1s,2s,5s)-2,5-双(4-叔丁基苯基)-1-(二甲氨基)磷杂环戊烷-1-氧化物(3.43g,8.31mmol)于乙醚(80ml)中的溶液中。在搅拌过夜之后,将戊烷(10ml)添加到过滤通过一次性烧结过滤器的反应混合物中。在减压下将滤液浓缩到干燥以产生白色固体。使白色固体悬浮于戊烷(20ml)中且放置于-35℃下的冷冻器手套箱冷冻器中过夜。过滤混合物且用冷戊烷少量地冲洗白色固体。随后将白色固体转移到小瓶中且在减压下干燥。通过浓缩戊烷洗涤液,继而冷却于手套箱冷冻器中来分离第二批以产生通过过滤分离,用冷戊烷少量地洗涤且在减压下干燥的白色固体。两批的组合产率为3.0g(93%)。1hnmr(400mhz,c6d6)δ:7.30(d,j=2.3hz,4h),7.27(d,j=8.2hz,2h),7.09-7.02(m,2h),3.86(td,j=8.6,2.2hz,1h),3.35-3.14(m,1h),2.54(ddd,j=11.3,7.2,3.3hz,1h),2.42(dq,j=15.7,8.1hz,1h),2.14(pd,j=10.7,8.8,5.3hz,1h),1.81-1.63(m,1h),1.24(d,j=2.0hz,18h).13cnmr(101mhz,c6d6)δ:149.50,139.10,138.91,134.24,128.41,127.94,126.07,125.57,57.94,57.62,53.49,53.16,34.66,34.48,32.34,32.30,31.49.31pnmr(162mhz,c6d6)δ:135.93步骤6.制备外消旋-(2s,5s)-n-丁基-2,5-双(4-叔丁基苯基)磷烷-1-胺将外消旋-(2s,5s)-2,5-双(4-叔丁基苯基)-1-氯磷杂环戊烷(1.0g,2.58mmol)于己烷(45ml)中的溶液添加到含正丁胺(2.6ml,25.8mmol)的己烷(45ml)中。在搅拌30分钟之后,使所得浆料过滤通过中性氧化铝塞。用额外45ml己烷冲洗氧化铝。在真空下浓缩滤液以产生呈油性白色固体状的产物。用冷戊烷重复冲洗白色残余物在干燥后产生呈白色固体状的产物(1.04g,95%)。1hnmr(400mhz,c6d6)δ:7.41-7.34(m,4h),7.33-7.28(m,2h),7.18(d,j=8.2hz,2h),3.16(ddd,j=22.1,12.5,6.1hz,1h),2.99(dt,j=12.6,6.7hz,1h),2.49(s,1h),2.33-2.19(m,2h),2.19-2.09(m,1h),1.90(qdd,j=12.5,5.1,2.6hz,1h),1.68(qdd,j=12.6,5.1,2.6hz,1h),1.29(s,9h),1.27(s,9h),1.05(s,1h),1.01-0.81(m,4h),0.68(t,j=7.0hz,3h).13cnmr(101mhz,c6d6)δ:148.48,148.46,148.26,141.54,141.35,137.32,125.70,125.39,55.64,55.50,50.08,49.85,47.97,47.75,35.53,35.46,34.59,34.56,34.44,34.42,32.03,32.01,31.64,31.61,20.08,14.07.31pnmr(162mhz,c6d6)δ:71.44。步骤7.制备外消旋-(2s,5s)-n-(双(2-氟苯基)磷基)-n-丁基-2,5-双(4-叔丁基苯基)磷烷-1-胺,l648将外消旋-(2s,5s)-n-丁基-2,5-双(4-叔丁基苯基)磷烷-1-胺(6)(0.25g,0.59mmol)和三乙胺(0.09ml,0.65mmol)于戊烷(20ml)中的冷(-35℃)溶液与双(2-氟苯基)碘膦(0.21g,0.59mmol)于戊烷(20ml)中的冷(-35℃)溶液组合,使得固体快速形成。在2小时之后,使反应混合物过滤通过硅藻土且浓缩。在去除挥发物之后,用二乙醚萃取残余物且过滤通过中性氧化铝。在真空下去除挥发物以产生产物(0.28g,74%)。1hnmr(400mhz,c6d6)δ:7.44(dd,j=8.3,1.7hz,2h),7.37(t,j=8.8hz,4h),7.14-7.05(m,3h),6.90-6.80(m,3h),6.77(dddd,j=9.6,8.3,4.2,1.2hz,1h),6.73-6.61(m,3h),4.42(ddt,j=12.2,8.4,4.5hz,1h),3.33(ddd,j=23.6,13.5,5.3hz,1h),3.23-2.97(m,3h),2.74-2.53(m,1h),2.19(tt,j=10.6,5.3hz,1h),1.68(qd,j=12.5,4.9hz,1h),1.27(d,j=4.5hz,18h),0.98(d,j=8.0hz,0h),0.71-0.53(m,3h),0.40(t,j=7.0hz,3h).13cnmr(101mhz,c6d6)δ:165.66,164.48,164.32,163.40,162.05,148.56,148.53,148.11,142.01,141.81,136.13,136.11,134.19,134.12,133.55,133.50,131.55,131.47,130.41,130.33,128.75,128.72,128.70,128.58,128.49,128.18,127.94,125.72,125.35,124.30,124.26,124.21,115.70,115.47,115.11,114.88,55.48,55.19,54.86,52.65,52.46,52.42,37.25,34.47,34.38,34.33,34.26,33.39,33.35,33.30,31.68,31.61,20.05,13.82.31pnmr(162mhz,c6d6)δ:101.00,32.49-30.79(m).19fnmr(376mhz,c6d6)δ:-102.79(d,j=42.1hz),-104.27(d,j=53.0hz)。制备外消旋-n-环丁基-n-(双(2,4-二氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l651步骤1.制备外消旋-n-环丁基-n-(双(2,4-二氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l651将三乙胺(0.079g,0.78mmol)于甲苯(1.6ml)中的冷溶液(-30℃)添加到外消旋-n-环丁基-2,5-二苯基磷烷-1-胺(0.20g,0.64mmol)于甲苯(2.0ml)中的冷(-30℃)溶液中且搅拌所得混合物10分钟。将混合物放置于-30℃下的冷冻器中30分钟。向此冷却的反应混合物中添加双(2,4-二氟苯基)碘膦(0.22g,0.57mmol)于2.2ml甲苯中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。将反应混合物传送通过5cm活化中性氧化铝塞且在真空下蒸发溶剂,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.24g(66.2%)。1hnmr(400mhz,c6d6,70℃)δ7.27(d,j=8.1hz,2h),7.17(d,j=7.5hz,2h),7.12-7.01(m,3h),6.96-6.75(m,4h),6.45-6.25(m,5h),4.14(s,1h),3.59(p,j=8.9hz,1h),3.19(m,1h),2.75(d,j=15.2hz,1h),2.61(m,1h),2.43(m,1h),2.09-1.91(m,2h),1.72-1.31(m,4h),1.11(q,j=9.5hz,1h).13cnmr(101mhz,c6d6,70℃)δ165.48(d,j=12.1hz),162.98(d,j=12.7hz),162.41(d,j=11.8hz),143.85(d,j=21.3hz),138.59(d,j=2.6hz),134.74-133.69(m),128.32,128.27(d,j=4.1hz),128.02,127.95,125.75(d,j=2.6hz),125.47(d,j=1.9hz),111.11(t,j=18.6hz),103.48(d,j=23.2hz),57.71(d,j=15.5hz),52.96(d,j=19.8hz),50.80(dd,j=23.1,3.4hz),36.21(d,j=2.5hz),33.07(dd,j=8.1,2.7hz),31.79(dd,j=12.8,4.1hz),14.39.31pnmr(162mhz,c6d6,70℃)δ81.98,29.68.19fnmr(376mhz,c6d670℃)δ1.84-0.86(m),-6.90,-8.98。制备外消旋-n-环戊基-n-(双(2,4-二氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l652步骤1.制备外消旋-n-环戊基-n-(双(2,4-二氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l652将三乙胺(0.075g,0.74mmol)于甲苯(1.5ml)中的冷溶液(-30℃)添加到外消旋-n-环戊基-2,5-二苯基磷烷-1-胺(0.20g,0.62mmol)于甲苯(2.0ml)中的冷(-30℃)溶液中且搅拌所得混合物10分钟。将混合物放置于-30℃下的冷冻器中30分钟。向此冷却的混合物中添加双(2,4-二氟苯基)碘膦(0.21g,0.54mmol)于2.1ml甲苯中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。使反应混合物传送通过5cm活化中性氧化铝塞且在真空下去除挥发物,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.14g(39.1%)。1hnmr(400mhz,c6d6,70℃)δ7.28(d,j=7.6hz,2h),7.19-7.06(m,4h),7.02(t,j=7.2hz,1h),6.92(t,j=7.5hz,2h),6.84(dd,j=9.7,5.4hz,2h),6.55(s,1h),6.50-6.25(m,4h),4.12(s,1h),3.39(m,1h),3.23(m,1h),2.80(s,1h),2.56-2.33(m,1h),2.12-1.84(m,2h),1.50(m,2h),1.44-0.89(m,6h).13cnmr(101mhz,c6d6,70℃)δ165.53(d,j=12.9hz),164.88,163.03(d,j=12.5hz),162.27,143.87(d,j=21.2hz),138.61(d,j=2.7hz),134.68(q,j=8.8,8.3hz),134.05,128.29(d,j=3.0hz),128.07(d,j=9.4hz),127.93,125.62(dd,j=21.6,2.4hz),121.45(d,j=18.7hz),111.03(d,j=19.9hz),103.21(dd,j=51.9,26.8hz),63.76(d,j=15.7hz),53.62,50.82(dd,j=22.9,3.7hz),36.67(d,j=3.0hz),35.05(dd,j=7.3,3.2hz),33.65(dd,j=12.4,3.9hz),32.95,24.06(d,j=5.9hz).31pnmr(162mhz,c6d6,70℃)δ84.22,30.88.19fnmr(376mhz,c6d670℃)δ-99.62(m),-107.76,-110.46。制备(外消旋)-n-丁基-n-(二(噻吩-2-基)磷基)-2,5-二苯基磷烷-1-胺,l653步骤1.制备n,n-二甲基-1,1-二(噻吩-2-基)膦在冷冻器中将装备有搅拌棒且装载有thf(20ml)和镁屑(0.825g,33.9mmol)的50ml罐冷却到-30℃。将溶解于thf(10ml)中的2-溴噻吩(5.00g,30.8mmol)缓慢添加到搅拌溶液中,且搅拌反应混合物过夜。通过gc/ms分析(去除较小等分试样且用氘化水淬灭)显示形成噻吩基格林纳试剂的反应完成且将罐放置于-30℃下的冷冻器中。在-30℃下的冷冻器中冷却装备有搅拌棒和装载有含二甲基亚磷酰胺二氯化物(2.20g,15.1mmol)的thf(75ml)的200ml罐1小时。将冷噻吩基格林纳试剂(5.60g,30.1mmol)缓慢添加到冷二甲基亚磷酰胺二氯化物溶液中。使反应混合物升温到室温,同时搅拌过夜。通过31pnmr光谱分析检查反应且发现完成。在真空下将反应混合物浓缩到干燥且在甲苯(100ml)中将残余物制成浆料。随后使甲苯混合物传送通过用较多甲苯(25ml)洗涤的过滤器。去除挥发物且使残余物溶解于二乙醚中且过滤。浓缩滤液且使残余物溶解于甲苯中。针对不同反应,保存三分之一溶液。采集三分之二溶液且在真空下去除溶剂以产生产物,1.2g,总产率1.8g(79%)。1hnmr(400mhz,c6d6)δ7.21(ddd,j=4.6,3.5,1.1hz,2h),7.14(dd,j=4.9,1.1hz,2h),6.81(ddd,j=4.8,3.5,1.3hz,2h),2.56(d,j=10.8hz,6h).13cnmr(101mhz,c6d6)δ141.39(d,j=30.9hz),134.13(d,j=24.3hz),130.91(d,j=2.3hz),127.97(d,j=6.1hz),41.35(d,j=15.2hz).31pnmr(162mhz,c6d6)δ41.94。步骤2.制备碘二(噻吩-2-基)膦50ml罐装备有搅拌棒且装载有n,n-二甲基-1,1-二(噻吩-2-基)膦(1.20g,4.97mmol)和甲苯(7ml)。将含hcl的乙醚(1.00m,5.00ml,4.97mmol)缓慢添加到搅拌反应混合物中。在室温下搅拌反应混合物过夜。第二天,通过31pnmr光谱分析检查反应混合物,之后测定还存在一些起始材料(10%)。将含额外hcl的乙醚(1ml)添加到反应混合物中且在室温下搅拌其过夜。当第二天通过31pnmr光谱分析检查时,反应完成。在真空下浓缩溶液,得到粗氯二(噻吩-2-基)膦(产率0.63g,54%)。31pnmr(162mhz,甲苯-d8)δ47.92(t,j=3.1hz)。使粗氯二(噻吩-2-基)膦溶解于甲苯(7ml)中且转移到装备有搅拌棒的40ml小瓶中。在冷冻器中使混合物冷却到-30℃且将冷(-30℃)三甲基碘硅烷(813μl,5.71mmol)添加到搅拌反应混合物中,使得瞬间颜色从淡黄色变成暗黄色。在室温下搅拌反应混合物若干天。通过31pnmr光谱分析显示反应完成。浓缩反应混合物,得到呈橙色固体状的产物。产率(0.78g,89%)。1hnmr(400mhz,c6d6)δ7.26(ddd,j=6.0,3.6,1.1hz,2h),7.05(ddd,j=4.9,1.2,0.4hz,2h),6.56(ddd,j=4.9,3.6,1.7hz,2h).13cnmr(101mhz,c6d6)δ136.41(d,j=34.3hz),134.45(d,j=1.5hz),128.39.31pnmr(162mhz,c6d6)δ2.45。步骤3.制备(外消旋)-n-丁基-n-(二(噻吩-2-基)磷基)-2,5-二苯基磷烷-1-胺,l653将碘二(噻吩-2-基)膦(0.130g,0.402mmol)于甲苯(5ml)中的冷(-30℃)溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.125g,0.402mmol)和三乙胺(62μl,0.40mmol)于甲苯(5ml)中的冷(-30℃)溶液,使得固体立即形成。在搅拌1小时之后,通过31pnmr光谱分析来分析反应混合物,其显示完全转化成产物。在真空下去除甲苯,且用乙醚萃取残余物。使混合物过滤通过中性活性氧化铝塞。在真空下去除乙醚以产生白色固体。用戊烷湿磨固体且干燥,提供呈白色固体状的产物。产率(0.133g,65.1%)。1hnmr(400mhz,c6d6)δ7.41(m,2h),7.31-7.19(m,5h),7.16-6.99(m,6h),6.77(ddd,j=4.8,3.5,1.2hz,1h),6.74-6.70(m,2h),4.22(m,1h),3.38-3.12(m,3h),3.09-2.96(m,1h),2.51-2.38(m,1h),2.25-2.12(m,1h),1.68-1.53(m,1h),1.29-1.16(m,1h),0.93-0.75(m,3h),0.60-0.54(m,3h).13cnmr(101mhz,c6d6)δ144.63(d,j=21.0hz),143.59(d,j=35.6hz),140.51(dd,j=32.1,1.4hz),139.43(d,j=2.2hz),135.42(d,j=27.9hz),133.82(d,j=23.2hz),131.07(dd,j=30.1,1.9hz),129.10(dd,j=3.4,2.2hz),128.87-128.46(m),127.51(d,j=7.3hz),125.97(dd,j=35.2,2.2hz),55.23-55.10(m),54.96-54.69(m),52.02(dd,j=22.9,3.4hz),36.33(d,j=2.4hz),34.10(d,j=8.3hz),33.38(dd,j=8.1,3.3hz),20.18,13.92.31pnmr(162mhz,c6d6)δ97.24(d,j=27.6hz),33.93(d,j=27.6hz)。hrms(esi-tof)m/z:对于c28h31np2s2,[m+h]+计算值为508.1446;实验值为508.1438。制备(外消旋)-n-(二苯基磷烷基)-n,2,5-三苯基磷烷-1-胺,l654步骤1.制备n,1,1-三苯基膦将氯二苯膦(1.0ml,5.4mmol)于己烷(5.0ml)中的溶液添加到苯胺(1.1ml,12mmol)中,使得白色沉淀物形成。在搅拌1小时之后,过滤混合物以去除盐且浓缩滤液以产生呈白色固体状的产物。产率(1.3g,86%)。1hnmr(400mhz,c6d6)δ7.44-7.33(m,4h),7.13-7.02(m,8h),6.97-6.87(m,2h),6.81-6.69(m,1h),4.09(d,j=7.6hz,1h).13cnmr(101mhz,c6d6)δ147.04(d,j=17.1hz),140.72(d,j=13.0hz),131.59(d,j=20.6hz),129.56(d,j=1.3hz),129.18,128.83,128.77,119.87(d,j=1.2hz),116.52(d,j=13.0hz).31pnmr(162mhz,c6d6)δ28.93。步骤2.制备(外消旋)-n-(二苯基磷烷基)-n,2,5-三苯基磷烷-1-胺,l654。将n,1,1-三苯基膦(0.25g,0.90mmol)和三乙胺(151μl,1.08mmol)于甲苯(2ml)中的冷(-30℃)溶液与(外消旋)-2,5-二苯基碘磷杂环戊烷(0.33g,0.90mmol)于甲苯(2ml)中的冷(-30℃)溶液组合且放置于冷冻器后部30分钟。随后在真空下去除溶剂且用乙醚萃取残余物且传送通过活化中性氧化铝塞。在去除挥发物之后,使产物溶解于戊烷中且在冷冻器中析出以产生呈白色固体状的产物。产率0.25g,54%。1hnmr(400mhz,c6d6)δ7.56-7.46(m,1h),7.45-7.33(m,4h),7.29-7.15(m,6h),7.15-6.85(m,10h),6.71-6.62(m,2h),6.42-6.32(m,2h),4.08(ddt,j=10.9,6.8,3.4hz,1h),3.20(ddd,j=25.1,13.3,5.8hz,1h),2.35-2.09(m,2h),2.08-1.91(m,1h),1.57-1.30(m,1h).13cnmr(101mhz,苯-d6)δ146.39(t,j=4.6hz),144.04(d,j=22.0hz),139.49,133.44(d,j=20.8hz),133.15(d,j=22.0hz),130.52(d,j=2.8hz),128.83(d,j=4.9hz),128.65,128.53(d,j=3.8hz),128.43,128.34,127.65(d,j=6.8hz),125.97(d,j=2.5hz),125.43,125.03,52.97(d,j=14.3hz),52.81,52.72(d,j=9.8hz),52.50(d,j=6.1hz),36.29(d,j=2.1hz),32.16(d,j=4.1hz).31pnmr(162mhz,c6d6)δ100.50(d,j=117.5hz),68.64(d,j=118.9hz)。制备外消旋-n-丁基-n-(双(4-氯-2-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l664。步骤1.制备双(4-氯-2-氟苯基)二乙基氨基膦将含正丁基锂的己烷(4.9ml,1.6m,7.8mmol)缓慢添加到4-氯-2-氟-1-碘苯(2.00g,7.80mmol)于乙醚(20.0ml)中的冷(-78℃)溶液中。在-78℃下搅拌所得反应混合物一小时。在-78℃下缓慢添加二乙基亚磷酰胺二氯化物(0.62g,3.6mmol)于乙醚(1.0ml)中的溶液。使反应混合物升温,同时搅拌过夜。在减压下去除挥发物。用己烷萃取固体,过滤且在减压下去除挥发物过夜以得到深棕色固体。产率1.14g(89.1%)。1hnmr(400mhz,c6d6)δ6.91(m,2h),6.85-6.75(m,2h),6.69(m,2h),2.78(dq,j=9.8,7.1hz,4h),0.71(t,j=7.1hz,6h).13cnmr(101mhz,c6d6)δ164.42(d,j=17.5hz),161.95(d,j=17.4hz),135.86(d,j=11.3hz),132.90(t,j=6.9hz),124.55(d,j=3.7hz),116.01(d,j=27.1hz),44.67(d,j=17.4hz),14.04(d,j=3.7hz).31pnmr(162mhz,c6d6)δ37.31(t,j=44.0hz).19fnmr(376mhz,c6d6δ-102.23(dt,j=44.0,8.4hz)。步骤2.制备双(4-氯-2-氟苯基)氯膦将hcl于乙醚(7.87ml,1.0m,7.87mmol)中的溶液添加到双(4-氯-2-氟苯基)二乙基氨基膦(1.14g,3.15mmol)于二乙醚(10.0ml)中的冷(-30℃)溶液中。将反应混合物搅拌1小时,同时加热到环境温度。过滤反应混合物且在减压下去除挥发物。用己烷萃取残余物且过滤。在减压下去除挥发物以得到呈深棕色固体状的产物。31pnmr光谱显示59.9%的所需产物。产率0.47g(46.1%)。产物不经进一步纯化即用于下一步骤中。1hnmr(400mhz,c6d6)δ7.14(m,2h),6.71(m,2h),6.56(m,1h).13cnmr(101mhz,c6d6)δ164.34(d,j=18.7hz),161.84(d,j=18.7hz),138.36(d,j=11.0hz),133.34(ddd,j=13.0,3.9,1.6hz),125.47-124.30(m),116.27(d,j=26.3hz).31pnmr(162mhz,c6d6)δ63.95-53.04(m).19fnmr(376mhz,c6d6)δ-102.09--103.21(m)。步骤3.制备双(4-氯-2-氟苯基)碘膦将三甲基碘硅烷(0.48g,2.2mmol)添加到双(4-氯-2-氟苯基)氯膦(0.47g,1.4mmol)于甲苯(5.0ml)中的溶液中以形成橙色溶液。在室温下搅拌混合物过夜。过滤反应混合物以去除深色沉淀物,其在反应之后悬浮于溶液中。在减压下蒸发挥发物以得到微黄色液体。31pnmr光谱显示71.4%的所需产物。产率(0.51g,85%)。1hnmr(400mhz,c6d6)δ7.15-7.03(m,2h),6.63(ddt,j=8.3,2.0,0.6hz,2h),6.51(ddd,j=9.3,3.7,2.0hz,2h).13cnmr(101mhz,c6d6)δ164.11(d,j=18.4hz),161.61(d,j=18.5hz),138.46(d,j=10.5hz),136.78(dd,j=11.6,4.2hz),125.15(dd,j=3.8,1.9hz),116.25(d,j=26.3hz).31pnmr(162mhz,c6d6)δ6.07(t,j=57.2hz).19fnmr(376mhz,c6d6δ-98.59(dt,j=57.2,8.5hz)。步骤4.制备外消旋-n-丁基-n-(双(4-氯-2-氟苯基)氧膦基)-2,5-二苯基磷烷-1-胺,l664。将三乙胺(0.063g,0.63mmol)于甲苯-d8(1.3ml)中的冷溶液(-30℃)添加到外消旋-n-丁基-2,5-二苯基磷烷-1-胺(0.13g,0.42mmol)于甲苯-d8(1.3ml)中的冷(-30℃)溶液中且搅拌所得混合物10分钟。将混合物放置于-30℃下的冷冻器中30分钟。向此冷却的混合物中添加双(4-氯-2-氟苯基)碘膦(0.17g,0.42mmol)于甲苯(1.7ml)中的冷(-30℃)溶液,同时形成白色沉淀物。在环境温度下搅拌反应混合物30分钟。将反应混合物传送通过5cm活化中性氧化铝塞且在真空下蒸发溶剂,得到在-30℃下由冷戊烷再结晶的固体产物以产生纯产物。产率0.05g(20%)。1hnmr(400mhz,c6d6)δ7.31(dt,j=8.0,1.5hz,2h),7.19(ddd,j=7.8,4.3,2.9hz,4h),7.06(td,j=7.3,1.3hz,1h),6.90(dd,j=8.2,6.6hz,2h),6.82(t,j=7.3hz,1h),6.75-6.58(m,5h),6.37(td,j=7.7,4.4hz,1h),4.10(m,1h),3.16(m,1h),2.98-2.71(m,3h),2.54-2.34(m,1h),2.00(dq,j=11.1,5.3hz,1h),1.48(dd,j=12.7,5.0hz,1h),1.01(m,1h),0.61(h,j=7.5,7.0hz,3h),0.36(t,j=7.1hz,3h).13cnmr(101mhz,c6d6)δ165.00(d,j=19.4hz),163.11(d,j=17.3hz),162.52(d,j=19.3hz),160.64(d,j=17.2hz),143.80(d,j=20.9hz),138.38(d,j=2.3hz),136.75(d,j=10.5hz),135.56-134.57(m),133.63(d,j=6.1hz),128.44,128.41-128.31(m),128.27(d,j=6.4hz),128.15,128.07,125.89(d,j=2.5hz),125.63(d,j=1.9hz),124.56(d,j=3.4hz),124.41(d,j=3.4hz),116.10(d,j=27.5hz),115.39(d,j=26.8hz),54.59(d,j=27.2hz),51.79(dd,j=22.5,4.6hz),36.65(d,j=1.8hz),33.84(dd,j=6.7,2.2hz),32.53(dd,j=7.6,3.5hz),22.31,19.54,13.86,13.26.31pnmr(162mhz,c6d6)δ101.47,32.98-28.58(m).19fnmr(376mhz,c6d5cd3)δ-112.24--112.40(m),-112.71(m)。制备(2r,5r)-n-丁基-n-(二(噻吩-3-基)磷基)-2,5-二苯基磷烷-1-胺,l665步骤1.制备n,n-二甲基-1,1-二(噻吩-3-基)膦将装备有搅拌棒且装载有thf(5ml)和3-溴噻吩(1.109g,6.852mmol)的40ml小瓶放置于冷冻器(约-30℃)中两小时。在从冷冻器中移出后,将同样在冷冻器中的含氯化异丙基镁-氯化锂络合物溶液的thf(5.270ml,1.30m,6.85mmol)缓慢添加到搅拌溶液中。在室温下搅拌反应混合物两小时,且随后放置于冷冻器后部。向新40ml小瓶中装入含二甲基亚磷酰胺二氯化物(0.500g,3.43mmol)的thf(10ml)且放置于冷冻器中1小时。去除两种反应剂且将3-溴噻吩和氯化异丙基镁-氯化锂络合物反应混合物缓慢添加到二甲基亚磷酰胺二氯化物溶液中。在室温下搅拌反应混合物两个半小时。反应后为31pnmr光谱分析且测定为完成。浓缩反应混合物,用甲苯萃取,且过滤通过中性氧化铝塞。滤液原样用于下一步骤中。1hnmr(400mhz,c6d6)δ7.14-7.11(m,2h),6.97-6.95(m,4h),2.45(d,j=10.3hz,6h).13cnmr(101mhz,c6d6)δ130.60(d,j=17.9hz),129.55(d,j=21.7hz),126.20(d,j=5.7hz),41.53(d,j=14.8hz).31pnmr(162mhz,c6d6)δ44.62。步骤2.制备氯二(噻吩-3-基)膦在40ml小瓶中搅拌n,n-二甲基-1,1-二(噻吩-3-基)膦和甲苯的混合物,同时缓慢添加含hcl的二乙醚(4.25ml,1.0m,4.25mmol)。在室温下搅拌反应混合物三个半小时。通过31pnmr光谱分析检查反应物且测定为完成。过滤反应混合物且浓缩,得到0.5305g,67.31%。1hnmr(400mhz,c6d6)δ7.11(dddd,j=4.6,2.8,1.2,0.4hz,2h),6.95(dddd,j=5.0,2.2,1.2,0.4hz,2h),6.72(dddd,j=5.0,2.8,1.1,0.4hz,2h).13cnmr(101mhz,c6d6)δ138.88(d,j=35.5hz),131.99(d,j=33.5hz),129.34(d,j=16.0hz),127.17(d,j=5.1hz).31pnmr(162mhz,c6d6)δ57.83。步骤3.制备碘二(噻吩-3-基)膦40ml小瓶装备有搅拌棒且装载有含氯二(噻吩-3-基)膦(0.484g,2.0814mmol)的甲苯(7ml)。将小瓶放置于冷冻器(约-30℃)中十五分钟。在从冷冻器中移出后,将同样在冷冻器中的三甲基碘硅烷(355μl,2.50mmol)缓慢添加到搅拌溶液中。反应混合物紧接着从淡黄色变成暗黄色。搅拌反应混合物三个半小时。通过31pnmr光谱分析检查反应时程且测定为完成。浓缩反应混合物,得到0.591g,87.6%。1hnmr(400mhz,c6d6)δ7.14-7.07(m,4h),6.77(ddd,j=5.0,2.8,1.1hz,2h).13cnmr(101mhz,c6d6)δ132.50(d,j=32.3hz),131.89(d,j=15.0hz),127.52(d,j=4.8hz).31pnmr(162mhz,c6d6)δ5.90。步骤4.制备(2r,5r)-n-丁基-n-(二(噻吩-3-基)磷基)-2,5-二苯基磷烷-1-胺,l665将碘二(噻吩-3-基)膦(0.260g,0.836mmol)于甲苯(5ml)中的冷(-30℃)溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.200g,0.643mmol)和三乙胺(99μl,0.707mmol)于甲苯(5ml)中的冷(-30℃)溶液,使得固体立即形成。在搅拌1小时之后,通过31pnmr光谱分析来分析样品,其显示完全转化成产物。在真空下去除甲苯,用乙醚萃取残余物,且过滤通过中性活性氧化铝塞。在真空下去除乙醚以产生白色固体。用冷戊烷湿磨固体且干燥,提供0.220g,67.53%呈白色固体状的产物。1hnmr(400mhz,c6d6)δ7.46-7.40(m,2h),7.30-7.13(m,7h),7.12-7.06(m,3h),6.90-6.88(m,2h),6.77(ddd,j=4.9,2.8,1.3hz,1h),6.58(td,j=2.9,1.2hz,1h),6.38(ddd,j=4.9,2.0,1.2hz,1h),4.04(ddt,j=12.3,7.4,4.7hz,1h),3.39-3.25(m,1h),3.08-2.85(m,3h),2.44-2.31(m,1h),2.21-2.11(m,1h),1.10-0.98(m,1h),0.78-0.61(m,3h),0.53-0.47(m,3h).13cnmr(101mhz,c6d6)δ144.65(d,j=20.9hz),141.81(d,j=25.3hz),139.78(d,j=2.3hz),139.17(d,j=18.4hz),131.37-130.22(m),129.52(d,j=19.2hz),129.31-129.14(m),128.89-128.52(m),126.50(d,j=5.7hz),126.23(d,j=2.5hz),125.85(d,j=1.9hz),125.33(d,j=5.9hz),55.85-55.31(m),54.63(dd,j=31.5,5.9hz),51.87(dd,j=22.5,3.4hz),36.77(d,j=2.7hz),34.14(d,j=7.2hz),33.26(dd,j=7.9,3.4hz),20.10,13.89.31pnmr(162mhz,c6d6)δ97.06(d,j=24.4hz),37.46(d,j=24.4hz)。制备(2r,5r)-n-丁基-n-(二(呋喃-3-基)磷基)-2,5-二苯基磷烷-1-胺,l696步骤1.制备n,n-二甲基-1,1-二(呋喃-3-基)膦在装备有搅拌棒和热电偶的250ml三颈圆底烧瓶中,将正丁基锂(6.86ml,2.5m,17mmol)缓慢添加到3-溴呋喃(2.832g,19.270mmol)于thf(约40ml)中的冷却(-70℃(干冰丙酮浴))溶液中。在-70℃下搅拌反应混合物2小时。随后通过注射器缓慢添加二甲基亚磷酰胺二氯化物(1.250g,8.565mmol)于thf(约40ml)中的溶液。搅拌反应混合物2小时。通过31pnmr光谱分析粗反应混合物显示反应完成。亮黄色反应混合物原样携带到下一步骤。31pnmr(162mhz,thf)δ20.41(s)。步骤2.制备氯二(呋喃-3-基)膦向来自先前步骤仍在-70℃下的反应混合物(包含thf中的n,n-二甲基-1,1-二(呋喃-3-基)膦)中添加hcl于二乙醚(18.85ml,1.0m,19mmol)中的溶液。搅拌反应混合物过夜,同时加热直到室温。通过31pnmr光谱分析粗反应混合物显示反应完成。在手套箱后部获取反应混合物且使粗混合物过滤通过硅藻土且浓缩,得到0.922g,53.68%淡黄色固体。1hnmr(400mhz,c6d6)δ7.24-7.22(m,1h),7.14(dd,j=1.5,0.9hz,1h),7.04-7.00(m,1h),6.94(td,j=1.7,0.9hz,1h),6.35-6.33(m,1h),6.31(td,j=1.8,0.9hz,1h).13cnmr(101mhz,c6d6)δ147.79(d,j=20.2hz),147.46(d,j=4.5hz),144.71(d,j=5.0hz),143.91(t,j=2.5hz),113.55(t,j=6.1hz),111.82(d,j=8.2hz).31pnmr(162mhz,c6d6)δ40.26。步骤3.制备二(呋喃-3-基)碘磷烷将装备有搅拌棒且含有氯二(呋喃-3-基)磷烷(0.500g,通过31pnmr为85%纯,2.493mmol)于甲苯(7ml)中的溶液的40ml小瓶放置于冷冻器(-30℃)中45分钟。将冷冻器中的冷三甲基碘硅烷(362μl,2.543mmol)添加到搅拌反应混合物中。使反应混合物升温到环境温度。在15分钟之后通过31pnmr光谱分析显示反应完成。浓缩反应混合物,得到0.3059g,49.43%暗黄色油。1hnmr(400mhz,c6d6)δ7.26-7.20(m,1h),7.12-7.08(m,1h),7.05-7.00(m,1h),6.99-6.94(m,1h),6.35-6.30(m,2h).13cnmr(101mhz,c6d6)δ147.34,146.92,144.60(d,j=5.1hz),143.90(t,j=2.4hz),114.13(d,j=8.1hz),113.55(t,j=6.1hz).31pnmr(162mhz,c6d6)δ-14.79。制备(2r,5r)-n-丁基-n-(二(呋喃-3-基)磷基)-2,5-二苯基磷烷-1-胺,l696将二(呋喃-3-基)碘磷烷(0.255g,通过31pnmr为60%纯,0.857mmol)于甲苯(5ml)中的冷(30分钟于-30℃冷冻器中)溶液逐滴添加到(外消旋)-n-丁基-2,5-二苯基磷烷-1-胺(0.160g,0.514mmol)和三乙胺(79μl,0.565mmol)于甲苯(5ml)中的冷(30分钟于-30℃冷冻器中)溶液中,使得沉淀物立即形成。搅拌反应混合物45分钟。通过31p-nmr光谱分析显示反应已实现完全转化。在真空下去除甲苯,用乙醚萃取残余物,且过滤通过中性活性氧化铝塞。在真空下去除乙醚以产生油,其通过31p-nmr分析且发现含有一些杂质。通过使油的甲苯溶液传送通过碱性氧化铝塞来纯化产物。浓缩滤液,得到呈淡黄色油状的产物,41.3mg,16.9%。1hnmr(500mhz,c6d6)δ7.40-7.35(m,2h),7.27-7.21(m,3h),7.20-7.16(m,2h),7.14-7.11(m,2h),7.06-7.00(m,3h),6.96(q,j=1.5hz,1h),6.69(dt,j=1.4,0.7hz,1h),6.15(dt,j=1.9,1.0hz,1h),5.70(dt,j=1.9,1.0hz,1h),4.00(ddt,j=12.3,7.4,4.7hz,1h),3.34-3.21(m,1h),3.00-2.79(m,3h),2.41-2.29(m,1h),2.12(ddt,j=14.8,13.0,5.2hz,1h),1.61-1.48(m,1h),1.26-1.13(m,1h),0.88-0.65(m,3h),0.56-0.52(m,3h).13cnmr(126mhz,c6d6)δ147.01(d,j=29.6hz),146.24(d,j=29.5hz),143.84(d,j=5.3hz),143.07(d,j=5.7hz),139.85(d,j=2.4hz),129.23-129.08(m),128.91-128.46(m),126.23(d,j=2.4hz),125.84(d,j=1.6hz),112.99(d,j=12.7hz),112.59(d,j=12.8hz),55.14(t,j=21.3hz),54.19(dd,j=30.4,5.7hz),51.49(dd,j=22.4,3.8hz),36.32(d,j=2.9hz),34.22(d,j=7.7hz),33.17(dd,j=7.8,3.4hz),20.15,13.93.31pnmr(202mhz,c6d6)δ96.13(d,j=22.8hz),15.59(d,j=22.9hz)。制备4,8-二-叔丁基-n-丁基-n-((2s,5s)-2,5-二苯基磷烷-1-基)-s-1,2,10,11-四甲基二苯并[d,f][1,3,2]二氧杂磷杂庚英-6-胺和4,8-二-叔丁基-n-丁基-n-((2r,5r)-2,5-二苯基磷烷-1-基)-s-1,2,10,11-四甲基二苯并[d,f][1,3,2]二氧杂磷杂庚英-6-胺的混合物,l699将三乙胺(0.117g,1.16mmol)于甲苯(1.2ml)中的冷溶液(-30℃)添加到外消旋-n-丁基-2,5-二苯基磷烷-1-胺(0.30g,0.96mmol)于甲苯(3.0ml)中的冷(-30℃)溶液中且搅拌所得反应混合物10分钟。将反应混合物放置于-30℃下的冷冻器中30分钟。向此冷却的反应混合物中添加s-4,8-二-叔丁基-6-碘-1,2,10,11-四甲基二苯并[d,f][1,3,2]二氧杂磷杂环庚三烯(0.49g,0.96mmol)于4.9ml甲苯中的冷(-30℃)溶液。在添加溶液完成之后,观测到白色沉淀物。在环境温度下搅拌溶液30分钟。在真空下去除挥发物。用甲苯(10ml)萃取粗产物且过滤通过5cm活化中性氧化铝。在真空下从滤液中去除挥发物,得到在-30℃下由冷戊烷再结晶的固体产物以产生两个异构产物的混合物。产率0.38g(69.9%)。1hnmr(400mhz,c6d6)δ7.46(m,4h),7.39-7.32(m,2h),7.29(m,2h),7.25-7.13(m,8h),7.10-6.89(m,8h),4.77(m,1h),3.90(m,1h),3.30(m,1h),3.09-2.33(m,9h),2.31-2.09(m,2h),2.09-1.91(m,12h),.71(s,3h),1.70(s,3h),1.69(s,9h),1.68(s,9h),1.65-1.47(m,8h),1.43(s,9h),1.34-1.23(m,1h),1.09(s,9h),0.89-0.46(m,9h),0.35(m,6h),0.26-0.10(m,1h).13cnmr(101mhz,c6d6)δ148.53,148.43,148.30,148.24,147.87,147.58,146.07,145.82,144.66,144.45,138.79,137.73(d,j=2.4hz),137.67-137.34(m),137.22,136.66,134.87(d,j=8.3hz),134.08,133.72,132.30(d,j=5.0hz),131.99,131.81,130.44,130.34(d,j=3.0hz),130.20,129.96,128.90,128.87-128.76(m),128.64,128.57(d,j=3.7hz),128.39,128.34(d,j=2.3hz),128.29,128.20(t,j=2.3hz),128.13,126.06(d,j=1.9hz),125.98-125.69(m),125.26,59.15(d,j=27.2hz),54.83(d,j=27.5hz),54.07-53.06(m),52.11-50.21(m),37.95,37.40,35.94(d,j=12.2hz),35.35(d,j=7.7hz),35.23-34.37(m),33.90,33.15(d,j=3.6hz),31.69-30.74(m),30.36,21.01,20.58-19.33(m),16.56-14.90(m),12.70(d,j=26.3hz).31pnmr(162mhz,c6d6δ143.44-143.17(m),102.02(d,j=27.6hz),92.14(d,j=13.5hz)。配位化合物-铬络合物制备制备1,2-双[(2s,5s)-2,5-二甲基磷烷]苯-crcl3((四氢呋喃))(me-duphos-crcl3(thf)),l372将thf(15ml)添加到含有1,2-双[(2s,5s)-2,5-二甲基磷烷]苯(me-duphos)(0.60g,1.96mmol)和三氯三(四氢呋喃)铬(crcl3(thf)3)(0.56g,1.51mmol)的小瓶中。在环境温度下搅拌所得溶液30分钟,且随后在60℃下加热1小时。浓缩thf,同时形成较多结晶材料。用移液管移取上清液以与固体分离。在减压下干燥固体以得到紫黑色结晶材料,0.4776g,59.0%。通过减缓thf溶液在环境温度下的蒸发来使适于x射线衍射分析的晶体生长。元素分析:计算值:c,49.22;h,6.76;实验值:c,49.24;h,6.69。晶体结构在图1中给出。制备(1,2-双[(2s,5s)-2,5-二甲基磷烷]苯-crcl3)2((me-duphos-crcl3)2),l423将甲苯(8ml)添加到含有1,2-双[(2s,5s)-2,5-二甲基磷烷]苯(0.588g,1.92mmol)和crcl3(thf)3(0.7133g,1.92mmol)的小瓶中。在80℃下加热反应混合物过夜,得到悬浮液。在无冷却的情况下过滤悬浮液以产生非晶形固体产物。用2ml甲苯和8ml己烷洗涤产物,且随后在减压下干燥得到0.7655g(产率=85.8%)结晶材料。元素分析:计算值:c,46.52;h,6.07;实验值:c,46.32;h,5.97。在环境温度下,由材料的cd2cl2/己烷溶液生长适于x射线衍射分析的晶体。晶体结构在图2中给出。制备(1,2-双[(2r,5r)-2,5-二乙基磷烷]苯-crcl3(thf)(et-duphos-crcl3(thf),l403)使crcl3(thf)3(513mg,1.38mmol)溶解于thf(5ml)中以得到紫色溶液。将1,2-双[(2r,5r)-2,5-二乙基磷烷]苯(et-duphos)(500mg,0.60mmol)于thf(5ml)中的溶液逐滴添加到crcl3(thf)3溶液中。几乎紧接着在添加配体后,溶液颜色变成深钴蓝色。搅拌反应混合物8小时,且随后在真空中去除溶剂。在真空下在60℃下干燥所得蓝色固体过夜。产率506.7mg,62%。通过在环境温度下使thf/己烷溶液蒸发来使适于x射线衍射分析的晶体生长。元素分析:计算值:c,52.67;h,7.48;n,0.00。实验值:c,52.43;h,7.26。晶体结构在图3中给出。制备1,2-双[(2r,5r)-2,5-二甲基磷烷]乙烷-crcl3(thf)(me-bpe-crcl3(thf),l421)使crcl3(thf)3(360mg,0.97mmol)溶解于thf(5ml)中以得到紫色溶液。将1,2-双[(2r,5r)-2,5-二甲基磷烷]乙烷(me-bpe)(250mg,0.97mmol)于thf(5ml)中的溶液逐滴添加到crcl3(thf)3溶液中。溶液颜色紧接着从紫色变成深钴蓝色。在环境温度下将溶液搅拌过夜。在真空中去除thf且使残余物再溶解于极少量thf(约5ml)中,继而添加己烷(约30ml)。使此悬浮液过滤通过熔块且在真空中从滤液中去除溶剂以产生299.9mg蓝色固体。产率63.4%。通过在环境温度下使thf/己烷溶液蒸发来使适于x射线衍射分析的晶体生长。元素分析:计算值:c,44.23;h,7.42;n,0.00。实验值:c,42.93;h,7.25。晶体结构在图4中给出。制备1,2-双[(2r,5r)-2,5-二乙基磷烷]乙烷-crcl3(thf)(et-bpe-crcl3(thf),l422)使crcl3(thf)3(295mg,0.80mmol)溶解于thf(5ml)中以得到紫色溶液。将1,2-双[(2r,5r)-2,5-二乙基磷烷]乙烷(et-bpe)(250mg,0.80mmol)于thf(5ml)中的溶液添加到crcl3(thf)3溶液中。在环境温度下搅拌反应混合物过夜,且随后添加30ml己烷。使所得悬浮液过滤通过熔块。在真空中从滤液中去除溶剂以产生354mg蓝色固体。产率81.7%。通过在环境温度下使thf/己烷溶液蒸发来使适于x射线衍射分析的晶体生长。元素分析:计算值:c,48.49;h,8.14;n,0.00。实验值:c,43.79;h,7.84。晶体结构在图5中给出。制备(1r,1′r,2s,2′s)-2,2′-二-叔丁基-2,3,2′,3′-四氢-1h,1′h-(1,1′)二异磷吲哚基-crcl3(thf)(duanphos-crcl3(thf),l455)使cr(thf)3cl3(98.0mg,0.26mmol)溶解于thf(3ml)中以得到紫色溶液。将(1r,1′r,2s,2′s)-2,2′-二-叔丁基-2,3,2′,3′-四氢-1h,1′h-(1,1′)二异磷吲哚基(duanphos)(100mg,0.26mmol)于thf(5ml)中的溶液添加到cr(thf)3cl3溶液中。在配体添加几分钟内,溶液颜色从紫色变成蓝色。在环境温度下搅拌反应混合物四天。将己烷(30ml)添加到反应混合物中,且使所得悬浮液过滤通过熔块,产生108.2mg蓝色固体。产率67.5%。在环境温度下由cd2cl2和己烷使适于x射线衍射分析的晶体生长。所得晶体结构为二聚体络合物:(duanphos-crcl3)2。因为元素分析指定单体结构,显而易见的是络合物在结晶条件下二聚。元素分析:计算值:c,54.87;h,6.58;实验值:c,55.48;h,6.96。制备((外消旋)-n-(二苯基磷烷基)-n-甲基-2,5-二苯基磷烷-1-胺)-crcl3(thf),l560使crcl3(thf)3(65.2mg,0.17mmol)溶解于甲苯(2ml)中以得到紫色溶液。将((外消旋)-n-(二苯基磷烷基)-n-甲基-2,5-二苯基磷烷-1-胺)(86.3mg,0.17mmol)于甲苯(8ml)中的溶液添加到cr(thf)3cl3溶液中。溶液颜色变成深紫色-黑色。在环境温度下搅拌反应混合物过夜。过滤反应混合物且在真空中去除溶剂,产生54.5mg蓝色固体。产率43.1%。元素分析:计算值:c,41.94;h,5.63。实验值:c,41.89;h,5.57。在-20℃下由二氯甲烷和氯仿的混合物使适于x射线衍射的紫色平板状晶体生长。因为元素分析确证本体组合物为单体物质,所以显而易见的是在结晶条件下形成二聚体结构。晶体结构在图7中给出。比较实例(cex)a-制备三氯[n,n-双(二苯基膦基)-n-异丙胺](四氢呋喃)铬,l404a向20ml小瓶中装入固体n,n-双(二苯基膦基)-异丙胺(如bollmann等人(“乙烯四聚:以格外较高选择率产生1-辛烯的新途径(ethylenetetramerization:anewroutetoproduce1-octeneinexceptionallyhighselectivities)”,bollmann,a.;blann,k.;dixon,j.t.;hess,f.m.;killian,e.;maumela,h.;mcguinness,d.s.;morgan,d.h.;neveling,a.;otto,s.;overett,m.;slawin,a.m.z.;wasserscheid,p.;kuhlmann,s.《美国化学学会杂志(j.am.chem.soc.)》2004,126,14712-14713)中所描述获得)(0.100g,0.234mmol)和固体三氯三(四氢呋喃)铬(2)(0.087g,0.213mmol)。将甲苯(8ml)添加到小瓶中且摇晃小瓶内含物。在5分钟内,含有大量未溶解的固体的溶液中产生深蓝色到黑色。充分摇晃小瓶内含物并使其静置过夜以产生几乎无未溶解的固体的溶液。使用针筒过滤器将溶液过滤到20ml小瓶中且使小瓶内含物静置过夜,在此期间形成若干极大晶体。通过单晶xrd分析从小瓶回收且干燥后的晶体。呈单甲苯溶剂合物形式的三氯[n,n-双(二苯基膦基)-n-异丙胺](四氢呋喃)铬的元素分析:计算值:c,60.85;h,5.78;n,1.87;实验值:c,60.28;h,5.69,n,1.62。晶体结构在图6中给出。比较实例(cex)b-制备三氯[n,n-双(1,3,2-二氧杂磷杂环戊烷)-n-异丙胺](四氢呋喃)铬,l430步骤1.制备n,n-双(1,3,2-二氧杂膦基)-n-异丙胺,l429将三乙胺(9.8ml,70.6mmol)添加到2-氯-1,3,2-二氧杂磷杂环戊烷(1.7ml,19.1mmol)于二氯甲烷中的溶液中。使反应混合物冷却到-28℃且在所述温度下静置一小时。添加异丙胺(0.7ml,8.6mmol)且使反应混合物升温到环境温度且搅拌过夜。观测到白色沉淀物。过滤反应混合物且在真空中浓缩滤液。使残余物溶解于少量己烷中。从己烷中沉淀出呈0.86g白色固体状的产物。产率42%。1hnmr(400mhz,cdcl3)δ4.16-4.04(m,4h),3.92-3.78(m,4h),3.50-3.33(m,1h),1.27(s,3h),1.25(s,3h).13cnmr(101mhz,cdcl3)δ64.30(m),45.88(s),44.97(t),25.58(t).31pnmr(162mhz,cdcl3)δ143.50。步骤2.制备三氯[n,n-双(1,3,2-二氧杂磷杂环戊烷)-n-异丙胺]-(四氢呋喃)铬,l430将n,n-双(1,3,2-二氧杂膦基)-n-异丙胺(100mg,0.42mmol)于甲苯(5ml)中的溶液添加到crcl3(thf)3(156.7mg,0.42mmol)于甲苯(5ml)中的紫色混合物中,得到蓝色溶液。在环境温度下搅拌反应混合物过夜。过滤反应混合物,产生97.5mg蓝色固体。产率49.7%。元素分析:计算值:c,28.2;h,4.73;n,2.99。实验值:c,29.15;h,5.18;n,3.20。比较实例(cex)c-制备三氯[n,n-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧基)-n-异丙胺](四氢呋喃)铬,l431步骤1.制备n,n-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧基)-n-异丙胺,l417将三乙胺(9.6ml,69.3mmol)添加到2-氯-5,5-二甲基-1,3,2-二氧磷杂环己烷(2.6ml,18.7mmol)于二氯甲烷中的溶液中。使反应混合物冷却到-28℃且在所述温度下静置一小时。添加异丙胺(0.7ml,8.6mmol)且使反应混合物升温到环境温度且搅拌过夜。观测到白色沉淀物。过滤反应混合物且在真空中浓缩滤液。使残余物溶解于少量己烷中。产物从己烷中沉淀出且滤出以产生1.2g(44%产率)白色固体。1hnmr(400mhz,cd2cl2)δ4.39-4.23(m,1h),3.85-3.66(m,8h),1.35(s,3h),1.33(s,3h),1.15(s,6h),0.81(s,6h).13cnmr(101mhz,cd2cl2)δ74.87(t),45.69(t),33.26(t),26.17(t),23.35(t),22.07(s).31pnmr(162mhz,cd2cl2)δ143.12。步骤2.制备三氯[n,n-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧基)-n-异丙胺]-(四氢呋喃)铬,l431将n,n-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧基)-n-异丙胺(100mg,0.31mmol)于甲苯(5ml)中的溶液添加到crcl3(thf)3(115.9mg,0.31mmol)于甲苯(5ml)中的紫色混合物中,得到蓝色溶液。在环境温度下搅拌反应混合物过夜。过滤反应混合物,产生57.3mg蓝色固体。产率33.5%。在环境温度下,通过蒸发产物的thf/己烷溶液,使适于x射线衍射分析的晶体生长。比较实例(cex)d-制备三氯[1,2-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧-2-基)苯](四氢呋喃)铬,l453步骤1.制备1,2-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧-2-基)苯使三乙胺(1.79ml,12.86mmol)和1,2-双(二氯磷烷基)苯(0.8ml,2.86mmol)于二氯甲烷(30ml)中的溶液冷却到-35℃,持续一小时。2,2-历经15分钟,将二甲基丙烷-1,3-二醇(0.56g,5.72mmol)缓慢添加到冷溶液中,使得形成白色沉淀物。在过滤之前搅拌所得浆料约24小时。在真空中浓缩滤液得到灰白色固体。由热己烷再结晶得到0.6g呈白色固体状的产物。产率61%。1hnmr(500mhz,cdcl3)δ7.60-7.56(brm,2h),7.45(t,2h),3.68-3.43(m,9h),1.29(s,6h),0.55(s,6h).13cnmr(101mhz,cdcl3)δ143.32(d,jc-p=14.51hz),142.79(d,jc-p=14.68hz),130.97,130.85,129.23,129.21,72.02,72.00,71.98,71.96,33.17,33.13,22.63,22.58.31pnmr(202mhz,cdcl3)δ147.53。步骤2.制备三氯[1,2-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧-2-基)苯](四氢呋喃)铬,l453将1,2-双(5,5-二甲基-1,3,2-二氧杂已内磷酰氧-2-基)苯(150mg,0.44mmol)于甲苯(5ml)中的溶液添加到crcl3(thf)3(164.2mg,0.44mmol)于甲苯(5ml)中的紫色混合物中,得到蓝色溶液。在环境温度下搅拌反应混合物过夜。过滤反应混合物且在真空中去除溶剂,产生164.8mg蓝色固体。产率70.1%。元素分析:计算值:c,41.94;h,5.63。实验值:c,41.89;h,5.57。乙烯低聚反应如下纯化乙烯低聚反应中所使用的溶剂和气体:使氮气和乙烯气体馈料和甲基环己烷溶剂传送通过含有活化a2氧化铝和q5反应物的纯化管柱。使氯苯和壬烷传送通过活化a-204氧化铝。将甲基环己烷、氯苯和壬烷储存在活化分子筛上。如上文所描述活化a2氧化铝、a204氧化铝和分子筛。mmao-3a获自阿克苏诺贝尔(akzonobel)。高通量实验信息热油压力反应器(hopr)用于进行使用某些上述制备的催化剂系统的一连串低聚实验,所述反应器为容纳于氮气填充手套箱中的高通量反应器,其中在装备有8ml玻璃插入件的不锈钢组块中的24个个别小室中的一些或全部中进行反应。hopr中的小室可加压到500磅/平方英寸(psi)(3.45兆帕(mpa));然而,所有小室共用共同的顶部空间且此设备无法监测个别反应的气体吸收分布。通过使用磁性搅拌棒实现有效混合。来自freeslate的librarystudio软件用于针对运行hopr中的24个实验的库进行设计。在运行库时,各玻璃插入件装备有搅拌棒,且随后称量玻璃插入件和搅拌棒组合以用作测定实验操作完成后残余固体重量的基础。插入件配置于24样品反应器平板(6×4)中且经由液体处理器添加预定量的甲基环己烷溶剂以使得添加所有其它组分后的最终体积将为4ml。液体处理器随后递送10wt%壬烷(gc内标物)于甲基环己烷中的溶液,各玻璃插入件总共50mg壬烷。随后经由埃彭道夫(eppendorf)移液管将催化剂系统的组分(包含所选活化剂溶液和所选预催化剂溶液)添加到玻璃插入件中以形成反应混合物。首先将活化剂(mmao-3a,呈甲基环己烷中的50mm溶液形式)添加到玻璃插入件中。随后将预催化剂添加到玻璃插入件中作为包含配位化合物和氯苯中的催化剂系统的铬源的预催化剂溶液。配位化合物和铬源选自上述工作实例的预先形成的配位化合物-铬络合物或上述工作实例的配位化合物以及所选铬源(在这些乙烯低聚实例中,crcl3(thf)3或三(2,4-戊二酮基-o,o')铬(cr(acac)3))。原位预催化剂溶液制备如下:在24样品板(3×8)中的8ml小瓶中,以1:1.2比率,将1mmcrcl3(thf)3或cr(acac)3的氯苯溶液与1mm所选配位化合物的氯苯溶液组合。在震荡器上混合样品30分钟,之后将其转移到hopr小室中的适当的玻璃插入件。通过在氯苯中混合如上述工作实例(例如ex1、cexa)中所示制备的预先形成的配位化合物-铬络合物来制备预先形成的配位化合物-铬络合物溶液以形成1mm溶液,之后将其转移到hopr小室中的适当的玻璃插入件。为便于比较,在各库中包括n,n-双(二苯基膦基)-n-异丙胺配位化合物100作为标准物。库之间的此标准物的一致活性和选择率允许横库比较催化结果。包含十二个个别实验的各库经设计以具有4ml全部溶液体积中存在的各高通量低聚结果表底部指定的铬量(除了一个库用5ml的全部溶液体积操作),其中各hopr操作中,各实验一式两份。在制备反应混合物后,将玻璃套管分布在hopr小室中的3×8构造中且密封反应器。用100psi(0.689兆帕(mpa))乙烯加压小室且加热到所需温度(45℃),如通过不锈钢组块中的五个热电偶所监测。在达到反应温度后,用乙烯将小室加压到500psi。在30分钟之后,通过停止乙烯馈料和冷却到室温终止反应。在室温下缓慢排放反应器以便限制低沸点分析物(例如1-己烯)损失。移出各小室的液体试样以便气相色谱(gc)分析,且在真空中在savantsc250exspeedvac浓缩器(赛默飞世尔)上去除存在的液体的其余部分。随后称量玻璃套管以测定存在的残余固体的量。存在的残余固体包含形成的任何聚合物和催化剂系统残余物。在下文低聚实例中使用的活化剂与配位化合物+铬源或活化剂与配位化合物-铬络合物比率下,超过95%的催化剂系统残余物由mmao-3a活化剂引起。因此,仅含有mmao-3a溶液的对照实验管的残余固体的重量减去低聚反应管中的总残余固体的重量以得到各低聚反应管中产生的聚合物量的良好近似值。在低聚结果表下方显示铬与活化剂(cr:mmao-3a)比率和铬负载量。高通量乙烯低聚实验的条件的概述在表1中给出。表1.高通量乙烯低聚实验的条件概述参数值铬源crcl3(thf)3铬源:配位化合物1:1.2乙烯压力500psi反应温度45℃反应时间30分钟溶剂甲基环己烷活化剂1000当量mmao-3a;来源:阿克苏诺贝尔gc内标物50mg壬烷活性和选择率计算包括所有主要反应产物:1-辛烯、1-己烯、聚合物、环状c6产物(甲基环戊烷和亚甲基环戊烷)和更高级c10-18烯烃低聚物。对环状产物(甲基环戊烷和亚甲基环戊烷)和更高级c10-18烯烃低聚物的量进行定量以获得完全质量平衡,然而,仅高通量乙烯低聚实验的主要相关产物(1-辛烯、1-己烯、聚合物以及针对一组结果,更高级c10-18烯烃低聚物)的活性和选择率概述在以下高通量低聚结果表(参见表4-9)中。此处给出的活性和选择率值为两个复本的平均值。分批反应器实验信息在装备有10ml催化剂发射槽和搅动器的300-ml帕尔分批反应器中进行乙烯低聚反应。通过电气电阻加热套加热反应器且通过内部冷却盘管冷却。反应器和温控系统都是通过camiletg自动化系统控制和监测。在氮气净化的手套箱中进行所有反应器操控和溶液制备。对于原位制备的预催化剂,以逐滴方式,将1.2当量所选配位化合物于甲基环己烷(2mm)中的溶液添加到1当量cr前体于氯苯(2mm)中的溶液中,且搅拌所得溶液30分钟。对于包含预先形成的配位化合物-铬络合物的预催化剂,在氯苯(2mm)中制备所选预先形成的配位化合物-铬络合物的溶液。在手套箱中将甲基环己烷(100ml)添加到反应器主体中,以及mmao-3a(1.77m于庚烷中)和壬烷,其充当gc分析的内标物。将预催化剂溶液装载到10ml催化剂发射槽中。用2.5ml甲基环己烷将用于处理预催化剂溶液的小瓶和针筒中的残余预催化剂溶液冲洗到发射槽中。密封反应器且从手套箱中移出。随后将反应器转移到具有加热套的反应器支柱,且将氮气和乙烯馈送管线、冷却管线、敲除罐和排气管线连接。打开搅动器。随后用氮气净化敲除罐五分钟,同时用氮气将反应器压力测试到750psi(5.17mpa)。在压力测试之后,使反应器缓慢排气到约10psi(68.9千帕(kpa)),且随后缓慢加热到70℃。在达到此温度后,通过布鲁克斯(brooks)热质量流量计添加乙烯达到所需反应压力。在反应器温度和压力稳定化后,用氮气使催化剂发射槽加压到超出反应器压力200psi(1.38mpa),且将预催化剂溶液注射到反应器中,开始反应。按需求通过布鲁克斯热质量流量控制器馈入乙烯且通过调节罩温度控制温度且流动通过内部冷却盘管。在30分钟反应时间之后,乙烯馈入停止且使反应器冷却到35℃,随后以每秒1-4psi(6.89-27.6kpa)的速率排气直到达到10psi为止。此时,反应器返回到打开的氮气填充手套箱。对反应器内含物进行取样以用于gc分析,随后排空到盘中。充分地清洁出反应器中残留的任何残余聚合物且添加到盘中的反应器内含物中。蒸发出溶剂本体且在真空烘箱中干燥残余固体。称量所得聚合物残余物以得到反应的聚合物产率。活性和选择率计算包括所有主要反应产物:1-辛烯、1-己烯、聚合物、环状c6产物(甲基环戊烷和亚甲基环戊烷)和更高级c10-18烯烃低聚物。对环状产物(甲基环戊烷和亚甲基环戊烷)和更高级c10-18烯烃低聚物的量进行定量以获得完全质量平衡,然而,仅分批反应器乙烯低聚实验的主要相关产物(1-辛烯、1-己烯和聚合物)的活性和选择率概述在以下分批反应器低聚结果表(参见表10-12)中。除非另外指示,否则给出的活性和选择率值获自单次操作(并非多次操作的平均值)。分析程序在安捷伦(agilent)7890gc系统上分析液体反应产物。安捷伦7890系统的gc条件在以下表2中列出。表2.gc条件高通量和分批反应器实验的gc分析的样品通过用25μl甲醇淬灭75μl反应混合物来制备。通过使用具有已知浓度的标准溶液进行校准,测定1-辛烯、1-己烯、甲基环戊烷和亚甲基环戊烷的响应因素。使用具有相同碳长度的封端烯烃(例如c10部分的1-癸烯)测定针对c10到c18部分所使用的响应因素。用作标准品的c10-c18烯烃的gc滞留时间在表3中给出。通过gc仪器,在g/(g壬烷)基础上报导反应产物的浓度,因为壬烷作为内标物以已知浓度包括于反应管中。相对于添加到反应混合物中的壬烷的量,计算所产生的各种反应产物的量。通过获得给定操作所选反应产物(例如1-辛烯、1-己烯、聚合物、环状物、c10-18低聚物,总计所有产物)的量(以克为单位)与给定操作中使用的铬的量(以克为单位)的比率且将所述比率除以给定操作的时间(以小时为单位),计算给定操作的活性(定义为获自给定操作的选择产物的量与给定操作中使用的铬的量除以给定操作的长度(以小时为单位)的比率)。通过获得所选反应产物(例如1-辛烯、1-己烯、聚合物、环状物、c10-18低聚物)的量(以克为单位)与给定操作的所有产物的总量(以克为单位)的比率,计算给定操作的选择率(定义为获自给定操作的所选产物的量与给定操作的所有产物的总量的比率)。关于活性和选择率的术语“所有产物”意指1-辛烯、1-己烯、聚合物、环状物和c10-18低聚物的总和。表3.c10-c18烯烃的滞留时间产物滞留时间(分钟)癸烯10.00-11.00十二碳烯11.30-11.80十四碳烯11.81-12.70十六碳烯13.00-13.50十八碳烯13.70-14.20表4.高通量低聚结果-原位催化剂形成**低聚条件:45℃;500psi乙烯;cr:mmao-3a=1:1000;运行时间=50分钟;铬源:crcl3(thf)3;铬装载水平:0.008μmol表5.高通量低聚结果-作为预催化剂的预先形成的络合物**低聚条件:45℃;500psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;实例100的铬源:crcl3(thf)3;铬装载水平:0.008μmol。表6.高通量低聚结果-作为预催化剂的预先形成的络合物**低聚条件:45℃;500psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;实例100的铬源:crcl3(thf)3;铬装载水平:0.05μmol表7.高通量低聚结果-作为预催化剂的预先形成的络合物**低聚条件:45℃;500psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;实例100的铬源:crcl3(thf)3;铬装载水平:0.1μmol表8.高通量低聚结果-比较实例**低聚条件:45℃;500psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;实例100的铬源:crcl3(thf)3;铬装载水平:0.1μmol;总体积5ml表9.高通量低聚结果-原位催化剂形成**低聚条件:45℃;500psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;铬源:crcl3(thf)3;铬装载水平:0.008μmol表10.分批反应器低聚结果**低聚条件:70℃;700psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;实例100和553的铬源:crcl3(thf)3**铬装载水平:0.05μmol铬装载水平:0.2μmol表11.cr(acac)3的分批反应器低聚结果**低聚条件:70℃;700psi乙烯;cr:mmao-3a=1:1000;运行时间=30分钟;铬源:cr(acac)3;催化剂装载量=0.2μmol**在给定条件下分批反应器中的三次操作的平均值在给定条件下分批反应器中的八次操作的平均值表12.不同铬浓度和cr:mmao比率的分批反应器低聚结果**低聚条件:70℃;700psi乙烯;运行时间=30分钟;铬源:cr(acac)3**cr:mmao-3a=1:1000cr:mmao-3a=1:500在给定条件下分批反应器中的两次操作的平均值‖在给定条件下分批反应器中的三次操作的平均值在给定条件下分批反应器中的七次操作的平均值当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1