气压驱动连续流动反应管、反应器、反应装置及其应用的制作方法
本发明涉及用于固相化学合成的反应仪器,特别涉及气压驱动连续流动反应管、反应器、反应装置及其应用,属于固相化学合成技术领域。
背景技术:
固相化学合成的基本方法是将反应物连接到带有活性基团的固相高聚物骨架上,通过流体相引入反应物与固相载体上的活性基团发生化学合成反应,杂质和副产物则留在流体相中经清洗而去除,最后采用适当的化学方法将目标合成产物裂解下来。由于固相合成的产物被固定在固相上,而杂质和副产物保留在液相中,容易进行分离,固相化学合成能够获得较高的产率和纯度。自美国科学家Merrifield创立(J.Am.Chem.Soc.,1963,85,2149-2154.)之后,固相化学合成已经得到了深入发展,Merrifield也因此获得诺贝尔化学奖。目前很多生物大分子,尤其是多肽和DNA等在生物学研究中具有重要意义的大分子,往往通过固相化学合成方法制备。
固相多肽合成是固相化学合成的一个重要应用方向。近年来,随着蛋白质组学等高通量研究方法的逐渐普及,对高通量合成多肽的需求也日趋增加。利用高通量方法可以合成大量多肽样品,进行定量蛋白质组学研究,也可以构建高容量肽库,通过与目标分子的相互作用,筛选获得多肽药物或疾病标记物等。然而,尽管固相多肽合成已经发展多年,商品化仪器也广泛应用,但这些设备一般基于低通量的大产量多肽合成,需要大量人工操作,不适应于蛋白质组学研究的需要。
CN201459000U公开了一种固相多肽合成装置,该装置能在低成本下实现半自动化,减少工作人员接触有毒溶剂的机率、简单重复工作的工作量,以及仪器及一些实验用品的应用,提高效率。然而,商品化玻璃砂芯管由于加工工艺的限制,体积较大,不适合用于毫克量级的多肽合成,并且由于多肽合成试剂腐蚀性较强,该装置中使用的三通阀、放空阀等需要使用玻璃材质制造,需要使用手工进行操作,无法做到完全自动化和高通量并行控制,并且不适用于高通量的微量或小量多肽的合成。
微量固相化学合成技术虽然已经有所报道(Science,2007,318,1888-1888.,Proteomics,2003,3,2135-2141.;发明专利申请:组装式化合物阵列芯片及制备方法,03112772.X),但是这些固相合成往往是静态反应,不能及时输送新鲜反应液,而且需要复杂昂贵的外部设备和特殊的反应试剂。因此,发展结构简单、易于高通量集成的微量固相化学合成仪具有十分诱人的前景。
微流控芯片(Sens.Actutors,B,1990,1,244-248.)是近年来发展迅速的科技领域之一,而构建化学微反应器是微流控芯片的重要应用方向之一(Tetrahedron,2005,61:2733-2742;Chem.Rev.,2007,107,2300-2318.)。采用微流控芯片技术构建固相化学合成微反应器,适合于微量化学分子合成,因此基于微流控芯片技术用于固相化学合成的反应器近年来也有报道(Lab Chip,2013,13:3347-3350;Lab Chip,2011,11:929-935)。但是,微流控芯片由于尺度太小,用于固相多肽合成时容易发生流道堵塞、后处理不便、附属装置复杂等问题,限制了此类装置进行高通量合成。同时,固相化学合成如固相多肽合成需要使用二甲基甲酰胺(DMF)、二氯甲烷(DCM)、三氟乙酸(TFA)等强有机溶剂和挥发性强酸,因此常规用于控制反应试剂的泵、阀等都难以直接运用。
由于工业中应用的多肽合成设备不适合于微量固相多肽合成,而微流控芯片等适合于微量多肽合成的方法不容易进行高通量自动化集成,因而以上两种途径均不能满足蛋白质学研究对多种类微量多肽的迫切需求。综上可知,本领域长期想开发一种反应仪,以期能够实现高通量自动化的微量或小量固相合成,但均未得到有效解决。
技术实现要素:
为解决上述技术问题,本发明的目的之一在于提供一种气压驱动连续流动反应管,该反应管能够实现气压驱动连续流动固相反应,藉此,能够开发出高通量自动化的微量或小量固相合成仪,解决本领域长期想解决但未能解决的技术问题。
本发明的另一目的在于提供包含前述反应管的反应器、反应装置及反应系统。
本发明的再一目的在于提供前述反应管、反应器、反应装置或反应系统的应用。
为实现上述目的,本发明提供一种气压驱动连续流动反应管,其中,该反应管两端开口,当垂直放置时,其顶端开口为入口(可装入固相载体、反应试剂及输入压力等),底端开口为出口(可为洗涤液、反应液等流出口),所述反应管内设置微孔薄膜作为截留膜,所述微孔薄膜的上方设有压环,其与管体间以过盈配合的方式将所述微孔薄膜固定。
应用前述反应管进行固相反应时,将固相载体与反应试剂从入口加入到反应管中,当反应试剂不受到外部气压驱动时,滞留在管中或缓慢流出,当反应试剂受到外部气压驱动时(例如采用塞子将反应管密封,然后使用带活塞的注射器向反应管内打气),反应试剂流经固相载体,实现连续流动的固相化学合成,可根据设定的压力大小和施压时间,按所需要的速率实现固相化学合成。
本发明以微孔薄膜作为截留膜,并以压环将其固定,封闭效果较好,液体不易从旁边缝隙中流过。而现有固相合成管使用玻璃砂芯作为截留板,其一方面需要专门定制;另一方面易碎不容易安放,需要采用热处理工艺实现其与玻璃反应管的粘合;再者,同等厚度时,玻璃砂芯存留反应试剂的效果弱于微孔薄膜(如硅胶等材质微孔薄膜)。以上原因使得玻璃砂芯固相合成管只能适用于结构尺寸较大的固相合成,不适合微量或小量固相合成,而本发明气压驱动连续流动反应管能适用于微量或小量固相合成,藉此,能够开发出高通量自动化的微量或小量固相合成仪。前述反应管能实现微量或小量固相化学合成,并易于扩展成相应的反应器、反应装置及系统,从而实现高通量自动化的固相化学合成。
作为本发明的具体实施方式,本发明所述反应管(例如在顶端外沿)设有挂载结构。例如所述挂载结构为挡板,利用该挡片能使反应管放置在有孔的支架或承载盘上,从而便于实现多反应管高通量集成。
本发明反应管中的微孔薄膜可商购获的,其层数的设置可根据实际情况而定,作为本发明的具体实施方式,本发明所述微孔薄膜的层数为4~12层,其孔径小于1微米。
作为本发明的具体实施方式,本发明所述微孔薄膜的材质选自硅胶或PTFE;
所述反应管的材质选自聚丙烯或FEP;
作为本发明的具体实施方式,所述压环的材质与所述反应管的材质相同。
作为本发明的具体实施方式,本发明所述反应管具有反应管主体及与其直接连通的锥形出口件,所述微孔薄膜位于反应管主体与锥形出口件的连通处附近;
优选地,所述反应管主体的内径逐渐减少,其上端内径为6~8mm,下端内径为4.5~5.5mm,所述反应管主体的长度为4~6mm。
进一步优选地,所述锥形出口件的长度为6~12mm,其出口内径为0.5~0.8mm。
当应用于具体类型及需求量的固相合成时,本发明可根据实际情况调整反应管主体的径高比,例如,对于微量或小量固相多肽合成而言,通常调整径高比使反应管所容纳的试剂可以进行0.1~10毫克范围的固相多肽合成,以满足微量或小量多肽合成的需求。
另一方面,本发明提供一种气压驱动连续流动反应器,所述反应器包含本发明前述气压驱动连续流动反应管及用于密封该反应管的密封件;
所述密封件为套层结构,最内层为通气管,通气管外面套轴向截面为倒T的弹性硅胶,所述弹性硅胶外面套轴向截面为倒T的不锈钢基体,所述不锈钢基体外面套弹簧,所述不锈钢基体靠近上端面附近设有凹槽以能通过卡簧将整个密封件固定,所述弹性硅胶下端面平整,该端面的直径大于所述反应管的顶端入口的外径,以使在压力的作用下可密封所述反应管。
本发明前述密封件用于密封所述反应管,其为有弹性、可通气的多层结构,密封件中的通气管可与气源连接,可以在密封反应管后对反应管施加气压,使管内液体流出。不锈钢基体结构下端面还可以衬托弹性硅胶,确保密封效果。鉴于采用本发明密封件能够更方便的将所述反应管密封,并能通过通气管向反应管内施于压力,因此,基于前述反应器更易扩展成相应的反应装置及系统,从而实现高通量自动化的微量或小量固相化学合成。
另一方面,本发明提供一种气压驱动连续流动反应装置,所述装置包括多套前述气压驱动连续流动反应器、可上下移动的机械、可水平移动的机械,气压驱动连续流动反应器中的密封件固定在所述可上下移动的机械上,气压驱动连续流动反应器中的反应管放置在所述可水平移动的机械上,通过该可上下移动的机械及该可水平移动的机械的移动能将所述反应管密封。
优选地,所述反应管垂直放置在所述可水平移动的机械上且其顶端开口朝上。
更优选地,所述反应管的中心线与所述密封件的轴心同轴。
一般而言,通过可水平移动的机械将所述反应管移动至所述密封件的下方,然后通过可上下移动的机械向下移动实现对反应管的密封,按相反的方式操作即可实现对反应管的解封。采用这种集成方式可使得反应管和反应管密封件既可以密封实现连续流动反应,又可以分离从而进行加样(如图3所示),根据固相合成所需的各个操作步骤,可以实现自动化的固相合成(如图4所示),由于所述装置可以装载在集成的传送带或圆盘上,易于通过自动传送结构转移所述装置实现合成步骤的自动切换,进而容易实现自动化、高通量的同时进行多个合成反应。
本发明所述“可上下移动的机械”或“可水平移动的机械”为现有技术中常用的机械结构,例如可上下移动的机械包括一可上下移动的固定件,该固定件可由电机带动使其上下移动,以实现所述密封件对所述反应管的密封或解封。“可水平移动的机械”同样为现有技术中常见的机械结构,例如可水平移动的机械包括支架或承载盘,该支架或承载盘可由电机带动使其水平移动。
另一方面,本发明还提供一种气压驱动连续流动反应系统,该反应系统包括前述气压驱动连续流动反应装置、气阀及正压气源,所述气阀能以气压脉冲方式控制所述反应管内的气压,所述正压气源出口与所述密封件中通气管通过管路连接,所述气阀设置在该管路中。
本发明所述正压气源可选自商用空气压缩机或氮气瓶。
本发明所述气阀可选用现有技术中能实现该功能的气阀,其中,控制方式也是现有技术,例如采用软件控制该气阀以能够以气压脉冲方式控制反应管内的气压,可根据实际需要进行选择,在此不另行赘述。
采用所述反应系统进行固相化学合成的方法是在所述反应管中装入固相载体和反应试剂,然后密封反应管,通过气压脉冲控制管体内气压,促使反应管中的试剂以连续流动方式不断通过固相载体,并在不同的反应步骤中实现不同的试剂流速,进行固相化学合成(如图4所示)。由于气压以脉冲方式提供,因此容易实现多个反应管的并行控制。方法为在单个时间点内快速为一个反应管供气,即给予一个气压脉冲,然后切换气路,为下一个反应管供气,直至为所有反应管供气。这种方式不会因个别反应管气密性不佳而影响其它反应管。通过控制气压、脉冲时间、脉冲间隔、脉冲次数,可以满足不同反应步骤的需求,使得反应试剂按预定的流速以连续流方式进行反应。由于利用气压脉冲方式可以通过快速切换对同时控制多个反应管,因此该系统更易实现高通量自动化的微量或小量固相合成。
再一方面,本发明提供前述的气压驱动连续流动反应管、前述的气压驱动连续流动反应器、前述的气压驱动连续流动反应装置、前述的气压驱动连续流动反应系统在固相合成中的应用。
优选地,所述固相合成为高通量微量或小量固相合成,进一步优选的,所述固相合成为高通量自动化的微量或小量固相合成。
优选地,所述固相合成为固相多肽合成。
本发明所述的高通量具有本领域熟知的定义,一般是指同时进行十条或以上固相合成(例如多肽固相合成)。
本发明所述的微量或小量合成具有本领域熟知的定义,一般是指合成的量(例如目标多肽的量)在0.1至10mg。通常而言,微量是指合成产量在0.1mg至1mg,而小量是指合成的量在1mg至10mg。
作为本发明的具体实施方式,所述应用包括如下步骤:
(1)在所述反应管中装入固相载体和反应试剂;
优选地,将所需反应试剂直接全部装载在所述反应管中;
(2)然后密封所述反应管;
(3)通过控制所述反应管内气压,促使所述反应试剂以连续流动方式通过所述固相载体,并在不同的反应程序中实现不同的试剂流速,进行固相合成。
当应用前述反应管进行所述固相反应时,在装入固相载体及反应试剂后,可采用塞子(该塞子可为现有技术中的塞子)对该反应管进行密封,然后向反应管中给予压力使所述反应试剂以连续流动方式通过所述固相载体。
当应用本发明所述的气压驱动连续流动反应器进行所述固相反应时,在装入固相载体及反应试剂后,通过所述密封件对所述反应管进行密封,然后向反应管中给予压力使所述反应试剂以连续流动方式通过所述固相载体。
当应用本发明所述气压驱动连续流动反应装置进行所述固相反应时,在装入固相载体及反应试剂后,通过所述可上下移动的机械及可水平移动的机械的移动实现所述密封件对所述反应管的密封,然后向反应管中给予压力使所述反应试剂以连续流动方式通过所述固相载体。
当应用本发明所述气压驱动连续流动反应系统进行所述固相反应时,在装入固相载体及反应试剂后,通过所述可上下移动的机械及可水平移动机械的移动实现所述密封件对所述反应管的密封,然后通过所述正压气源及所述气阀向反应管中给予压力使所述反应试剂以连续流动方式通过所述固相载体。
本发明的有益效果为:通过设计反应管结构和反应方式,能够在结构较为简单的反应管中实现加料、储液、连续流动反应,适合进行微量或小量等固相化学合成,例如微量或小量多肽合成,可合成的多肽量级在百微克至十毫克之间,能够满足大部分蛋白质组学等多肽研究的需求,较常规的大产量的多肽合成方法有成本优势。反应管制造不需要任何精密的微纳加工,可通过开模大规模制备,因此制作过程简单,成本低廉。本发明所述系统可采用气压脉冲控制,便于实现高通量集成,从而用于大批量生物活性物质的合成(例如多肽)。本发明所述反应管、反应器、反应装置及反应系统具备高通量自动化微量或小量合成能力,对于蛋白质组学研究、药物研发等领域有显著优势。当将本发明应用固相多肽合成时,本发明所提供的技术方案,可以快速、高效、低成本取得游离多肽,多肽产量可达到毫克水平,足够用于蛋白质学的主要实验,能很好解决蛋白质组学对于高通量合成多肽的主要问题,从而根本解决目前缺乏高通量、自动化合成毫克量级或微量级游离多肽的技术瓶颈。
附图说明
图1为本发明实施例1所述气压驱动连续流动反应管的结构示意图。
图2为本发明实施例1的密封件的结构示意图。
图3为本发明实施例1所述反应器的工作过程示意图。
图4为本发明实施例2的所述反应系统进行多肽合成的过程示意图。
图5为本发明实施例2合成的多肽产物的液相色谱分析结果图。
图6为本发明实施例2合成的多肽产物的质谱结果图。
图中的标号具有如有意义:
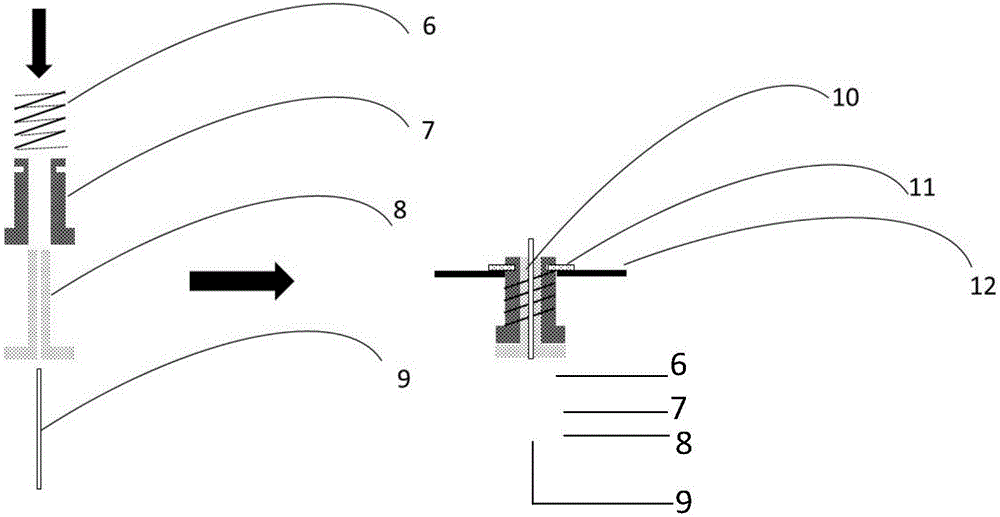
1:反应管基体;2:压环;3:微孔薄膜(多层);4:反应管基体轴向剖面图;5:反应管;6:弹簧;7:不锈钢基体;8:弹性硅胶;9:通气管;10:密封件;11:卡簧(固定反应管密封结构用);12:可上下移动的固定件(由电机控制可上下移动);13:试剂加样针;14:反应试剂;15:固相载体;16:反应系统工作流程示意图;17:加入清洗试剂并加压排空步骤;18:加入脱保护试剂并加压排空步骤;19:加入清洗试剂并加压排空步骤;20:加入偶联试剂并加压排空步骤。
具体实施方式
下面通过具体实施方式对本发明的气压驱动连续流动反应管、反应器、反应装置、反应系统及其在固相多肽合成中的应用进行详细描述。如无特殊说明,实施例中均为常规方法;所用的实验材料及部件,如无特殊说明,均为自常规生化试剂厂商或仪器商购买得到的。
实施例1
请参见图1右侧,于本实施例中,气压驱动连续流动反应管5两端开口,当垂直放置时,所述反应管5顶端开口为入口(可装入固相载体、反应试剂及输入压力等),底端开口为出口(可为洗涤液、反应液等流出口),所述反应管5内设置有4层的微孔薄膜3,所述微孔薄膜3的上方设有压环2,其与管体间以过盈配合的方式将所述微孔薄膜3固定;所述反应管顶端外沿设有多个挡片。利用挡片,反应管5可挂载在有孔的支架或承载盘上,本实施例支架或承载盘上开有多个挂载孔,可以同时挂载多只反应管5,以组装如下所述的多个反应器。
本实施例所述反应管5具有反应管主体(可以将固相载体和反应试剂装载在管内)及与其直接连通的锥形出口件,所述微孔薄膜3位于反应管主体与锥形出口件的连通处附近。
本实施例所述反应管主体的内径逐渐减少,其上端内径为8mm,下端内径为5.5mm,所述反应管主体的长度为5cm。
本实施例所述锥形出口件的长度为10mm,其出口内径为0.5mm。
本实施例所述微孔薄膜3的层数为4层,微孔滤膜孔径为0.5微米。
本实施例所述微孔薄膜3的材质选自硅胶;所述反应管5的材质选自聚丙烯;所述压环2的材质与所述反应管的材质相同。
本实施例所述反应管5经气压作用时,反应试剂以连续流动方式流经固相载体,参与合成反应;废液从底部出口排出。
本实施例反应管5可开模制造,然后填充微孔滤膜3,成为实际可用的反应管,请参见图1左侧及中间所示图,具体可为:
首先开模批量加工反应管基体1(反应管基体轴向剖面图4),然后利用打孔机制作或委托加工制作直径与反应管底部直径相当的圆形微孔薄膜3(微孔滤膜),将4层微孔薄膜3整齐填充至反应管底部,然后填入压环2并压紧,将4层微孔滤膜密实填充在反应管底部,确保微孔薄膜3的填充效果,最终得到完成装配的可实际使用的反应管5。
本实施例提供的气压驱动连续流动反应器包含前述的气压驱动连续流动反应管及用于密封该反应管的密封件;请参阅图2右侧,于本实施例中,所述密封件10为套层结构,最内层为通气管9,通气管外面套轴向截面为倒T的弹性硅胶8,所述弹性硅胶8外面套轴向截面为倒T的不锈钢基体7,所述不锈钢基体7外面套弹簧6,所述不锈钢基体7靠近上端面附近设有凹槽以能通过卡簧11将整个密封件固定,所述弹性硅胶8下端面平整,该端面的直径大于所述反应管5的顶端入口的外径,以使在压力的作用下可密封所述反应管5;
不锈钢基体7下端面可以衬托硅胶弹性结构,确保密封效果。
通过通气管9可以在密封反应管后对反应管5施加气压,使管内液体流出。
实际安装时,可以从最内层至最外层逐层安装,然后通过卡簧把整个密封结构固定。请参阅图2左侧,具体的密封件10的制作过程可为:
使弹簧6的内径与不锈钢基体7的外径匹配,不锈钢基体7的内径与弹性硅胶8的外径匹配,弹性硅胶8的内径与通气管9的外径匹配。四者按顺序进行套接,即可得到密封件10。密封结构10的单体下端面为硅胶材质,在受到压力作用时,能够紧密贴合反应管5,确保对反应管5的密封,同时可经过通气管9往反应管5中施加气压,促使反应管5中的试剂以连续流动方式参与反应并流出。
本实施例提供气压驱动连续流动反应装置包括前述的气压驱动连续流动反应器、可上下移动的固定件12、可水平移动的支架或承载盘,所述气压驱动连续流动反应器中的密封件10可固定在所述可上下移动的固定件上且通过该上下移动的固定件能将所述反应管5密封;所述气压驱动连续流动反应器中的反应管5可放置在所述可水平移动的支架或承载盘上。
本实施例中可水平移动的支架或承载盘为有孔的支架或承载盘上,反应管5可插入到该孔中。本实施例可上下移动的固定件由电机控制其上下移动。
请再参阅图2右侧,于本实施例中,密封件10通过卡簧11固定在可上下移动的固定件12上。所述反应管5放置在可水平方向移动的支架或承载盘上,为使上下移动的固定件12能将所述反应管5密封,本实施例确保反应管5顶部开口的中心与密封件10的轴心同轴。通过在可上下移动的固定件12上设置多个安装孔位,可以同时安装并控制多个密封件10,相应的,在有孔的支架或承载盘上放置多只所述反应管5,以实现对多只反应器同时控制。
当密封件10向上移动解除对反应管5的密封后,可以进行试剂加样,而密封件10向下移动对反应管5实施密封并施加气压后,可以实现连续流动反应。因而所述装置可以实现试剂加样、连续流动反应、排出反应废液的功能。本实施例在可水平移动的机械(支架)和可上下移动的机械上放置多个反应管5和密封件10,并分别确保反应管5与各自对应的密封件10同轴,实现了多个所述反应装置的高通量集成及对多个反应装置的并行控制。
本实施例还提供气压驱动连续流动反应系统,该反应系统包括前述气压驱动连续流动反应装置、气阀及正压气源,所述气阀能以气压脉冲方式控制所述反应管5内的气压,所述正压气源出口与所述密封件10中通气管9通过管路连接,所述气阀设置在该管路中。
请参阅图3,反应系统工作流程示意图16为:在反应管5中加入合成所需要的固相载体15,反应系统进入正常工作过程,首先水平移动支架或承载盘,使得密封件10不再位于反应管5上方,使用试剂加样针13(如三维机械臂的试剂加样针)从反应管5的上方加入所需数量的反应试剂14,完成加样过程;然后再次水平移动支架或承载盘,使得密封件10再次位于反应管5上方且密封件的轴心与反应管5的轴心同轴;接下来通过可上下移动的机械向下移动使密封件10与反应管5之间形成良好密封,打开气阀经密封件10中间的通气管9(本实施例利用软件控制该气阀以能够以气压脉冲方式控制反应管内的气压,这些气阀和软件均为现有技术,可根据实际需要进行选择,在此不另行赘述)向反应管5内提供气压,使得反应试剂14在气压的作用下以连续流动方式参与反应,并从反应管5底部流出,一定时间后,完全排空反应试剂14,反应管5中仅保留固相载体15。
实施例2
请参阅图4,于本实施例中,对如何利用实施例1提供的反应系统进行固相多肽合成作如下说明:
(a)反应管5中装载连接有C端第一个氨基酸的树脂(根据要合成的多肽序列,预先在树脂上连接多肽C端的氨基酸,如商品化WANG树脂),经溶胀后用于固相多肽合成;
(b)加入清洗试剂并加压排空步骤17:反应管5中直接装入清洗试剂,密封反应管5使用气压排空清洗试剂,实现清洗效果;
(c)加入脱保护试剂并加压排空步骤18:反应管5中直接装入脱保护试剂,密封反应管5在气压作用下实现连续流动反应,并最终排空脱保护试剂;
(d)加入清洗试剂并加压排空步骤19:反应管5中直接装入清洗试剂,密封反应管5使用气压排空清洗试剂,实现清洗效果;
(e)加入偶联试剂并加压排空步骤20:反应管5中直接装入偶联试剂,密封反应管5在气压作用下实现连续流动反应,从而连接上第二个氨基酸,并最终排空脱保护试剂;
(f)经过若干轮(b)~(e)步骤的循环,逐一连上各个所需的氨基酸,最终获得目标多肽;
(g)经后续的裂解步骤,获得游离的目标多肽。由于所述反应系统易于实现多个并行控制,在将多个所述反应系统进行集成后,还实现高通量的固相多肽合成。
基于上述步骤,本实施例准备合成的多肽序列为GKTVIEY。本例使用市售的Fmoc-Y修饰的固相肽合成载体作为固相载体。
具体合成步骤如下:
(i)装入合成载体:使用移液器从反应管5的顶部入口灌入分散于N’N-二甲基甲酰胺(DMF)中的Fmoc-Y修饰的固相肽合成载体(树脂)至反应管5中,固相肽合成载体干重约10mg。
(ii)试剂准备:将下一步偶联需要的氨基酸试剂(如第一轮偶联为Fmoc-E,第二轮偶联为Fmoc-I)等分别与苯并三氮唑-N,N,N’,N’-四甲基脲六氟磷酸盐(HBTU)混合,加入活化试剂(摩尔浓度为0.4mol/L的N-甲基吗啡啉的DMF溶液)配成氨基酸偶联试剂,配置质量百分含量为20%的六氢吡啶的DMF溶液为脱保护试剂,另外取DMF作为偶联后和脱保护后的清洗溶剂。
(iii)清洗:控制机械结构,使得密封件10对齐反应管5并下压密封反应管5,打开气压阀门,通过通气管9往反应管5中施加正压,促使反应管5中的DMF试剂全部流出,实现清洗效果。
(iv)脱保护:控制机械结构,使得反应管5上方为空,利用自动加样臂加入步骤(b)配置的脱保护试剂。然后控制机械结构,使得密封结构对齐反应管5并下压密封反应管5,利用软件控制气压阀门,以快速通断的方式提供气压脉冲,使得反应管中压力保持在适当范围,促使反应管5中脱保护试剂以连续流动方式缓慢流出,实现固相载体上Fmoc基团的脱保护,反应废液不断从反应管底部流出,并保证新鲜试剂与固相载体有效接触。
(v)脱保护后清洗:控制机械结构,使得反应管5上方为空,利用自动加样臂加入步骤(b)配置的清洗试剂。再控制机械结构,使得密封件5对齐反应管5并下压密封反应管5,打开气压阀门,通过通气管9往反应管5中施加正压,促使反应管5中的DMF试剂全部流出,实现清洗效果。
(vi)偶联:控制机械结构,使得反应管5上方为空,利用自动加样臂加入步骤(b)配置的偶联试剂。然后控制机械结构,使得密封件10对齐反应管5并下压密封反应管5,利用软件控制气压阀门,以快速通断的方式提供气压脉冲,使得反应管5中压力保持在适当范围,促使反应管5中偶联试剂以连续流动方式缓慢流出,在固相载体上连接新的氨基酸残基,反应废液不断从反应管底部流出,并保证新鲜试剂与固相载体有效接触。
(vii)控制机械结构,使得反应管5上方为空,利用自动加样臂加入步骤(b)配置的清洗试剂。
(viii)重复执行步骤(b)~步骤(g),每执行一轮即实现一轮多肽的延伸。直至所有氨基酸残基接至多肽上。
(ix)目标序列合成结束之后,继续执行一轮(b)~(e)步骤,将最后连接的氨基酸的FMOC保护基团脱去。
(x)裂解:从反应管5中取出已合成完毕的固相载体,置于裂解试剂(质量百分含量为97.5%的三氟乙酸(TFA)的水溶液)中裂解。经氮气吹干、无水乙醚沉淀等步骤后,得到游离的目标多肽。
(k)分析鉴定:使用高效液相色谱-质谱联用仪验证产物正确性,其结果如图5和图6所示。从图5中可以看出合成产物纯度很高,只有一个单独的主峰,从图6可以看出合成产物与目标多肽分子量一致,证明所合成产物确实是目标多肽。
利用本发明所提出的气压驱动连续流动反应管、反应器、反应装置及反应系统,可以进行固相多肽合成。基于实施例1所设计的具体合成系统,单轮固相多肽合成反应可在0.5-1小时内完成,实施例2的多肽可在3-6小时内完成,相比常规多肽合成数十小时的反应周期,反应效率大大提高。反应系统可采用气体脉冲驱动反应流体并控制流速,可以根据不同反应步骤的需要实现对各步骤的最优化控制。反应系统易于进行并行化操作,从而实现较高通量的自动化多肽合成。
本发明通过上述实施例来说明本发明的详细特征以及详细方法,但本发明并不局限于上述详细特征以及详细方法,即不意味着本发明必须依赖上述详细特征以及详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所提出的反应器结构进行等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!