用于选择性富集目标颗粒或细胞的流通池的制作方法
本发明涉及微流体领域。特别地,本发明涉及一种用于从流体选择性富集目标颗粒或细胞的新颖流通池。流通池展现出新颖的设计,其大大地改进目标颗粒或细胞产量。本发明还提供一种微流体装置,该微流体装置包括根据本发明的流通池。在另一方面,本发明涉及用于从流体样品分离目标颗粒或细胞的本发明的流通池或微流体装置的使用。最后,本发明涉及一种用于使用本发明的流通池来从流体选择性富集目标颗粒或细胞的方法。
背景技术:
在不同的实际领域中,可靠地检测液体中稀有细胞是重要的。例如,检测和量化饮用水中的致病细菌极度重要。另一示例是血中循环肿瘤细胞(ctc)的检测,其成为了监测和控制肿瘤疾病领域的重要工具。从原发肿瘤扩散且循环到血中的肿瘤细胞对罹患癌症(诸如乳腺癌)的患者构成高风险,因为这些细胞可形成转移瘤。因此,血中循环肿瘤细胞的检测对于确定癌症诊断后的预后、评估转移的风险以及治疗监测是重要的。
然而,因为血中这些细胞的浓度极其低使得细胞的初步富集或分离成为必要,检测ctc在技术上有挑战性。同时,建立了用于从血分离ctc的用于分离和富集的若干免疫细胞化学方法。例如,用相对于肿瘤特异性细胞表面抗原的抗体衍生的磁性颗粒用来从血样分离肿瘤细胞或肿瘤细胞群集。然而,所建立的系统选择性不足,且因此通常展现出非特异性细胞结合。此外,本领域中已知的系统是昂贵的,且它们的使用通常是耗时的。
除免疫细胞化学富集方法之外,所谓的微流体系统开发用于检测流体中的颗粒或细胞。这些系统包括具有微通道的玻璃或聚合物流通池,微通道蚀刻或模制到流通池材料中。引导包含受关注的颗粒或细胞的流体通过通道,且已由对颗粒或细胞展现出特异性的分子衍生的表面捕获。然而,已发现,当引导通过微流体流通池或装置时,细胞遵循流线,分子在整个流动通道中的扩散最小。所导致的缺乏混合减小细胞或颗粒与衍生捕获表面之间相互作用的次数,从而导致低捕获效率。因此,流体的层流单轴流的有效混合对于分离流通系统中的颗粒或细胞是必需的。混合提供颗粒或细胞与流通池表面之间的改进接触。
为了该目的,流通池中的微通道通常配备有干扰直流的屏障元件,从而产生流动翻转。例如,开发包括微柱的微流体系统,其引起层流的限定偏转。所谓的“ctc芯片”(nagrath等,2007年)使用约78000个微柱,该微柱干扰层流且同时相当大地扩展芯片的表面。ctc芯片的表面通过抗epcam抗体来化学功能化,以在与表面接触时捕获肿瘤细胞。该系统可以以1-2ml/h的最大流率操作,且达到60-65%的捕获效率。
同样,sheng等(2012年)使用微流控系统,其包括每个通道约59000个柱。代替上文提到的抗体,将固定化的肿瘤细胞特异性适体涂覆在微柱上,即与肿瘤细胞表面结构结合的单链dna寡核苷酸。在40μm高度的微通道中使用该系统,其中全血样品具有600nl/s的流率,实现了>95%的肿瘤细胞的捕获效率。在28分钟内处理1ml全血。在包括微柱的系统中,借助于光学检测系统对捕获的颗粒或细胞的后续检测是困难的,因为它为三维系统,且不存在相同焦点水平上的细胞。
除上文提到的微柱之外,还使用所谓的鱼骨结构,例如在“人字形芯片”中(stott等,2010年)。该芯片包括八个微通道,该微通道在它们的表面上包含鱼骨结构。通道的所有内壁涂覆有抗epcam抗体。根据作者的意思,鱼骨结构在层流中引起涡旋,这增加系统中细胞表面的相互作用。然而,在该小型化程度的微流体系统中,由于水性系统中的雷诺数低,不能发生涡旋,使得这些系统中的流实际上是层流。使用1.2ml/h的流率以该芯片实现对于肿瘤细胞系pc-3的91.8%±5.2%(n=6)的捕获效率。
另外,使用正弦形的微通道,其中细胞通过离心力输送到通道壁(adams等,2008年;kamande等,2013年)。这些壁的宽度取决于应用来变化,从而排除此类系统的标准化。warkiani等(2013年)使用梯形微通道,其中目标细胞流向通道的外壁。
用上文描述的流通池系统,可从全血样品选择性分离各种颗粒或细胞,例如血小板、巨噬细胞、循环肿瘤细胞、红细胞、白细胞等,且捕获在衍生表面上。然而,该系统的分离时间相对较长,且因此仅用于处理少量样品。另外,系统中没有一个能够有效地增加颗粒表面接触的次数。另外,集成在芯片或流通池表面上的屏障元件过度地阻碍自动光学检测和评估,或甚至使它们不可能。因此,需要可克服当前使用的系统的缺点的新的微流体系统。
技术实现要素:
本发明提供一种具有新颖架构的微流体流通池,其克服上文缺点且提供用于改进的颗粒或细胞产量。特别地,本发明涉及用于从流体选择性富集或分离目标颗粒或目标细胞的微流体流通池。流通池包括顶部和底部,顶部和底部可相互配合以形成至少一个曲折形流动通道,以用于引导流体通过流通池。优选地,例如通过蚀刻或切割将流动通道凹入流通池的顶部,其中在将流通池的两个部分彼此装配好之后,流通池底部部分的表面形成流动通道的底板。曲折形流动通道由从流通池的相反侧交替延伸的多个隔开的内壁部分限定。
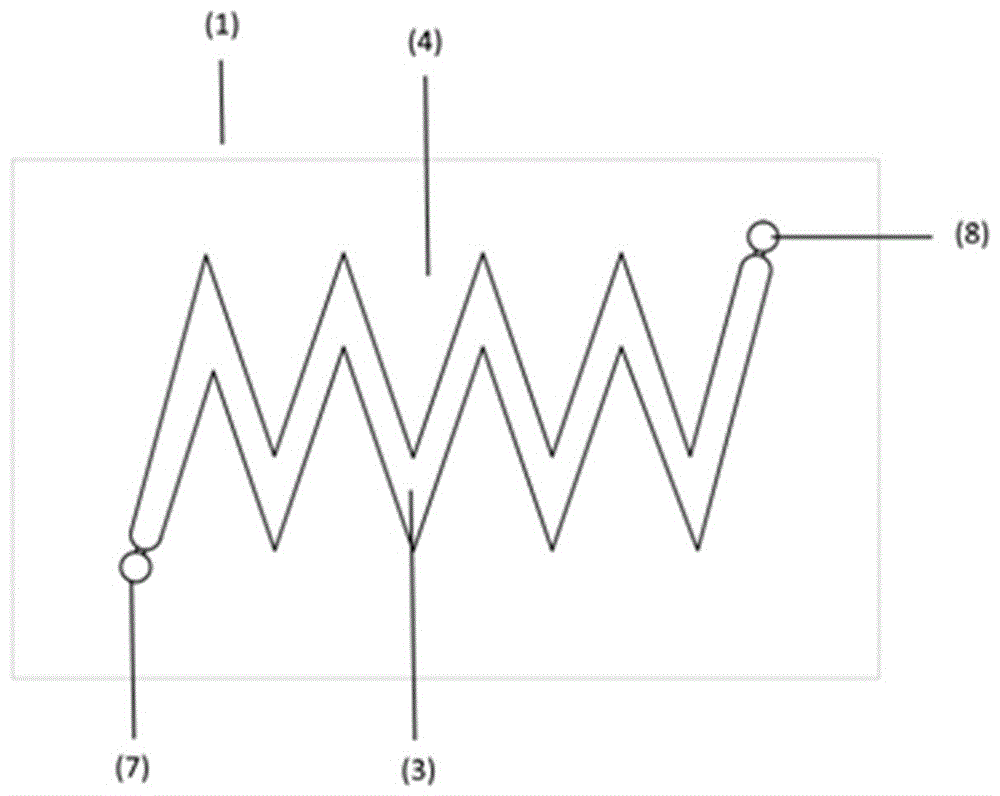
图2a、图2b和图2c中描绘流动通道的示例性实施例。在这些示意图中,示出流通池的顶部部分,其中流动通道凹入顶部部分。凹进流通池顶部部分的流动通道具有曲折形图案,这意指流动通道定形成使得流过通道的流体流沿着通道的空间延伸部分反转几次。优选地,流动通道是s形或正弦形的,以便一次或多次将流动方向改变基本180度,即,完全反转流动方向。结果,当流过通道的相邻区段时,引导通过通道的流体流改变其方向。更特别地,当流体流在从流通池的两侧延伸的内壁部分中的一个周围流动时,流体流改变其方向。图2a、图2b和图2中描绘流动通道的示例性实施例。在这些示意图中,示出流通池的顶部,其中流动通道凹入顶部。凹进流通池顶部部分的流动通道具有曲折形图案,这意指流动通道定形成使得流过通道的流体流沿着通道的空间延伸部分反转几次。优选地,流动通道是s形或正弦形的,以便一次或多次将流动方向改变基本180度,即,完全反转流动方向。结果,当流过通道的相邻区段时,引导通过通道的流体流改变其方向。更特别地,当流体流在从流通池的两侧延伸的内壁部分中的一个周围流动时,流体流改变其方向。
流动通道还包括至少一个表面,该表面涂覆有对目标颗粒或细胞具有亲和力的分子,例如针对目标细胞的表面结构的抗体或适体。优选地,涂覆形成流动通道的底板的流通池的底部部分。这具有特别的优点,即重力有助于将细胞和颗粒推向涂覆的捕获表面。然而,也可能多于一个内表面涂覆有亲和分子。
根据本发明,已发现可通过修改限定流通池内的流动通道的壁部分来增加目标细胞或颗粒富集的效率。特别地,提供屏障以重新引导流体流的至少一个且优选所有内壁部分包括至少一个开口,以允许流过流动通道的流体流的一部分穿过相应的壁部分,而流体流的其余部分在壁部分周围流动。这些开口优选具有凹部或狭缝的形式。更优选地,所有的壁部分包括至少一个此类开口。开口具有允许引导流体的部分通过流动通道穿过壁部分的尺寸。这意指当包含目标细胞或颗粒的流体与壁部分接触时该流体分成两个子流,使得生成第一流体流,该第一流体流通过壁部分的开口穿过壁部分,从而直接在沿着通道扩张部存在的压力梯度方向上流动。同时,生成第二流体流,该第二流体流由壁部分偏转,使得它重新定向以在所述壁部分周围流动。当两鼓流通过壁部分后再次合并时,生成螺旋对流,其将流体中存在的颗粒或细胞快速输送到涂覆的捕获表面。优选地,涂覆的捕获表面由流通池的底部部分形成。
本发明的流通池的顶部部分和/或底部部分可由玻璃、塑料、硅或诸如聚二甲基硅氧烷(pdms)的聚合材料组成。优选地,为流通池的顶部部分和/或底部部分选择的材料是半透明的且具有低的自发荧光,以便允许通过荧光显微镜来光学检测所捕获的细胞。在一个优选实施例中,顶部部分由那些材料中的一种制成。在另一优选实施例中,底部部分由那些材料中的一种制成。在又一优选实施例中,顶部部分和底部部分均由那些材料中的一种制成。最优选地,顶部部分和底部部分由相同的材料制成。在本发明的优选实施例中,顶部部分和/或底部部分由可通过注塑模制来处理的塑料组成。这允许流通池通过注塑模制来制造,这大大地降低生产流通池的成本。
微流体流通池包括至少一个流动通道,但它优选地包括多于一个流动通道。在优选实施例中,微流体流通池包括2-100个流动通道、2-50个流动通道或2-10个流动通道。通道优选地平行布置。还优选的是,所有通道在相同平面中。流通池通常将还包括至少一个入口和至少一个出口,其中流动通道位于入口与出口之间。每个流动通道与流通池的入口接触,因此流体可经由入口泵入流通池,进入与入口流体接触的流动通道,且可在其流过流动通道之后经由出口离开流通池。
根据本发明,流动通道中的至少一个,且优选地所有流动通道,提供用于引导通过流动通道的流体的多次重新定向。流动通道的方向由内壁部分限定,该内壁部分从流通池的相反侧交替延伸。可容易地产生这些交替延伸的内壁部分,例如通过将s形流动通道蚀刻或切割在合适材料(诸如pdms)的固体块中,然后形成流通池的顶部部分。
提供用于流动的重新定向的内壁部分可具有不同的几何形状,且在优选实施例中,这些壁部分是平面的条或突起。在单个流通池的顶部部分中交替延伸的壁部分的数量可在约10-1000范围,优选为约50-500,诸如约200-400。通过此类布置,被迫流过流动通道的流体流在延伸的壁部分周围流动,从而多次改变流动方向。优选地,流动的方向以至少约90度、约100度、约110度、约120度、约130度、约140度、约150度、约160度、约170度或约180度改变。该架构在流动通道内产生基本s形的流动模式,这意指流体呈基本正弦形或s形曲线的形式重复地流过流动通道。
流动通道优选地具有约0.4与约2.0mm之间、更优选为约0.6与约2.0mm之间,且还更优选为约0.9与约1.8mm之间的宽度。如本文中使用的,流动通道的宽度限定为流动通道的两个侧壁之间的空间。此外,通道的高度在约10与约400μm之间,诸如在约100与约200μm之间。如本文中使用的,流道的高度定义为由顶部部分形成的上通道壁与由流动通道的底部部分形成的下通道壁之间的空间。延伸壁部分可具有约0.1mm与约1.0mm之间、更优选为约0.6mm与约0.8mm之间,且还更优选为约0.3mm与约0.6mm之间的宽度。在本发明的特别优选的实施例中,流通池包括10-50个流动通道,其中的每个具有约100与约200μm之间的宽度、约100与约200μm之间的高度,且各自包括延伸的壁部分,其中宽度在0.6与0.8mm之间。
如上文提到的,壁部分包括开口,该开口允许流体的部分通过壁部分而不在它们周围流动。优选地,开口是在壁部分中形成的狭缝或凹部。狭缝或凹部可位于壁部分中任何地方,但优选地它位于捕获表面附近,例如在壁部分的与流通池的底部部分相邻的部分中。在优选实施例中,凹部是壁部分的下边沿与流通池的底部部分之间的间隙,即壁部分不与流通池的底部部分接触,而改为具有凹部,该凹部在壁部分的一部分或整个宽度上延伸。
在流动通道具有小于1.3mm宽度的情况下,狭缝或凹部可具有约10-100μm、优选为约20-60μm、更优选为约20-40μm的宽度。在流动通道具有大于1.3mm宽度的情况下,狭缝或凹部可具有约10-100μm、优选为约20-70μm、更优选为约20-50μm的宽度。
关于微流体流通池的整体尺寸,它通常将具有≤2cm的宽度,诸如约0.5cm、约1.0cm或约1.5cm。优选地,本发明的微流体流通池具有约0.5与2.0cm之间、更优选地1.5与2.0cm之间的宽度。微流体流通池通常将具有≤5cm长的长度,诸如约1.0cm、约2.0cm、约3.0cm、约4.0cm或约5.0cm。优选地,本发明的微流体流通池具有约1.0与5.0cm之间、更优选地2.0与4.0cm之间的长度。
至少一个流动通道包括至少一个表面,该表面具有涂层,该涂层对于待富集的颗粒或细胞具有特异性亲和力。该表面在本文中称为“捕获表面”,优选地在微流体流通池的底部处,使得重力可使待富集或分离的颗粒或细胞朝捕获表面引导。然而,它也可位于通道的侧壁处。备选地,还可能的是,一个或多个通道的所有壁涂覆有亲和涂层。涂层包括至少一种类型的亲和分子,其适于选择性结合到目标颗粒或细胞上的预定结构。
根据特别优选的方面,包括亲和分子的捕获表面涂覆有天然或合成的亲水性聚合物层。优选地,亲水聚合物在高度水合的支承材料上形成三维结构。因此,此类聚合物网络通常称为“水凝胶”。水凝胶可包含最多达99%或更多的水,而聚合物含量可为1%或还更少。用于制备用于本发明中的水凝胶的方法在例如wo02/10759中描述。以其整体结合于本文中的该国际申请描述粘附介体层的使用,该粘附介体层提供水凝胶聚合物与支承材料的偶联。wo02/10759中提供的水凝胶涂层特别优选地用于本发明的方法中。
各种亲水聚合物可用于水凝胶涂层。例如,涂层可包括多糖、多元醇、聚醚、聚酰胺、聚羧酸、聚硫酸盐、聚磺酸盐、聚磷酸盐、聚膦酸盐和/或它们的组合或官能化衍生物或由其组成。此类官能化包括例如异硫氰酸酯、异氰酸酯、羧酸叠氮化物、n-羟基琥珀酰亚胺、磺基-n-羟基琥珀酰亚胺、n-酰基咪唑、磺酰氯衍生物、醛、酮、乙二醛、环氧乙烷、碳酸盐、芳基卤化物、酰亚胺酯、酸酐、卤代烷基、卤代酰基、马来酰亚胺、氮丙啶、丙烯酰基、硫氢基、二硫化物、重氮烷烃、重氮乙酰基、咪唑基氨基甲酸酯、酰肼、重氮化合物、酰基叠氮、二苯甲酮、重氮基丙酮酸酯或双吖丙啶。另一优选的官能化涉及次氮基三乙酸(nta)衍生物,使得可借助于金属螯合物固定配体或抗体。链霉亲和素和/或生物素衍生物也适于官能化。根据优选的实施例,水凝胶涂层包括多羧酸盐聚合物或由多羧酸盐聚合物组成。根据另一优选的实施例,水凝胶涂层具有轻微的负电荷,例如通过电动电势测定法测量的。
水凝胶涂层可具有允许在水凝胶表面上捕获目标颗粒或细胞的任何厚度。优选地,水凝胶涂层具有约100nm与约5000nm之间、优选为约500nm与约3000nm之间的厚度,例如约600nm、约700nm、约800nm、约900nm、约1000nm、约1100nm、约1200nm、约1300nm、约1400nm、约1500nm、约1600nm、约1700nm、约1800nm或约1900nm。涂层的厚度可通过现有技术中可用的常规方法来确定,例如通过原子力显微镜或椭圆偏振法。
涂层优选提供三维表面结构,其中亲水性聚合物的链与基底表面至少部分地竖直对准,即刷状。由于与平面结构相比它们的表面增加,所以此类刷状水凝胶表面示出对生物分子(诸如能够结合目标颗粒或细胞的抗体和其它亲和分子)的固定化能力的特别增强。已发现,刷状结构的水凝胶涂层,特别是包括某些聚羧酸盐聚合物或由其组成的那些,提供用于将细胞选择性附接到固体支承件的优异表面,以用于随后的检测和/或量化。用于本发明中的优选水凝胶表面可用作例如来自德国杜塞尔多夫的xantecbioanalyticsgmbh的hc或hcx涂覆的片。
根据本发明,捕获表面包括一种或多种不同类型的亲和分子,其选择性结合到样品中的目标细胞,从而允许目标颗粒或细胞与流体中存在的任何其它颗粒或细胞分离。“亲和分子”广泛地理解为与颗粒或细胞的预定结构结合的分子,优选地与细胞表面上存在的蛋白质或糖结构结合的分子。亲和分子优选是蛋白质分子,诸如受体、凝集素、配体、抗体、抗体片段、核酸(诸如适体)、糖结构或其组合。在特别优选的方面,亲和分子是抗体,诸如对于癌症抗原的抗体。
当期望分离细胞时,特别优选的是使用抗体分子或抗体的抗原结合片段。因此,在优选实施例中,本发明的微流体流通池的捕获表面上的涂层包括抗体,优选为与肿瘤细胞特异性结合的抗体。在本发明的上下文中,用语“抗体”包括单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)、抗独特型抗体、嵌合抗体和人源化抗体,只要它们展现出所期望的免疫活性,即与目标细胞特异性结合。特别地,该用语理解为包括通过移植技术等制备的任何种类的人工抗体分子。用于本方法中的抗体可为任何同种型,诸如igg、igm、iga、ige和igd以及它们的亚类,例如igg1、igg2等。
除完整抗体之外,本发明还涉及特异性结合目标细胞的抗体的抗原结合片段。如本文中使用的,抗体的抗原结合片段是此类片段,其保留整个抗体分子对目标细胞(例如扩散的肿瘤细胞)的特定抗原结构的特异性结合活性的至少一部分。本发明的抗原结合片段可包括fv、fab、f(ab')和f(ab')2片段。用语“抗原结合片段”还包括单链fv抗体片段和二硫键连接的fv片段(dsfv)。用于重组生产抗体片段的方法在现有技术中描述,且例如包括诸如噬菌体显示或核糖体显示的技术。可纯化和测试通过这些方法产生的重组抗体片段,以与目标细胞(例如肿瘤细胞)的结合亲和力和特异性。
特异性亲和分子与捕获表面的固定可以不同的方式完成。在其中捕获表面是固体支承件(诸如载玻片)的情况下,可使用玻璃表面的氨基硅烷化。在捕获表面包括水凝胶的情况下,可使用亲和分子经由氨基或羟基官能团与通过n-羟基琥珀酰亚胺(nhs)预活化的水凝胶共价偶联。由于固定的亲和分子与水凝胶涂层共价结合而不是吸附,因此固定过程同样适用于所有种类的亲和分子,例如抗体、蛋白质、肽、带有低分子量的化合物、核酸等,只要这些亲和分子带有合适的反应性基团,诸如氨基、二硫键或醛基。对于备选的偶联策略,链霉亲和素、蛋白a、二硫键或酰肼官能化的涂层同样可用于现有技术中。包含亲和分子的缓冲剂可应用于整个捕获表面,或可点样到所述表面的限定区域上。容易可能的是,在一个基底上组合不同的亲和分子。在优选实施例中,水凝胶涂覆的捕获表面包括具有不同结合特异性的2个或更多个亲和分子,诸如2、3、4或5种不同的抗体。
当然,本发明的捕获表面还可包括不同类型的亲和分子,诸如针对相同目标细胞的相同或不同抗原结构的不同抗体或抗体片段。备选地,在相同过程内期望同时富集不同类型目标细胞的情况下,捕获表面还可包括针对不同目标细胞的不同抗体或抗体片段。优选地,本发明的捕获表面上的亲和分子的总密度在约0.1至约100ng/mm2的范围内,例如,约0.5ng/mm2、约1ng/mm2、约5ng/mm2、约8ng/mm2、约10ng/mm2、约15ng/mm2、约20ng/mm2、约30ng/mm2、约40ng/mm2、约50ng/mm2、约60ng/mm2、约70ng/mm2、约80ng/mm2、约90ng/mm2、约100ng/mm2或还更高的密度。特别优选的是,上文密度是指抗体或抗体片段的亲和分子。还优选的是,固定在捕获表面上的亲和分子的结合能力基本不由偶联过程所影响。在固定到捕获表面上之后,亲和分子,例如抗体或抗体片段,保留它们对目标分子的原始结合能力的大于50%,优选地大于60%、大于70%、大于80%、大于90%,且更优选地大于95%,即在不固定的情况下对于目标的结合能力。
基于它们展现出与目标细胞(例如肿瘤细胞)的选择性结合的能力来选择本发明的亲和分子,例如抗体或从其衍生的抗原结合片段。如本文中使用的,选择性结合意指亲和分子与目标细胞的结合相对于与样品中非目标细胞的结合强至少约4倍,通常强大于约5倍,强大于约6倍,强大于约8倍,强大于约10倍,强大于约15倍,强大于约20倍,强大于约50倍,或甚至强大于约100倍,例如,这通过亲和分子/靶配体对的kd值反映。例如,当在本发明的方法中使用全血样品时,亲和分子不应展现出与滤液中存在的白细胞的任何实质性结合。
在另一方面,捕获表面上的亲和分子可为受体、凝集素、配体或其功能部分。另外,可使用对目标细胞的结构具有低亲和力的亲和分子。虽然仅一种相互作用对于分离过程大体上将不是足够稳定的,分布在一个细胞与捕获表面的接触区域上的若干弱相互作用的协同作用导致足够强且特异性的相互作用。与现有技术的基于纳米粒子的技术相比,这是显著的优点,因为那些粒子的相对较小的表面积太小以至于不能允许此类协同机制。
在优选实施例中,待富集和/或分离的目标细胞是扩散的肿瘤细胞,其经由具有对于这些肿瘤细胞的细胞表面标记的特异性结合亲和力的抗体或其片段结合到通道中的捕获表面,例如水凝胶涂覆的表面。扩散的肿瘤细胞的合适表面标记是本领域众所周知的,且包括表皮生长因子受体(egfr)、上皮细胞粘附分子(epcam或cd326)、胰岛素生长因子-1受体(igf-1r)、表皮生长因子受体2(her2)、细胞角蛋白19(ck19)、细胞角蛋白20(ck20)、粘蛋白1(muc1)、粘蛋白2(muc2)、人类上皮膜抗原(ema)、上皮抗原(ber-ep4)和/或叶酸受体α(fralpha)。另外的标记在文献中广泛论述,例如,见pantel等(2008年),naturereviews,8,1-12;pantel等(2009年),natrevclinoncol.,6(6):339-51。
因此,用于在微流体流通池的涂层中作为亲和分子的抗体可包括:抗epcam抗体,诸如抗体克隆323a3(可从美国西雅图的kamiyabiomedicalcompany获得),抗体克隆mk-1-25(可用德国黑尔福德的acris获得),抗体克隆aua1(可从美国利特尔顿的novusbiologicals获得),抗体克隆158206(可从德国威斯巴登的r'n'dsystemsgmbh获得),抗体克隆528(可从德国海德堡的santacruzbiotechnologyinc.获得),抗igf-1r抗体,诸如cp-751,871(可从德国柏林的pfizerpharmaag获得),抗cd19抗体,诸如可从德国海德堡的santacruzbiotechnologyinc.获得的那些,称为目录号sc-70563、sc-18895、sc-70560、sc-70559、sc-70561、sc-21714、sc-65295、sc-52311、sc-69736、sc-65255、sc-8498、sc-52378、sc-20922、sc-18884、sc-18894、sc-19650、sc-51529、sc-8500-r、sc-13507、sc-53191、sc-8499、sc-18896和sc-69735;抗muc1抗体,诸如可从德国海德堡的santacruzbiotechnologyinc.获得的那些,称为目录号sc-71611、sc-71610、sc-71612、sc-71613、sc-59931、sc-71614、sc-59794、sc-59795、sc-59796、sc-59797、sc-52347、sc-6827、sc-53376、sc-59798、sc-52085、sc-59799、sc-53377、sc-6826、sc-59793、sc-59800、sc-15333、sc-25274、sc-53379、sc-52086、sc-52087、sc-52088、sc-52089、sc-52090、sc-52091、sc-52092、sc-52093、sc-6825、sc-53380、sc-73595、sc-53381、sc-56441、sc-65589、sc-65220、sc-69644、sc-73606、sc-80889、sc-73605、sc-7313和sc-52094;抗muc2抗体,诸如可从德国海德堡的santacruzbiotechnologyinc.获得的那些,称为目录号为sc-59859、sc-7314、sc-15334、sc-23170、sc-23171和sc-13312;抗ck19抗体,诸如可从德国海德堡的santacruzbiotechnologyinc.获得的那些,称为目录号sc-53258、sc-53257、sc-33110、sc-33120、sc-25724、sc-33111、sc-33119、sc-53003和sc-56371;抗ck20抗体,诸如可从德国海德堡的santacruzbiotechnologyinc.获得的那些,称为目录号为sc-25725、sc-17112、sc-52320、sc-70918、sc-56522、sc-56372和sc-58730;抗上皮膜抗原抗体,诸如德国汉堡的dakodeutschlandgmbh的克隆e29;抗上皮抗原抗体,诸如德国汉堡的dakodeutschlandgmbh的克隆ber-ep4;抗egfr抗体,诸如可从德国海德堡的santacruzbiotechnologyinc.获得的sc-120。例如,其它合适的抗体是来自德国柏林的novocastradeutschland的抗体vu-1d9;来自德国海德堡的progenbiotechnikgmbh的抗体ks5+8.22/c22;来自德国慕尼黑的micromet的抗体a45-bb3-cy3;来自德国罗拉赫的enzolifesciencesgmbh的抗体mov18/zel。本发明还设想到使用上文抗体中任一种的抗原结合片段。
包括待分离的颗粒或细胞的流体优选为液体,但它也可为气体。优选地,流体是来自个体的体液或组织提取物。优选地,样品来源的个体是脊椎动物,且更优选地,哺乳动物。在特别优选的实施例中,样品源自人类。流体通常将是细胞悬液。样品可包括血(例如全血)或血成分、尿液、胸腔积液、腹水、支气管肺泡灌洗液、女性乳腺的乳头抽吸物或骨髓,或由其组成。在优选的方面,包括目标细胞的样品是血或骨髓样品,例如分别来自包括血或骨髓或主要由血或骨髓组成的人类个体的样品。可通过现有技术中已知的任何合适的方法来获取样品。例如,如果样品是人类血样,可通过静脉穿刺获取。用于获得骨髓(例如人类骨髓)的方法在本领域中也是众所周知的。例如,可从髂骨的顶部或胸骨中获取获与血混合的红色骨髓,其介入大体上通过微创手术来执行。备选地,生物学样品可为腹水,即腹膜腔积液、胸腔积液、来自女性乳头的抽吸物、尿液和其它体液。
在另一优选实施例中,流体是为其确定微生物负荷的液体。例如,液体可为需要无菌的液体食品或液体药物产品,例如因为其配制成用于静脉内给药。在此类实施例中,流通池可用于确定液体中包括多少细菌细胞。因此,流通池可用于食品或药品的质量控制。
当在根据本发明的方法中使用的样品具有特别高的粘度时,可期望在将样品施加到过滤元件之前或同时将其稀释。为了该目的,可使用任何生理上可接受的缓冲剂,其不干扰目标细胞随后与亲和分离表面的结合。用于稀释样品的合适的缓冲剂是在生理ph范围内缓冲的等渗缓冲剂,例如磷酸盐缓冲盐水(pbs)、hank氏平衡盐溶液、tris缓冲盐水、hepes缓冲盐水、mes缓冲剂等。生理缓冲剂的ph优选地在约ph6.0至约9.0的范围内,更优选地在约ph6.5至约8.0之间,且最优选地在约ph7.0至约7.5之间,例如7.4。
在更进一步的方面,本发明涉及一种微流体装置,包括
(a)如上文描述的微流体流通池,以及
(b)至少一个泵,该至少一个泵用于引导流体通过微流体流通池。
微流体装置包括如在上文别处所描述的微流体流通池,以及(另外)用于引导流体通过微流体流通池的通道的至少一个泵。在一些情况下,可能优选具有连接到微流体装置的多个泵,例如,控制流体流动的一个泵,以及用于使洗涤缓冲剂流过流通池的另一泵。
本发明进一步涉及用于从流体样品分离目标颗粒或细胞的如本文中描述的微流体流通池或微流体装置的使用。如上文描述的,样品可为体液样品,诸如血样。本文中优选使用本发明的微流体流通池或装置从流体样品分离肿瘤细胞。本发明进一步涉及用于通过增加所述目标颗粒或细胞与包括亲和分子的表面之间的接触来改进从流体样品分离的目标颗粒或细胞产量的如本文中描述的微流体流通池或微流体装置的使用。
在又一方面,本发明提供一种从流体选择性富集目标颗粒或细胞的方法,包括
(a)通过如本文中别处所描述的微流体流通池引导流体样品,以及
(b)随后从涂覆表面分离目标颗粒或细胞。
本发明的方法包括两个连续的步骤。在第一步骤中,引导流体样品通过微流体流通池。通常,流通池先前已用缓冲剂洗涤。优选地,样品是包含或被认为包含肿瘤细胞的血样。使用0.1与5ml/h之间、优选为1.0与5.0ml/h之间的流率。目标颗粒或细胞将与通道中涂覆的捕获表面相互作用且粘附在表面上。一旦引导流体样品通过流通池,可通过用洗涤缓冲剂冲洗流通池来洗涤流通池表面。洗涤步骤去除与捕获表面非特异性结合的任何材料。随后,可通过从捕获表面小心去除细胞来获得细胞。例如,可通过将细胞从其结合的表面上小心地刮除来去除。备选地,可通过膜片钳等将单个细胞去除。
在又一方面,本发明涉及一种用于改进从流体样品分离的目标颗粒或细胞产量的方法,所述方法包括
(a)引导流体样品通过本文中别处所描述的微流体流通池,以及
(b)随后从涂覆表面分离目标颗粒或细胞。
图4中示出用于执行上文方法的示例性微流体装置。该装置包括本发明的微流体流通池,该微流体流通池经由其入口和其出口连接到管,该管继而连接到泵,该泵将包括待分离或富集的颗粒或细胞的流体从罐引导到流通池。图4中的装置还包括用于从液体去除蛋白质的柱,否则其可干扰肿瘤细胞与涂覆在流通池中捕获表面上的抗体的结合。
在待分析的流体样品是血样的情况下,优选的是,从样品去除红血细胞和/或血小板,否则其可干扰目标细胞与捕获表面的结合。为了该目的,样品可通过具有其中尺寸在0.5与5μm之间的孔隙、孔或孔口的过滤元件过滤。红血细胞(红细胞)是平均直径为5-8μm的无核血细胞,其负责血中的氧气传输。已发现,由于这些细胞的高可变形性,孔隙尺寸低至0.5μm的过滤元件可有效地用于去除这些细胞的绝大多数。红血细胞具有扁平的形状,且可形成管状结构,该管状结构能够通过具有显著地小于其松弛扁平状态下的红血细胞的平均直径的尺寸的孔口。
类似地,血小板是没有核的细胞,其通常具有1-2μm之间的平均直径和某一程度的可变形性,这意指它们也能够通过具有上文提到的孔隙尺寸的过滤元件的孔隙。相反,有核细胞(诸如白细胞或肿瘤细胞)大体上大于5μm且具有有限的变形能力。那些细胞将由过滤元件保留。过滤步骤去除样品中存在的红血细胞的相当大的部分。优选地,过滤过程去除样品中存在的红细胞的约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%或甚至最多达约96%、约97%、约98%、约99%或更多。过滤步骤同样适于去除样品中存在的血小板的相当大的部分。优选地,过滤过程去除样品中存在的血小板的约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%或甚至最多达约96%、约有97%、约98%、约99%或更多。有核细胞(诸如白细胞或肿瘤细胞)由过滤元件保留,使得过滤分别可用来相对于红血细胞或血小板富集这些细胞的部分。过滤元件的孔隙尺寸在0.5与5μm之间,例如0.5、1、2、3、4或5μm。优选地,过滤元件的孔隙尺寸在1与3μm之间。在该方面,特定孔隙的尺寸在本文中理解为横跨该孔隙的最小直径。换句话说,如本文中使用的孔隙尺寸与仍能够通过孔隙的最大球形体的直径相同。
过滤元件可包括织造或非织造织物或由其组成。由允许细胞分离的无纺布制成的过滤元件在本领域中是众所周知的,且它们可由各种材料组成,诸如纤维素或纤维素衍生物,包括醋酸纤维素、硝酸纤维素、羟丙基纤维素(hpc)、羟乙基纤维素(hec)、羟丁基甲基纤维素、羟丙基甲基纤维素。非织造过滤器的其它常用材料包括聚碳酸酯、羟乙基淀粉、聚砜、聚醚砜、聚酰胺、聚醚酮、聚醚酰亚胺、聚亚芳基、聚苯醚、聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)等,以及玻璃。非织造过滤材料可通过各种已知方法来制造,例如熔喷、纺粘、气流成网、湿法成型和粘合梳理网方法。合适的非织造过滤器也可从若干不同的供应商处获得,例如,从carlroth(德国卡尔斯鲁厄)、schleicher&schuell(德国达塞尔)和satorius(德国哥廷根)。备选地,过滤元件可为织造织物,即已通过编织工艺来制备的材料。用于本方法中的织造织物可包括聚酰胺、芳族聚酰胺、聚乙烯、聚丙烯、聚酯、聚碳氟化合物、聚丙烯腈、聚氨酯、聚丙烯酸酯、尼龙、聚苯硫醚、聚四氟乙烯、聚苯并咪唑等,或由其组成。合适的织造过滤器可从不同的供应商处购买。
仅通过在过滤元件的两侧之间提供压力差就可通过过滤元件过滤样品或稀释的样品,其中在提供样品的一侧和形成滞留物的一侧的压力更高。例如,此类压力差可有利地通过适当地使用重力或静水压力上的差异来产生。取决于选择成用于过滤的特定设置,且取决于过滤元件的参数,特别是过滤元件的孔隙或网眼尺寸,本领域技术人员将能够调整待施加以用于引导样品通过过滤元件的压力。
用于去除红血细胞和/或血小板的过滤步骤将在样品与本发明的流通池接触之前执行。为容易地将此类步骤结合到整个过程流程中,可能使用现成的塑料或其它合适材料的筒,该筒已经包括管和对于分离过程有用的其它元件。例如,分离筒可经由注塑模制来制造,该分离筒包括限定的插入位置,该插入位置包括流通池以及带有鲁尔锁的集成管,用于连接泵、废物容器等。类似地,滤筒可设有漏斗形容器,例如通过注射器将样品注射到其中。漏斗形容器包括用于分离红血细胞和/或血小板的过滤元件。优选地,滤筒可插入分离筒上,使得过滤和随后的分离可在一个过程流程中执行而不介入。图6a和图6b中示出包含滤筒和分离筒的流通池组件。
附图说明
图1示出安装在对应的保持装置中的本发明的微流体流通池的示意性分解视图。
图2示出本发明的微流体流通池内的流动通道几何形状的三个可能的实施例。
图3示出本发明的流通池的不同可能架构的示意图。
图4示出包括本发明的微流体流通池的本发明的微流体装置的示意图。
图5示出用于使用本发明的微流体流通池来测量平均细胞检测率的实验结果。外左条:氨基硅烷化表面上的活细胞的回收。内左条:氨基硅烷化表面上甲醛固定细胞的回收。内右条:hc衍生化表面上的活细胞的回收。外右条:hc衍生化表面上甲醛固定细胞的回收。
图6示出包括滤筒和分离筒的本发明的微流体装置的示意图。
具体实施方式
现在参考附图示例性地描述本发明。图1示出本发明的微流体流通池,其包括顶部部分(1)和底部部分(2),它们可相互配合以形成至少一个曲折形流动通道。在图1中示出的实施例中,底部部分是载玻片,其涂覆有对于待分离或富集的目标细胞或颗粒具有亲和力的分子。可选地,诸如橡胶环的密封器件(9)可位于顶部部分(1)与底部部分(2)之间。当用于微流体装置中时,流通池的顶部部分(1)和底部部分(2)由上保持器件(10)和下保持器件(11)围绕,上保持器件(10)和下保持器件(11)定形成使得它们包围和稳定顶部部分(1)和底部部分(2)的组装。顶部部分(1)包括蚀刻或模制到顶部部分的材料中的一个或多个流动通道。
流动通道可具有不同的几何形状,其中的一些在图2中示出。例如,图2a描绘本发明的流通池的顶部部分(1),其包括流动通道(3),该流动通道为s形且具有角形卷绕。流动通道(3)由多个隔开的内壁部分(4)限定,多个间隔的内壁部分从流通池的相反侧交替地延伸。流通池的顶部部分(1)包括入口(7),其与流动通道(3)流体接触,且允许流体经由泵引导到包括流动通道(3)的顶部部分(1)中。流体经由入口(7)进入流动通道(3),且经由出口(8)离开流通池。图2b描绘本发明的流通池的顶部部分(1),其包括具有圆形卷绕的s形流动通道(3)。图2c描绘本发明的流通池的顶部部分(1),其包括z字形流动通道(3)。
图3a示出本发明的流通池的示例性实施例的示意图。流通池包括顶部部分(1),其包括顶板和两个侧壁(未示出顶板和一个侧壁)。顶部部分(1)与底部部分(2)可相互配合以形成流动通道。底部部分是涂覆的载玻片。顶部部分包括多个隔开的内壁部分(4),其从流通池的相反侧壁交替地延伸。通过该架构,形成基本s形流动通道。在该实施例中,仅从右侧壁延伸的内壁部分(4)包含开口,该开口形成在壁部分的下边沿与流通池的底板之间。引导通过流通池的流体流与壁部分接触,且分成两流。一股流在壁部分周围流动,而第二流穿过壁部分与底板之间的开口。当流再次合并时,生成将颗粒和细胞推向底板的力。
图3b示出通过图3a的流通池的截面。壁部分(4)从流通池的顶部部分(1)的右侧壁延伸。壁部分(4)与底部部分(2)隔开,使得形成开口(6)。图3c示出穿过具有备选架构的池的截面。在此,开口(6)不呈壁部分(4)与底部部分(2)之间的间隙的形式,而呈壁部分(4)的中间的狭缝的形式。图3d中描绘流通池的还另一备选架构,其中延伸到流动通道中的壁部分中的每个具有两个开口(6),其中的一个具有与底部部分(2)相邻的水平狭缝的形式,且一个形成与流动通道的顶部部分(1)的侧壁相邻的竖直狭缝。
为了从样品流体分离目标细胞,使用具有如图2b中示出的顶部部分(1)的微流体流通池。内壁部分的宽度为0.5mm,且流动通道3的宽度为1.75mm。另外,内壁部的下边沿与流通池的底部部分之间的开口为40μm。将尺寸为1x3cm的载玻片用作流通池的底部部分(2)。o形环(9)用来密封微流体流通池。实验中使用的微流体流通池的大体组件在图1中示出。不同的功能化载玻片用作涂覆的捕获表面。在一种途径中,用抗epcam抗体固定hc涂覆的玻片表面,该抗体与mcf7或ht29癌细胞的epcam抗原特异性结合。在另一途径中,使用氨基硅烷化的带正电的表面(也称为组织键),其有助于分离细胞,其后者通常带负电。对于氨基硅烷化的表面,在实验中使用没有任何另外成分的细胞悬液。在分离之前,用新鲜缓冲剂洗涤流通池。分离过程用活的mcf7或ht29肿瘤细胞以及先前固定在甲醛中的细胞来执行。将细胞悬液移液到hc涂覆的微量滴定板的孔中,且用光学扫描仪来计数精确的细胞数。随后,使用hc涂覆的移液器末端将细胞悬液转移到微流体装置中。通常,在转移期间中损失约1.8%的固定细胞和约5.8%的活细胞。此类细胞损失分别是由于与移液器末端的粘附或细胞死亡。通过使用泵(其中泵速为2ml/小时)来将细胞悬液引入微流体流通池中。通过引导细胞悬液通过流通池来分离肿瘤细胞。在光学扫描仪中评估流通池,且计数结合到载玻片的细胞。获得以下结果:
上表中示出,使用本发明的微流体流通池的细胞检测率非常高。特别地,使用本发明的新的微流体流通池实现85-96%之间的回收率。细胞回收实验的结果在图5中示出。外左条示出在氨基硅烷化的表面上回收活细胞的结果。内左条示出氨基硅烷化表面上甲醛固定细胞的回收结果。内右条示出在hc衍生的表面上回收活细胞的结果。外右条示出在hc衍生的表面上回收甲醛固定细胞的结果。
图4示出本发明的包括新颖微流体流通池的微流体装置。流通池包括顶部部分(1)和底部部分(2),它们可相互配合以形成流动通道(3)。流通池经由管(17)连接到泵(13),该泵将缓冲剂和样品通过微流体装置引导。包括目标颗粒或目标细胞的流体样品经由与注射装置(12)连接的阀(14)注射到装置中。注射装置可为例如经由管连接到阀的注射器。在图4中示出的实施例中,该装置还包括纯化柱(15),该纯化柱从样品流体去除某些化合物,否则其可干扰流通池中样品的处理。代替纯化柱,也可使用一个或多个过滤器。例如,可使用从血样去除红血细胞的过滤器来避免过量的红血细胞进入微流体流通池。该装置还可包括废物容器(16),以收集流过流通池的流体。
图6a示出带有分离筒(18)和滤筒(24)的筒组件的侧视图,且图6b是其顶视图。滤筒(24)插入在分离筒(18)上,使得滤筒(24)的漏斗形容器(22)竖直定向,且分离筒(18)水平定向。滤筒(24)可经由鲁尔锁(21)连接到注射器(19),该注射器用来将样品流体施加到滤筒(24)。在优选实施例中(其中样品流体是血样),漏斗形容器(22)包括连接到废物导管(26)的容器的顶部区段中的过滤元件(25)。过滤元件(25)包括一个或多于一个过滤器,该过滤器具有其中尺寸在0.5与5μm之间的孔隙、孔或孔口,以允许红血细胞和血小板通过过滤元件。血样经由入口注射到漏斗形容器(22)中。入口定位在过滤元件(25)下的区段中。在将样品注射到漏斗形容器(22)中之前,可已经连接到分离筒(18)的滤筒(24)颠倒转动,使得过滤元件(25)在入口下。然后将血样注射到漏斗形容器(22)中,且从而使其与过滤元件(25)接触。红血细胞和血小板通过过滤元件,且经由废物导管(26)离开漏斗形容器(22)。分离可通过依靠重力来执行,或它可通过连接到废物导管(26)的泵来辅助。滤筒(24)保持在该位置中达足以允许红血细胞和血小板与样品中包含的其它细胞分离且通过过滤元件(25)的时间段。将红血细胞和血小板从容器(22)去除,且通过导管(26)引导到废物容器中。在去除红血细胞和血小板之后,将滤筒(24)再次转动到正确位置中,且然后将排用尽红血细胞和血小板的样品经由管(20)引导到分离筒(18)和进入流通池(23)来处理。在流通池(23)中,颗粒被捕获且固定到涂覆有相应亲和分子的表面上。
- 还没有人留言评论。精彩留言会获得点赞!