一种酶复合材料及其制备方法与应用
(一)技术领域
本发明涉及复合材料制备技术领域,具体涉及一种酶@zif-8-nh2材料及其制备方法与应用。
(二)
背景技术:
酶是一种重要的生物大分子,是一种具有高效的催化能力和高度的催化专一性的生物催化剂,但蛋白质易失活,稳定性低,价格昂贵且难以重复利用,极大地限制了酶在工业上的应用。
酶的固定化可以将酶固定在一个特定区域内,但仍能进行特定的催化反应,与游离酶相比,固定化酶在保持酶高效、专一的优点同时,还呈现稳定性高、分离回收容易、操作连续可控等一系列优点。在众多固定化材料中,金属有机框架(metal-organicframework,mof)具有高比表面积、可调节的孔径尺寸等优点,是固定化酶的良好载体。其中沸石咪唑酯框架-8(zif-8)具有温和的合成条件、高化学和热稳定性和优秀的生物兼容性。在水溶条件下,通过将配体溶液、酶溶液、金属盐溶液混合将酶原位包封在zif-8内。
根据以上所述,zif-8可以起到保护酶的作用,使得易失活的酶的环境适应性大大提高,减少酶的泄露,增加酶的稳定性。zif-8可以选择不同的有机配体从而引入配体上的官能团,让固定化酶结构更稳定,增大zifs材料的比表面积,增加与底物的接触面积。通过资料及文献检索,目前还未见有关采用mof固定化微生物酶的相关报道。
(三)
技术实现要素:
本发明目的是提供一种酶@zif-8-nh2复合材料及其制备方法与在降解卤代烃污染物中的应用,在载体中引入一种新的有机配体和氨基,制备一种酶@zif-8-nh2复合材料,采用化学交联、物理包埋方法结合固定化酶以提高酶活及稳定性,相比于传统微生物降解卤代烃等难降解污染物时间长、效率低等缺点,本发明所提出的酶@zif-8-nh2复合材料能在较短时间内实现卤代烃等难降解污染物的高效、快速降解。
本发明采用的技术方案是:
本发明提供一种酶复合材料,特别是酶@zif-8-nh2复合材料,所述复合材料按如下方法制备:将咪唑配体与水混合,加入酶液,再添加交联剂,25℃交联反应5-25min,然后加入六水合硝酸锌水溶液,室温下磁力搅拌30-150min,4℃静置12h,反应液离心,沉淀干燥,制得酶复合材料,即酶@zif-8-nh2复合材料;所述咪唑配体为2-甲基咪唑或2-氨基苯并咪唑中的一种或两种;所述交联剂为戊二醛。
进一步,所述咪唑配体为2-氨基苯并咪唑与2-甲基咪唑以物质的量之比1:4-19的混合,优选1:19,或者2-甲基咪唑。
所述咪唑配体总物质的量与六水合硝酸锌水溶液中六水合硝酸锌物质的量之比为1:0.05-0.25,优选1:0.05。所述酶液中酶质量加入量以咪唑配体总物质的量计为100-500mg/mol,优选250mg/mol;所述戊二醛加入体积终浓度为0.5-2.0%,优选1%。所述水为超纯水,所述超纯水是指电阻率达到18mω*cm(25℃)的水。所述水的体积加入量以咪唑配体总物质的量计为300-800ml/mol,优选500ml/mol。所述六水合硝酸锌水溶液投加浓度为0.2975mg/ml。
进一步,所述交联反应是在25℃反应20min;所述磁力搅拌时间为90min。
进一步,所述反应液离心和沉淀干燥是指反应液在4℃、6000-8000rpm条件下离心20-30min,收集沉淀,再用超纯水洗涤2-3min后离心分离,重复2-3次,经0.05mpa下真空干燥8h后,得到酶@zif-8-nh2复合材料。
进一步,所述酶来自嗜麦芽窄食单胞菌(stenotrophomonasmaltophilia)cctccno:m20191025。所述酶液按如下步骤制备:将嗜麦芽窄食单胞菌(stenotrophomonasmaltophilia)cctccno:m20191025(已在专利申请cn111254091a中公开)接种于lb固体培养基,30℃培养箱培养,获得斜面菌体;lb固体培养基组成:5g/l酵母膏,10g/lnano3,10g/l蛋白胨,18g/l琼脂,ph自然,溶剂为去离子水;将斜面菌体接种至lb液体培养基中,30℃、160rpm摇床培养24h,培养液4℃、8000rpm条件下离心20min,收集沉淀,再用0.05m,ph为7.0的磷酸缓冲溶液洗涤3min后离心分离,重复三次,将洗涤后的菌液用超声破胞仪在400w(超声3秒,间歇2秒,循环工作99次)条件下破胞,再4℃、8000rpm条件下离心30min,取上清液即为酶液。lb液体培养基组成:5g/l酵母膏,10g/lnano3,10g/l蛋白胨,ph自然,溶剂为去离子水。
本发明还提供一种所述酶复合材料在降解卤代烃污染物中的应用,所述应用为:以酶复合材料,特别是酶@zif-8-nh2复合材料为催化剂,以卤代烃为底物,以ph7.0、0.05m磷酸缓冲溶液为反应介质,在25℃水浴、150rpm条件下反应,降解卤代烃。所述催化剂加入量以缓冲液体积计为0.01-0.1g/ml,优选0.02g/ml,所述底物加入终浓度为5-15mg/l,优选11.87mg/l。
进一步,所述卤代烃包括三氯甲烷、二氯甲烷等。
与现有技术相比,本发明有益效果主要体现在:
本发明酶@zif-8-nh2复合材料的制备方法简单,价格低且效率高。利用混合配体引入氨基,并利用交联剂使得酶与配体发生化学交联使二者结合更紧密,在水相中一锅法包埋酶,保证其生物催化活力,可以保护酶免受高温、有机溶剂、胰蛋白酶等环境的影响,增加酶的循环能力和储存稳定性,相比于传统微生物降解三氯甲烷(最高浓度8.9mg/l)一般需要48h-72h,本发明制备的酶@zif-8-nh2复合材料不仅能降解最高浓度为11.87mg/l的三氯甲烷,而且降解时间仅需1.5h,具有高效、快速的特点。
本发明提供的酶@zif-8-nh2复合材料具有高催化活力和高稳定性,可有效降解三氯甲烷等氯代烃,有望成为工业污染治理领域中的一类良好生物催化剂。
(四)附图说明
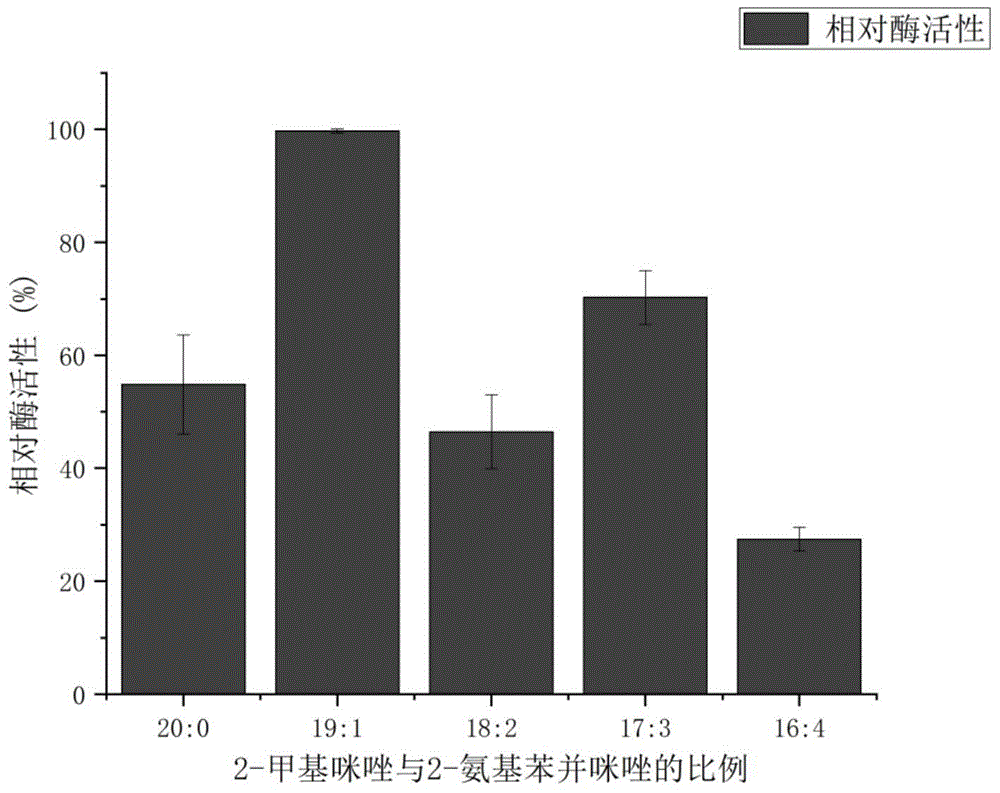
图1为实施例2中配体比例不同合成的酶@zif-8-nh2复合材料相对酶活对比图。
图2为实施例3中交联剂浓度不同合成的酶@zif-8-nh2复合材料相对酶活对比图。
图3为实施例4中交联时间不同合成的酶@zif-8-nh2复合材料相对酶活对比图。
图4为实施例5中磁力搅拌时间不同合成的酶@zif-8-nh2复合材料相对酶活对比图。
图5为实施例6中金属离子与配体比例不同合成的酶@zif-8-nh2复合材料相对酶活对比图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、酶液
将嗜麦芽窄食单胞菌(stenotrophomonasmaltophilia)cctccno:m20191025(已在专利申请cn111254091a中公开)接种于lb固体培养基,30℃培养箱培养,获得斜面菌体;lb固体培养基组成:5g/l酵母膏,10g/lnano3,10g/l蛋白胨,18g/l琼脂,ph自然,溶剂为去离子水;
将斜面菌体接种至lb液体培养基中,30℃、160rpm摇床培养24h,培养液4℃、8000rpm条件下离心20min,收集沉淀,再用ph为7.0、0.05m的磷酸缓冲溶液洗涤3min后离心分离,重复三次,将洗涤后的菌液用超声破胞仪在400w(超声3秒,间歇2秒,循环工作99次)条件下破胞,在4℃、8000rpm条件下离心30min,取上清液即为酶液,采用bradford法测定蛋白浓度(使用752n-紫外可见分光光度计,上海仪电分析仪器有限公司),测蛋白含量为0.5mg/ml。lb液体培养基组成:5g/l酵母膏,10g/lnano3,10g/l蛋白胨,ph自然,溶剂为去离子水。
酶活测定方法:分别取50ml、ph为7、0.05m磷酸缓冲溶液加入到500ml的摇瓶中,加入搅拌磁子,再加入上述酶液4ml(酶含量为2mg),盖上橡胶塞,用进样针加入0.4微升三氯甲烷(加入终浓度11.87mg/l),封上封口膜,于磁力搅拌器上,150rpm,25℃水浴反应10min,分别取1ml反应前和反应十分钟时反应瓶中反应液,采用离子色谱检测反应液中氯离子含量。酶活定义为每分钟内催化1微摩尔三氯甲烷所需的酶量为1u。经过计算,该游离酶的酶活为0.0376u/ml。
离子色谱检测条件:dionexics2000离子色谱仪(美国dionex公司),ionpacas18色谱柱(4x250mm);检测器为电导检测器,检测方式为抑制电导检测;流动相为40mm氢氧化钾,流动相流速为1ml/min,采用梯度淋洗,前15min为20mm,升至40mm保持10min,再降至20mm保持10min,总工作时间为25min,柱加热器温度为30℃,检测器抑制器电流为40ma。
实施例2
1、酶@zif-8-nh2复合材料:
将1.64g(加入终浓度0.020mol)的2-甲基咪唑溶于10ml超纯水,再加入0g的2-氨基苯并咪唑,溶解后加入实施例1方法制备的酶液10ml(酶含量5mg),然后加入0.8ml戊二醛至体积终浓度为1%,25℃交联20分钟后,再加入297.5mg/ml的六水合硝酸锌水溶液1ml(六水合硝酸锌0.001mol),室温(25-30℃)下磁力搅拌90min,再于4℃条件下静置反应12h;反应结束后,在4℃、8000rpm条件下离心30min,收集沉淀,再用超纯水洗涤3min后离心分离,重复三次,经0.05mpa下真空干燥8h后,得到酶@zif-8-nh2复合材料1.976g,记为酶@zif-8-nh2复合材料1。
同样条件下,按照表1添加各个原料,分别制备得到1.938g酶@zif-8-nh2复合材料2、1.917g酶@zif-8-nh2复合材料3、1.932g酶@zif-8-nh2复合材料4、1.862g酶@zif-8-nh2复合材料5。
表1、各物质添加量
2、酶活检测及降解三氯甲烷
酶活检测:取50ml磷酸缓冲溶液(0.05m,ph7.0)加入到摇瓶(500ml)中,加入搅拌磁子(6x20mm),取步骤1制备的酶@zif-8-nh2复合材料1.4g加入到摇瓶,取样1ml作为反应前溶液,盖上橡胶塞,用进样针加入0.4微升三氯甲烷(加入终浓度11.87mg/l),封上封口膜,于磁力搅拌器上,25℃水浴、150rpm反应90min。取反应90min时的反应液1ml,采用实施例1方法检测反应前溶液和反应液90min后反应液中氯离子浓度,并计算底物降解率,见表1。
相对酶活为反应十分钟时反应液中氯离子浓度减去反应前溶液中氯离子浓度。将单位时间内产物生成量最大的酶@zif-8-nh2复合材料的相对酶活定义为100%,其它酶@zif-8-nh2复合材料与产物生成量最大的酶@zif-8-nh2复合材料的氯离子含量比值为其他酶@zif-8-nh2复合材料的相对酶活。
测定上述制备好的酶制剂的酶活性如图1所示,酶@zif-8-nh2复合材料1的相对酶活为54.85%,酶@zif-8-nh2复合材料2的相对酶活为100%,酶@zif-8-nh2复合材料3的相对酶活46.44%,酶@zif-8-nh2复合材料的相对酶活70.25%,酶@zif-8-nh2复合材料的相对酶活27.43%。
三氯甲烷的浓度为底物浓度为11.87mg/l。2-甲基咪唑与2-氨基苯并咪唑之间最好的摩尔比是19:1,三氯甲烷降解率可以达到100%。
实施例3
1、酶@zif-8-nh2复合材料
将15.58g(0.19mol)的2-甲基咪唑溶于100ml超纯水,再加入1.33g(0.01mol)的2-氨基苯并咪唑,溶解后加入实施例1方法制备的含50mg酶的酶液100ml,获得酶混合液200ml。分别取5份酶混合液,每份20ml,然后加入戊二醛至体积终浓度分别为0%、0.5%、1%、1.5%、2%,25℃交联20分钟后,再加入297.5mg/ml的六水合硝酸锌水溶液1ml(六水合硝酸锌0.001mol),室温(25-30℃)下磁力搅拌90min,再于4℃条件下静置反应12h;反应结束后,在4℃、8000rpm条件下离心30min,收集沉淀,再用超纯水洗涤3min后离心分离,重复三次,经0.05mpa下真空干燥8h后,分别得到酶@zif-8-nh2复合材料1.649g、1.863g、1.895g、1.669g、1.753g。
按照实施例2方法测定酶@zif-8-nh2复合材料的酶活性,如图2所示。戊二醛至体积终浓度分别为0%、0.5%、1%、1.5%、2%,对应的酶@zif-8-nh2复合材料相对酶活分别为28.52%、69.11%、100%、48.77%、46.27%,对应的降解率分别为:49.77%、80.04%、100.00%、80.19%、50.18%。
按照实施例2方法检测酶@zif-8-nh2复合材料对于11.87mg/l底物三氯甲烷的降解情况,当交联剂浓度为1%时,相对酶活最高。
实施例4
将15.58g(0.19mol)的2-甲基咪唑溶于100ml超纯水,再加入1.33g(0.01mol)的2-氨基苯并咪唑,溶解后加入实施例1方法制备的含50mg酶的酶液100ml,获得酶混合液200ml。分别取5份酶混合液,每份20ml,然后加入戊二醛至体积终浓度为1%,分别在25℃交联5min、10min、15min、20min、25min后,再加入297.5mg/ml的六水合硝酸锌水溶液1ml(六水合硝酸锌0.001mol),室温(25-30℃)下磁力搅拌90min,再于4℃条件下静置反应12h;反应结束后,在4℃、8000rpm条件下离心30min,收集沉淀,再用超纯水洗涤3min后离心分离,重复三次,经0.05mpa下真空干燥8h后,分别得到酶@zif-8-nh2复合材料1.893g、1.845g、1.824g、1.839g、1.848g。
按照实施例2方法测定酶@zif-8-nh2复合材料的酶活性,如图3所示。交联时间5min、10min、15min、20min、25min,对应的酶@zif-8-nh2复合材料相对酶活分别为28.17%、53.53%、89.9%、100%、38.06%,对应的降解率分别为:31.47%、54.14%、52.83%、100.00%、70.07%。
按照实施例2方法检测酶@zif-8-nh2复合材料对于11.87mg/l底物三氯甲烷的降解情况,当交联时间20min时,相对酶活最高。
实施例5
将15.58g(0.19mol)的2-甲基咪唑溶于100ml超纯水,再加入1.33g(0.01mol)的2-氨基苯并咪唑,溶解后加入实施例1方法制备的含50mg酶的酶液100ml,获得酶混合液200ml。分别取5份酶混合液,每份20ml,然后加入戊二醛至体积终浓度为1%,在25℃交联20min后,再加入297.5mg/ml的六水合硝酸锌水溶液1ml(六水合硝酸锌0.001mol),室温(25-30℃)下分别磁力搅拌30min、60min、90min、120min、150min,再于4℃条件下静置反应12h;反应结束后,在4℃、8000rpm条件下离心30min,收集沉淀,再用超纯水洗涤3min后离心分离,重复三次,经0.05mpa下真空干燥8h后,分别得到酶@zif-8-nh2复合材料1.992g、1.845g、1.963g、1.894g、1.857g。
按照实施例2方法测定酶@zif-8-nh2复合材料的酶活性,如图4所示。搅拌时间30min、60min、90min、120min、150min,对应的酶@zif-8-nh2复合材料相对酶活分别为42.21%、73.80%、97.20%、44.23%、63.41%,对应的降解率分别为:42.21%、82.62%、100.00%、51.78%、63.41%。
按照实施例2方法检测酶@zif-8-nh2复合材料对于11.87mg/l底物三氯甲烷的降解情况,当搅拌时间90min时,相对酶活最高。
实施例6
将15.58g(0.19mol)的2-甲基咪唑溶于100ml超纯水,再加入1.33g(0.01mol)的2-氨基苯并咪唑,溶解后加入实施例1方法制备的含50mg酶的酶液100ml,获得酶混合液200ml。分别取5份酶混合液,每份20ml,然后加入戊二醛至体积终浓度为1%,在25℃交联20min后,再分别加入297.5mg/ml(0.001mol)、371.9mg/ml(0.00125mol)、495.8mg/ml(0.00167mol)、743.7mg/ml(0.0025mol)、1487.5g/ml(0.005mol)的六水合硝酸锌水溶液各1ml,室温(25-30℃)下磁力搅拌90min,再于4℃条件下静置反应12h;反应结束后,在4℃、8000rpm条件下离心30min,收集沉淀,再用超纯水洗涤3min后离心分离,重复三次,经0.05mpa下真空干燥8h后,分别得到固定化酶1.954g、1.935g、1.864g、1.821g、1.997g。
按照实施例2方法测定酶@zif-8-nh2复合材料的酶活性,如图5所示。不同六水合硝酸锌浓度,对应的酶@zif-8-nh2复合材料相对酶活分别为100%、92.3%、82.78%、97.07%、93.87%,对应的降解率分别为:100.00%、94.21%、80.00%、58.68%、44.79%。
按照实施例2方法检测酶@zif-8-nh2复合材料对于11.87mg/l底物三氯甲烷的降解情况,当锌金属与咪唑配体最适的摩尔比为1:20时(即锌金属离子物质的量为0.001m,配体物质的量为0.020m,2-甲基咪唑与2-氨基苯并咪唑物质的量总和为0.020m),相对酶活最高。
- 还没有人留言评论。精彩留言会获得点赞!