一种利用碱金属氢化物还原二氧化碳制备可燃性气体的方法与流程
本发明涉及一种利用碱金属氢化物还原二氧化碳制备可燃性气体的方法,具体涉及一种通过加热法使碱金属氢化物与二氧化碳反应生成氢气与甲烷混合气的方法,属于清洁能源技术领域。
技术背景
甲烷(CH4)为天然气的主要成分,是一种多用途的优质清洁能源,被广泛用作发电、交通、民用燃料。同时,甲烷还是优质的有机化工原料,被广泛用于化肥、甲醇、聚甲醛、甲胺等的生产中。由于石油资源日趋枯竭和环境危机的出现,全球天然气的需求越来越大,到2020年将增加至4.9万亿立方米。尽管天然气的探明储量在不断增长,目前的开采量和需求量之间的差距仍有拉大的趋势,全国常有大面积供气紧张的情况。将清洁燃料甲烷应用于汽车已经引起了人们的高度重视。但是,与汽油相比,甲烷作为燃料的主要缺点是体积能量密度低,只有汽油的1/3。甲烷汽车广泛应用的最主要技术阻碍,就是缺少一种安全、便利、高密度的燃料存储技术。针对二氧化碳带来的温室效应及甲烷的短缺和存出问题,研究者们一方面在积极探寻经济高效的CO2甲烷化的方法,另一方面在努力寻找安全、便利、高密度的甲烷存储方法。
CO2甲烷化反应是由法国化学家Paul Sabatier(Rev.Inorg.Chem.1985年第7卷,315–339页)提出的(二氧化碳还原技术),因此,该反应又叫做Sabatier反应,而全球CO2循环策略来解决全球的CO2排放问题,共包括三个环节,第一步,用电解产生氢气;第二步,H2和CO2反应生成CH4和少量其他碳氢化合物;第三步,生成的CH4作为能源消耗又生成了CO2,如此循环往复。其中的核心环节就是利用太阳能发电和CO2催化加氢甲烷化的反应。反应过程是将按一定比例混合CO2的和H2气通过装有催化剂的反应器,在一定的温度和压力条件下CO2和H2发生反应生成水和甲烷。化学反应方程式如下。
CO2+4H2=CH4+2H2O
这一过程目前颇具实用性,而从长远观点看,以二氧化碳为原料合成天然气是开发新能源的途径之一,从大气中回收二氧化碳制取甲烷则具有战略意义。近年来,人们发现,与一氧化碳相比,二氧化碳的甲烷化反应在相当大的温度范围内具有负的自由能变化,△rG绝对值较大,从热力学角度看,进行这一过程毫无问题,并且该反应具有较低的活化能,较低的反应温度及更高的选择性。因此,该过程对化学工作者具有很大的诱惑 力。目前,这方面工作的着重点主要在于揭示这一过程的机理及选择高性能的催化剂使反应在可以接受的速度范围内进行。
然而这一过程是放热的,△H随温度变化不大。过多的放热可能使催化剂过热失活并促使温度上升至反应难以进行的程度。此外,甲烷的产生还与原料气的比例有关。较高的H2/CO2比有利于提高甲烷的产率。压力对反应影响不大,但在超过425℃时有较大的影响。较高的压力可使反应在较低的H2/CO2比下进行而不发生催化剂表面的积碳,但也可能因放热增大,过多的放热会导致贵金属催化剂活性组分产生烧结和表面积碳现象,从而造成催化剂的中毒。可见,在该体系下进行甲烷化反应时,一般控制条件为较低的温度,较高的H2/CO2比,良好的散热条件及适当的压力范围。虽然二氧化碳的来源十分广泛储存方式也十分方便,但是对于该反应涉及到危险气体H2,且氢气的储存也较为困难。
鉴于以上原因,目前为止利用氢气还原CO2甲烷化还没有得到广泛的应用。因此,积极探索新的思想和技术路线来实现CO2的甲烷化已成为当前国际研究的热点。例如,Sehoon Park等(J.Am.Chem.Soc.2012年第134卷,11404–11407页)在过渡金属化合物的催化下,利用硅烷实现了CO2甲烷化;Jun Chul Lee等(J.Chem.Technol.Biot.2012年第87卷,844–847页)在固定床反应器中采取生物法将CO2转化为甲烷,H.Park等(J.Mater.Chem.2012年第22卷,5304–5307页)及Tu,Wenguang等(Adv.Funct.Mater.2013年第23卷,1743–1749页)发现孔状的锌镓氧化物、TiO2–碳氢化物在还原CO2制备甲烷方面表现出很高的光催化活性。但上述反应方法存在以下缺点:
1、利用硅烷通过过渡金属化合物催化还原二氧化碳至甲烷过程中所用催化剂较为昂贵(铱催化剂),且中间产物生成较多及反应机理也较为复杂。
2、采取生物法将CO2转化为甲烷过程中,甲烷化的速率极大地受到氢气与二氧化碳比例的约束,甲烷化过程所需的厌氧固定床反应器中需要填入氢营养产烷微生物,但其来源不广。
3、采用光催化法实现了CO2甲烷化过程中,较低二氧化碳物质量的转移限制了二氧化碳的还原速率,其反应速率需要进一步的提高,且对应的孔状氧化物催化剂制备过程也较为繁琐。
4、此外,将二氧化碳还原至甲烷后,对于生成甲烷的存储问题仍然面临巨大的挑战,目前,甲烷存储、运输密度的技术主要有液化甲烷和压缩甲烷。但高成本、存在潜在的安全隐患、而且低温容器保养难度大,还存在蒸发损失等因素的影响。
技术实现要素:
本发明的目的在于提供一种利用碱金属氢化物还原二氧化碳制备可燃性气体的方法。所述方法在不需要催化剂的条件下能让二氧化碳在强还原剂的作用下自发还原为甲烷。
实现本发明的技术方案是:
一种利用碱金属氢化物还原二氧化碳制备可燃性气体的方法,其特征在包括以下步骤:
第一步,原料预处理,在手套箱氩气气氛保护下(H2O和O2浓度小于1ppm),将碱金属氢化物MH置于球磨罐中进行球磨处理,即可制得比表面积较大的轻质高能氢化物;
补充说明,在动态球磨条件下,球磨反应容器与球磨间会产生非常强的摩擦力和碰撞力,可使碱金属氢化物颗粒变小增大反应接触面积。
第二步,静压反应,在氩气气氛保护下(H2O和O2浓度小于1ppm),在手套箱中将第一步得到的高能氢化物放入静式加热管中,关闭加热管阀门后从手套箱中拿出,与配备有高精度压力传感器的抽真空管路体系相连接,抽出氩气,充入高纯二氧化碳,反应在25~550℃进行,随着反应的进行加热管内便产生了甲烷与氢气的混合气体,且随着碱金属氢化物的不同、反应时温度的不同、充入二氧化碳的压力不同,反应时间的不同,反应后甲烷最终的产率及甲烷在混合气体中的体积分数也会变化;
第三步,产物定量,混合气体通过气相色谱和红外光谱联合检测混合气体中甲烷的产率。
进一步地,第一步中,碱金属氢化物MH选用LiH或NaH。
第一步中,球磨罐内球质比为90:1,转速为450转/分钟。
第二步中,反应在200~550℃进行,反应1~72h。
第二步中,反应在450℃进行,反应48h。
第三步中,甲烷气体产率计算方法为其中,为甲烷的产率,为生成甲烷的物质的量,为初始二氧化碳的物质的量。甲烷的可以利用气相色谱的定量测试法(外标法中的标准曲线法)来获得。
反应过程中生成的碱金属氧化物M2O可以通过氢化、电化学方法重新还原回为碱金属氢化物,从而实现碱金属氢化物的循环利用。
本发明涉及的反应机理如下:
前人研究指出(J.Appl.Phys.2009年第105卷,023527页)碱金属氢化物与NH3反应这类可逆储氢材料能在温和条件下自动放出氢气,是一种具有前途的储氢材料。相关放氢反应如下:
MH+NH3→MNH2+H2 (M=Li,Na,K)
研究表明高能的MH除了能与氨气反应制备氢气,还能在温和条件下被用作还原剂,使肉桂醛高选择性和高转化率的还原成肉桂醇,对于同时含有C=C和C=O键的分子(Acta Phys.Chim.Sin.2002年第18卷,55-58页)选择加氢的意义也十分重大。考虑到CO2是弱的电子给予体,强的电子受体,难于氧化而易于还原,所以将二氧化碳活化常用的方法之一就是还原活化,氢元素在第一周期,最外层为一个电子,与之性质相同的第一主族其他元素例如Li、Na与氢元素所形成的碱金属氢化物中氢元素显示-1价,具有氢气的共同点,即还原性很强,所以设计利用碱金属氢化物与CO2反应将更有利于二氧化碳甲烷化的反应。
对于碱金属氢化物与二氧化碳反应均可按照如下反应进行。
4MH+CO2→2M2O+C+2H2→2M2O+CH4 (M=Li,Na) (1)
4MH+3CO2→2M2CO3+C+2H2→2M2CO3+CH4 (M=Li,Na) (2)
研究发现碱金属氢化物(LiH,NaH)–二氧化碳体系不仅具有负的吉布斯自由能变和合适的焓变(△H=–210~–964KJ/mol),而且甲烷化反应为放热反应,这些特点决定了碱金属氢化物-二氧化碳体系有希望成为高能量密度且在温和条件下自发甲烷化的高容量储氢材料,前期研究证明碱金属氢化物–二氧化碳体系为在温和条件下的能量密度为8805.2KJ/L,等价于室温下24.5Mpa甲烷的能量密度。这表明碱金属氢化物和CO2的形式可以存储相当高密度的甲烷,为甲烷的高密度存储提供了新的方法。
本发明与现有技术相比,其显著优点是:
1、与其他二氧化碳甲烷化体系相比,MH–CO2体系具有如下特点;
(1)该体系能实现对二氧化碳固定并使之转化为有用的绿色能源;
(2)具有高体积能量密度;以氢化锂的密度为820g/L,液体二氧化碳的密度为706g/L计算,1L LiH–CO2体系(按照4:1进行)理论最大的甲烷存储量为9.89mol(相当于标况下221.5L),其能量密度为8805.2KJ/L,等价于室温下24.5Mpa甲烷的能量密度。这表明该体系以碱金属氢化物和二氧化碳的形式反应可以存储制备相当高密度的甲烷,为甲烷 的高密度存储提供了新的方法;
(3)储存、使用的安全与方便性;碱金属氢化物为固体粉末状物质,其存储、运输十分安全、方便;二氧化碳为无毒、容易液化的气体。向碱金属氢化物为固体粉末中吹入CO2可以安全、方便地得到清洁燃料用气,避免了甲烷的存储、运输时的不安全问题;
(4)本反应生成的固体碱金属氧化物M2O可以通过氢化、电化学等方法重新还原回为碱金属氢化物,从而实现碱金属氢化物的循环利用;
(5)对于氢气二氧化碳甲烷化体系而言,其制备甲烷的装置较为复杂,且所用催化剂容易中毒,制得的甲烷仍然需要通过压缩的方法进行存储,加大了其运行成本,而对于碱金属氢化物二氧化碳体系而言其反应制备装置简单,在密闭体系中通过加热碱金属与二氧化碳气固混合物就可将其中存储的甲烷释放出来,且甲烷就已经存储于密封体系中,但考虑到LiH自身的成本相比于氢气而言大约贵10倍左右,所以本体系适用于区域性小规模地,可移动地生产,适合于车载能源的开发与应用。
2、若将碱金属氢化物–二氧化碳制备甲烷体系中的MH与CO2按照一定的摩尔数进行配比,升高到一定温度,在静压反应加热管中就可生成一定量的甲烷及氢气的可燃混合气,且甲烷在混合气体中的摩尔比及二氧化碳甲烷化的转化率会随着反应条件的改变而改变。其特点如下:
(1)在一定温度范围内,甲烷在混合气体中的摩尔比及二氧化碳甲烷化的转化率会会随着反应温度的升高而升高,其中LiH–CO2体系在较低温度下就可以产生甲烷,NaH在一定温度下与二氧化碳反应后甲烷在混合气中的体积分数比能达到90%;
(2)同一碱金属氢化物在相同条件下与二氧化碳反应会随着反应时间的提高,甲烷在混合气体中的摩尔比及二氧化碳甲烷化的转化率也会随之提高,其中LiH在一定温度下反应1h后二氧化碳甲烷化的转化率就可以达到22%,甲烷在混合气体中的摩尔比能达到17.6%;
(3)不同的碱金属氢化物在相同条件下与二氧化碳反应,甲烷在混合气体中的摩尔比及二氧化碳甲烷化的转化率也会有所差异,其中LiH在一定温度下反应48h后二氧化碳甲烷化的转化率能达到80%。
3、碱金属氢化物与二氧化碳体系在一定温度下得到的甲烷与氢气的混合气体极大克服了甲烷自身的缺点:
(1)由于甲烷里混有氢气使得体系中H/C原子比得到提高,这样会减少该混合气 体燃烧后温室气体二氧化碳的排放;
(2)在甲烷中引入氢气可以改善火焰燃烧的速率及稳定性,最终将减少燃烧持续时
间和提高热效率;
(3)在甲烷中引入氢气可以减少甲烷燃烧的淬灭间隔,使发动机输入更少的能量就
可轻易发动。
附图说明
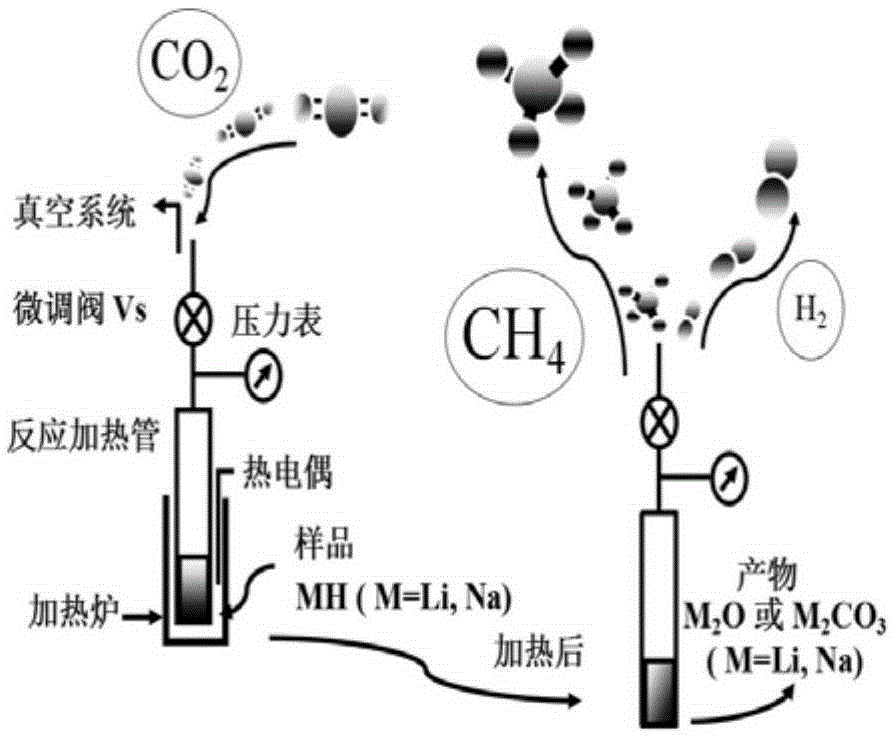
图1是本发明MH–CO2体系制备可燃性气体的预处理球磨装置图;
图2是本发明MH–CO2体系制备可燃性气体的静压反应装置图;
图3是本发明碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在450℃下反应48h后生成气体的气相色谱图;
图4是本发明碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在200℃、350℃、450℃、550℃恒温加热48h后生成气体的气相色谱图;
图5是本发明碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在450℃恒温下分别加热1h,24h,48h,72h后生成气的色谱图;
图6是本发明碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在450℃恒温加热48h后生成气体的气体红外图;
图7是本发明碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在200℃、350℃、450℃、550℃恒温加热48h后生成甲烷在混合气体中的摩尔分数图,内置图为碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在200℃、350℃、450℃、550℃恒温加热48h后二氧化碳甲烷化的产率图;
图8是本发明碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在450℃恒温下分别加热1h,24h,48h,72h后生成甲烷在混合气体中的摩尔分数图,内置图为碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在450℃恒温下分别加热1h,24h,48h,72h后二氧化碳甲烷化的产率图。
具体实施方式
为了更好地理解本发明,下面结合附图通过具体的实施例来具体说明本发明的技术方案。
实施例1
在手套箱氩气气氛保护下,将0.3g的碱金属氢化物MH(LiH,NaH)置于球磨罐中(内部体积约70cm3),放入30个钢珠(直径6mm)。然后在装有样品的球磨罐内充入0.1MPaAr气(>99.999%),球磨2h。球磨装置是行星式球磨机(QM-3SP4),如图1所示,球磨钢珠和粉末的质量比约90:1,在氩气气氛保护下,在球质比为90:1和转速为450转/分钟的条件下球磨48h,即可制得比表面积较大的轻质高能氢化物。
在氩气气氛保护下,在手套箱中将球磨后的碱金属氢化物放入加热管中,如图2所示,关闭加热管附带的微调阀后拿出手套箱,将其中的氩气抽出后充入高纯二氧化碳(分别为0.25Mpa),使得碱金属氢化物/二氧化碳的摩尔比值为4:1,将静压反应加热管至于200℃,350℃,450℃,550℃的恒温加热炉内恒温48h,然后将反应后的气体导入带有压力传感器且与色谱相连的真空管路系统进行GC检测以便定性与定量,其中MH–CO2(NaH–CO2、NaH–CO2)体系在450℃下反应48h后生成气体的气相色谱图如图3所示。
图4(a,b)是碱金属氢化物MH(LiH,NaH)与二氧化碳(0.25Mpa)在200℃,350℃,450℃,550℃恒温加热48h后生成气体的色谱图,结果表明静压反应加热管中的碱金属氢化物/二氧化碳至于200℃,350℃,450℃,550℃恒温加热48h后,对于LiH–CO2体系从200℃开始反应就有较为明显的甲烷产生,而NaH–CO2在350℃左右才有甲烷生成,值得注意的是NaH在450℃下反应后,甲烷在混合气中的色谱峰面积比例最大,这说明产生的甲烷在混合气体中所占含量也最多。而对于LiH、NaH–CO2这两种体系进一步升温至550℃,其甲烷的峰面积在混合气体中的比例并没有进一步提高,值得注意的是在任意温度下两个体系都存在氢气,随着温度从200℃升温至450℃,氢气的峰面积比例不断下降,而甲烷的峰面积都在进一步上升,这表明碱金属氢化物MH与二氧化碳在200–450℃内甲烷的转化率会随着温度的升高而升高。
图6是碱金属氢化物MH(LiH,NaH)与二氧化碳(0.25Mpa)在450℃恒温加热48h后生成气体的红外光谱图。从图可以看出,LiH–CO2体系反应后,混合气体中在3013cm-1和1300cm-1有较为明显的甲烷红外吸收峰,而NaH–CO2体系反应后,混合气体中除了有甲烷的特征吸收峰,还出现了在2883cm-1和1476cm-1的乙烷或丙烷的特征吸收峰,但考虑到乙烷或丙烷次主峰位置的吸收峰相对于甲烷的次主峰吸收较小,可以认为副产物乙烷或丙烷的生成量较小,以上实验说明LiH–CO2体系适用于在不同温度下反应制备纯净的甲烷与氢气混合气,而NaH–CO2反应体系中还有可能产生了乙烷或丙烷的气体,这可 能和其较为复杂反应机理有关系。
图7是碱金属氢化物MH(LiH,NaH)与二氧化碳(0.25Mpa)在200℃,350℃,450℃,550℃恒温加热48h后甲烷在生成气体中的体积分数图及二氧化碳甲烷化产率图(内图)。结果表明对于LiH–CO2体系而言,从200℃左右就有较为明显的甲烷产生且产率为7.2%,而NaH–CO2体系在350℃左右才有甲烷生成,且产率较低,只有17%,而此时LiH–CO2体系在350℃的产率达到了54.2%。两个体系在200–450℃下反应48h后其甲烷的摩尔体积分数和甲烷的产率都会随着温度的上升而上升,但当温度继续升到550℃后,其甲烷的摩尔体积分数和甲烷的产率都不会继续上升。值得注意的是NaH在450℃下反应48h后,甲烷在混合气中的摩尔体积分数能达到90%。这说明NaH–CO2体系在450℃下反应48h后能制备出较为纯净的甲烷,而此时LiH–CO2体系在450℃的产率达到了80%,综上所述碱金属氢化物/二氧化碳在静压反应条件下反应产率及摩尔体积分数在450℃下反应最优,碱金属氢化物/二氧化碳甲烷化的性能极大地受到反应温度的影响。
实施例2
在手套箱氩气气氛保护下,将0.3g的碱金属氢化物碱金属氢化物MH(LiH,NaH)放入加热管中(内部体积约70cm3),放入30个钢珠(直径6mm)。然后,装有样品的球磨罐内充入0.1Mpa Ar气(>99.999%),球磨2h,所用球磨装置是行星式球磨机(QM-3SP4),球磨钢珠和粉末的质量比约为90:1。在氩气气氛保护下,在球质比为90:1和转速为450转/分钟的条件下球磨48h,即可制得轻质高能氢化物。
在氩气气氛保护下,在手套箱中将高能碱金属氢化物放入静式加热管中,关闭阀门后拿出手套箱,再将其中的氩气抽出,充入高纯二氧化碳(分别为0.25Mpa),使得碱金属氢化物–二氧化碳的摩尔比值为4:1,在静压反应加热管至于450℃下恒温分别加热1h,24h,48h,72h,然后将反应后的气体导入带有压力传感器且与色谱相连的真空管路系统中进行GC检测。
图5(c,d)是碱金属氢化物MH(LiH,NaH)与CO2(0.25Mpa)在450℃恒温下分别加热1h,24h,48h,72h后生成气的色谱图,结果表明静压反应加热管中的碱金属氢化物/二氧化碳至于450℃恒温加热1h后就有较为明显的甲烷产生,值得注意的是除了NaH在450℃下反应1h后的生成气外,在其他任意时间下NaH–CO2甲烷在混合气中的色谱峰面积比例相对于同等条件下LiH–CO2体系的都要大,这说明产生的甲烷在混合气体中所 占含量也最多。对于LiH、NaH–CO2这两种体系进一步延长时间至24h,48h后,其甲烷的色谱峰面积也随着反应时间的延长而增大,而对于LiH、NaH–CO2这两种体系进一步延长时间至72h后,其甲烷在混合气体中的色谱峰面积并没有进一步提高。在任意时间下两个体系都存在氢气,随着反应时间至72h,氢气与甲烷的峰面积比例将不再改变,这说明甲烷的摩尔体积分数在反应48h后没有随着反应时间进一步上升而上升。综上说明延长一定的反应时间有利于碱金属氢化物/二氧化碳甲烷化的进行。
图8是碱金属氢化物MH(Li,Na)在450℃下与0.25Mpa二氧化碳恒温加热不同时间(1h,24h,48h,72h)后生成甲烷气体的产率(内嵌图)及甲烷在混合气体中的摩尔分数图,结果表明碱金属氢化物–二氧化碳体系在静压反应加热管中于450℃恒温加热1h后就有较为明显的甲烷产生,LiH–CO2体系在1h内甲烷化的产率就达到35%。随着反应时间的延长,二氧化碳甲烷化的转化率及甲烷在混合气体中的比例也逐渐提高,值得注意的是LiH在450℃下与0.25Mpa压强二氧化碳反应不同时间后,甲烷在混合气体中的产率相比于NaH–CO2体系要高的多,虽然NaH–CO2体系中甲烷的气体摩尔分数在1h后都比LiH–CO2体系的高,但其转化率较低,这可能是由于其反应机理与LiH–CO2体系不同导致的,但值得注意的是当NaH–CO2体系在450℃下与0.25Mpa压强二氧化碳反应48h后甲烷在混合气体中的摩尔分数达到最大值90%,以上说明LiH–CO2体系的二氧化碳甲烷化转化率为最好,且延长一定的反应时间有利于甲烷的生成,NaH–CO2体系在高温下反应一段时间后能得到较为纯净的甲烷气体。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!