利用微流控芯片构型和动力学进行光力测量和细胞成像的微流控芯片设备的制作方法
本发明总体上涉及用于粒子分析以及流体中粒子或细胞成像的设备和方法,尤其涉及利用压力、流体动力学、电动力学和光力(opticalforces)对流体进行粒子成像的设备和方法。
本发明针对一种微流控芯片,其中注入发生在垂直向上的方向上,流体小瓶位于芯片下方,以便在芯片通道的分析部处和该处之前最小化粒子沉降。
实现本发明需对现有微流控芯片设计进行改变。例如,为了使小瓶与芯片垂直对齐,需建立与现有技术不同的芯片接口。具体而言,本发明使输入和流体经过芯片底部向上,在一个方面使用歧管,这避免了流体/流体动力学的水平重新定向,而不是使输入管经由端口以正交方式与芯片接合(微流控芯片实验室系统中的典型做法),端口附接至芯片最大面上,然后首先横过芯片泵送流体,然后将流体泵送到芯片上方。
根据本发明,小瓶所容之物位于芯片下方,并被直接垂直向上泵送到芯片的第一通道中。长通道从芯片底部延伸至芯片顶部附近。然后,该通道转一个短水平弯,但新通道太短,几乎可以抵消任何由于重力和壁处零流速导致的细胞沉降的影响。然后,与现有技术相反,将流体向上泵送至分析部。因此,水平分析部是芯片中的最高通道/流控点,所以水平分析部靠近芯片顶部,这使得显微镜/照相机和样本之间的芯片材料(如玻璃)比现有技术少,成像也就更加清晰。在分析过程中,激光也会使细胞悬浮在该通道中,防止它们沉降。
背景技术:
相关技术说明
根据现有技术,将含有待分离和/或分析的细胞或粒子的微流控芯片小瓶放置于侧面,并水平泵送至微流控芯片中的通道中。首先,小瓶所容之物(例如,粒子或细胞)被垂直向上泵送,然后转u型弯向下行进,接着被水平泵送至芯片中(参见例如第9594071号美国专利)。
与芯片的水平连接,再加上连接中的死体积(流控连接中的空白空间,在某种程度上不可避免),在重力作用下导致显著的额外沉降。这种配置还使连接所需的相对较大直径通道成为必要,除了死体积外,还形成了一个相对低速的区域,进一步加重了粒子沉降的问题。根据本发明的芯片不仅消除了对大型水平输入通道的需要,还消除了对从大型水平输入通道到第一垂直芯片管道中的相对较细上升流的较突然变化的需要。这种配置消除了水平沉降和导致沉降的不必要方向变化。使细胞进入芯片的底部边缘也解决了死体积中沉降的问题,方法是将其定向为与重力垂直,使得细胞或粒子无法在水平通道的底部沉降,相反它们不断被流动向上引导。这并不是凭直觉获知的,且在设计当前展现的解决方案之前,需要进行大量实验来理解该问题。与本发明相比,当前可用的微流控设备在抛光表面和更大面积的玻璃上包括定制或商业上可获得的连接,这一般迫使样本流中所含的如细胞的任何粒子在进入芯片后立即转弯并水平行进。
此外,现有技术中,细胞或粒子在到达分析通道之前,在微流控芯片上进行几次水平移动,而这导致沉降。当小瓶所容之物进入芯片和芯片中的通道时,所容之物相对垂直的芯片内通道被水平泵送。然后,通道向上流动,转一个长水平弯,此时由于重力作用,细胞往往在通道底部沉降,同时由于层流条件,细胞往往在壁处出现较低的速度。本质上,由于抛物线速度剖面,在通道中部流量最大,在通道壁处或其附近降至零。在第一个水平芯片内通道之后,流体在分析通道之前向下转弯,在分析通道进行粒子成像或分离。由于这种配置,显微镜/照相机与分析通道之间存在相对较远的距离。在这种典型的现有技术配置中,粒子被迫向下并最终离开芯片底部。
此外,由于现有技术中的限制,需要多个水平移动,使得细胞在通道中的多个地方沉降。这反过来又导致图像质量下降,这是因为需要通过芯片边缘处的附加材料成像。芯片的现有技术通道不得不垂直向上泵送,然后水平泵送,然后再进行之字形泵送,以获得足够的细胞或粒子悬浮,然后向下并离开芯片。本发明避免了之字形通道。
还存在关于流体中细胞或粒子的3d图像渲染的现有技术。例如,m.哈巴扎、m.克尔施鲍姆、c.根特-马尔施纳、g.达迪克曼、i.巴内亚、r.科伦斯坦、c.杜什尔、n.t.沙克德在《尖端科学》(advancedscience)(2017,4,1600205)中教导了捕捉细胞,高速旋转该细胞,并使用干涉测量法测定细胞内的折射率分布。干涉测量法也被用于分析微流控通道中的细胞(参见例如y.宋等人的《应用物理评论》(physicalreviewapplied),2014年2月27日;1:014002)。然而,本发明要求在细胞或粒子在流体流中行进以及通过(一个或多个)成像设备的焦平面时,为其拍摄多个图像,从而消除了为了获取3d图像而捕捉细胞的需要。其他技术也有教导,比如使用机械位移平台来移动细胞或粒子(例如,n.卢等人的光学快报(opticsexpress),2008年9月29日;16(20):16240-6),这些技术都不使用本发明所述的明场成像,也没有利用流体流来提供相对于图像焦平面的细胞定位。
本发明引用的所有现有技术参考文献均借引用全文并入于此。
技术实现要素:
本发明针对一种微流控芯片,其中进行注入且样本小瓶位于芯片下方,以便最小化粒子沉降。因此,小瓶的内容物位于芯片下方,并被直接垂直向上泵送到芯片的通道中。长通道从芯片底部延伸至芯片顶部附近。然后,该通道转一个短水平弯,但新通道太短,使其相对细胞沉降的任何影响无关紧要,细胞沉降由通道壁处的零流速导致。然后,与现有技术相反,将样本向上泵送至分析部。因此,水平分析部是芯片中的最高通道/流控点,所以水平分析部靠近芯片顶部,这使得显微镜/相机之间的玻璃比现有技术少,成像也就更加清晰。分析通道与芯片顶部之间的距离可以在100微米到2mm之间,但也可以长达100mm,如从100微米到200微米、从200微米到300微米、从300微米到400微米等等。一个实施例中,在经过芯片分析部之后,样本(如流体、细胞和/或粒子)被向下泵送至芯片底部,被迫向外移动。
本发明进一步针对一种微流控芯片,其中水平移动最小化,尤其是当流体进入芯片通道时。现有技术芯片含有约13mm水平通道(非分析部),其中约2mm为直径大很多的注入端口,加剧了由低速导致的沉降。本发明描述的芯片在优选实施方案中具有约0.2至3.0mm的(非分析)水平通道,尽管水平通道的长度可在0.01至100.0mm之间,如从0.01mm到0.02mm、从0.02mm到0.03mm、从0.03mm到0.04mm,等等。这取决于发明的通道系统,与现有技术不同按照数量级排序,这样可以改进流动,消除了细胞/粒子沉降。
本发明的另一方面针对一种微流控芯片,其中进行成像和分析基于芯片角落处或其附近进行的,因为这样使照相机和分析通道之间的玻璃更少、距离更短,以改进从多个视点进行的成像。这还使得能够使用更高数值的物镜,通过增加数量级,来改进精细成像。这种设计改良减少了玻璃(或构成芯片的其他物质,如塑料或任何透明或半透明材料)和距离(例如,由于玻璃中的瑕疵)导致的图像失真。成像设备和分析通道之间的距离可以在100微米到2mm之间,但也可以长达100mm,如从100微米到200微米、从200微米到300微米、从300微米到400微米等等。
另外,本发明针对一种微流控分类芯片,其从分析通道下游分离,允许同时或依次分开使用压力和/或激光(或其他光力)来激活分类功能。一个方面,为了进行分类功能,流动将从分析通道继续。例如,粒子将被指引到垂直通道中,然后被指引到水平分类通道。一个实施例中,在分类通道流动方向上施加光力和/或压力,来推动粒子通过该通道。未受光力直接作用的粒子将由于例如重力、电动力学力、磁力、层流线、流线、降低的流速、正交的光力、或者真空(施加真空以将粒子吸入可供替代的通道)而转向至可供替代的通道。在与分类后的分析通道相关的另一方面,本发明允许从芯片后侧(激光或光力定向在同一流动方向)引导光力,并且在一些方面允许分解主激光。一些实施例中,可在物质通过通道移动的相反方向上施加光力和/或压力,例如逆流,或可在物质在通道中移动的同一方向上施加,例如顺流。细胞或粒子分类可在单个设备或单独的芯片上进行。例如,图1b中,在出口管件145之前的第五通道含有一条或多条分支,以实现单个或多个分类区域。
本发明的另一方面,歧管连接至小瓶,连接方式使得管件通过歧管,连接至其他侧面上的小瓶或其他容器,该其他侧面与小瓶中的物质(例如流体)接触。歧管允许小瓶连接至微流控芯片但要存储在芯片下方,和/或歧管允许小瓶的内容物从芯片底部注入,减轻现有技术面对的数个问题,如小瓶或来自小瓶的管件连接至微流控芯片或与其连通处的细胞或粒子沉降。
另一方面,本发明针对一种微流控芯片保持器,该芯片保持器包括引导光源的结构,该结构包括集成棱镜腔,该集成棱镜腔装配有棱镜时,使光以相对芯片成一定角度射出,这是照亮受限几何构型的优选方法。一些实施例中,光源包括但不限于光纤光学器件或平行(collimated)或聚焦光源。尤其,光源精准地对准或定向至分析通道,或被引导到分析通道中。
本发明的另一方面中,设备包括第二成像设备,其被定向为与第一照相机和通道视图正交。设置第二照相机的原因各不相同。一方面,设置第二成像设备的原因是帮助分析通道中的激光或光力的视觉调准。另一方面,使用本发明所述的方法,能够记录来自第一照相机的数据。有了第二照相机,数据能够与来自第一照相机的数据组合,带来能用于更准确地推断细胞位置、大小、形状、体积等的附加数据。该关于同一细胞(或粒子)的附加信息提高了准确性,扩大了测量和分析的范围。另一个方面,第二照相机与第一照相机组合能实现细胞或粒子、或细胞或粒子群的三维重建,这由正交照相机和流中的照相机或朝向芯片侧面定位的照相机成像。使用本发明所述的算法或其他算法,包括逆转或减慢流动并为特定细胞或粒子、或细胞或粒子群拍摄一张或多张图像,本发明允许多张图像的分析和处理,从而允许特征/特性/定量测量的确定,例如细胞体积、细胞形状、细胞核部位、细胞核体积、细胞器或包涵体部位等。本发明的另一方面中,照相机定向为,在流动方向上的轴上成像。
一个方面,本发明不需要蜿蜒的(蛇形)或之字形(锯齿状)的通道来保持粒子的恰当悬浮,而这在现有技术中是优选的。由于被注入芯片的流体和粒子或细胞的垂直性质,垂直集成的泵送粒子可直接向上通过通道到达第一水平通道(本发明中称为第二通道),从而避免了之字形通道。
附图说明
附图图示了本发明的一些实施例的某些方面,不作为对本发明的限制或界定。附图与文字说明一起用于解释本发明的某些原理。
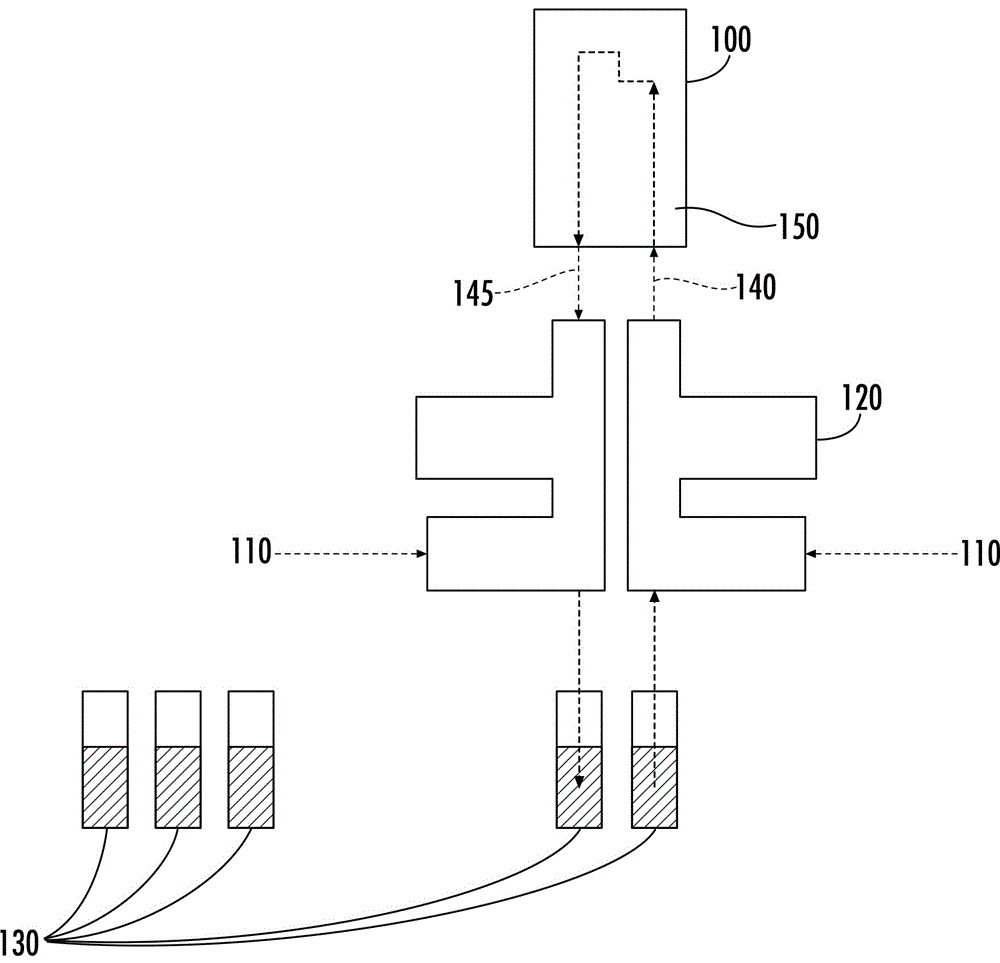
图1a是描绘设备配置的全局视图的示意图,包括芯片、歧管和小瓶。图1b是示意图,显示了芯片通道定向和部位的某些描绘。
图2a和b含有描绘根据本发明的微流控芯片保持器的示意图。
图3a和3b为描绘根据本发明的芯片保持器的角度和方面的示意图。
图4a和4b是显示与芯片相关的细胞路径和成像配置的示例的示意图。图4c为显示可供替代的细胞路径的示意图。
图5为显示片内多平面成像以及如何使用其来渲染3d图像和信息的示意图。
图6a和6b为显示流体流中的片内多平面成像以及如何使用其来渲染3d图像的示意图。
图7为一个示意图,显示了捕捉细胞的可能方式和/或在芯片的分析部内平衡细胞的可能方式,以及从多个角度为细胞成像的可能方式。
图8为一个示意图,显示了如何能够将照相机和照明源放置为与激光和流动方向对齐,从而使粒子远离照相机。
图9为一个示意图,显示了如何能够将照相机和照明源放置为与激光和流动方向对齐,从而使粒子向照相机移动。
具体实施方式
已经参考具有各种特征的特定实施例描述了本发明。对于本领域技术人员来说,显而易见的是,在不脱离本发明的范围或精神的情况下,可以在本发明的实践中进行各种修改和变动。本领域技术人员将认识到,可能基于给定应用或设计的要求和规范单独或以任何组合使用这些特征。含有各种特征的实施例也可以由这些各种特征组成或基本上由这些各种特征组成。思考本发明的说明书和实践后,本发明的其他实施例对于本领域技术人员来说将是显而易见的。所提供的对本发明的描述在性质上仅仅是示例性的或解释性的,因此不偏离本发明本质的变动意在包括在本发明范围之内。
在详细解释本发明的至少一个实施例之前,应理解,本发明不限于其在下文描述中阐述的或在以下附图中示出的部件结构和配置详情中的应用。本发明能够具有其他实施例,或能够以多种方式实践或实施。另外,应当理解,本发明中运用的措词和术语仅作说明,不作限制。
现在转到图1a,图1a显示了本发明教导的设备的全局视图。样本小瓶130位于微流控芯片100(本发明中通常也称为基板)的下方,并且小瓶数量或尺寸不受限制。小瓶被配置成容纳可通过设备移动的任何类型的样本,例如一种或多种物质,包括但不限于一种或多种流体、液体、气体、血浆、血清、血液、细胞、血小板、粒子等,或其组合。在本说明书的背景下,术语流体或样本可用于泛指此类一种或多种物质。小瓶直接或间接地连接,例如间接使用空气管件110与芯片的下侧进行可操作地连通。如图1a进一步所示,小瓶也可以通过歧管120连接。图1b显示了微流控芯片100的优选实施例,物质、流体、粒子和/或细胞被注入到微流控芯片的一个外表面,如边缘(例如,图1b中的xz平面)。图1b显示沿最小距离共享面之一(例如xz面或xy面)注入。在这个特定实施例中,边长x160的长度小于边长y170的长度和边长z180的长度。这种配置允许样本在进入芯片上的通道后具有最小的偏差(例如,不需要右转弯,而现有技术中通常需要右转弯)。
图1a显示了歧管120将一个或多个小瓶130连接到微流控芯片100,使得物质、流体、粒子和/或细胞可以被垂直向上地注入或泵送到微流控芯片中。该歧管允许从芯片底部注入物质,同时还以最小化细胞沉降的方式放置电子设备、流量传感器和管件(液体和空气),从而优化吞吐量。空气管件提供压力或真空,当密封时,在歧管装置的范围内提供封闭的系统。在一个实施例中,(一个或多个)小瓶与歧管之间有一段距离,表明没有密封,内部容积的压力为大气压力。这允许从向大气开放的容器中泵送物质或向这种容器泵送物质(从开口容器泵送需要的真空)。歧管以最小化细胞沉降的方式放置电子设备、流量传感器和管件(液体和空气),从而优化吞吐量。
通过从芯片底部注入所容之物,本发明最小化入口管件140和出口管件145中的水平移动,水平移动导致诸如粒子或细胞在(一条或多条)通道150中的沉降等问题。在本例中,出口管件在z和x维度上与入口管件偏离(图1b)。一些实施例中,出口管件相对入口管件偏离、不偏离、笔直、对齐或成角度。这种配置避免了对蜿蜒的或之字形垂直通道的需要,这是因为当前的配置解决了现有技术中出现的沉降问题,例如与细胞和/或粒子组合的流体从侧面以水平方向注入或泵送至芯片,然后必须改变方向和流体动力学才能被向上推动的情况中。歧管和从芯片底部的注入也允许在芯片下方放置额外的元件、部件、机械装置或硬件(见图1a)。
歧管120的工作原理是调节小瓶所容之物上方的空气压力,并为流量传感器和电子设备提供正确的几何构型。如流体或空气管件的管件通过歧管并在另一侧连接到小瓶。加压空气通过歧管的一侧,在歧管内形成封闭的加压系统。通过调节密闭区域内的压力,该系统允许改变如流速和流体动力学等参数。加压区域既在(一个或多个)小瓶130中,又在歧管120中。在另一方面,小瓶不需要任何空气连接,这是因为它向环境大气开放。这样可以对更多种类的容器和来源进行采样。在这种实施例中,对其他一个或多个小瓶施加真空,从而产生压差以驱动来自开口容器的流体流。
一个实施例中,采用基于压力的样本注入。小瓶填装有流体中的样本,用盖子或连接芯片的管件密封。在附接到盖子之前,小瓶可以向空气开放,也可以用隔膜或其他气密设备密封。在一个方面,盖子可含有两个连接器,一个用于诸如气体的流体,另一个用于液体。任选地,该方法实施例还包括提供与样本入口线连通的样本入口线尖端,该样本入口线尖端与第一通道连通。
另一个实施例中,采用基于真空的样本注入。小瓶填装有流体中样本,用盖子或连接芯片的管件密封。在附接到盖子之前,小瓶可以向空气开放,也可以用隔膜密封。在一个方面,盖子可含有两个连接器,一个用于诸如气体的流体,另一个用于液体。任选地,可通过向一个或多个其他小瓶施加真空压力,从向大气开放的小瓶中吸出流体。任选地,该方法实施例还包括提供与样本入口线连通的样本入口线尖端,该样本入口线尖端与第一通道连通。
图2a-b和3a-b显示了芯片保持器200、300。芯片保持器包括引导光源210(例如光纤光源、发光二极管或激光器)的结构以及可装配棱镜的集成棱镜腔220、320。光源由芯片保持器内的集成结构或通道240引导或排列到所需部位。即使在受限的几何环境中(例如在微流控芯片230、330或微流控芯片中的通道上),光纤光源的内置空间也允许照明,例如照明锥250。在优选方面,该光源尤其被精确对准、或定向、或聚焦在分析通道260上。在优选实施例中,芯片保持器包括用于棱镜220、320和光纤光源210的内置空间,允许以受限几何构型进行照明。芯片还包括在保持器底部的孔或开口350,以精确排列本发明所述的流控管件。一个实施例中,可调节螺钉与一个或多个面上的螺纹孔360成为一体,以便恰当定位。
图4a是本发明描述的微流控芯片400的优选实施例。如图所示,流体首先垂直向上行进通过第一通道410,然后与第二水平通道420连通。如图4所示,另一垂直通道430使流体更接近芯片顶部,在该点第四通道440是水平的并且包括分析通道。这些通道可操作地连通至彼此,以允许样本从一条通道到另一条通道移动通过该系统。一些实施例中,样本可以从第一通道流向第二通道,再到第三通道,再到第四通道,或者反向流动,或者两者的组合。可提供泵和/或真空装置,以在通道的开口和/或出口处提供正压和/或负压,使物质能够移动通过通道。分析通道靠近基板的一个或多个外表面,例如芯片的面、边缘或侧面。例如,根据这种配置的分析通道靠近芯片的顶部和侧面,从而改进通过微流控芯片的物质的成像和分析。在优选实施例中,分析通道至芯片顶部和侧面的距离在约1mm到约2mm之间。然而,分析通道至芯片顶部的距离可以在0.1mm到100mm之间,例如从0.1mm到0.2mm、从0.2mm到0.3mm、从0.3mm到0.4mm,等等。换言之,分析通道可能被布置在基板的顶部50%、33%、25%、10%或5%内。根据本发明的水平分析通道的长度可以在约250微米到约10mm之间。然而,分析通道的长度可以在100微米到100mm之间,例如从0.1mm到0.2mm、从0.2mm到0.3mm、从0.3mm到0.4mm等等。换言之,分析通道的长度可以是基板/芯片的高度、宽度或长度的约75%或更少,例如基板/芯片的高度、宽度或长度的50%或更少、33%或更少、25%或更少、10%、或5%或更少。
图4b中显示了两个成像设备450,如机器视觉照相机。一个实施例中,照相机可以位于芯片上方,并且定向为与分析通道正交。在另一个实施例中,照相机可以位于芯片的侧面,并且定向为与流动方向正交或与流动方向成对角线(例如在通道上方、在通道下方或与通道侧面成角度)。一些实施例中,照相机可以被放置在与一种或多种物质流成任意角度都能进行成像的位置,如与一种或多种物质流正交或成90度,或者如从0至90度、或从10至80度、或从30至60度,等等。另一个实施例中,可以使用两个或多个照相机来拍摄分析通道中的细胞或粒子。例如,照相机可以在芯片上方,并且定向为与分析通道正交。第二个照相机可以位于芯片的侧面,并且定向为与流动方向正交或与流动方向成对角线(例如在通道上方、在通道下方或与通道侧面成角度)。如图4b中所示,一个或多个光源460可用于照亮分析通道440,并且这种光源可位于芯片下方并向上、向芯片侧面照射,并且沿流动方向或逆流动方向照射,或者在芯片上方并向下、沿对角线向分析通道照射。
或者,双色镜840或其他适当的光学元件可用于选择性地使特定波长范围的光转向,同时允许其他波长范围的光通过,如图8所示。这将允许照像机810与分析通道对齐放置。如图所示8和9所示,这种情况的实施例有几个,包括将光力激光器830和照相机810放在分析区域的同一端或相反端。还可能需要用于照相机的照明源860,例如图8和9所示,照明源860可能以几种方式定向。光源可能是如一个或多个led的广谱光源,或如激光器的窄光源。照像机可能以单个照像机形式使用,或如本发明所述,作为与其他视点组合的多照像机系统的部分使用。
图4a还显示,光源480(例如激光器)可用于影响细胞流。激光器可以与细胞流对齐放置,也可以与细胞流相反放置。激光器也可以被放置和/或定向为与细胞流正交或成对角线。
本发明的实施例包括用于粒子分析的设备。(参见例如图4-9)本发明的实施例包括至少一个照相机450,用于拍摄微流控通道(例如440)中粒子或细胞的图像。在一个实施例中,包括激光器或其他光力480,如可操作以生成至少一个平行光源光束的平行光源。至少一个平行光源光束包括至少一个光束横截面。本发明的实施例包括基板,基板带有第一通道410,第一通道410在基板中沿垂直方向延伸,使得第一平面基本上沿其长度横穿第一通道410,由此流体样本被从芯片底部注入到基板/芯片中,并且在正压或负压作用下被迫向上。本发明的实施例包括与第一通道正交的第二通道420,因此第二通道420水平布置在基板中,使得第二平面基本上沿其长度横穿第二通道420,并且第二平面与第一平面正交布置。第二通道在芯片的水平方向上。第二通道直接或间接地与第一通道连通。第二通道直接或间接地与短的垂直向上的第三通道430连通,第三通道使通道网络更靠近芯片的顶部。第三通道直接或间接地与位于芯片顶部和/或角落附近的第四水平通道440连通。在优选实施例中,第四通道是最靠近芯片顶部的通道。在一实施例中,第四通道是分析通道。在一个方面中,照相机450定向为与第四通道中的流动方向正交。本发明的实施例包括可操作地连接到第一通道的聚焦粒子射流喷嘴。在本发明的另一方面,第二通道在与第三通道连通之前,要进行大小改变并通过喷嘴。
图4c显示微流控芯片的样本路径的另一实施例。如图所示,流体在芯片中首先沿垂直向上方向行进通过第一通道410,该第一通道410随后直接或间接地与第二水平通道420连通,第二水平通道420在本示例中位于芯片顶部,并在本实施例中包括分析通道。根据这种配置的分析通道靠近芯片的顶部,从而改进通过微流控芯片的物质的成像和分析。在优选实施例中,分析通道至芯片顶部和侧面的距离在约1mm到约2mm之间。然而,分析通道至芯片顶部的距离可以在0.1mm到100mm之间,例如从0.1mm到0.2mm、从0.2mm到0.3mm、从0.3mm到0.4mm等等。换言之,分析通道可能被布置在基板的顶部的50%、33%、25%、10%或5%内。根据本发明的水平分析通道的长度可以在约250微米到约10mm之间。然而,分析通道的长度可以在100微米到100mm之间,例如从0.1mm到0.2mm、从0.2mm到0.3mm、从0.3mm到0.4mm等等。换言之,分析通道的长度可以是基板/芯片的高度、宽度或长度的约75%或更少,例如基板/芯片的高度、宽度或长度的50%或更少、33%或更少、25%或更少、10%、或5%或更少。一些实施例中,基板可包括一条或多条分析通道,如1、2、3、4、5、6、7、8、9或10条分析通道。
图4c还图示光源480(例如激光器)可用于影响如细胞流的物质流。激光器可以与细胞流对齐放置,也可以与细胞流相反放置。激光器也可以被放置和/或定向为与细胞流正交或成对角线。
如图1和4所示,含有细胞或粒子的流体流被指引垂直通过第一通道。一种或多种物质(流体、细胞和/或粒子)通过在第一通道的开口处通过芯片底部进入,并沿垂直方向进入基板。第一垂直通道的长度在100微米到100mm之间,例如从0.1mm到0.2mm、从0.2mm到0.3mm等等。第一通道之后为第二正交/水平通道,在优选实施方案,第二正交/水平通道比第一通道短。第二通道的长度可以在250微米到100mm之间,例如从0.25mm到0.5mm、从0.5mm到0.75mm、从0.75mm到1.0mm等等。第三通道垂直延伸并与第一通道平行。第三通道的长度可以在50微米到100mm之间,例如从0.05mm到0.1mm、从0.1mm到0.15mm、从0.15mm到0.2mm等等。这些通道被布置为可操作地直接或间接连通,以允许一种或多种物质移动通过多条通道。流体流的典型方向由图4a和4c中的流向箭头给出,但可以反向流动。
优选实施例中,第四通道包括分析通道,第四通道为长度在250微米到100mm之间的通道,例如从0.25mm到0.5mm、从0.5mm到0.75mm、从0.75mm到1.0mm等等。在该实施例中,第四通道是最靠近芯片顶部的通道。垂直测量的第四通道与芯片顶部之间的距离可以在100微米到2mm之间,但也可以长达100mm,例如从100微米到200微米、从200微米到300微米、从300微米到400微米,等等。换言之,第四通道可能被布置在芯片的顶部的50%、33%、25%、10%或5%内。如照相机的成像设备可能被定向为与第四通道正交,其距第四通道的距离可以在约100微米到2mm之间,但与第四通道的距离也可能长达100mm,例如从100微米到200微米、从200微米到300微米、从300微米到400微米等等。
一个实施例中,激光器或其他光源具有聚焦透镜元件。图4a描述了本发明在激光器480运行时,发射激光光束,指引光束通过聚焦透镜元件进入第四流动通道440。由于梯度力向激光强度最高的区域吸引粒子,粒子在激光光束内排列。激光散射力沿激光光束传播的方向推动粒子(例如,图4a中从左到右)。
在另一实施例中,除了与第四通道正交定向的照相机或拍摄设备之外,第二照相机或拍摄设备(参见450)还朝向分析(或第四)通道的侧面定向,并且正交对准第四通道或成任何角度对准第四通道;例如,如图4b中所示。为每个细胞拍摄一个正交视图图像,实现了两个方向上的多个细胞属性的计算,例如大小和形状,从而增加了能够为每个细胞获取的信息量。这也将实现细胞体积属性的计算,包括总体积、形状,并提供对不沿与流动方向平行的轴(如图5所示的z轴)对称的细胞的深入了解。使用两个或更多个照相机,可以通过使用例如现有的三维重建算法(例如衍射理论方法或照明旋转方法)组合正交图像,来构造细胞550的基本三维模型。三维模型及其分析将实现对细胞的更精确分析,例如细胞大小、形状、定向,以及微流控芯片第四通道中的一个或多个粒子或一个或多个细胞的其他定量和定性测量。
在图5中,从两个不同的平面显示分析通道540的部分,平面如可以从成像设备成像的平面(参见例如图4)。在第一平面520中,细胞或粒子510的一部分在某一定向上成像。在第二平面530中,同一细胞或粒子的另一部分从另一照相机的不同视角成像。这实现了多细胞属性的计算,为每个照相机每个细胞创建数据矩阵,并创建了细胞或粒子550的三维演示。
随着细胞的不同部分通过(一个或多个)成像设备的焦平面(例如630(xz焦平面)和640(yz焦平面)),当细胞借助例如流体流620移动时,可以为细胞的不同切片成像。这显示在图6a中。在图6a中,细胞或粒子的部分在多个时间点和/或空间点,以不同的定向和从不同的视角成像。该示例中,随着细胞通过焦平面移动和旋转,其在连续的图像中呈现出不同的大小(例如图6a中所示,来自两个不同照相机的、每个平面的四个示例图像)。使用三维重建算法实现了粒子或细胞的更复杂三维渲染650。根据这种渲染,可以推断细胞或粒子的某些特性,例如细胞大小、体积、细胞核以及其他细胞器的部位和大小,以及细胞形貌的测量或概述。此外,由于生物物理或生物化学属性的变化(包括但不限于折射率、双折射或细胞形状或形态),细胞的旋转可以基于光力的转矩的函数来测量。
图6b描绘了芯片内的多平面成像,以及例如随着细胞移动通过焦平面,随时间拍摄的同一细胞的多张图像。在这种情况下,细胞的视图在本领域中被称为“切片”或“图像切片”。图像切片实际上是被成像的光学平面的厚度。图像平面或切片的厚度由成像系统的光学倍率等因素决定。在较高倍率下,物镜的工作距离减小,因此需要使透镜更靠近待成像的细胞或粒子。在一个实施例中,可以使用激光器或其他光力670来影响分析通道中的细胞流。优选实施方案中,可通过移动激光器和/或照相机,或使用流体动力聚焦调整(一条或多条)流或位置,有目的地引诱细胞或粒子进入通道的焦平面或从通道的焦平面出来,以进行成像。使用例如压电致动器或线性电光机工作台可移动激光源距离660。这可能以每个细胞或每个群体的方式进行。可改变细胞的流体动力聚焦,以影响细胞的初始位置和轨迹。例如,由于向激光强度最高的区域吸引粒子的梯度力,粒子可能在激光光束内的焦平面中被排列或定向。激光散射力沿激光光束传播的方向推动粒子。参见图6b。在该例中沿x轴移动激光器,实现了对细胞不同部分的特征的成像,如盘680图示。这可能代表例如细胞核、细胞器、包涵体或细胞或粒子的其他特征。由于梯度力的作用,激光器把细胞拉到其中心。还预期到,两个或更多个照相机可能增加详细度和精确度。
图7中所示的本发明实施例是静态模式,其中粒子或细胞710由于光力730和流控力735的平衡停止在特定的差异保留部位。光力可通过例如激光器或平行光源来施加。如图5和6a-b所示和所述,可在多个平面拍摄图像。流量传感器用于测量给定激光器功率下,每个粒子在流中停止时的流速。因为光力和流控力是平衡的,所以流控阻力(即来自流速和通道方向的阻力)等于光力。可以按这种方式依次测量每个细胞的属性。虽然不是高吞吐量测量系统,但本发明实施例实现了对被捕捉细胞的近距离观察和成像,并且还实现由细胞中生物化学或生物变化而导致的光力的动态变化。含有化学品、生化制品、细胞或其他标准生物药剂的试剂流可被引进到流动通道中,以与被捕捉的(一个或多个)细胞相互作用。可以通过在单个或多个细胞的实验期间测量光力中的变化,来定量监测这些动态过程。
一个实施例中,顺着或逆着分析通道中的流动将照相机或其他成像设备定向和/或聚焦,使得照相机或其他成像设备与流动对齐和平行(参见例如图8和图9)。图8显示了与分析通道820和激光器或平行光源830对齐的照相机810。双色镜或类似设备840将激光器光835从照相机反射到别处,以防止损坏,但是使照明源860产生的光865通过,以实现成像。照相机被定向为与流体流870平行,使得在一个实施例中,细胞或粒子880移动离开照相机。照明源被定向为与通道和激光器正交。穿过激光器光并反射照明光的第二双色镜845用于指引照明光和激光器光通过通道。该配置的另一个实施例调换激光器和照明源的部位,以使得激光器与通道正交,照明源与通道平行。第二双色镜仍将指引激光器光和可见光通过通道。
图9显示了另一个实施例。这种情况下,照相机或成像设备910被定向为使得细胞或粒子980在流体流970中朝照相机行进。因此,照相机和激光器930位于通道同侧,而照明源960位于通道的相反端。两个双色镜940和945用于指引激光器光935和照明光965进入通道,向照相机指引照明光,并使激光器光从照明源转向到别处。该配置的另一个实施例调换激光器和照相机的位置,以使得激光器与通道正交,照明源与通道平行。然后第二双色镜945将指引激光器光通过通道,并向照相机指引照明光。
可选地,本发明的实施例还包括至少一个光学元件,其位于光力源和上述第四通道之间,并且可操作该至少一个光学元件来产生标准tem00模式光束、标准tem01模式光束、标准tem10模式光束、标准厄米高斯光束(hermite-gaussianbeam)模式、标准拉盖尔高斯光束模式、贝塞尔光束,或标准多模光束。可选地,至少一个光学元件包括标准圆柱透镜、标准轴棱锥、标准凹面镜、标准环面镜、标准空间光调制器、标准声光调制器、标准压电镜阵列、衍射光学元件、标准四分之一波片,和/或标准半波片。可选地,光力源可包括标准圆偏振光束、标准线偏振光束或标准椭圆偏振光束。
可选地,本发明包括一种设备,其包括微流控通道、被光学器件聚焦到微流控通道中的激光器光源、在操作中通过电极连接到微流控通道的电场源;液体中的流动粒子通过微流控通道;以及操纵激光器光和电场以联合作用于微流控通道中的粒子,从而基于大小、形状、折射率、电荷、电荷分布、荷迁移率、介电常数和/或可变形性来分离粒子。在又一个实施例中,一种设备包括微流控通道,该微流控通道被配置成通过(1)电极系统或(2)绝缘体介电泳(dep)系统向通道内部提供dep场,还包括被光学器件聚焦到微流控通道中的激光器光源;液体中的复数个流动粒子进入微流控通道;以及联合运行激光器光与场来作用于微流控通道中的粒子,以捕捉粒子或改变其速度,其中上述dep场为线性或非线性。该设备的另一个可能的实施例包括微流控通道,该微流控通道包括入口和复数个出口,还包括激光器光源,其被光学器件聚焦,以在与微流控通道中流速相匹配的临界角穿过微流控通道,以对粒子产生光力,并同时最大化所选粒子在激光器光中的停留时间,从而将粒子分离到复数个出口,其中可操作激光器光以对流动通过微流控通道的粒子施加力,借此将粒子分离到复数个出口中。
可选地,本发明的实施例还包括与一条或多条通道连通的至少一个粒子询问单元,通道如(一条或多条)分析通道,特别是第四通道。粒子询问单元包括标准照明器、标准光学器件和标准传感器。可选地,至少一个粒子询问单元包括标准明视场成像仪、标准光散射检测器、标准单波长荧光检测器、标准光谱荧光检测器、标准ccd照相机、标准cmos照相机、标准光电二极管、标准光电倍增管、标准光电二极管阵列、标准化学发光检测器、标准生物发光检测器和/或标准拉曼光谱检测器。
与第四通道连通的至少一个粒子询问单元包括基于激光力的装置或设备,其有助于细胞疾病的识别、选择和分类。在一方面,该单元利用由粒子大小、形状、折射率或形态的变化引起的光学压力的固有差异作为分离和表征粒子的手段。在一个方面,近红外激光器光束对细胞施加物理力,然后对其进行测量。借助辐射压力的光力,当与粒子上的流控阻力平衡时,导致可用于识别不同粒子的粒子速度变化,或基于固有差异的粒子群变化。流控和光力平衡也可以用来基于粒子固有属性改变粒子之间的相对位置,从而导致物理分离。询问单元的另一实施例包括用于粒子分析和/或分离的设备,例如至少一个平行光源,可操作其生成至少一个平行光源光束。至少一个平行光源光束包括至少一个光束横截面。
本发明的实施例涉及在上文整体式设备中论述的几个上述设计要素的组合。实施例还包括使用此类设备的方法。图1图示了这种整体式设备的示例。本发明的图示实施例是一个五层结构,所有五个层彼此粘合以产生固态微流控芯片,尽管芯片可能是与粘合层相反的一种结构。芯片的制造可以使用数种标准材料,包括但不限于熔融石英、冕玻璃、硼硅酸盐玻璃、钠钙玻璃、蓝宝石玻璃、环烯烃聚合物(cop)、聚(二甲基)硅氧烷(pdms)、oste、聚苯乙烯、聚甲基丙烯酸甲酯、聚碳酸酯、其他塑料或聚合物。该芯片允许样本输入、流体动力聚焦、光学询问、成像、分析、样本离开以及激光器光进出区域的透明光学通路。实施例中的芯片也可能以3d打印、模制或以其他方式成形。
可选地,至少一种粒子类型包括复数种粒子类型。复数种粒子类型中的每种粒子类型包括各自的固有属性和各自的诱导属性。可选地,固有属性包括大小、形状、折射率、形态、内源荧光和/或长宽比。可选地,诱导属性包括变形、角定向、旋转、旋转速率、抗体标记荧光、适体标记荧光、dna标记荧光、染色标记荧光、差异保留度量和/或梯度力度量。该方法实施例还包括基于固有属性和诱导属性中的至少一项,根据各自的粒子类型,来识别和分离复数个粒子。可选地,该方法实施例还包括询问或操纵样本流。可选地,询问样本流包括确定粒子类型的固有属性和诱导属性中的至少一项,以及测量复数个粒子的粒子速度。至少一种固有属性的测量应用范围广泛,包括但不限于:确定细胞样本的病毒感染性(在特定细胞群中存在的功能性感染性病毒粒子的数量,类似于噬斑试验或终点稀释试验),以便进行病毒定量、过程开发和监测、样本释放试验、不定因素测试、临床诊断、生物标志物发现;就抗体或蛋白质确定细胞生产力,以便进行过程开发和监测;确定作为基于细胞的疗法产生的细胞的功效、质量或激活状态,包括cart和其他肿瘤学应用和干细胞;确定化学物质、细菌、病毒、抗菌素或抗病毒药物对特定细胞群的影响;以及确定研究或临床细胞样本的疾病状态或可能性。可选地,光力源包括至少一个光束轴,样本流包括样本流轴。确定粒子类型的固有属性和诱导属性中至少一项的步骤,以及测量复数个粒子的粒子速度的步骤一起组成光束轴从样本流轴的偏移。可选地,确定粒子类型的固有属性和诱导属性中至少一项的步骤,以及测量复数个粒子的粒子速度的步骤一起组成从样本流轴向至少一个光束轴偏移的复数个粒子中一个粒子的斜度和轨迹的计算。
本领域技术人员将认识到,可能基于给定应用或设计的要求和规范单独或以任何组合使用这些特征,或省略这些特征。当实施例谈及“包括(comprising)”某些特征时,应当理解,该实施例或者能够“由”或“基本上由”上述特征中的任意一条或多条“组成(consist)”。思考本发明的说明书和实践后,本发明的其他实施例对于本领域技术人员来说是将是显而易见的。
应特别注意的是,本说明书中提供了值的范围,该范围的上限和下限之间的每个值也被具体公开。这些较小范围的上限和下限也可以独立地包括在范围内或从范围中排除。除非上下文另有明确规定,单数形式“a”、“an”和“the”包括复数指代。说明书和示例应被视为是示范性的或解释性的,并且不偏离本发明本质的变化包括在本发明的范围之内。此外,本发明中引用的所有参考文献均借引用单独地全文并入于此,这些参考文献的引用,旨在提供对本发明的使能公开进行补充的有效方法,并提供详细说明本领域普通技术水平的背景。
- 还没有人留言评论。精彩留言会获得点赞!