用于电镀移动的金属条的方法和由此制造的镀层金属条与流程
本发明涉及一种用于在连续高速电镀生产线中制造镀层钢基体的方法,并且涉及一种使用所述方法制造的镀层金属条。
背景技术:
电镀或者(简称)镀是这样的工艺,其使用电流还原溶解的金属阳离子,使得它们在电极上形成粘附的金属镀层。电镀或者电沉积主要用于改变物体的表面特性(例如,抗磨损性、防腐、润滑、美学品质、等)。待电镀的部分是电流中的阴极。通常,阳极由待电镀在该部分上的金属制成。两个部件均浸入在称作电解液的溶液中,所述电解液包含一种或者多种溶解的金属盐以及其它离子,所述金属盐或者其它离子允许电流流动。电源将直流电供应到阳极,从而氧化包含阳极的金属原子并且允许金属原子溶解在溶液中。在阴极处,电解质溶液中的溶解金属离子在溶液和阴极之间的交界面处还原,使得它们“析出”到阴极上。针对流经电路的电流来说,阳极溶解的速率等于阴极被电镀的速率。以这种方式,电解质镀液中的离子由阳极连续补充。
其它电镀工艺可以使用非自耗阳极,诸如铅或者碳。在这些技术中,必须在镀液中补充待电镀的金属的离子,因为所述离子从溶液中析出。
镀铬是将薄的铬层电镀到金属物体上的技术。铬层能够为装饰性的,提供抗腐蚀,或者增加表面硬度。
传统上,通过使电流通过包含六价铬(Cr(VI))的电解质溶液来实现铬的电沉积。然而,使用Cr(VI)电解质溶液存在的问题在于Cr(VI)化合物具有毒性和致癌特性。因此,近年来的研究集中在寻找基于Cr(VI)的电解质的替代方案。一种替代方案提供了一种基于Cr(III)的电解质,原因在于此类电解质没有毒性并且提供了与从Cr(VI)电解质溶液中沉积的镀层类似的铬镀层。
对于一些类型的包装钢来说,生产了镀铬的钢。用于包装目的的镀铬的钢通常是钢板或者钢条,所述钢板或者钢条电解地涂覆有铬层和氧化铬层,其中,镀层的厚度小于20nm。原名叫TFS(无锡钢),现在更广为熟知为首字母缩略词ECCS(涂覆有电解铬的钢)。ECCS通常应用在制造不必焊接的DRD(拉拔&再拉拔)两件式罐和部件中,诸如端部、盖、冠状瓶塞、四旋盖和喷雾器底部和顶部。ECCS擅长粘附至有机镀层(漆层和聚合物层),如PET或者PP镀层,其提供了针对很宽范围的侵蚀性填充产品的可靠保护,并且还提供了优越的食品安全标准(不含双酚A和BADGE)。迄今为止,基于Cr(VI)工艺生产ECCS。传统的Cr(III)工艺被证实不能复制基于Cr(VI)的层的质量,原因在于Cr(III)工艺导致产生非晶形层和/或多孔层,而不是晶形层和致密层。然而,近年来的研究显示基于Cr(III)的电解质能够成功地沉积镀层,如WO2013143928论证的那样。
在工业过程中,重要的是快速生产以及节省成本。然而,传统工艺需要随着条速度的增大而增大电流密度。更高的电流密度导致更快的沉积速度,但是还导致用于电力和高电功率设备的更高成本。
技术实现要素:
本发明的目的在于提供一种方法,所述方法是在更低电镀电流密度的条件下以高速在单个电镀步骤中在钢基体上提供铬-铬氧化物(Cr-CrOX)层。
本发明的目的还在于由简单的电解质以高速在单个电镀步骤中在钢基体上制造铬-铬氧化物(Cr-CrOX)层。
本发明的目的还在于基于三价铬化学物由简单的电解质以高速在钢基体上电镀铬-铬氧化物层来生产铬-铬氧化物(Cr-CrOX)层。
通过在连续高速电镀生产线中以至少100m/min的线速度(v1)操作来生产涂覆有铬金属-铬氧化物(Cr-CrOX)镀层的钢基体来实现这些目的中的一个或者多个,其中,通过使用电镀工艺由单种电解液使移动通过生产线的条形导电基体的一侧或者两侧涂覆有铬金属-铬氧化物(Cr-CrOX)镀层,其中,所述基体是作为阴极的钢基体,并且其中,通过因将H+离子还原为H2(g)而在基体/电解液交界面处增加pH值(即,表面pH值)来驱使CrOX沉积,并且其中,通过从电解液主体向基体/电解液交界面的H+离子的扩散通量来抵消pH值的增加,并且其中,通过增加电解液的运动粘度和/或通过使条和电解液顺流地移动通过电镀生产线来减小从电解液主体向基体/电解液交界面的H+离子的扩散通量(其中,钢条以速度(v1)输运通过电镀生产线,并且其中,电解液以速度v2输运通过所述条的电镀生产线),由此减小了沉积CrOX的电流密度并且减少了形成在基体/电解液交界面处的H2(g)的量。根据金属的类型,能够将金属氧化物中的一些进一步还原为金属。本发明人发现的是,这发生于Cr的情况中。
术语“金属氧化物”涵盖所有包括MexOy的化合物,其中,x和y可以是整数或者实数,而且还包括如氢氧化物Mex(OH)y及其混合物的化合物,其中,Me=Cr。
高速连续电镀生产线定义为这样的电镀生产线,通常为条形式的待电镀的基体以至少100m/min的速度移动通过所述高速连续电镀生产线。钢条的卷定位在电镀生产线的进入端处,其中,所述卷的孔眼在水平面中延伸。然后,卷绕的条的前端被展开并且被焊接到已经处理的条的尾端。在离开生产线后,卷再一次分离并且成卷、或者被切割成不同长度而且(通常)成卷。电沉积工艺因此能够连续而不会中断,并且通过使用条加速器而避免在焊接期间降速的需要。优选的是使用允许甚至更高速度的沉积工艺。因此,根据本发明的方法优选地允许在连续高速电镀生产线中生产镀层钢基体,所述连续高速电镀生产线以至少200m/min的直线速度、更加优选地以至少300m/min的直线速度、甚至更加优选地以至少500m/min的直线速度操作。尽管对于最大速度没有限制,但是明确的是:速度越高,控制沉积工艺、防止拖延以及控制电镀参数和其限制变得更加困难。所以,适当的最大速度限制为900m/min。
本发明涉及在条电镀生产线中通过电解从含水电解质中沉积铬和铬氧化物层(Cr-CrOX)。CrOX的沉积通过因在条表面(作为阴极)处将H+(更加正式地:H3O+)还原为H2(g)而增加表面pH值来驱使,而非通过常规的电镀工艺来驱使,在常规电镀工艺中,根据Men+(aq)+n·e-→Me(s)通过电流来释放金属离子。在该工艺中,当条速度增加时(假设金属离子向基体的扩散并不作为限制因素),增加电流密度足以实现相同的电镀厚度。
在一个实施例中,本发明涉及在条电镀生产线中通过电解从三价铬电解液来沉积铬和铬氧化物层(Cr-CrOX)。CrOX的沉积通过因H+的还原而增加表面pH值来驱使,而非通过常规电镀工艺驱使,在所述常规电镀工艺中,通过电流释放金属离子。在图3中示出的线性关系为下述假设提供了依据,所述假设为由扩散通量来驱使Cr(HCOO)(H2O)3(OH)2(s)在电极表面上的沉积。在第二阶段中,Cr(HCOO)(H2O)3(OH)2(s)沉积物部分被进一步还原为Cr金属并且部分转换成Cr碳化物。
由基于Cr(III)的电解液的沉积工艺的机理如下。当电流密度增加时,表面pH值变得更加碱性,并且如果pH>5,则Cr(OH)3沉积。通过假设以下平衡反应链能够定性解释这种实验行为:
或者,更加精确地,在甲酸根离子(HCOO-)是络合剂的情况中:
状况I:
[Cr(HCOO)(H2O)5]2++OH-→[Cr(HCOO)(OH)(H2O)4]++H2O
状况II:
[Cr(HCOO)(OH)(H2O)4]++OH-→Cr(HCOO)(OH)2(H2O)3+H2O
状况III:
Cr(HCOO)(OH)2(H2O)3+OH-→[Cr(HCOO)(OH)3(H2O)2]-+H2O
当将铬的沉积针对电流密度进行绘制时,可看到状况I-III(如图4所示)。状况I是存在电流但是还没有沉积的区域。表面pH值对于铬沉积而言不够充分。状况II是当沉积开始并且随着电流密度线性增加直到其达到峰值并在状况III中下降时的区域,在状况III中,沉积物开始溶解。
当表面pH值变得过于碱性(pH>11.5)时,Cr(OH)3将再次溶解:
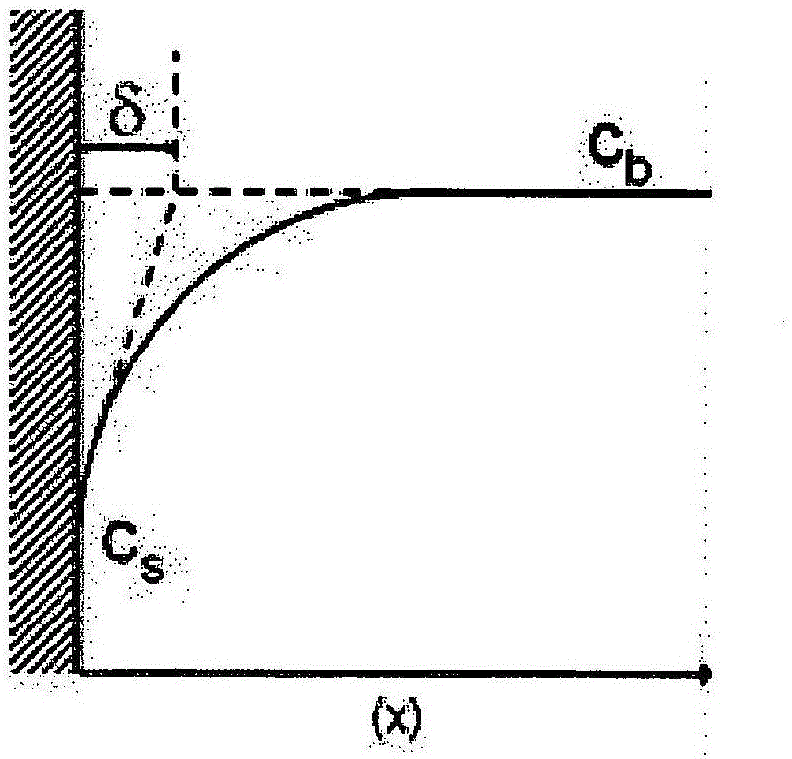
因为H+离子在条的表面处被还原,所以H+离子的浓度将在条的表面附近降低。结果,将在条的表面附近逐渐建立浓度梯度。图1示出了在电极附近的能斯特扩散层(CS:表面浓度[mol/m-3],Cb:主体浓度[mol/m-3],δ:扩散层厚度[m],X:与电极相距的距离[m])。
术语“单个电镀步骤”旨在表示在一个沉积步骤中从一种电解液沉积Cr-CrOX。当沉积发生在状况II内的电流密度条件下时,在复合物Cr(HCOO)(H2O)3(OH)2(s)沉积在基体表面上之后立即形成Cr金属、Cr碳化物和一些剩余的CrOX。在状况II中使用的电流密度越高,则最终沉积物中的Cr金属的量越大(见图7)。明显地,可以选择连续地沉积一个或者多个层。当沉积例如两层时,则这些层中的每一层均能够在一个沉积步骤中从一种电解液沉积。
在众所周知的能斯特扩散层概念中,假设厚度为δ的滞止层位于电极表面附近。在该层的外部,对流在主体浓度处保持浓度均匀。在该层内,质量仅仅通过扩散发生。
由费克第一定律给出在条的表面处的扩散通量J:
其中,D是扩散系数[m2s-1]。
在科学文献中,已经针对许多实际情况推导出了扩散层厚度的表达式,如旋转圆盘(Levich)、旋转圆柱(Eisenberg)、通道中的流动(Pickett)、以及移动条(Landau)。根据由Landau推导的表达式,在条的表面处的扩散通量与条速度的0.92次幂成比例:J≈VS0.92。这表示扩散层厚度在条速度增加的条件下变得更薄。
对于常规的条电镀工艺,例如,电镀锡、镍或者铜,扩散通量随着条速度增加而增加是非常有利的,原因在于能够施加更高的电流密度并且获得更高的沉积速率。在这些金属的电镀工艺中,通过电流在阴极处使金属离子放电(还原)成金属,并且被还原的金属离子(即,金属原子)沉积到阴极(金属条)上。
但是,在CrOX沉积的情况中,扩散通量随着条速度增加而增加起相反作用,原因在于将H+离子从电解液主体更加快速地传递(补充)到条表面阻碍了表面pH值的增加,而沉积Cr(OH)3需要表面pH值的增加。因此,在更高的条速度的条件下,沉积相同量的Cr(OH)3需要越来越高的电流密度。图2示出了经由H+的电解来沉积Cr(OH)3导致阴极(即,钢条)处的表面pH值的增加。一旦CrOX(例如Cr(OH)3形式)被沉积,则该沉积物的一部分被还原为金属Cr。
图3示出了随着沉积60mg/m2的Cr如Cr(OH)3所需的条速度而变化的电流密度。这些数据从旋转圆柱电极(RCE)的研究中获得,通过使针对RCE的和条电镀生产线(SPL)的质量传递速率方程相等来研究旋转圆柱电极。明确地,需要越来越高的电流密度以在更高的条速度条件下沉积相同数量的Cr(OH)3。
更高的电流密度不仅仅需要更大功率(并且成本高昂)的整流器,而且还面临在阳极处发生不期望的副反应的风险,如将Cr(III)氧化为Cr(VI)。而且,当在条的表面处形成更多的H2(g)时,需要具有更大容量的排气系统来保持低于氢气-空气混合物的爆炸极限。而且,在更高电流密度条件下,损坏阳极上的催化剂层的风险增大。
而且,当在条的表面处形成更多的H2(g)时,因附着到金属表面上的氢气泡而导致在镀层中形成小孔的风险也升高。
因此,本发明基于增加扩散层厚度的想法,这与直觉相反,因为大多数电沉积反应都是从薄扩散层中获益。
本发明人发现的是,能够通过增加电解液的运动粘度来增加扩散层的厚度。
现在将通过非限制性实施例来进一步解释本发明。
在WO2013143928中,电解液用于Cr-CrOX沉积,其包括120g/l的碱性硫酸铬、250g/l的氯化钾、15g/l的溴化钾和51g/l的甲酸钾。通过添加硫酸将pH值调节为在25℃测量条件下介于2.3和2.8之间。进一步的研究显示,优选地是用硫化物替代氯化物,以防止形成Cl2(g)。本发明人发现基于氯化物的电解液中的溴化物不能防止在阳极处将Cr(III)氧化成Cr(VI),如在US3954574、US4461680、US4804446、US6004448和EP0747510中错误声明的那样,但是溴化物降低了氯的形成。因此,当用硫化物替代氯化物时,能够从电解液安全地移除溴化物,原因在于其不再发挥作用。通过使用适当的阳极,能够防止在基于硫化物的电解液中在阳极处将Cr(III)氧化成Cr(VI)。电解液由Cr(III)盐的水溶液、优选地由Cr(III)硫酸盐、呈硫酸钾形式的导电率增强盐和作为螯合剂的甲酸钾以及可选地一些硫酸构成,以获得在25℃条件下的理想pH值。这种溶液作为与本发明比较的基准。
表1a:具有K2SO4的三价铬电解液
通过添加H2SO4将pH值调整到25℃条件下的2.9。
表1b:具有Na2SO4的三价铬电解液
通过添加H2SO4将pH值调整到25℃条件下的2.9。明确地,Na2SO4的溶解性(1.76M)远远高于K2SO4的溶解性(0.46M)。对于电沉积实验而言,选择包含氧化铱或者混合金属氧化物的催化镀层的钛阳极。通过使用氢气体扩散阳极能够获得类似结果。RCE的旋转速度保持恒定为10s-1(Ω0.7=5.0)。基体为0.183mm厚的冷轧黑钢板材料且圆柱体的直径为113.3mm×φ73mm。在电镀之前,在以下条件下清洁以及活化圆柱体。
表2:基体的预处理
安东帕(Anton Paar)MCR 301型电流计用于粘度测量。通过将测量的动力粘度(kg/m/s)除以密度(kg/m3)计算得到运动粘度υ(m2/s)。利用辐射计CDM 83导电计测量导电率。
粘度和导电率在50℃条件下的测量结果如下:
表3:粘度和导电率
尽管对于相同的浓度来说钾溶液的导电率高于钠溶液的导电率,但是250g/l的硫酸钠的导电率高于80g/l硫酸钾的导电率。
表的最后一列表示是否将甲酸钾(51.2g/l或者0.609M)或甲酸钠(41.4g/l或者0.609M)用作络合剂。甲酸盐的差异还解释了具有250g/l的Na2SO4的电解液的导电率小于具有200g/l的Na2SO4的电解液的导电率的原因。
针对RCE的扩散通量与υ﹣0.344成比例(Eisenberg,J.Electrochem.Soc.,101(1954),306)
J=0.0642D0.644v-0.344r0.4(cb-cs)ω0.7
其中,ω=2πΩ
带入测量的运动粘度值(扩散系数D被约去,因为其为比值),预期针对Na2SO4电解液的扩散通量(以及电流)将比针对K2SO4电解液的扩散通量(以及电流)小24%:
当电流变得更小时,电势也将变得更小,原因在于对于电流中的所有欧姆电阻而言电势与电流直接成正比(根据欧姆定律:V=IR)。忽略电极处的极化电阻,由以下方程给出整流器功率:
P=VI=I2R
其中,R代表电路中的所有电阻(电解液,汇流条、母线接头、阳极、导电辊、碳刷、条、等)的和。因此,预期的整流器功率将节约大约42%(0.762=0.58)。
对于条电镀生产线来说,预期的整流器功率将节约更多(60%!),原因在于扩散通量与υ﹣0.59成比例(Landau,Electrochem.Society Proceedings,101(1995),108):
J=0.01D0.67v-0.59L-0.08(Cb-Cs)vs0.92
而且,Na2SO4电解液的导电率大了11%,从而导致进一步的整流器功率节约。
Cr(mg/m2)针对i(A/dm2)的沉积显示:在Cr-CrOX沉积开始之前具有阈值,达到峰值后突然锐减,结束于稳定阶段。从K2SO4切换成Na2SO4电解液显示出对于Cr-CrOX沉积来说需要低得多的电流密度。对于沉积100mg/m2Cr-CrOX而言,仅仅需要21.2A/dm2而非34.6A/dm2(见图4中的箭头)。基于扩散通量的比(0.61对0.76),减少量大于预期,这可能由沉积机理的近似特征所导致。
XPS测量显示:在由Na2SO4或者K2SO4电解液制造的Cr-CrOX沉积物的成分中不存在显著差异。由于需要更低的电流密度,孔隙率随着运动粘度更高的电解液而减小,并且结果减少了H2(g)泡的形成。还通过XPS分析了具有大约100mg/m2Cr-CrOX的镀层重量的样本(表4)。
表4:通过XPS分析样本
剩余物是一些Cr2(SO4)3(分别为0.8和0.6mg/m2)
在表5中给出了用于沉积100mg/m2的Cr(这对于多种应用而言为适当的目标值)的电流密度和沉积最大量的Cr的电流密度。导电的盐的浓度由其溶解极限限制。
表5:沉积100mg/m2的Cr所需的电流密度
明确地,通过使用硫酸钠作为导电盐(由图6的分解视图的箭头表示)而不使用甲酸钾或者硫酸钾将沉积100mg/m2的Cr所需的电流密度转移至低得多的值。
除了更低的电流密度和相关的明显优势之外,还存在降低由于在更低电流密度条件下在阳极处的不期望的副反应而形成Cr(VI)(在Cr-CrOX的情况中)风险的优势,延长了起催化作用的氧化铱镀层的使用寿命,并且能够使得用于H2(g)的排气系统更小(小得多),原因在于产生了更少的H2(g)。
在本发明的一个实施例中,通过使用基于三价铬电解液的电镀工艺从单种电解液使移动通过生产线的导电基体的一侧或者两侧涂覆有Cr-CrOX镀层,所述三价铬电解液包括三价铬化合物、螯合剂和导电率增强盐,其中,电解质溶液优选地没有氯离子而且还优选地没有缓冲剂。适当的缓冲剂是硼酸,但是硼酸是潜在的有害化学物,因此如果可能应当避免使用硼酸。这种相对简单的含水电解液被证明在沉积Cr-CrOX中最有效。不存在氯化物并且优选地不存在硼酸简化了化学过程,而且排除了形成氯气的风险,而且还由于不存在硼酸而使得电解液更加良性。该镀液允许在一个步骤中并且从单种电解液沉积Cr-CrOX,而不是在一种电解液中首先形成Cr金属,然后在另一种电解液中在顶部上产生CrOX镀层。结果,氧化铬分布在由一个步骤的沉积工艺获得的铬-铬氧化物镀层中,而在两个步骤的工艺中,铬氧化物集中在铬-铬氧化物镀层的表面处。
根据US6004448,需要两种不同的电解液经由三价铬化学物生产ECCS。从具有硼酸缓冲剂的第一种电解液沉积铬金属,而随后从没有硼酸缓冲剂的第二电解液沉积铬氧化物。根据该专利申请,在连续高速生产线中,产生了这样的问题,即,来自第一电解液的硼酸将被越来越多地引入到第二种电解液种,原因在于其被从包含第一种电解液的容器拖出到包含第二种电解液的容器中,并且因此铬金属的沉积增加而铬氧化物的沉积减小或者甚至被终止。通过将络合剂添加到第二种电解液中来解决这个问题,所述络合剂中和了已经被引入的缓冲剂。本发明人发现的是,对于经由三价铬化学物生产ECCS而言,仅需要一种简单的不包含缓冲剂的电解液。尽管这种简单的电解液不包含缓冲剂,但是本发明人发现的是,由于铬氧化物被部分还原为铬金属,出人意料地从这种电解液中也沉积了铬金属。该发现大幅简化了整个ECCS生产,原因在于不再像US6004488中错误假设的那样需要使用具有缓冲剂的电解液来沉积铬金属,而是仅需要一种简单的没有缓冲剂的电解液,这还解决了这种电解液被缓冲剂污染的问题。
在本发明的一个实施例中,从电解液主体向基体/电解液交界面的H+离子的扩散通量通过增加电解液的运动粘度和/或通过使条和电解液顺流移动通过电镀生产线而减小,其中,金属条被以至少100m/s的速度(v1)输运通过电镀生产线,并且其中,电解液以v2(m/s)的速度输运通过条电镀生产线。两者均导致更厚的扩散层,这对于通过减小从电解液主体向基体/电解液交界面的H+离子的扩散通量以阻止pH值的增大而沉积Cr-CrOX来说是有益的。
在本发明的一个实施例中,通过使用适当的导电率增强盐来增加运动粘度,所述盐的浓度使得当在50℃的条件下测量运动粘度时能够获得具有至少1·10-6m2/s(1.0cSt)的运动粘度的电解液。注意的是,这不意味着电解液仅在50℃的条件下使用。50℃的温度在此旨在提供测量运动粘度的参考点。在本发明的一个优选实施例中,当在50℃的条件下测量时,电解液的运动粘度至少为1.25·10-6m2/s(1.25cSt),更加优选的为至少1.50·10-6m2/s(1.50cSt),乃至更为优选地为1.75·10-6m2/s(1.75cSt)。尽管物理上来说运动粘度的上边界不受限制,只要电解液保持为液体即可,但是每次增加将导致更粘的电解液,并且在某一阶段粘度将开始导致出现增加的拖出(更粘的液体将粘到条上)以及更严重的擦拭行为。用于运动粘度的适当上限是1·10-5m2/s。
在本发明的一个实施例中,通过使用硫酸钠作为导电率增强盐来增加运动粘度。通过使用在水中具有更高溶解性的这种盐,能够将导电率增加至与硫酸钾相同的水平乃至超越硫酸钾并且同时产生了更高的运动粘度。
在本发明的一个实施例中,通过使用增稠剂来增加运动粘度。还能够通过添加增稠剂使得电解液更粘来增加运动粘度。
增稠剂能够是无机的(例如,热解硅石)或者有机的(例如多糖)。适当的多糖凝胶或者增稠剂的示例是纤维素醚类(诸如,甲基纤维素、羟丙基甲基纤维素、羟丙基纤维素、乙基纤维素或者羧甲基纤维素钠)、藻酸或者其盐(诸如海藻酸钠、阿拉伯胶、刺梧桐胶、琼脂、瓜尔豆胶或者羟丙基瓜耳胶、槐树豆胶)。能够使用由微生物发酵制成的多糖,例如,黄原胶。能够使用多糖的混合物并且可以有利地赋予其温度稳定的低剪切黏度。替代的有机凝胶剂是明胶。替代地,能够使用合成的聚合物凝胶或者增稠剂,诸如,丙烯酰胺的聚合物或者丙烯酸或者其盐,例如,聚丙烯酰胺、部分水解聚丙烯酰胺或者聚丙烯酸钠、或者聚乙烯醇。优选地增稠剂是多糖。
在本发明的一个实施例中,螯合剂是甲酸钠。通过使用甲酸钠而非例如甲酸钾进一步简化了化学过程。沉积层的成分不受这种变化的影响。
在本发明的另一个实施例中,通过使条基体和电解液顺流通过条电镀生产线而增加扩散层的厚度,其中,(v1/v2)的比至少为0.1和/或至多为10。如果v1/v2=1,则条基体和电解液以相同的速度移动。优选的是,流态是层流。湍流将对扩散层的厚度造成不利影响。
在本发明的一个实施例中,(v1/v2)的比至少为0.25和/或至多为4。在本发明的一个优选实施例中,(v1/v2)的比至少为0.5和/或至多为2。
在本发明的一个实施例中,多个(>1)Cr-COX镀层沉积到导电基体的一侧或者两侧上,其中,每一层在单个步骤中在接续的电镀槽中沉积,随后通过同一电镀生产线或者随后通过接续的电镀生产线。
通过因在条表面(阴极)处将H+还原为H2(g)而增加表面pH值来驱使沉积CrOX的机制。这意味着在条表面处形成氢气泡。这些气泡中的大部分在电镀处理期间被驱逐出,但是少数气泡可能附着到基体上一段时间,该时间足以在这些点处导致底侵作用(underplating),从而可能导致金属以及金属氧化物层(Cr-CrOX)出现小的孔隙率。通过在导电基体的一侧或者两侧上将多层(>1)Cr-CrOX镀层沉积在彼此上来降低镀层的孔隙率。例如,通常来说,首先沉积铬(Cr)层,然后在第二工艺步骤中在顶部上产生CrOX层。在根据本发明的工艺中,同时形成Cr和CrOX(即,在一个步骤中),这表示为Cr-CrOX层。然而,即使具有单层并且因此在Cr-CrOX镀层中具有一些孔隙的产品也通过了用于包装应用的所有性能测试,在所述包装应用中具有Cr-CrOX镀层的钢基体设置有聚合物镀层。因此其性能与具有聚合物镀层的传统(基于Cr(VI))ECCS材料相当。通过在导电基体的一侧或者两侧上将多层(>1)Cr-CrOX镀层沉积在彼此上来降低空隙率。在这种情况中,在单个步骤中沉积每一单个Cr-CrOX层,并且例如在后续电镀槽或者在后续电镀生产线中或者通过多于一次地通过单个电镀槽或者电镀生产线来沉积多个单层。这进一步地整体上减小了Cr-CrOX镀层系统的孔隙率。
在多层的沉积之间,可以期望乃至需要的是,从条的表面移除氢气泡。这例如可以通过使条离开并且再进入电解液、通过使用脉冲板整流器或者通过诸如震动行为或者擦拭行为的机械行为发生。
在本发明的一个优选实施例中,电解液由硫酸铬(III)硫酸钠和甲酸钠的水溶液、不可避免的杂质以及可选的硫酸构成,含水电解液在25℃条件下的pH值介于2.5和3.5之间,优选地至少为2.7和/或至多3.1。在电镀期间,来自基体的某些材料可以溶解并且最终出现在电解液中。这可以被认为是镀液中的不可避免的杂质。而且,当使用不足100%的纯化学物来生产或者保持电解液时,可能在镀液中存在不应当存在的物质。这也将认为是镀液中的不可避免的杂质。任何不可避免的副反应所导致的在电解液中存在的在开始并不存在的材料均认为是镀液中不可避免的杂质。期望的镀液是如下的水溶液,在初始制备镀液期间以及在其使用期间补充镀液时仅仅将铬(III)硫酸盐、硫酸钠和甲酸钠(均以适当形式添加)以及可选的调节pH值的硫酸添加到所述水溶液中。由于发生拖出(电解液粘到条上)以及由于从电解液沉积(Cr-)CrOX而需要在其使用期间补充电解质。
优选地,用于在单个步骤中沉积Cr-CrOX层的电解液由硫酸铬(III)、硫酸钠和甲酸钠的水溶液、以及可选的硫酸构成,含水电解液在25℃条件下的pH值介于2.5和3.5之间,优选地至少为2.7和/或至多3.1。优选地,电解液包含:硫酸铬(III),其介于80和200g/l之间,优选地介于80和160g/l之间;硫酸钠,其介于80和320g/l之间,更加优选地介于100和320g/l之间,甚至更加优选地介于160和320g/l之间;和甲酸钾,其介于30和80g/l之间。
尽管根据本发明的方法能够应用于任何导电基体,但是优选地是从以下选择导电基体:
○沉积态或者流熔态的镀锡铁皮;
○对由至少80%的FeSn(50%的铁和50%的锡)构成的铁-锡合金扩散退火而形成的镀锡铁皮;
○单次或者二次还原的冷轧全硬质黑钢板;
○冷轧以及再结晶退火的黑钢板;
○冷轧以及恢复性退火的黑钢板,
其中,所形成的镀层钢基体旨在应用在包装产品中。
本发明的第二方面涉及一种镀层钢条,其根据本发明的方法制造。
本发明的第三方面涉及一种由根据本发明的方法制造的镀层金属条生产的包装。
附图说明
图1示出了从电极(CS)(虚线块,在x=0处)至主体浓度(Cb)的H+离子的浓度梯度。δ表示能斯特扩散层概念中的滞止层(扩散层厚度)。在该层外部,对流在主体浓度处保持浓度均匀。在该层内,质量传递仅通过扩散发生。由在电极处的浓度的梯度来确定δ的厚度。
图2是Cr(OH)3在基体上的沉积机理的示意图。注意的是,为了简化,用直线近似表示H+浓度分布。δ再次表示能斯特扩散层概念中的滞止层。
图3示出了当移动通过电镀生产线的条速度增加时用于沉积固定量的Cr(OH)3所需的电流密度如何增加。对于基于Men+(aq)+n·e﹣→Me(s)的电沉积来说,电流密度增加将是充分的。对于基于沉积Cr(OH)3的机理而言,高速导致更薄的扩散层厚度,并且因此,导致不期望的H+向电极的扩散也加速。测量值表示对于100m/min的线速度来说,沉积60mg/m2的Cr-CrOX需要24.3A/dm2的电流密度,而对于300m/min而言,需要73A/dm2并且对于600m/min而言,需要将近150A/dm2。
图4示出了Cr-CrOX对电流密度的曲线图:在Cr-CrOX沉积开始之前的阈值、峰值、峰值之后突然的锐减并终止于稳定状态。
图5示出了针对不同的电解质以及针对变化量的磷酸钠的Cr-CrOX对电流密度的曲线图。
图6示出了从图5中裁剪的曲线图,其示出了用于沉积100mg/m2的Cr的电流密度,沉积100mg/m2的Cr是适当的目标值。
图7画出了对于200g/l的Na2SO4以及1秒的沉积时间来说镀层成分随电流密度的变化,并且在图8中,针对20A/dm2的电流密度和200g/l的Na2SO4,画出了镀层成分的重量随沉积时间的变化。在最大电流密度(状况III-如图4和图5所示,对于200g/l的Na2SO4而言为大约25A/dm2)之外,随着电流密度逐渐增加,Cr金属的量下降并且镀层逐渐由Cr氧化物构成。在朝向最大值的线性状况II中,主要以Cr氧化物为代价,Cr金属含量随着电解时间增加而增加。就图8中的所有沉积时间而言,Cr碳化物的数量大约相同。
- 还没有人留言评论。精彩留言会获得点赞!