一种电化学合成具有S-N键的次磺酰胺化合物的方法与流程
本发明属于有机合成技术领域,具体涉及一种电化学合成具有s-n键的次磺酰胺化合物的方法。
背景技术:
次磺酰胺化合物中的s-n键,因为其独特的结构和性质使其成为天然产物合成中的重要官能团,在制备工业用橡胶硫化促进剂等精细化工产品中具有广泛的应用前景。在有机合成、药物学以及生命科学中也占有举足轻重的地位。
尽管次磺酰胺的应用非常广泛,但关于其制备的报道却寥寥无几。在这些报告中,亚砜酰氯与胺之间的反应是一种经典但效率低下的方法,原因是磺酰氯的利用率较低[davis,f.a.j.org.chem.1977,42,967–972]。由巯基化合物与胺类的交叉氧化偶联反应构建s-n键是最为经济的有效方法[koval,iv;rus.chem.rev.1996,65(5),421-440]。但是氧化偶联反应中常常用到强氧化剂,如:过氧化氢,卤素,亚硝酸钠以及伯吉斯试剂等。因为强氧化剂的使用,不免会发生过度氧化反应,造成反应效率低下。也开发出了分子氧作为氧化剂的方法,但是不免需要使用金属催化剂,反应也需要在高压下才能进行。这些方法在实际生产过程中对设备要求高,难以实现清洁生产,不符合国家环保政策和节能减排的生产要求。
有机电合成工艺作为一种新型而有效的化学合成方法,日益受到人们的重视。与传统的合成方法相比,电化学合成借助电子这一最清洁的试剂,避免了其他催化剂和氧化剂的使用,由此也避免了过氧化反应的发生,副产物只有氢气。而且可在常温常压下运作。还可以借助调节电压和电流(密度)以控制反应的进行,便于整个过程的自动化控制。因此,在电化学的反应条件下实现s-n键的构建,对于实际生产有着重要意义。
技术实现要素:
为了克服现有技术的不足本发明提供了一种电化学合成具有s-n键的次磺酰胺化合物的方法,该方法无需另外添加氧化剂和催化剂,就能得到中间体s-n键,后续处理简单。
本发明采用以下技术方案:
本发明提供了一种电化学合成具有s-n键的次磺酰胺化合物的方法,包括以下步骤:
(1)以巯基类化合物和胺类化合物为底物,将底物和电解质加入至有机溶剂中,插入电极,搅拌并电解反应;电解阴极和电解阳极选用同一种材质,电解阴极和阳极均为金属网,电解电压区间为0.2-10v,电解电流区间为0.03-0.5a,反应温度为0-100℃,反应时间为0.5-24小时;
(2)反应结束后,将反应溶液分离提纯得具有s-n键的次磺酰胺化合物产物。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中所述胺类的用量是巯基化合物的1-40当量。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中所述巯基化合物为芳香硫酚或巯基杂环。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中所述胺类为芳香胺、杂环胺、脂肪胺和环烷胺中的任意一种。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中所述电解质为四丁基四氟硼酸铵bu4n·bf4、高氯酸锂liclo4、四丁基溴化铵bu4n·br、四丁基高氯酸按bu4n·clo4、四乙基四氟硼酸铵et4n·bf4、四甲基四氟硼酸铵me4n·bf4或四丁基六氟磷酸铵bu4n·pf6;电解质浓度范围为:0.01-0.2毫摩尔/毫升。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中所述有机溶剂为乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n,n-二甲基亚砜、n-甲基吡咯烷酮、甲醇、乙醇、四氢呋喃和1,4-二氧六环中的至少一种。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中所述金属网的材料为泡沫镍、泡沫铁和泡沫铜中的任意一种,且电极材料纯度无要求,无需高纯金属材料;反应结束后,金属网可重复使用。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中电解可采用恒压电解,此时所述的反应电压为0.2v-10v;也可采用恒流电解,此时所述反应电流为0.03-0.5a。
根据上述的电化学合成具有s-n键的次磺酰胺化合物的方法,步骤(1)中反应气氛不受限制,对空气中的水和氧气不敏感;反应可在任意敞口玻璃或塑料容器中进行,无需专用电解池。
本发明的合成方法与现有技术相比有以下优点:
1.在本发明方法中,不需要添加氧化剂和催化剂,合成步骤简单、反应条件温和、操作简便易行,而且所适用的底物范围广泛,为s-n键的构建提供了一种新思路。而且反应中所使用的电极材料廉价易得,还可重复利用,副产物少,能源消耗少,适用于工业化生产。
2.本发明合成步骤简单、反应无废料生成,反应条件温和,反应所需电极和容器廉价易得,无需专业设备,普通家用电池和金属网即可大规模制备目标产物,反应所用有机溶剂可回收再利用,无需有机废物后处理。且反应中无副产物生成,后处理十分简便。最重要的是,反应对气氛不敏感,可在敞口容器中进行,空气中的水和氧气对反应无任何影响。而且反应无需添加催化剂,操作简便易行,反应效率高,电极材料可重复利用,副产物少,能源消耗少,适用于工业化生产,为s-n键的构建提供了一种新思路。目前实验室结果已证实可一次合成公斤级产品。
附图说明
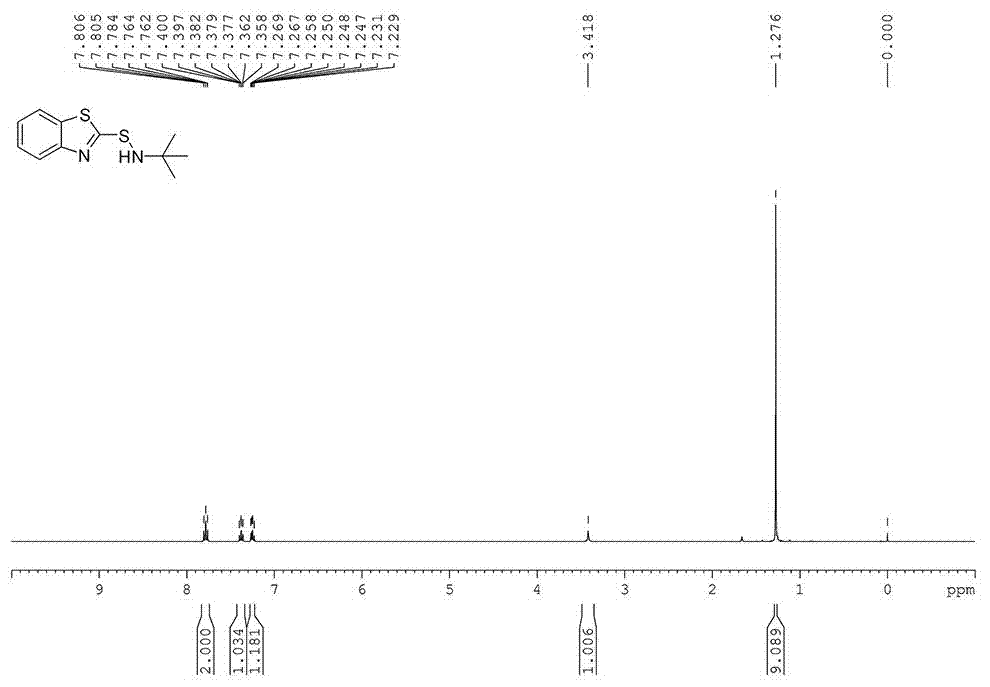
图1是实施例1制备的n-叔丁基-2-苯并噻唑次磺酰胺的1hnmr谱图;
图2是实施例1制备的n-叔丁基-2-苯并噻唑次磺酰胺的13cnmr谱图。
图3是实施例2制备的n,n-二乙基-2-苯并噻唑次磺酰胺的1hnmr谱图;
图4是实施例2制备的n,n-二乙基-2-苯并噻唑次磺酰胺的13cnmr谱图。
图5是实施例3制备的4-(2-吡啶基硫基)-吗啉次磺酰胺的1hnmr谱图;
图6是实施例3制备的4-(2-吡啶基硫基)-吗啉次磺酰胺的13cnmr谱图。
图7是实施例4制备的n-苄基-2-苯并噻唑次磺酰胺的1hnmr谱图;
图8是实施例4制备的n-苄基-2-苯并噻唑次磺酰胺的13cnmr谱图。
图9是实施例5制备的n-正丙基-2-苯并噻唑次磺酰胺的1hnmr谱图;
图10是实施例5制备的n-正丙基-2-苯并噻唑次磺酰胺的13cnmr谱图。
图11是实施例6制备的n-环丙基-2-苯并噻唑次磺酰胺的1hnmr谱图;
图12是实施例6制备的n-环丙基-2-苯并噻唑次磺酰胺的13cnmr谱图。
图13是实施例7制备的2-(1-吡咯烷基硫基)-苯并噻唑的1hnmr谱图;
图14是实施例7制备的2-(1-吡咯烷基硫基)-苯并噻唑的13cnmr谱图。
图15是实施例8制备的2-(3-甲基哌啶硫基)-苯并噻唑的1hnmr谱图;
图16是实施例8制备的2-(3-甲基哌啶硫基)-苯并噻唑的13cnmr谱图。
图17是实施例9制备的2-(4-硫代吗啉基硫基)-苯并噻唑的1hnmr谱图;
图18是实施例9制备的2-(4-硫代吗啉基硫基)-苯并噻唑的13cnmr谱图。
图19是实施例10制备的2-(4-哌啶酮缩乙二醇硫基)-苯并噻唑的1hnmr谱图;
图20是实施例10制备的2-(4-哌啶酮缩乙二醇硫基)-苯并噻唑的13cnmr谱图。
图21是实施例11制备的n-(4-氯苄基)-2-苯并噻唑次磺酰胺的1hnmr谱图;
图22是实施例11制备的n-(4-氯苄基)-2-苯并噻唑次磺酰胺的13cnmr谱图。
图23是实施例12制备的n-(二苯基甲基)-2-苯并噻唑次磺酰胺的1hnmr谱图;
图24是实施例12制备的n-(二苯基甲基)-2-苯并噻唑次磺酰胺的13cnmr谱图。
图25是实施例13制备的2-(4-吗啉基硫基)-苯并恶唑的1hnmr谱图;
图26是实施例13制备的2-(4-吗啉基硫基)-苯并恶唑的13cnmr谱图。
图27是实施例14制备的4-(4-吡啶基硫基)-吗啉次磺酰胺的1hnmr谱图;
图28是实施例14制备的4-(4-吡啶基硫基)-吗啉次磺酰胺的13cnmr谱图。
具体实施方式
为了对本发明进行更好地说明,现举实施例如下:
实施例1
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.25mol(82.25g)bu4n·bf4、1.5mol叔丁胺(109.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在25℃的温度下恒压1.9v电解20h。反应结束后,反应液旋蒸过柱得到目标产物;收率为95%。
1hnmr(400mhz,cdcl3)δ7.82-7.74(m,2h),7.41-7.35(m,1h),7.28-7.22(m,1h),3.42(s,1h),1.28(s,9h).
13cnmr(100mhz,cdcl3),δ=181.14,155.14,134.94,125.78,123.45,121.48,120.93,55.55,29.04.
实施例2
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.1mol(16.10g)me4n·bf4、0.5mol二乙基胺(36.5g)、加入ch3cn2l,加入电极片(阳极/阴极=泡沫镍/泡沫铜),在40℃的温度下恒流(0.3a)电解12h。反应结束后,反应液旋蒸过柱得到目标产物。收率为91%。
1hnmr(400mhz,cdcl3)δ=7.83-7.73(m,2h),7.40-7.34(m,1h),7.27-7.21(m,1h),3.15(q,j=7.1hz,4h),1.25(t,j=7.1hz,6h).
13cnmr(100mhz,cdcl3)δ=179.21,155.21,135.03,125.79,123.50,121.50,120.93,52.50,13.51.
实施例3
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基吡啶0.2mol(22.2g),然后依次加入0.25mol(82.25g)bu4n·bf4、1.5mol吗啉(130.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫铜),在10℃的温度下恒压(5v)电解6h。反应结束后,反应液旋蒸过柱得到目标产物;收率为94%。
1hnmr(400mhz,cdcl3)δ=8.45-8.39(m,1h),7.65-7.55(m,1h),7.45(d,j=8.1hz,1h),7.01-6.94(m,1h),3.77(t,j=4.8hz,4h),3.24(t,j=4.8hz,4h).
13cnmr(100mhz,cdcl3)δ=164.21,149.45,136.56,119.57,118.11,67.95,56.17.
实施例4
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.3mol(65.10g)et4n·bf4、0.5mol苄胺(53.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫铁),在60℃的温度下恒流0.25a电解6h。反应结束后,反应液旋蒸过柱得到目标产物;收率为93%。
1hnmr(400mhz,cdcl3)δ=7.80-7.72(m,j=11.4,8.0hz,2h),7.38-7.27(m,5h),7.28-7.19(m,2h),4.20(d,j=6.0hz,2h),3.49(t,j=5.8hz,1h).
13cnmr(100mhz,cdcl3)δ=177.39,154.83,138.49,135.04,128.76,128.48,128.03,125.98,123.81,121.67,121.16,57.08.
实施例5
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.3mol(65.10g)et4n·bf4、1.5mol正丙胺(88.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在25℃的温度下恒流0.2a电解12h。反应结束后,反应液旋蒸过柱得到目标产物;收率为94%。
1hnmr(400mhz,cdcl3)δ=7.77-7.69(m,2h),7.35-7.29(m,1h),7.21-7.16(m,1h),3.23(t,j=5.4hz,1h),3.07-2.97(m,2h),1.63-1.52(m,2h),0.90(t,j=7.4hz,3h).
13cnmr(100mhz,cdcl3)δ=178.69,154.96,135.02,125.88,123.63,121.57,121.07,54.87,23.80,11.28.
实施例6
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.15mol(32.55g)et4n·bf4、3mol环丙胺(177g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在25℃的温度下恒流0.25a电解10h。反应结束后,反应液旋蒸过柱得到目标产物;收率为91%。
1hnmr(400mhz,dmso)δ=8.00(d,j=7.9hz,1h),7.77(d,j=8.1hz,1h),7.43(t,j=7.7hz,1h),7.32(t,j=7.6hz,1h),6.09(s,1h),2.79-2.70(m,1h),0.66-0.52(m,4h).
13cnmr(100mhz,dmso)δ=179.90,155.04,134.76,126.55,124.15,122.15,121.49,33.55,8.36.
实施例7
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.3mol(31.8g)liclo4、0.75mol四氢吡咯(53.25g)、加入dmf2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在50℃的温度下恒流0.1a电解15h。反应结束后,反应液旋蒸过柱得到目标产物;收率为92%。
1hnmr(400mhz,cdcl3)δ=7.76-7.68(m,2h),7.33-7.28(m,1h),7.21-7.15(m,1h),3.26(t,j=6.5hz,4h),1.94-1.82(m,4h).
13cnmr(100mhz,cdcl3)δ=177.14,154.12,134.00,124.74,122.52,120.54,119.96,54.67,25.17.
实施例8
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.25mol(82.25g)bu4n·bf4、1.5mol3-甲基哌啶(148.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫铁),在40℃的温度下恒压2.0v电解8h。反应结束后,反应液旋蒸过柱得到目标产物;收率为89%。
1hnmr(400mhz,cdcl3)δ=7.84-7.77(m,2h),7.41-7.36(m,1h),7.29-7.23(m,1h),3.33-3.21(m,2h),3.12-3.00(m,1h),2.76(t,j=11.0hz,1h),1.92-1.82(m,1h),1.81-1.70(m,3h),1.05-0.93(m,1h),0.91(d,j=6.7hz,3h).
13cnmr(100mhz,cdcl3)δ=177.39,155.21,135.12,125.68,123.46,121.56,120.89,64.81,57.37,32.58,31.56,26.60,19.14.
实施例9
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.5mol(164.5g)bu4n·bf4、1.5mol硫代吗啉(154.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫铁),在25℃的温度下恒压2.0v电解10h。反应结束后,反应液旋蒸过柱得到目标产物;收率为93%。
1hnmr(400mhz,cdcl3)δ=7.86-7.77(m,2h),7.44-7.37(m,1h),7.31-7.25(m,1h),3.55(t,j=4.9hz,4h),2.79(t,j=5.0hz,4h).
13cnmr(100mhz,cdcl3)δ=175.75,155.18,135.02,126.00,123.90,121.87,121.06,58.65,28.58.
实施例10
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.15mol(32.55g)et4n·bf4、0.9mol4-哌啶酮缩乙二醇(128.7g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在25℃的温度下恒流0.20a电解12h。反应结束后,反应液旋蒸过柱得到目标产物;收率为90%。
1hnmr(400mhz,cdcl3)δ=7.85-7.76(m,2h),7.50-7.32(m,1h),7.33-7.19(m,1h),3.97(s,4h),3.38(t,j=5.6hz,4h),1.89(t,j=5.6hz,4h).
13cnmr(100mhz,cdcl3)δ=176.83,155.29,135.20,125.86,123.68,121.75,121.04,105.82,64.42,55.22,36.13.
实施例11
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.5mol(164.5g)bu4n·bf4、1.5mol对氯苄胺(213g)、加入dmf2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫铁),在50℃的温度下恒压1.5v电解10h。反应结束后,反应液旋蒸过柱得到目标产物;收率为88%。
1hnmr(400mhz,cdcl3)δ=7.87-7.79(m,2h),7.45-7.39(m,1h),7.35(s,4h),7.32-7.27(m,1h),4.25(d,j=5.8hz,2h),3.60(t,j=5.7hz,1h).
13cnmr(100mhz,cdcl3)δ=176.47,154.67,136.86,135.01,133.85,129.87,128.88,126.04,123.92,121.71,121.17,56.18.
实施例12
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并噻唑0.15mol(25.05g),然后依次加入0.5mol(164.5g)bu4n·bf4、1.5mol二苯甲胺(274.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫铁),在25℃的温度下恒压1.9v电解12h。反应结束后,反应液旋蒸过柱得到目标产物;收率为90%。
1hnmr(400mhz,cdcl3)δ=7.80-7.72(m,2h),7.38-7.27(m,8h),7.25-7.16(m,4h),5.35(d,j=5.6hz,1h),4.00(d,j=5.6hz,1h).
13cnmr(100mhz,cdcl3)δ=176.20,154.57,141.80,135.12,128.74,127.88,127.75,126.00,123.88,121.71,121.18,69.11.
实施例13
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入2-巯基苯并恶唑0.15mol(22.65g),然后依次加入0.5mol(164.5g)bu4n·bf4、1.5mol吗啉(130.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在25℃的温度下恒压1.9v电解12h。反应结束后,反应液旋蒸过柱得到目标产物;收率为93%。
1hnmr(400mhz,cdcl3)δ=7.61-7.56(m,1h),7.44-7.39(m,1h),7.27-7.18(m,2h),3.69(t,j=4.7hz,4h),3.37(t,j=4.8hz,4h).
13cnmr(100mhz,cdcl3)δ=165.18,151.37,141.66,124.45,124.35,119.19,110.19,67.75,55.79.
实施例14
结构式如下的有s-n键的次磺酰胺化合物的制备方法:
向干燥的3l的电解池中加入4-巯基吡啶0.5mol(55.5g),然后依次加入0.5mol(164.5g)bu4n·bf4、3mol吗啉(260.5g)、加入ch3cn2.5l,加入电极片(阳极/阴极=泡沫镍/泡沫镍),在25℃的温度下恒流0.25a电解10h。反应结束后,反应液旋蒸过柱得到目标产物;收率为90%。
1hnmr(400mhz,cdcl3)δ=8.45-8.40(m,2h),7.23-7.20(m,2h),3.82-3.75(m,4h),3.12-3.06(m,4h).
13cnmr(100mhz,cdcl3)δ=152.27,149.32,117.03,77.36,77.04,76.72,67.75,56.19.
按实施例1相同的方法合成含有硫-氮键的有机物,其各种反应条件和反应结果见表1。
表1不同条件下合成各种含有硫-氮键的有机物
由以上实施例可知,采用本发明的制备方法,收率均达到了90%,该制备方法不需要使用金属催化剂,反应效率高。
以上所述均为本发明的部分实施例,并非用来限制本发明。但凡依本发明内容所做的均等变化与修饰,都为本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!