用于DNA原位合成的电化学芯片及DNA原位合成方法与流程
本发明涉及DNA合成,尤其涉及一种用于DNA原位合成的电化学芯片,以及一种电化学芯片DNA原位合成方法。
背景技术:
基因芯片(gene chip,DNA chip,DNA microarray)又被称为DNA芯片、DNA微阵列或生物芯片,是指以大量人工合成的或应用常规分子生物学技术获得的核酸片段作为探针,按照特定的排列方式和特定的手段固定在硅片、载玻片或塑料片上,一个指甲盖大小的芯片上排列的探针可以多达上万个。在使用时,先将所研究的样品标记,然后与芯片上的寡聚核苷酸探针杂交,再用激光共聚焦显微镜等设备对芯片进行扫描,配合计算机软件系统检测杂交信号的强弱,从而高效且大规模地获得相关的生物信息。此项技术将大量的核酸分子同时固定在载体上,一次可检测分析大量的DNA和RNA,解决了传统核酸印迹杂交技术复杂、自动化程度低、检测目标分子数量少、成本高、效率低等的缺点。
另外,通过设计不同的探针阵列(array),利用杂交谱重建DNA序列,还可实现杂交测序(sequencing by hybridization,SBH)。目前,该技术在基因表达研究、基因组研究、序列分析及基因诊断等领域已显示出重要的理论和应用价值。
随着基因芯片技术的不断完善和发展,出现多种芯片技术。最初的芯片主要目标是用于DNA序列的测定、基因表达图谱鉴定及基因突变体的监测和分析,因此称为基因芯片。但目前这一技术已扩展到非核酸领域,如已出现了蛋白质芯片分析技术、Biacore技术和丝网印刷技术等。在这一发展趋势下,芯片技术现多被称为生物芯片技术。基因芯片技术是分子生物学中常用分子杂交技术的扩展。其基本做法是将大量的核酸片段有规则地固定在某种介质上,制成芯片,然后将要检测的样品加以标记,再与做成的芯片充分杂交,加以洗脱,用图像显示出来。目前适用于制作芯片的载体材料主要有半导体硅片、玻璃片、金属片、各种有机高分子制作的薄膜等。
基因芯片一般有两种制作方法。一种为合成后交联(post-synthetic attachment),多用于大片段DNA,有时也适合于寡核苷酸甚至mRNA;另一种为原位合成(in-situ synthesis),适合于寡核苷酸。其中,常见的原位合成方法有光导原位合成法、电压打印法、流体通道合成法、分子印章法和机械点涂法。这些方法操作成本很高,工艺较为复杂,重复性较差,并且在单位面积上探针的数量会受 到技术的限制。
本发明提供了一种电化学芯片DNA原位合成方法,通过计算机控制芯片上电极的电位实现DNA的稳定、准确的原位合成,进而实现DNA的自动原位合成。
技术实现要素:
有鉴于现有技术的缺陷,本发明所要解决的技术问题是,提供一种电化学芯片DNA原位合成方法,通过计算机控制芯片上电极的电位实现DNA的稳定、准确的原位合成,进而实现DNA的自动原位合成。
具体地说,本发明提供了一种用于DNA原位合成的电化学芯片,其特征在于,包括反应区,该反应区包括电极区与涂覆于该电极区表面的高分子聚合物,所述电极区包括至少一个铂电极,所述高分子聚合物在所述电极的另一侧具有碱基序列连接端,并且此碱基序列连接端连接有保护基团。
本发明还提供了一种基于上述电化学芯片进行DNA原位合成方法,包括
在所述电化学芯片的反应区的外侧表面覆盖电解质溶液;
将选定电极置于高电位,从而在所述电极周围、反应液中产生氢离子;
连接于所述电化学芯片表面碱基序列连接端的保护基团在所述氢离子提供的局部酸性环境中脱去;
恢复所述电极的电位,将所述反应区的外侧表面的电解质溶液替换为反应液,所述反应液呈碱性并溶解有一端连有保护基团的碱基;
所述一端连有碱基保护基团的碱基连接到所述碱基序列连接端;
去除所述反应液。
进一步地,所述电解质溶液呈碱性。
进一步地,恢复所述电极的电位,将所述反应区的外侧表面的电解质溶液替换为反应液,所述反应液反应液呈碱性并溶解有一端连有保护基团的碱基包括
将所述电极的电位置于零电位;
吸取所述电解质溶液;
使用第一缓冲液冲洗所述反应区的外侧表面;
在所述反应区的外侧表面覆盖反应液,其中溶解有一端连有保护基团的碱基。
进一步地,所述第一缓冲液为醋酸盐缓冲液、碳酸盐缓冲液、柠檬酸盐缓冲液、HEPES缓冲液、MOPS缓冲液、磷酸盐缓冲液、TRIS缓冲液或碘酸钾溶液。
进一步地,所述反应液呈碱性。
进一步地,所述去除所述反应液包括
吸取所述反应液;
使用第二缓冲液冲洗所述反应区的外侧表面。
进一步地,所述第二缓冲液为醋酸盐缓冲液、碳酸盐缓冲液、柠檬酸盐缓冲液、 HEPES缓冲液、MOPS缓冲液、磷酸盐缓冲液、TRIS缓冲液或碘酸钾溶液。
本发明提供的电化学DNA原位合成方法通过改变特定电极的电位,实现DNA的稳定和准确的原位合成;结合计算机控制和自动控制技术,还可实现DNA的自动原位合成,降低基因芯片的合成成本,精度也大为提高。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
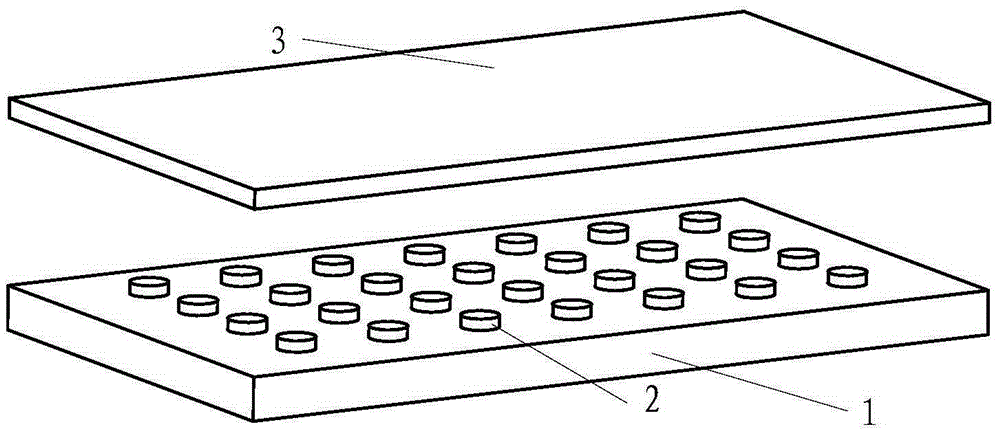
图1是一种电化学芯片上铂电极在底板上的排列示意图;
图2是一种电化学芯片的主要结构示意图;
图3是电化学芯片上铂电极和高分子聚合物在底板上的位置示意图;
图4示出了高分子聚合物表面的碱基序列连接端以及其上连接的保护基团;
图5是电化学芯片表面覆盖有电解质溶液时的示意图;
图6是将图5中左侧铂电极置于高电位时的反应示意图;
图7是将图6中的电解质溶液替换为反应液时的示意图,其中铂电极已在低电位;
图8是5’端保护的碱基连接到脱去保护的碱基序列连接端的反应示意图;
图9是将图8中的反应液替换为电解质溶液时的示意图;
图10是继续将图5中左侧铂电极置于高电位时的反应示意图;
图11是将图10中的电解质溶液替换为反应液时的示意图,其中铂电极已在低电位;
图12是5’端保护的碱基连接到事先已经连接于碱基序列连接端、并已脱去保护的碱基的反应示意图;
图13是将图12中的反应液替换为电解质溶液时的示意图;
图14是将图5中右侧铂电极置于高电位时的反应示意图;
图15是将图14中的电解质溶液替换为反应液时的示意图,其中铂电极已在低电位;
图16是5’端保护的碱基连接到脱去保护的碱基序列连接端的反应示意图;
图17是去除图16中反应液并用缓冲液冲洗电化学芯片表面的示意图,其中铂电极已在低电位;
图1-图17中,1-基板,2-铂电极,3-高分子聚合物,4-碱基序列连接端,5-保护基团,6-电解质溶液,7-5’端保护的碱基,8-反应液,9-脱去保护的碱基。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至 终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”、“顺时针”、“逆时针”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
在本发明中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是直接相连,也可以通过中间媒介间接相连。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
在本发明中,除非另有明确的规定和限定,第一特征在第二特征之“上”或之“下”可以包括第一和第二特征直接接触,也可以包括第一和第二特征不是直接接触而是通过它们之间的另外的特征接触。而且,第一特征在第二特征“之上”、“上方”和“上面”包括第一特征在第二特征正上方和斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”包括第一特征在第二特征正上方和斜上方,或仅仅表示第一特征水平高度小于第二特征。
图1是一种电化学芯片的基板1的结构示意图,其上设置有铂电极2的阵列。如图2所示,在基板1及铂电极2的表面涂覆有高分子聚合物3,厚度为10-30μm。DNA原位合成即是在高分子聚合物3图示位置的上表面进行。
图3示出了基板1、铂电极2及高分子聚合物3的相对位置关系。
需要说明的是,在高分子聚合物3表层具有特殊结构,即其表面具有碱基序列连接端4,碱基序列连接端4连接有保护基团5。其结构已经在图4中示出。相邻铂电极2的中心之间的距离为300μm。虽然相邻铂电极2之间也具有相同结构,但是因为原位合成的过程中并不涉及,故已省略。
如图5,在高分子聚合物3表面覆盖一层电解质溶液6(NaCO3溶液,其浓度为0.05mol/L),覆盖过程为将电解质溶液6充入高分子聚合物3表面设置的反应室(未示出)。后续各步骤的溶液覆盖和冲洗均通过在这样的反应室内充入溶液进行,不 再赘述。电解质溶液6呈现碱性,其pH约为9。保护基团5在碱性环境中并不会脱去,但是在酸性环境中会脱去。
为便于说明,本实施例以两个相邻的铂电极为例说明,但是这并不暗示参与反应的铂电极之间有任何位置关系的要求;事实上,实际操作过程中,本例所述的反应过程可以发生在任一设置于基板上的铂电极位置。
如图6所示,给左侧的铂电极2通电,提高其电位至+5V,在其对应位置的电解质溶液中会局部聚集H+离子,从而形成酸性微环境,使对应位置碱基序列连接端4所连接的保护基团5脱去,而右侧铂电极2附近的碱基序列连接端不受影响。通电过程持续约8s。恢复所有通电铂电极2的电位。
用HEPES缓冲溶液冲洗高分子聚合物3的表面,再如图7所示在高分子聚合物3表面覆盖溶解有5’端保护的碱基7的反应液8。那么,5’端保护的碱基7的3’端连接到已经脱去保护基团5的碱基序列连接端4,而没有脱去保护基团5的碱基序列连接端4则不能连接5’端保护的碱基7,如图8。此处碱基可为鸟嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一种。
如图9,用HEPES缓冲溶液冲洗高分子聚合物3的表面三次,再覆盖电解质溶液6。此时,需要在左侧的铂电极2表面的高分子聚合物3已经连接的5’端保护的碱基7末端继续连接碱基。则,如图10所示仍将左侧铂电极2置于+5V,与前述过程类似,小范围聚集的H+形成的局部酸性环境使之前连接的5’端保护的碱基7所连接的保护基团5脱去。
用HEPES缓冲溶液冲洗高分子聚合物3的表面,再如图11所示在高分子聚合物3表面覆盖溶解有5’端保护的碱基7的反应液8。此处碱基可为鸟嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一种。
如图12,后续加入的5’端保护的碱基7连接到前述已经脱去保护基团并连接于碱基序列连接端4的碱基上。
使用HEPES缓冲溶液冲洗高分子聚合物3的表面三次,再覆盖电解质溶液6。此时需要在右侧铂电极对应的高分子聚合物3表面连接碱基,则将右侧铂电极2置于高电位的+5V,如图14,局部的酸性环境使碱基序列连接端4连接的保护基团5脱去。
用HEPES缓冲溶液冲洗高分子聚合物3的表面,再如图15所示在高分子聚合物3表面覆盖溶解有5’端保护的碱基7的反应液8。此处碱基可为鸟嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一种。则此处添加的5’端保护的碱基7的3’端如图16所示连接于碱基序列连接端4。
使用HEPES缓冲溶液冲洗高分子聚合物3的表面三次,此时在高分子聚合物3表面得到长度分别为2个碱基和3个碱基的两种碱基链,如图17。碱基可为鸟嘌呤、腺嘌呤、胞嘧啶、胸腺嘧啶中的任一种。
以上步骤描述了通过改变铂电极2的电位从而在高分子聚合物3表面连接碱基的过程。后续需要合成结构更加复杂的用于实用目的的碱基链,可以重复上述类似的过程,直至得到所需的碱基链,可用于实验或诊断目的,例如制作DNA探针。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!