先兆子痫的早期检测的制作方法
本申请根据35U.S.C.§119(e)要求于2014年3月21日提交的美国临时申请序列号61/968,728和于2014年3月24日提交的美国临时申请序列号61/969,520的权益,其内容通过引用整体并入本文。
技术领域
本发明一般地涉及先兆子痫的生物标志物以及用于治疗该疾病的方法。
背景技术:
先兆子痫(preeclampsia,PE)是产妇和胎儿发病率和死亡率的首要原因,其影响4%至8%的妊娠,在全世界范围内每年导致超过800万病例。在临床上,先兆子痫由存在高血压、蛋白尿、水肿,以及在一些患者中存在HELLP综合征和子痫来定义。已进行了大量努力来开发可准确预测先兆子痫的标志物。已对产妇子宫动脉中的生化标志物和血流多普勒超声测量(Doppler ultrasound measurement)进行大量测试,但迄今为止这些中没有一种实现了广泛的临床应用(Conde-Agudelo等,Obstet General 2004;104:1367-91)。仍然需要开发用于预测先兆子痫的可靠且临床上可用的标志物。能够鉴定处于患先兆子痫之风险中的孕妇可允许使用已知有效预防先兆子痫发生的预防剂。
发明概述
本发明提供了非侵入性测定以可靠地鉴定有倾向发生PE的女性。这允许用合适的治疗进行早期干预以预防或减轻PE。本发明至少部分地基于如下发现:与具有正常(健康)妊娠的女性中的水平相比,在其先前妊娠中患有先兆子痫(PE)的女性中子宫内膜膜联蛋白A2(annexin A2,ANXA2)水平降低。
根据本发明的某一方面,提供了用于治疗先兆子痫的方法。所述方法包括如下确定对象发生先兆子痫的风险是否提高:通过测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平,将测试样品中ANXA2的水平与ANXA2的对照水平进行比较以确定对象发生先兆子痫的风险是否提高;以及向确定发生先兆子痫风险提高的对象施用有效量的糖胺聚糖。
在一些实施方案中,对象无先兆子痫病史。在一些实施方案中,样品选自:子宫内膜组织、子宫内膜基质细胞和子宫内膜流体的样品。在一些实施方案中,ANXA2的对照水平来自于有过成功妊娠并且无先兆子痫病史的对象。在一些实施方案中,糖胺聚糖选自:低分子量肝素、硫酸乙酰肝素、经化学修饰的肝素或硫酸乙酰肝素、低分子量硫酸皮肤素及其混合物。在一些实施方案中,使用选自ELISA、Western印迹和免疫组织化学染色的免疫测定来确定ANXA2的水平。在一些实施方案中,对象已知怀孕。在一些实施方案中,对象试图怀孕。
本发明的一些方面提供了用于诊断先兆子痫或帮助诊断先兆子痫的方法。所述方法包括测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平;并将测试样品中ANXA2的水平与ANXA2的对照水平进行比较以确定对象发生先兆子痫的风险是否提高。
在一些实施方案中,对象无先兆子痫病史。在一些实施方案中,样品选自:子宫内膜组织、子宫内膜基质细胞和子宫内膜流体的样品。在一些实施方案中,对照样品获自有过成功妊娠并且无先兆子痫病史的对象。在一些实施方案中,使用选自ELISA、Western印迹和免疫组织化学染色的免疫测定来确定ANXA2的水平。在一些实施方案中,对象已知怀孕。在一些实施方案中,对象试图怀孕。
本发明的一些方面提供了用于治疗先兆子痫的方法。所述方法包括获得目前未患先兆子痫的对象的子宫内膜流体样品,其中所述对象怀孕或者其中所述对象计划怀孕;进行测定以确定子宫内膜流体样品中ANXA2的水平;将子宫内膜流体样品中ANXA2的水平与ANXA2的对照水平进行比较以确定对象发生先兆子痫的风险是否提高;以及如果确定对象发生先兆子痫的风险提高,向所述对象施用有效量的糖胺聚糖。
在一些实施方案中,对象无先兆子痫病史。在一些实施方案中,ANXA2的对照水平来自于有过成功妊娠并且无先兆子痫病史的对象。在一些实施方案中,糖胺聚糖选自:低分子量肝素、硫酸乙酰肝素、经化学修饰的肝素或硫酸乙酰肝素、低分子量硫酸皮肤素及其混合物。在一些实施方案中,使用选自ELISA、Western印迹和免疫组织化学染色的免疫测定来确定ANXA2的水平。
本发明的一些方面提供了用于治疗先兆子痫的方法。所述方法包括鉴定与ANXA2的对照水平相比具有低ANXA2水平、计划怀孕并且无先兆子痫病史的对象;以及向所述对象施用足以提高对象中ANXA2水平之量的糖胺聚糖。
在一些实施方案中,ANXA2的对照水平来自于有过成功妊娠并且无先兆子痫病史的对象。在一些实施方案中,糖胺聚糖选自:低分子量肝素、硫酸乙酰肝素、经化学修饰的肝素或硫酸乙酰肝素、低分子量硫酸皮肤素及其混合物。在一些实施方案中,使用选自ELISA、Western印迹和免疫组织化学染色的免疫测定来确定ANXA2的水平。
本发明的一些方面提供了用于评估糖胺聚糖治疗对先兆子痫之效力的方法。所述方法包括用有效量的糖胺聚糖治疗患有先兆子痫或发生先兆子痫风险提高的对象;在用糖胺聚糖治疗之前和之后测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平,其中治疗后的ANXA2水平相对于治疗前水平提高表明糖胺聚糖治疗是有效的。
在一些实施方案中,糖胺聚糖选自:低分子量肝素、硫酸乙酰肝素、经化学修饰的肝素或硫酸乙酰肝素、低分子量硫酸皮肤素及其混合物。在一些实施方案中,使用选自ELISA、Western印迹和免疫组织化学染色的免疫测定来确定ANXA2的水平。
本发明的每种限制可涵盖本发明的多个实施方案。因此,可以预期,涉及任一个要素或要素组合的本发明每种限制可包含在本发明的每个方面之中。本发明并不将其应用限制于以下说明书中阐述或附图中所例示的结构细节和组件布置。本发明能够具有其他实施方案并且能够以多种方式实践或实施。此外,本文中使用的措辞和术语是为了描述的目的并且不应被视为限制。本文中使用“包括”、“包含”或“具有”、“含有”、“涉及”及其变化形式意在涵盖此后列出的项目及其等同物以及另外的项目。
附图简述
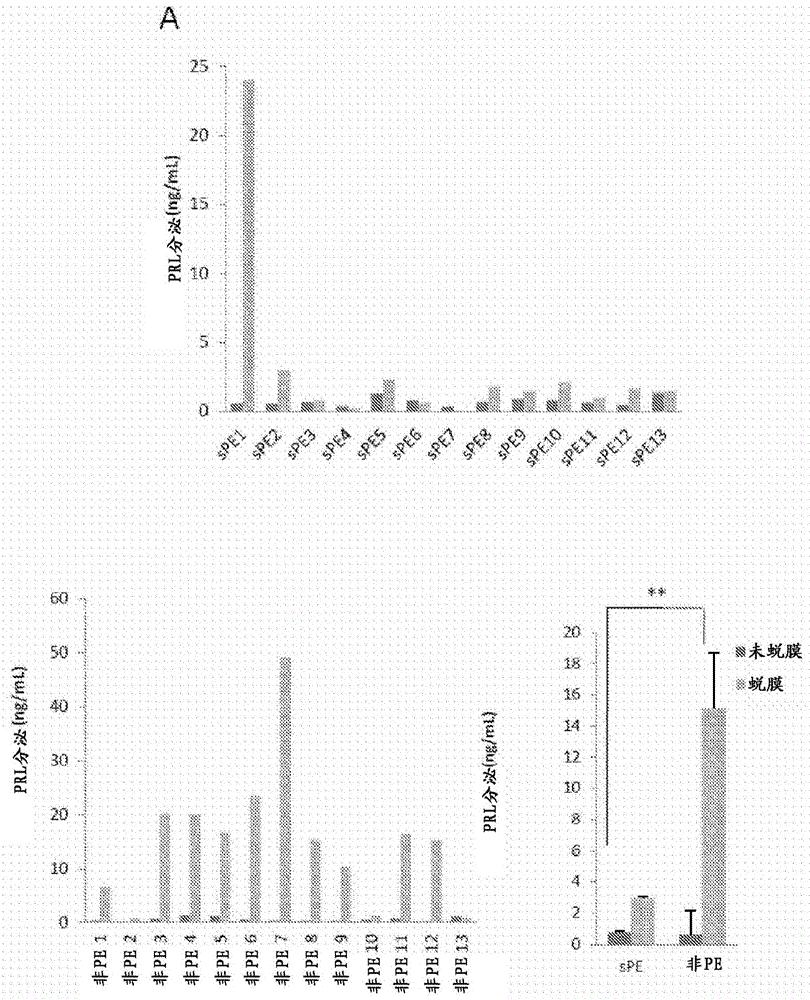
图1示出了在先前妊娠中患有sPE的患者中的体外hESC蜕膜化(decidualization)。图1A和1B示出了通过ELISA测量的来自在其先前妊娠中患重度先兆子痫(severe preeclampsia,sPE)的女性(n=13)和对照患者(非PE)(n=13)的蜕膜hESC与未蜕膜hESC的催乳素和IGFBP-1分泌。催乳素和IGFBP-1分泌显示为未蜕膜(黑条)和蜕膜(灰条)的ng/ml(平均值±sd),并且在图中示意地示出中值(media value)。图1B示出了通过ELISA测量的IGFBP-1分泌。图1C示出了当与未蜕膜hESC相比对来自sPE和非PE的hESC诱导体外蜕膜化时的F-肌动蛋白重构。*,P<0.05;**,P<0.005
图2示出了sPE中ANXA2的免疫组织化学和western印迹分析。图2A示出了从重度先兆子痫(sPE)子宫内膜的活检中提取的总细胞蛋白质,其经受SDS-PAGE,并用ANXA2抗体和持家蛋白(housekeeping protein)β肌动蛋白进行免疫印迹。由3次不同的实验进行ANXA2的光密度分析(densitometric analysis)并用GAPDH进行归一化。图2B示出了在非PE和sPE子宫内膜组织中观察到的ANXA2含量的染色轮廓(staining profile)。图2C示出了获得自sPE患者和非PE患者的hESC蜕膜子宫内膜和未蜕膜子宫内膜的总细胞蛋白质提取物的ANXA2western印迹和光密度分析。图2D分别示出了蛋白质提取物和条件培养基hESC的细胞内和细胞外ANXA2分析。通过ELISA由3次不同的实验测量ANXA2蛋白质并表示为ng/mL(平均值±sd)。*,P<0.05;**,P<0.005
图3示出了ANXA2抑制对体外蜕膜化的影响。图3A示出了与未经处理的hESC相比通过两个系统:P4+E2和cAMP+MPA进行的蜕膜hESC的ANXA2western印迹和光密度测定分析。图3B示出了在3次不同的实验中通过ELISA测量的蜕膜hESC和未经处理的hESC的条件培养基的细胞外ANXA2水平。通过RT-PCR和western印迹分析评价对照细胞(未转染)、用乱序序列(scramble sequence)(对照siRNA)转染的细胞或用ANXA2特异性siRNA(ANXA2siRNA)转染的细胞的mRNA(图3C)和蛋白质ANXA2水平(图3D)。图3E和3F示出了通过ELISA测量的对照和ANXA2siRNA抑制的hESC的条件培养基的PRL和IGFBP-1水平。图3G示出了通过罗丹明鬼笔环肽染色可视化的对照、对照siRNA和ANXA2抑制的hESC的F-肌动蛋白结构。图3H示出了通过体内测定分析的G-肌动蛋白(可溶的)、F-肌动蛋白(丝状的)和总肌动蛋白级分,并通过ANXA2抑制的hESC和对照hESC中的western印迹分析观察结果。由3次不同的实验进行光密度分析,表示为G/F肌动蛋白比例,并用总肌动蛋白进行归一化。
图4示出了ANXA2抑制的hESC的运动性(motility)、滋养层扩散和侵袭分析。图4A示出了对照和ANXA2抑制的hESC的创伤愈合测定。在受伤后0小时和24小时测量创伤宽度。通过图像分析确定创伤闭合百分比。值为来自3次不同实验的10次测量的平均值。图4B示出了用ANXA2 siRNA转染,然后与小鼠胚泡共培养直至发生胚胎附着的hESC。48小时后,将hESC用波形蛋白(vimentin)免疫染色并将小鼠滋养层细胞用E-钙黏蛋白(E-cadherin)免疫染色。小鼠胚泡在hESC上的扩散用白线圈出并以像素为单位测量面积。图4C示出了用于测量人滋养层JEG-3细胞侵袭对ANXA2抑制的hESC的影响的胶原transwell侵袭测定的示意图。直方图示出了JEG-3侵入细胞的百分比,将对照细胞的侵袭指定为100%。数据代表3次独立实验的平均值。*,P<0.05;**,P<0.005
图5示出了ANXA2抑制的hESC和sPE hESC的纤溶活性。图5A示出了在3次不同的实验中通过ELISA评价的来自sPE患者的ANXA2抑制的hESC和hESC的条件培养基的纤溶酶原水平并表示为中值pg/mL。图5B示出了hESC条件培养基具有的通过荧光功能测定评价的纤溶酶活性并表示为活性纤溶酶的mM浓度。在3次不同的实验中通过ELISA评估ANXA2抑制的hESC和sPE hESC的条件培养基的MMP2(图5C)和MMP9(图5D)蛋白质水平。图5E示出了对照、对照siRNA、ANXA2siRNA和sPE hESC,其用50μg/mL或100μg/mL肝素处理以及未经处理并在0分钟、15分钟、30分钟和60分钟的间隔期间分析纤溶酶原水平。图5E示出了用100μg/mL肝素处理或未经处理的ANXA2抑制的hESC和sPE hESC的条件培养基的纤溶酶活性。图5F示出了用肝素剂量处理的hESC之条件培养基的分泌的ANXA2蛋白质。通过ELISA评价经肝素处理的hESC之条件培养基的MMP2(图5H)和MMP9(图5G)水平。
图6示出了作为PE的母系原因的模型,所述模型整合了存在于sPE中的至少部分地由ANXA2缺失介导的hESC蜕膜化抗性与浅滋养层侵袭和纤溶改变。
图7示出了子宫内膜流体中ANXA2水平的研究。
发明详述
本发明至少部分地基于如下发现:与正常妊娠的女性中的水平相比,在其先前妊娠中患有先兆子痫(PE)的女性中子宫内膜膜联蛋白A2(ANXA2)水平降低。本发明的方法提供非侵入性测定以可靠地鉴定有倾向发生PE的女性。因此,本发明使得可以在症状出现之前早期检测患PE的倾向,从而允许及时开始合适的治疗。本发明的另一个优点在于可用提高ANXA2水平的药剂治疗已确定发生先兆子痫风险提高的女性以便预防或减轻先兆子痫。
先兆子痫(PE)是以先前血压正常的女性在妊娠20周后出现高血压(收缩压≥140mmHg和/或舒张压≥90mmHg)为特征的病症。此外,与正常水平相比,尿中的蛋白质水平提高。将提高的蛋白尿定义为在24小时收集的尿中≥300mg(The National High Blood Pressure Education Program Working Group Report on High Blood Pressure in Pregnancy.Am J Obstet General 2000;183:S1-S22)。随着血压的升高,可能出现相关体征和症状,例如头痛、腹痛、出血问题、癫痫发作和并发症,例如胎儿生长不良、早产以及甚至胎儿或母亲死亡。频率占所有妊娠的5%至8%,但在某些群体(例如怀双胞胎的女性)中可大得多。
根据本发明的一个方面,提供了用于治疗先兆子痫的方法。所述方法包括如下确定对象是否患有先兆子痫或发生先兆子痫的风险是否提高:通过测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平,将测试样品中ANXA2的水平与ANXA2的对照水平相比以确定对象是否患有先兆子痫或发生先兆子痫的风险是否提高;以及向确定发生先兆子痫风险提高的对象施用有效量的已知提高ANXA2水平的药剂。
在一些实施方案中,所述方法包括如下确定对象发生先兆子痫的风险是否提高:通过测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平,将测试样品中ANXA2的水平与ANXA2的对照水平相比以确定对象发生先兆子痫的风险是否提高;以及向确定发生先兆子痫风险提高的对象施用有效量的糖胺聚糖。
根据本发明的一个方面,提供了用于诊断先兆子痫或帮助诊断先兆子痫的方法。所述方法包括测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平;并将测试样品中ANXA2的水平与ANXA2的对照水平相比以确定对象发生先兆子痫的风险是否提高。
根据本发明的一个方面,用于治疗先兆子痫的方法。所述方法包括获得目前不患先兆子痫的对象的子宫内膜流体样品,其中所述对象怀孕或者其中所述对象计划怀孕;进行测定以确定子宫内膜流体样品中ANXA2的水平;将子宫内膜流体样品中ANXA2的水平与ANXA2的对照水平相比以确定对象发生先兆子痫的风险是否提高;以及如果确定对象发生先兆子痫的风险提高,向所述对象施用有效量的糖胺聚糖。
根据本发明的一个方面,提供了用于治疗先兆子痫的方法。所述方法包括鉴定与ANXA2的对照水平相比具有低的ANXA2水平、计划怀孕并且无先兆子痫病史的对象;以及向所述对象施用足以提高对象中ANXA2水平之量的糖胺聚糖。
根据本发明的一个方面,提供了用于评估糖胺聚糖治疗对先兆子痫之效力的方法。所述方法包括用有效量的糖胺聚糖治疗患有先兆子痫或发生先兆子痫风险提高的对象;在用糖胺聚糖治疗之前和之后测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平,其中治疗后的ANXA2的水平相对于治疗前水平的提高表明糖胺聚糖治疗是有效的。
本文中使用的“对象”包括所有哺乳动物,包括但不限于狗、猫、马、绵羊、山羊、牛、猪、人和非人灵长类动物。在一些实施方案中,对象是女性。本文中使用的“发生先兆子痫的风险提高”的对象包括当与群体的平均代表相比时患先兆子痫的可能性更高的对象。在一些实施方案中,对象已知怀孕。在一些实施方案中,对象试图怀孕。对象可以先前未有过妊娠、先前有过一次或更多次正常妊娠、或者在先前妊娠中患有PE。在一些实施方案中,对象具有先兆子痫的一个或更多个风险因素。例如,对象可具有以下一个或以下的任意组合:怀有多于一个婴儿的对象;有慢性高血压、糖尿病、肾病或器官移植病史的对象;初次怀孕的对象;肥胖(特别是身体质量指数(Body Mass Index,BMI)为30或更高)的对象;40岁以上或18岁以下的对象;具有先兆子痫家族史(即,母亲、姐妹、外祖母或阿姨患病)的对象;具有多囊卵巢综合征的对象;具有狼疮或其他自身免疫疾病(包括类风湿性关节炎、结节病和多发性硬化症)的对象;已进行体外受精或患有镰状细胞疾病的对象。
在一些实施方案中,本文中描述的方法包括鉴别与ANXA2的对照水平相比具有低ANXA2水平、计划怀孕并且无先兆子痫病史的对象。本文中使用的“识别与ANXA2的对照水平相比具有低ANXA2水平、计划怀孕并且无先兆子痫病史的对象”意指选择与ANXA2的对照水平相比具有低ANXA2水平、计划怀孕并且无先兆子痫病史的对象。通过向如此鉴定或选定的对象施用足以提高所述对象中ANXA2水平之量的糖胺聚糖来对所述对象进行PE治疗。
术语“测试样品”是指来自于使用本发明方法评价的对象(例如,怀孕或试图怀孕的对象)的样品。样品的非限制性实例包括子宫内膜组织、子宫内膜基质细胞和子宫内膜流体。获得对象的样品意指取得对象的样品。获得来自对象的样品意指从对象中取出样品。因此,获得对象的样品并测量样品中ANXA2水平的人不一定从所述对象获得样品。在一些实施方案中,可由医疗从业者(例如,医生、护士或临床实验室从业者)从对象中取出样品,然后提供给测量ANXA2水平的人。可由对象或由医疗从业者(例如,医生、护士或临床实验室从业者)将样品提供给测量ANXA2水平的人。在一些实施方案中,测量ANXA2水平的人通过从对象中取出样品而从所述对象获得样品。
膜联蛋白A2(ANXA2)是钙调节的磷脂结合蛋白,其在人子宫内膜的分泌中期和分泌后期显著上调。这种蛋白质是通过调节F-肌动蛋白网由子宫内膜上皮获得接受表型的关键。ANXA2是在人子宫内膜基质细胞(human endometrial stromal cell,hESC)上存在并起作用的原纤溶受体(pro-fibrinolytic receptor)。其充当纤溶酶原及其激活物tPA的细胞表面共受体(co-receptor),显著增强细胞表面纤溶酶形成。本文中使用的术语“膜联蛋白A2”是指膜联蛋白A2的任何已知同种型。不受此限制,其包括核酸序列NM_001002858.2、NM_001136015.2、NM_004039.2、和NM_001002857.1以及蛋白质序列NP_001002858.1、NP_001129487.1、NP_004030.1和NP_001002857.1。其他已知的膜联蛋白A2核酸和编码的多肽描述于WO 2009/143633(通过引用并入本文)中。
本文中公开的方法通常包括测量样品中ANXA2的水平或者进行测定以确定ANXA2的水平。通常可通过检测来自细胞的mRNA和/或检测表达产物(例如多肽和蛋白质)来检测ANXA2的水平。由核酸编码的转录物和/或蛋白质的表达可通过本领域中任何多种已知的方法来测量。例如,测量ANXA2蛋白水平的方法包括但不限于酶联免疫吸附测定(ELISA)、Western印迹、免疫组织化学分析、放射免疫测定(RIA)、质谱、微阵列和显微术。检测ANXA2核酸序列的方法包括但不限于聚合酶链反应(PCR)、逆转录酶-PCR(RT-PCR)、原位PCR、定量PCR(q-PCR)、原位杂交、Southern印迹、Northern印迹、序列分析、微阵列分析、报告基因的检测或其他DNA/RNA杂交平台。
本文中公开的方法通常包括将测试样品中ANXA2的水平与ANXA2的对照水平相比以确定对象发生先兆子痫的风险是否提高。在一些实施方案中,“ANXA2的对照水平”来自于有过成功妊娠并且无先兆子痫病史的对象。在这样的一些情况下,当ANXA2的对照水平来自于有过成功妊娠并且无先兆子痫病史的对象时,测试样品中ANXA2的水平低于对照水平指示对象患有先兆子痫或发生先兆子痫的风险提高。在一些实施方案中,已知对照水平可预测发生PE,并且在这样的一些情况下,测试样品中对应于对照水平的ANXA2水平表明对象患有先兆子痫或发生先兆子痫的风险提高。因此,与其确定测试水平是否在统计上低于对照水平,不如可确定测试水平是否处于已知预测发生PE的范围内。对照水平可以是固定的数字,例如,以ANXA2单位/ml子宫内膜流体计。对照水平可以是一个范围。对照水平可以是在对照样品中测量的比较水平,所述水平与测试水平的测定同时测量。对照水平可表示成平均值与标准偏差。本发明不旨在受限于通过其确定测试样品在统计上低于或对应于对照的特定方法。
在一些实施方案中,在整个月经周期的任何阶段测量ANXA2水平。在一些实施方案中,在月经周期的黄体期期间测量ANXA2水平。在一些实施方案中,在月经周期的黄体中期(第18-24天)期间测量ANXA2水平。在一些实施方案中,正常对象(即,有过成功妊娠并且无先兆子痫病史的对象)在月经周期的黄体中期(第18-24天)期间测量的ANXA2的平均对照子宫内膜流体水平为32μg/ml(平均值±4),而有倾向患PE的对象在黄体中期的ANXA2水平与该对照水平相比显著降低。在一些实施方案中,有倾向患PE的对象中的ANXA2水平低于该平均对照ANXA2水平2、3、4或5个标准偏差。在一些实施方案中,有倾向患PE的对象在黄体中期的ANXA2水平小于5μg/ml、小于10μg/ml、小于15μg/ml、小于20μg/ml或小于25μg/ml。
在一些实施方案中,测试样品中ANXA2的水平相对于对照样品降低指示对象患有PE或发生先兆子痫的风险提高。“表达降低”意指测试样品中ANXA2的表达与对照样品中相比统计上显著降低。例如,当测试样品中ANXA2的表达水平比对照样品中的低至少1%、至少5%、至少10%、至少25%、至少50%、至少100%、至少250%、至少500%或至少1000%时,可检测到显著降低。类似地,当测试样品中ANXA2的表达水平比对照样品的低至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少100倍或更多时,可检测到显著降低。可通过使用合适的统计检验来鉴定显著性差异。统计学显著性检验在本领域中是公知的并且在Petruccelli,Chen和Nandram的1999年重印版的Applied Statistics for Engineers and Scientists中例示。
在一些实施方案中,总结分析结果(即,对象是否患有PE或有倾向患PE)和有关该分析的任何其他信息的报告可任选地作为分析的一部分生成(其在本文中可互换地称为“提供”报告、“产生”报告或“生成”报告)。例如,可确定血压和/或尿中蛋白质含量的测量值并且这些可以包含在报告中。报告的实例可以包括但不限于纸质报告(例如测试结果的计算机生成的打印输出)或等效格式和存储在计算机可读介质(例如CD、计算机硬盘驱动器或计算机网络服务器等)上的报告。报告(特别是存储在计算机可读介质上的那些)可以是数据库(例如患者记录数据库,其可以是具有限制获取报告的安全特性的“安全数据库”,例如,仅允许患者和患者的医疗从业者查看报告)的一部分。作为生成有形报告的补充或替代,还可使报告显示在计算机屏幕(或另一电子器件或仪器的显示器)上。
还可将报告传输、传递或报告(在本文中这些术语可互换使用)给例如被测试的个体、医疗从业者(例如,医生、护士、临床检验从业者、遗传咨询师等)、医疗机构、临床实验室和/或意图查看或持有报告的任何其他方。“传输”或“传递”报告的行为可基于报告的形式通过本领域中已知的任何方法来进行,并且包括口头传输和非口头传输。此外,“传输”或“传递”报告可包括递送报告(“推”)和/或撤回(“拉”)报告。例如,非口头报告可通过如下这样的方式传输/传递:在各方之间物理地传送(例如对于纸质形式的报告);例如通过从一方物理地递送到另一方;或者通过以电子方式或以信号形式(例如,经由电子邮件或通过互联网、通过传真、和/或通过本领域中已知的任何有线或无线通信方法)传输;例如通过从存储在计算机网络服务器上的数据库检索等。
在一些实施方案中,本文中描述的方法包括用有效量的已知提高ANXA2水平的药剂治疗鉴定为患有先兆子痫或有倾向发生先兆子痫的对象以预防或减轻先兆子痫。已知提高ANXA2水平的药剂包括但不限于糖胺聚糖。糖胺聚糖的实例包括但不限于低分子量肝素、硫酸乙酰肝素、经化学修饰的肝素或硫酸乙酰肝素、低分子量硫酸皮肤素及其混合物。用于治疗先兆子痫的糖胺聚糖的另外的实例描述于EP1016410中,其通过引用并入本文。
本文中使用的术语“治疗”意指降低或减轻对象发生PE的风险。对象发生PE的风险降低可表现为与治疗前获得的ANXA2水平相比或者与对照正常ANXA2水平(即,先前有过成功妊娠并且无PE病史的对象的ANXA2水平)相比,ANXA2水平提高。在一些实施方案中,术语“治疗”意指以可检出的量或程度减轻或缓解PE。本文中使用的术语“治疗”指完整治疗和局部治疗二者。例如,治疗PE可表现为尿中蛋白质水平降低和/或与治疗前获得的血压水平相比或者与对照正常血压水平相比,血压水平降低。
糖胺聚糖的“有效量”是指足以引起期望的生物应答(即,治疗先兆子痫)的量。如本领域普通技术人员所理解的,糖胺聚糖的有效量可根据例如这样的因素而变化:期望的生物学终点、化合物的药物代谢动力学、被治疗的病症、施用方式以及对象的年龄和健康状况。有效量包括但不限于减缓、减轻、抑制、缓解或逆转与PE有关的一种或更多种症状所必需的量。在PE的治疗中,这样的量可指与治疗前获得的血压水平相比或者与对照正常血压水平相比足以降低血压水平的量。在一些实施方案中,有效量可指足以引起尿中蛋白质水平降低的量。在一些实施方案中,有效量可指足以降低对象发生PE的风险的量。这样量可指与治疗前获得的ANXA2水平相比或与对照正常ANXA2水平(即,有过成功妊娠并且无先兆子痫病史的对象的ANXA2水平)相比足以提高/提升ANXA2水平的量。在一些实施方案中,所述量足以重建被治疗对象中ANXA2的对照正常水平。
化合物的有效量可在约0.001mg/kg至约1000mg/kg的范围内变化,施用一个或更多个剂量,持续一天或数天(取决于施用方式)。在某些实施方案中,有效量在约0.001mg/kg至约1000mg/kg,约0.01mg/kg至约750mg/kg,约0.1mg/kg至约500mg/kg,约1.0mg/kg至约250mg/kg,以及约10.0mg/kg至约150mg/kg的范围内变化。在一些实施方案中,有效量为1000IU、2000IU、3000IU、40000IU、5000IU、6000IU或7000IU糖胺聚糖。在一些实施方案中,有效量为5000IU糖胺聚糖(例如,低分子量肝素)。糖胺聚糖可经由任何合适的施用途径施用。例如,糖胺聚糖可通过皮下、静脉内、腹膜内或肌内途径施用。
在一些实施方案中,本文中描述的方法包括在用糖胺聚糖治疗之前和之后测量从对象获得的测试样品中膜联蛋白A2(ANXA2)的水平。相对于治疗前的水平,预期有效治疗在治疗后可提高ANXA2的水平。因此,有效治疗由治疗后ANXA2的水平提高指示。
通过以下实施例进一步举例说明本发明,所述实施例决不应解释为进一步的限制。本申请全文中引用的所有参考文献(包括参考文献、授权的专利、公开的专利申请和正审查的专利申请)的全部内容均通过引用明确并入本文。
实施例
实施例1:通过ANXA2缺乏介导的子宫内膜蜕膜化抗性揭示先兆子痫的母系原因
材料和方法
组织收集、hESC分离、以及培养
于2011年8月8日获得CEIC Ethics Committee of Hospital La Fe,Valencia Spain的IRB批准(代码2011/0383)并且每位患者在组织收集之前签署了知情同意书。从在其上次妊娠(发生在1年至5年间)期间患有sPE的女性获得重度先兆子痫(sPE)子宫内膜活检(n=13)。从年龄为18-32岁的正常妊娠女性(n=13)中收集非先兆子痫(非PE)子宫内膜活检。所有患者有规律的月经周期,没有潜在的子宫内膜病理状况,并且在活检收集之前3个月内没有接受激素治疗。两组的平均年龄和平均BMI相似。
在无菌条件下使用pipelle(Genetics,Belgium)获得子宫内膜活检。对样品进行处理,并如先前所述(41)通过温和胶原酶消化分离基质隔室。使用由含有10%经活性炭吸附(charcoal stripped)的胎牛血清(fetal bovine serum,FBS)和0.1%抗生素的Dulbecco改良Eagle培养基(DMEM)/F12(Sigma,Madrid,Spain)构成的培养基培养人子宫内膜基质细胞(hESC)培养物。将用于不同测定的hESC在板中培养至融合,2天或4天。
体外蜕膜化方案
用含有2%FBS、0.1%抗生素的DMEM/F12和如下两个不同的蜕膜化方案使融合的hESC单层蜕膜:i)在9天期间孕酮(P4)(1μM)和β-雌二醇(E2)(30nM),每3天更换培养基;ii)在3天期间8-溴-cAMP(cAMP,Sigma)(0.5mM)和醋酸甲羟孕酮(MPA,Sigma)(1μM)。对照hESC并行培养而不含蜕膜反应的诱导物。
通过用ELISA分析条件培养基中PRL(Abnova)和IGFBP-1(Raybiotech)蛋白水平在生物化学上证实以及通过F-肌动蛋白染色在形态上证实特征性蜕膜表型。将hESC在塑料板中培养至30%-40%融合。为了使表位掩蔽的影响最小化,将细胞用低浓度固定剂(2%-3%多聚甲醛)固定并用5%BSA封闭。将细胞于室温下在黑暗中用来自鬼笔鹅膏(Amanita Phalloides)的针对F-肌动蛋白的0.1μg/mL鬼笔环肽-四甲基罗丹明B异硫氰酸酯(Phalloidin-tetramethylrhodamine B isothiocyanate)缀合物(Sigma Aldrich,USA)孵育30分钟。用配备有100×1.45数值孔径物镜和Yokogawa转盘式共聚焦单元(PerkinElmer)的Nikon显微镜获得荧光共聚焦图像。对于每种免疫荧光标记,至少使用三个不同的组织制备物。
细胞内和细胞外ANXA2蛋白质测定
使hESC细胞在裂解缓冲液(50mM Tris-HCl pH 8.0、150mM NaCl、1%IGEPAL CA 360、0.5%Na-DOC、0.1%SDS和0.5M EDTA)中裂解。通过电泳在10%SDS-PAGE凝胶上分离蛋白质提取物(25μg/泳道),将其转移到聚偏二氟乙烯膜(Hybond-P(疏水性聚偏二氟乙烯膜))(Amersham Biosciences,NJ,USA)上并在包含5%乳和0.1%Tween的PBS缓冲盐水中封闭。将膜在4℃下用1/2500兔多克隆抗人膜联蛋白II(Abcam,Cambridge,UK)和1/2000小鼠单克隆抗人β-肌动蛋白(Santa Cruz,CA,USA)孵育过夜,并用来自Santa Cruz(CA,USA)的辣根过氧化物酶缀合的山羊抗兔和山羊抗小鼠IgG-HRP二抗显示。使用增强化学发光ECL Plus试剂(Amersham Biosciences,CT,USA)检测抗体-抗原复合物。
通过ELISA(R&D Systems,MN,USA)分析蛋白质提取物(2μg/孔)和条件培养基。固定化捕获抗体特异性结合膜联蛋白A2。在洗去未结合的物质后,使用标准的链霉亲和素-HRP形式,使用膜联蛋白A2特异性的生物素化检测抗体来检测结合的膜联蛋白A2。每个条件重复进行三次并对将吸光度值外推至标准曲线以建立人膜联蛋白A2浓度(pg/mL)。
ANXA2免疫组织化学
将福尔马林固定和石蜡包埋的子宫内膜活检切片并安装到涂有Vectabond(Vector Laboratories,Burlingame,CA,USA)的载玻片上。脱蜡和再水化后,将切片用PBS润洗3次,持续5分钟。使用LSAB过氧化物酶试剂盒(Dako,Carpinteria,CA,USA)在子宫内膜切片上进行免疫组织化学。用PBS中的5%BSA封闭非特异性结合。将切片于室温下用在含有3%BSA的PBS中稀释的1∶100兔多克隆抗人膜联蛋白II(Abcam,Cambridge,UK)孵育1小时。在不存在抗体的情况下,阴性对照用包含3%BSA的PBS孵育。二抗包含在LSAB过氧化物酶试剂盒(Dako)中,其对兔来源一抗有效。用3,30-二氨基联苯胺(DAB)色原进行染色持续30秒至1分钟的时间。在用苏木精复染色10秒并用蒸馏水洗涤后,将载玻片用entellan(Merck,Darmstadt,Germany)封固。ANXA2 siRNA
为了使ANXA2沉默,使用ANXA2特异性的siRNA寡核苷酸(CGGCCUGAGCGUCCAGAAATT,SEQ ID NO:1)和阴性对照RNA双链体,其均用3’-AlexaFluor488(Qiagen CA,USA)修饰。将hESC用ANXA2 siRNA(100nM)或siRNA阴性对照(100nM)转染。所有转染实验使用Lipofectamine 2000(Invitrogen)和DMEM/F12培养基进行。将细胞在处理下于37℃下孵育6小时,然后用不含siRNA的新鲜培养基更新培养基。
F-肌动蛋白/G-肌动蛋白体内测定
使用G-肌动蛋白/F-肌动蛋白体内测定试剂盒(Cytoskeleton,CO,USA)确定经受ANXA2抑制随后经受蜕膜诱导物(AMPc和MPA)的ESC细胞中游离单体肌动蛋白(G-肌动蛋白)与丝状肌动蛋白(F-肌动蛋白)的含量。在37℃下使未蜕膜对照、对照野生型、ANXA2siRNA和蜕膜ESC细胞在F-肌动蛋白稳定缓冲液中匀化。然后用低速离心机(2000rpm)从细胞裂解物中清除出未破损的细胞。然后将清除的裂解物以100000×g离心以分离可溶的G-肌动蛋白与不溶的F-肌动蛋白。然后将级分按比例上样到聚丙烯酰胺凝胶上,通过SDS-PAGE电泳分离并转移至硝酸纤维素膜上以用1/500抗肌动蛋白抗体(Cytoskeleton,CO,USA)进行探测。Western印迹的光密度定量确定细胞溶质中存在的G-肌动蛋白相对于并入细胞骨架的F-肌动蛋白的比例(用总肌动蛋白归一化)。
创伤闭合测定
将hESC细胞接种到盖玻片上,生长至融合并蜕膜,随后用ANXA2siRNA处理(6小时)。96小时后,用无菌移液管尖端刮划每个盖玻片,用PBS洗涤并置于新鲜培养基中。即刻和在24小时之后通过相差显微镜术测量创伤宽度。将创伤闭合计算为初始创伤宽度的闭合面积的百分比。所示数据代表取自3次独立实验的10次测量的平均值±SEM。
滋养层扩散测定
依照美国国立卫生研究院的实验动物护理和使用指南(U.S.National Institutes of Health guidelines for the Care and Use of Laboratory Animals),所使用的方案得到瓦伦西亚大学医学院动物护理和使用委员会(Animal Care and Use Committee of the Valencia University School of Medicine)的批准。B6C3F1小鼠品系购自Charles River Laboratories(Barcelona,Spain)。使6-8周龄雌性小鼠超数排卵(superovulated)并与种畜雄性成对安置过夜。在妊娠的第2天,从输卵管中取出胚胎并在CCM-30培养基(Vitrolife,Lubeck,Germany)中培养3天。研究中仅包含具有正常形态的扩张胚泡(n=425个小鼠胚胎)。
将孵化的胚胎在融合的蜕膜hESC单层上共培养充当对照、对照siRNA或ANXA2 siRNA。48小时后,对胚泡附着的滋养层扩散面积进行评价。将共培养物用低浓度固定剂(2%-3%多聚甲醛)固定并用5%BSA封闭,在室温下用在3%BSA中稀释的包含1/50小鼠抗波形蛋白(Sigma Aldrich,USA)和1/100兔抗E钙黏蛋白(Abeam,Cambridge,UK)的一抗孵育2小时。将细胞于室温下在黑暗中用1/1000抗波形蛋白的TRICT抗小鼠二抗(Invitrogen,Barcelona,spain)和1/1000抗E钙黏蛋白的Alexa Fluor488抗兔二抗(Invitrogen,Barcelona,Spain)孵育1小时。在每个实验中每种条件下对10-15个小鼠胚泡进行评估。将生长面积(以像素表示)表示为取自3次独立实验的一式三份组的测量值的平均值±SEM。
侵袭测定
使用由滋养层得到的细胞系JEG-3来评价滋养层通过蜕膜hESC侵袭的能力(参考Hannan 2010)。用胶原Transwell侵袭试剂盒(Chemicon Int.Billerica,MA)进行侵袭测定。培养作为对照、对照siRNA或ANXA2 siRNA的5×105个蜕膜hESC以在24小时期间融合成8mm孔径的transwell插入物。在插入物的上方,使106个JEG-3细胞重悬于hESC培养基中并允许JEG-3细胞侵袭48小时。使用标准酶标仪(microplate reader)通过OD测量侵袭(图4C)。
纤溶研究
通过ELISA试剂盒(Cell Biolabs,CA,USA)按照制造商指示评估条件培养基中的纤溶酶原水平。通过减去包含培养基但不含hESC的孔的背景来计算一式两份孔中的平均吸光度(Δ450nm)。
通过荧光测定试剂盒(Anaspec,CA,USA)测量条件培养基中的纤溶酶活性。其基于蛋白酶切割纤溶酶底物产生在496nm/520nm(激发/发射)处检测具有亮绿色荧光的罗丹明110荧光团。将50微升的条件培养基在室温下预孵育10分钟并向每个孔中添加50uL纤溶酶底物。立即开始测量获得荧光信号的运动读数并且每5分钟记录数据,持续60分钟,总计记录13次。每个条件评估两次。使用Rh110荧光参考标准将荧光转换成浓度值。
MMP2和MMP9水平
通过商业ELISA分析(RayBiotech,GA,USA)评估MMP2和MMP9前体形式和活性蛋白形式。这些测定使用包被到96孔板上的对人MMP-2和MMP-9特异性的抗体。将标准品和样品一式两份吸移到孔中并使样品中存在的MMP-2和MMP-9通过固定化抗体结合到所述孔中。添加生物素化的抗人MMP-2和MMP-9和HRP缀合的链霉亲和素。添加TMB底物溶液并将450nm处的吸光度外推至标准曲线。
定量PCR
使用Trizol LS试剂(Invitrogen,Barcelona,Spain)按照制造商的说明书从hESC培养物中提取总RNA。首先,使用Advantage RT-for-PCR试剂盒(Clontech CA,USA)根据制造商的说明书将1μg总RNA逆转录成cDNA。在Light Cycler 480系统(Roche)中使用SYBR Green(Roche)进行定量实时PCR。使用GAPDH作为内对照,将转录物通过相应的标准曲线量化。每个实验用一式三份的各样品进行3次。使用以下引物:
ANXA2(Fw:TGTGCAAGCTCAGCTTGGA,SEQ ID NO:2,
Rv AGGTGTCTTCAATAGGCCCAA,SEQ ID NO:3)和GAPDH
(Fw GAAGGTGAAGGTCGGAGTC,SEQ ID NO:4,Rv GAAGATGGTGATGGGATTTC,SEQ ID NO:5)。
肝素剂量响应
在50μg/mL和100μg/mL肝素(Sigma,Madrid)的存在下,将hESC在单层上培养15分钟、30分钟和60分钟以精心进行剂量-响应实验。收集来自hESC细胞的条件培养基以分析纤溶酶原水平、纤溶酶活性和金属蛋白酶产生。
统计分析
每个实验使用至少3种不同的子宫内膜活检并且测量一式三份地进行。表示为平均值±SEM,n表示实验次数。使用t检验用SPSS软件分析数据以分析组之间的总体差异。P≤0.05的p值被认为是显著的。(*p≤0.05,**p≤0.01,***p≤0.001)
结果
在其先前妊娠中患有sPE的患者中的体外蜕膜化抗性
与具有正常妊娠史的对照患者(非PE)(n=13)相比,对来自在其先前妊娠中患有重度PE(sPE)的女性(n=13)的hESC的体外蜕膜化进行评估。在sPE组中,从患有包括如下不同形式的女性中分离出hESC:并发的HELLP综合征、子痫或先前两次连续的结束于子痫的发生sPE的HELLP综合征。sPE患者和非PE患者的BMI和年龄相当,但患sPE的女性具有更高的收缩压/舒张压、蛋白尿、GOT、GPT和更低的血小板计数和纤维蛋白原水平。用cAMP(0.5μM)+MPA(1μM)持续5天作为蜕膜刺激或者用激素诱导物P4(1μM)+E2(30nM)持续9天蜕膜的hESC表现出类似的结果。因此,本研究使用cAMP+MPA方案。有趣的是,PRL和IGFBP-1分泌证明,与获得自非PE的对应物相比,在获得自sPE的hESC中体外蜕膜化受损(分别为图1A和1B)。在体外蜕膜化期间研究hESC中的F-肌动蛋白重组(reorganization),并且在非PE中显示出成纤维细胞表型向扩大的圆形细胞形态的转变,而在来自sPE患者的蜕膜hESC中不存在向蜕膜表型的转变(图1C)。
sPE中ANXA2的下调和失调的hESC表达
与非PE患者相比,对来自在其先前妊娠中患有sPE的女性的全部子宫内膜样品中ANXA2蛋白丰度进行分析(图2A)。光密度分析示出,与非PE患者(n=6)相比,在来自sPE(n=6)的子宫内膜中ANXA2丰度显著降低(图2A)。检查了子宫内膜ANXA2定位。与非PE相比,在sPE中在基质隔室处观察到较低的染色(图2B)。接着,使来自sPE患者与非PE患者的hESC分离、蜕膜并通过western印迹评估ANXA2蛋白(图2C)。光密度分析证明,与非PE患者相比,在sPE女性中,ANXA2在基础条件下显著降低并且在蜕膜hESC中失调(图2C)。为了进一步量化该分子,使用ELISA分析这两种条件下在蜕膜化期间的细胞内ANXA2形式和分泌的ANXA2形式。该分析证实,与对照相比,在蜕膜化刺激物的存在下,来自sPE女性的hESC经历显著降低和细胞内和细胞外ANXA2二者中的失调(图2D)。此外,分泌形式反映细胞内ANXA2,这证实了ANXA2作为生物标志物的用途可用于在PE患者中预测蜕膜化抗性。
体外蜕膜化期间hESC中ANXA2的调节和功能性
先前的研究示出,在感受性获得(receptivity acquisition)与胚胎着床的初始步骤期间,ANXA2在人子宫内膜中在整个月经周期中受到调节。接着对hESC体外蜕膜化期间ANXA2的调节进行研究。通过western印迹评估的细胞内ANXA2(图3A)和光密度分析证实,相对于未蜕膜hESC,在使用这两种方案的蜕膜hESC中细胞内ANXA2上调(图3A)。通过ELISA比较hESC细胞内动态测量其上清液中分泌的ANXA2(图3B)。这些结果表明,在体外蜕膜化期间hESC中的细胞内ANXA2和细胞外ANXA2上调。
接着,在体外蜕膜化期间通过使用siRNA方法抑制ANXA2分子来评估hESC中ANXA2的功能性。在hESC转染后24小时,与未蜕膜和蜕膜这两种条件下的对照组和对照siRNA组相比,在siRNA组中观察到ANXA2mRNA(图3C)和蛋白质(图4D)显著降低。为了证实其功能相关性,以蜕膜生物标志物(例如PRL和IGFBP-1)的分泌以及蜕膜刺激开始后72小时的形态学表型变化评价ANXA2抑制的影响。不同于对照,siRNA蜕膜的hESC中不存在PRL和IGFBP-1(图3E和3F)。此外,罗丹明鬼笔环肽染色证实,在蜕膜化过程期间,ANXA2干扰终止F-肌动蛋白结构的特征表型修饰从而使F-肌动蛋白丝的纵向取向未改变(图3G)。还使用细胞溶质中存在的游离单体G-肌动蛋白相对于并入细胞骨架的F-肌动蛋白的比例研究肌动蛋白细胞骨架在ANXA2抑制后的蜕膜化期间的重组(图3H)。在蜕膜表型和未蜕膜表型的对照和对照siRNAhESC细胞中平均G-肌动蛋白/F-肌动蛋白比例为约1∶1,而ANXA2抑制的hESC细胞显示与F-肌动蛋白相比单体G-肌动蛋白的含量显著提高(在未蜕膜ANXA2siRNA处理的细胞中比例为3∶1,而在蜕膜ANXA2siRNA处理的细胞中比例为4∶1)(图3H)。这些数据证明,ANXA2抑制通过肌动蛋白丝解聚和G-肌动蛋白单体分数显著提高来诱导蜕膜化抗性,这证明在蜕膜化过程期间ANXA2在F-肌动蛋白纤维重组中的功能作用。
ANXA2抑制降低hESC运动性、滋养层扩散和侵袭
为了进一步理解由ANXA2抑制诱导的蜕膜化抗性对滋养层扩散和侵袭的旁分泌作用,进行创伤闭合测定以分析ANXA2在hESC运动性中的影响。使hESC蜕膜化,随后用ANXA2siRNA转染6小时,然后用划痕破坏细胞单层,并在24小时期间通过视频显微术追踪ANXA2抑制在迁移方面的作用(图4A)。与对照和对照siRNA细胞相比,在ANXA2siRNA抑制的细胞中创伤闭合的百分比显著降低(图4A)。
接着使用异源体外共培养模型研究ANXA2抑制对滋养层扩散的影响,在所述模型中将小鼠胚胎置于融合的蜕膜hESC单层之上,随后进行ANXA2 siRNA抑制。E钙黏蛋白和波形蛋白的免疫染色分别鉴定小鼠滋养层和hESC。将滋养层扩散的总面积评价为像素数,并且与对照和对照siRNA hESC细胞相比在ANXA2 siRNA hESC细胞中观察到显著降低(图4B)。
还使用胶原侵袭室测定分析JEG-3人滋养层细胞系对ANXA2抑制的hESC细胞的侵袭性。蜕膜hESC为ANXA2 siRNA抑制的并且培养在胶原层上的插入物中。然后,将JEG-3细胞悬液置于插入物的上方。对侵袭通过经处理的hESC单层和胶原屏障的能力进行检查。JEG-3细胞侵入ANXA2抑制的细胞的百分比与对照hESC相比显著降低(图4C)。
由于ANXA2抑制的不足的纤溶活性也存在于来自sPE的hESC中
纤溶系统通过纤维蛋白沉积和有倾向患内皮功能障碍与PE的发病机制有关。与来自PE女性的hESC相比,对hESC ANXA2抑制对纤溶活性的功能作用进行研究。出于该目的,对来自蜕膜对照、ANXA2 siRNA和来自PE的hESC的条件培养基中的纤溶酶原水平和纤溶酶活性进行分析。与对照siRNA hESC和对照蜕膜hESC相比,在ANXA2 siRNA和来自sPE的hESC中纤溶酶原水平和纤溶酶活性显著降低(纤溶酶原水平:分别为229.1±23.1pg/mL和191.5±36.7pg/mL与305.1±23.2pg/mL和397.1±45.1pg/mL;纤溶酶活性:分别为12.7±3.6mM和4.2±0.75mM与27.5±10.2mM和23.1±4.1mM)(图5A和5B)。因此,当ANXA2在蜕膜hESC中受到抑制并且在来自SPE患者的hESC中在更大程度上受到抑制时,纤溶系统有缺陷。
有趣的是,纤溶酶原/纤溶酶系统通过产生降解ECM组分(例如纤维蛋白和胶原)的MMP2和MMP9蛋白调节滋养层侵袭。通过ELISA分析ANXA2抑制的hESC和sPE蜕膜hESC的条件培养基中的MMP2和MMP9蛋白分泌。当ANXA2受到抑制时以及在sPE患者中,MMP2和MMP9分泌水平显著降低(图5C和5D)。
肝素治疗有利于ANXA2降低的hESC中缺陷纤溶系统的活化
肝素通过组织纤溶酶原激活物(tPA)作用于纤溶途径,并且也已被描述为肝素与ANXA2结合的直接效应。在测量对对照siRNA hESC、ANXA2siRNA抑制的hESC、非PE和PE蜕膜hESC的纤溶酶原丰度和纤溶酶活性的剂量响应和时间依赖性实验中分析肝素对纤溶的影响。100ug/mL肝素在所有研究条件下(包括在ANXA2抑制的hESC和sPE蜕膜hESC中)显著提高条件培养基中纤溶酶原和纤溶酶的分泌(图5E)。另外,还评价了肝素对纤溶酶的影响,结果表明,在相同剂量下显著提高对ANXA2siRNA和来自sPE的hESC的纤溶酶活性(图5F)。通过ELISA测量对照、ANXA2 siRNA和来自sPE患者的hESC的条件培养基中分泌的细胞外ANXA2水平。结果证实,肝素处理诱导分泌到培养基中的ANXA2蛋白的显著提高(图5G)。
最后,体外测试在所有条件下肝素对MMP2和MMP9金属蛋白酶之产生的功能作用(图5H)。用肝素处理诱导金属蛋白酶显著提高,所述金属蛋白酶是促进滋养层侵袭通过子宫内膜基质细胞的关键要素。因此,通过siRNA诱导或sPE患者中自然存在的肝素对ANXA2缺陷蜕膜hESC的直接和/或间接作用至少部分地纠正相关纤溶缺陷。
基于这些数据,提出了作为PE的母系原因的模型,所述模型整合了存在于sPE中的至少部分地由ANXA2缺陷介导的hESC蜕膜化抗性与浅滋养层侵袭和纤溶变化(图7)。发现,sPE中ANXA2缺乏的hESC或通过siRNA诱导的hESC未适当地蜕膜,原因是肌动蛋白丝解聚和G-肌动蛋白单体分数显著提高阻碍其典型形态学转变。主要的下游结果包括对酶原纤溶酶原的直接影响,导致纤溶酶生成降低,从而由于纤溶系统的缺陷产生前凝血(protrombotic)旁分泌作用。类似地,ANXA2活化缺陷通过抑制降解ECM组分(例如纤维蛋白和胶原)的MMP2和MMP9导致浅的滋养层侵袭。添加通过ANXA2起作用的肝素能够克服所指出的下游效应。
讨论
尽管正深入研究作为PE的可能原因的缺陷CTB分化,但这项研究集中在涉及该产科并发症起源的子宫内膜的母体旁分泌因子。流行病学研究显示,母系家族中先前的PE与女性亲属患PE的风险提高24%-163%相关。然而,父系家族中的PE发作不影响给定患者患PE的风险。因此,PE的遗传易感性显然与母系相关。
通过调节CTB侵入子宫壁的蜕膜的蜕膜化转变靶向hESC。与非PE对应物相比,获得自sPE的hESC中的蜕膜化抗性鉴定促进了本研究。
膜联蛋白A2(ANXA2)是钙调节的磷脂结合蛋白,其在人子宫内膜的分泌中期和分泌后期显著上调。这种蛋白质是通过调节F-肌动蛋白网由子宫内膜上皮细胞获得接受表型的关键。ANXA2是在hESC上存在并发挥作用的纤溶受体。其充当纤溶酶原及其激活物tPA的细胞表面共受体,可显著增强细胞表面纤溶酶生成。由于PE中的纤溶途径改变,机制分析集中在ANXA2上,原因是该分子的高滴度与抗磷脂综合征(antiphospholipid syndrome,APS)(已知有倾向发生PE的病症)中的血栓形成事件相关。此外,患有PE的胎盘中的ANXA2自身抗体已被认为是胎盘凝血酶形成的可能原因。
首先,与非PE患者相比,在其先前妊娠中患有sPE的患者中,子宫内膜基质隔室中的ANXA2降低。接着,分析证实,与对照相比,在蜕膜化刺激物的存在下,来自sPE女性的hESC经历细胞内ANXA2和细胞外ANXA2的显著降低和失调。另一个出人意料的发现是,在体外蜕膜化期间hESC中的细胞内ANXA2和细胞外ANXA2上调并且其功能抑制通过肌动蛋白丝解聚和G-肌动蛋白单体分数提高诱导蜕膜化抗性。通过ANXA2抑制诱导的蜕膜化抗性的自分泌和旁分泌作用的进一步调查研究显示对hESC运动性和滋养层扩散降低及侵袭的直接影响,这些是该病理状况的标志。
纤溶是这样的有序过程:通过其通过重构和降解纤维蛋白血栓的组织纤溶酶原激活物(tPA)和尿激酶纤溶酶原激活物(uPA)的作用将纤溶酶原转化为纤溶酶。来自PE的胎盘中的常见组织病理学发现是出现不同程度的血栓形成和纤维蛋白沉积。纤溶功能缺陷是血栓形成提高的已知风险因素。在PE中存在纤溶改变,这表明在该疾病的发生中纤溶异常是原因或结果。ANXA2对酶原纤溶酶原和相同的外源性纤溶途径具有直接影响,因此,当ANXA2受到抑制时,蜕膜hESC中的纤溶系统中存在缺陷,并且在来自sPE患者的具有蜕膜化抗性的hESC中在更大程度上存在缺陷。纤溶酶原/纤溶酶系统的改变通过抑制降解ECM组分(例如纤维蛋白和胶原)的MMP2和MMP9损害滋养层侵袭。还证明,剂量为100ug/mL的肝素在体外在所有被研究的条件下提高分泌的ANXA2蛋白质、纤溶酶原、纤溶酶、MMP2和MMP9产生。因此,本研究为理解PE中肝素治疗所报道的有益效果确立了基础。
参考文献
1.Steegers EA,von Dadelszen P,duvekot JJ,Pijnenborg R.Pre-eclampsia.Lancet 2010;376:631-644.
2.Gifford RW,August PA,Cunningham G,Green LA,Lindheimer MD,McNellis D,AL E.Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy.Am J Obstet Gynecol.2000;183,S1-S22.
3.Roberts,J.M.&Gammill,H.S.Preeclampsia:recent insights.Hypertension 2005;46,1243-1249.
4.Pijnenborg,R.,Vercruysse,L.&Hanssens,M.Fetal-maternal conflict,trophoblast invasion,preeclampsia,and the red queen.Hypertens Pregnancy 2008;27,183-196.
5.Roberts DJ,Post MD.The placenta in preeclampsia and intrauterine growth restriction.J Clin Pathol.2008;61:1254-60.
6.Roberts JM,Taylor RN,Goldfien A.Clinical and biochemical evidence of endothelial cell dysfunction in the pregnancy syndrome preeclampsia.Am J Hypertens 1991;4,700-708.
7.Vinnars MT,Nasiell J,Ghazi S,Westgren M,Papadogiannakis N.The severity of clinical manifestations in preeclampsia correlates with the amount of placentalinfarction.Acta Obstet Gynecol Scand.2011;90:19-25.
8.Naicker T,Khedun SM,Moodley J,Pijnenborg R.Quantitative analysis of trophoblast invasion in preeclampsia.Acta Obstet Gynecol Scand.2003;82:722-729.
9.Brosens IA,Robertson WB,Dixon HG.The role of the spiral arteries in the pathogenesis of preeclampsia.Obstet Gynecol Annu.1972;1:J77-191.
10.Zhou Y,Damsky CH,Chiu K,Roberts JM,Fisher SJ.Preeclampsia is associated with abnormal expression of adhesion molecules by invasive cytotrophoblasts.J C1in Invest.1993;91:950-960.
11.Zhou Y,Damsky CH,Fisher SJ.Preeclampsia is associated with failure of human cytotrophoblasts to mimic a vascular adhesion phenotyPe.One cause of defective endovascular invasion in this syndrome?J Clin Invest.1997;99:2152-2164.
12.Zhou Y,Gormley MJ,Hunkapiller NM,Kapidzic M,Stolyarov Y,Feng V,Nishida M,Drake PM,Bianco K,Wang F,McMaster MT,Fisher SJ.Reversal of gene dystegulation in cultured cytotrophoblasts reveals possible causes of preeclampsia.J Clin Invest.2013;123:2862-2872.
13.Irwin JC,Utian WH,Eckert RL.Sex steroids and growth factors differentially regulate the growth and differentiation of cultured human endometrial stromal cells.Endocrinology 1991;129:2385-2392.
14.Brar AK,Frank GR,Kessler CA,Cedars MI,Handwerger S.Progesterone-dependent decidualization of the human endometrium is mediated by cAMP.Endocrine 1997;6:301-307.
15.Gellersen B,Reimann K,Samalecos A,Aupers S,Bamberger AM.Invasion of human endometrial stromal cells is promoted by decidualization and by trophoblast-derived signals.Hum Reprod 2010;25:862-873.
16.Dunn CL,Kelly RW,Critchley HO 2003Decidualization of the human endometrial stromal cell:an enigmatic transformation.Reprod Biomed Online 7:151-161
17.Giudice LC,Mark SP,Irwin JC.Paracrine actions of insulin-like growth factors and IGF binding protein-1in non-pregnant human endometrium and at the decidual-trophoblast interface.J Reprod Immunol.1998;39:133-48.
18.Jabbour HN,Critchley HO.Potential roles of decidual prolactin in early pregnancy.Reproduction.2001;121:197-205.
19.Ramathal CY,Bagchi IC,Taylor RN,Bagchi MK.Endometrial decidualization of mice and men.Semen Reprod Med.2010;28:17-26.
20.Tababelli S,Tang B,Gurpide E.In vitro decidualization of human endometrial stromal cells.J Steroid Biochem Mol Biol 1992;42:337-44
21.Garrido-Gomez T,Dominguez F,Lopez JA,Camafeita E,A,Martinez-Conejero JA,Pellicer A,Conesa A,Simón C.Modeling human endometrial decidualization from the interaction between proteome and secretome.J Clin EndocrinolMetab.2011;96:706-716.
22.Garrido-Gómez T,Dominguez F,A,Estella C,Vilella F,Pellicer A,Simon C.Annexin A2 is critical for embryo adhesiveness to the human endometrium by RhoA activation through F-actin regulation.FASEB J.2012;26:3715-3727.
23.Cesarman-Maus G,Ríos-Luna NP,Deora AB,HuangB,Villa R,Cravioto M del C,et al.Autoantibodies against the fibrinolytic receptor,annexin 2,in antiphospholipid syndrome.Blood.2006;107(11):4375-4382.
24.Chu SC,Yang SF,Lue KH,Hsieh YS,Hsiao TY,Lu KH.Urokinase-type plasminogen activator,receptor,and inhibitor correlating with gelatinase-B(MMP-9)contribute to inflammation in gouty arthritis of the knee.J Rheumatol.2006;33(2):311-317.
25.Beier JI,Kaiser JP,Guo L,Martínez-Maldonado M,Arteel GE.Plasminogen activator inhibitor-1 deficient mice are protected from angiotensin II-induced fibrosis.Arch Biochem Biophys.2011;510(1):19-26.
26.Kruse-Blinkenberg HO,Gormsen J.The influence of low dose heparin in elective surgery on blood coagulation,fibrinolysis,platelet function,antithrombin III and antiplasmin.Acta Chir Scand.1980;146:375-382.
27.Pogliani EM,Vigo A,Cofrancesco E,Colombi M,Cristoforetti G,Marchetti G,Vercesi G,Radaelli F.Low-dose heparin in thoracic surgery:effect on blood coagulation and fibrinolysis system.Thromb Res.1982;27:211-219.
28.Arnesen H,Engebretsen LF,Ugland OM,Seljeflot I,Kierulf P.Increased fibrinolytic activity after surgery induced by low dose heparin.Thromb Res.1987;45:553-559.
29.Shao C,Zhang F,Kemp MM,Linhardt RJ,Waisman DM,Head JF,Seaton BA.J Biol Chem.Crystallographic analysis of calcium-dependent heparin binding to annexin A2.2006;281:31689-31695.
30.Boyd HA,Tahir H,Wohlfahrt J,Melbye M.Associations of personal and family preeclampsia history with the risk of early-,intermediate-and late-onset preeclampsia.Am J Epidemiol.2013;178:1611-1619.
31.Domínguez F,Garrido-Gómez T,López JA,Camafeita E,A,Pellicer A,Simón C.Proteomic analysis of the human receptive versus non-receptive endometrium using differential in-gel electrophoresis and MALDI-MS unveils stathmin 1and annexin A2 as differentially regulated.Hum Reprod.2009;24:2607-2617.
32.Bharadwaj A,Bydoun M,Waisman 2013 Annexin A2 Heterotetramer:structure and function.Int J Mol Sci 2013
33.Cesarman GM,Guevara CA,Hajjar KA.An endothelial cell receptor for plasminogen/tissue plasminogen activator(t-PA).II.Annexin II-mediated enhancement of t-PA-dependent plasminogen activation.J BiolChem.1994;269:21198-211203.
34.LingQ,Jacovina AT,Deora A,FebbraioM,Simantov R,Silverstein RL.Annexin II regulates fibrin homeostasis and neoangiogenesis in vivo.J Clin Invest.2004;113(1):38-48.
35.Cesarman-Maus G,Hajjar KA.Molecular mechanisms of fibrinolysis.Br J Haematol 2005;129:307-321.
36.Crabbe SJ,Cloningef CC.Tissue plasminogen activator:a new thrombolytic agent,Clin Pharm.1987;6:373-386.
37.Sobel BE.Fibrinolysis and activators of plasminogen.Heart Lung.1987;16:775-779.
38,Gohil R,Peck G,Sharma P.The genetics of venous thromboembolism.A metaanalysis involving approximately 120 000cases and 180 000controlls.Thromb Haemost.2009;102:360-370.
39.Sucak GT,Acar K,Sucak A,Kirazli S,Haznedar R.Increased global fibrinolytic capacity as a clue for activated fibrinolysis in pre-eclampsia.Blood Coagul Fibrinolysis.2006;17:347-352.
40.Conserva V,Muggiasca M,Arrigoni L,Mantegazza V,Rossi E,Ferrazzi E.Recurrence and severity of abnormal pregnancy outcome in patients treated by low-molecular-weight heparin:a prospective pilot study.J Matern Fetal Neonatal Med.2012;25:1467-1473.
41.Simón C,Mercader A,Garcia-Velasco J,Nikas G,Moreno C,Remohí J,Pellicer A.Coculture of human embryos with autologous human endometrial epithelial cells in patients with implantation failure.J Clin Endocrinol Metab.1999;84:2638-2646.
42.Tackels-Horne,D,Goodman,MD,Williams AJ,Wilson DJ,Eskandari T,Vogt LM,Boland JF,Scherf U,Vockley JG.Identification of differentially expressed genes in hepatocellular carcinoma and metastatic liver tumors by oligonucleotide expression profiling.Cancer 2001;92:395-405.
43.Vaquerizas JM,Conde L,Yankilevich P,Cabezón A,Mínguez P,Díaz-Uriarte R,Al-Shahrour F,Herrero J,DopazoJ.GEPAS,an experiment-oriented pipeline fof the analysis of microarray gene expression data.Nucleic Acids Res 2005;33:616-620.
44.Al-Shahrour F,Minguez P,Tárraga J,Montaner D,Alloza E,Vaquerizas JM,Conde L,Blaschke C,Vera J,Dopazo J.BABELOMICS:a systems biology perspective in the functional annotation of genome-scale experiments.Nucleic Acids Res 2007;34:472-476.
45.Herrero J,Valencia A,Dopazo J.A hierarchical unsupervised growing neural network for clustering gene expression patterns.Bioinformaties 2001;17:126-136.
46.Benjamini Y,Hochberg Y.Controlling the false discovery rate:a practieal and powerful approach to multiple testing.J Royal Statist Soc B 1995;57:289-300.
47.Al-Shahrour F,Arbiza L,Dopazo H,Huerta J,Minguez P,Montaner D,Dopazo J.From genes to funetional classes in the study of biologieal systems.BMC Bioinformatics 2007;8:114
48.Al-Shahrour F,Diaz-Uriarte R,Dopazo J.FatiGO:a web tool for finding significant associations of Gene Ontology terms with groups of genes.Bioinformatics 2004;20:578-580.
49.Al-Shahrour F,Minguez P,Tarraga J,Medina I,Alloza E,Montaner D,Dopazo J.FatiGO+:a functional profiling tool for genomic data.Integration of functional annotation,regulatory motifs and interaction data with microarray experiments.Nucleic Acids Res 2007;35:91-96.
除本文示出和描述的那些以外,根据前述说明书,本发明的多种修改对本领域技术人员而言将是显而易见的并且落入所附权利要求书的范围之内。本发明的优势和目的不必包含于本发明的每个实施方案中。
- 还没有人留言评论。精彩留言会获得点赞!