用于含细胞液体样品的固定剂组合物的制作方法
本发明涉及一种适用于固定尤其是液体样品中细胞的无福尔马林的固定剂组合物、所述固定剂用于处理生物样品的用途、处理含细胞液体样品的方法及含有所述固定剂的试剂盒。
已知大量用于固定生物材料的固定剂。其中大多数被描述用于固体样品,例如组织。然而,有机会固定包含在液体样品中的生物材料,从而保持细胞形态和组织学特性以及样品细胞的分子生物学内含物也是重要的。
细针抽吸是侵袭性较小的诊断程序,用于例如肿块或团块的研究。在该技术中,将细的中空针插入团块中对细胞取样。细针抽吸通常由微小的组织样品和体液中(如淋巴液或血液)的单细胞混合物组成。使用细针抽吸(FNA)活组织检查的细胞诊断标准程序是在抽吸到载玻片上后直接将吸出物的一部分进行涂片。涂片可以进行风干和染色,或者它们可以进行固定,例如采用95%的乙醇,随后染色。其它技术包括将FNA样品的细胞固定在福尔马林中和制备石蜡包埋的细胞块。
这两种方法在分子分析中的应用都有限。从风干和醇类固定涂片纯化的生物分子很难,且经常导致产率和质量较低。含有甲醛的固定剂会诱导生物分子之间产生交联和修饰,这就导致了在敏感的下游应用(如定量PCR)中的抑制。
其它保存FNA标本以供分子测试的方法,例如低温保存或在酒精中进行基于液体的固定,则在细胞形态学上有所欠缺或甚至对其有所破坏。在细胞样品是基于液体(相对于固体组织中的细胞,以单层生长或在载玻片上涂片)并在液体固定剂中固定时,基于醇类的固定剂会使细胞(例如细胞质)严重收缩。
与开放性手术活检相比,细针抽吸(FNA)活检是一种微创技术。它是一种用于诊断良性和恶性明显和隐匿性病变的敏感、廉价的技术,例如在乳腺、甲状腺、淋巴结和其他器官中。FNA样品是液体,包括血液(高达70%)、单细胞和或多或少的细小细胞团块。用于FNA样品的细胞学检查的最常见方法是在显微镜载片上收回后立即将少量的FNA进行涂片。根据所使用染色的要求,涂片或被风干以用于诸如May/Grunwald/Giemas、Diff Quik、Giemsa等的血液学染色,或者根据巴氏-Papanicolaou(pap)进行醇类固定染色,或者经苏木精和伊红(H&E)(染色)。最常用的醇固定剂是95%乙醇,但是也存在一些市售的喷雾固定剂。
作为在载玻片上进行液体FNA样品涂片的替代方案,通常可以通过离心收集细胞。所得的细胞沉淀可以用例如福尔马林或无福尔马林固定剂如固定,再次离心,并将固定的细胞沉淀与例如琼脂糖混合以形成固体基质。这种固体基质可以像组织样品一样处理,即将其置于盒中、加工并进行石蜡包埋。这种细胞块的切片可以用H&E或用免疫组织化学法染色。细胞块技术的优点在于可以将一个FNA样品的多个切片进行不同的染色。缺点是操作难以进行,需要很多设备和几天的时间。
用于诊断和疾病分类的样品分子检测变得日渐普遍并且越来越重要。来自常规细胞学染色的FNA活检残余物可用于分子测试。然而,当残余液体材料直接用例如市售的固定剂固定时,所述材料不能再用于细胞学再测试,因为细胞的形态均被破坏。
从细胞块的切片提取生物分子是可能的,然而,该技术较耗时,大部分生物分子被降解,特别是经福尔马林固定的样品,且来自这种样品的生物分子的产量通常非常低。此外,如上所述,福尔马林通过交联对生物分子如蛋白质和核酸进行了化学修饰,并导致了生物分子的降解以及下游应用的抑制。
作为可能的解决方案,最近建议从载玻片制备中留下的FNA样品材料进行冻保存(Ladd等,肿瘤细胞病理学-Cancer Cytopathology 2011Apr 25;119(2):102-10)。该方法具有几个严重的缺点,因为在临床环境中,物流上较为困难,且维持冷链较为昂贵。此外,形态学以及敏感的生物分子如RNA会因为细胞的解冻而受损。
尽管一些基于醇类和/或交联剂的试剂组合物和方法被描述为可以稳定细胞形态和生物分子,但目前没有可用于将来源于生物液的单细胞或微小细胞块在液体固定剂中直接固定和保存、并保持细胞形态以及生物分子的解决方案。例如,在US7,138,226B2中,提及了可以对细胞进行细胞学处理,但对如何实现这一点没有进行解释。在US2010/0068690中,描述了用于保存几种生物样品(尤其是FNA样品)中磷酸蛋白及细胞形态的组合物。然而,仅显示了FNA样品中磷酸化蛋白的稳定性,而不是是否可以和如何通过细胞学染色研究稳定的细胞。在EP1455174A1中描述了一种固定剂,其能够评价组织的形态学并对完整蛋白质和核酸进行回收,并且提到其可以用于细胞学制备。然而,再次,这仅仅描述了涂片于载玻片上的FNA。
申请人的实验已经表明,当溶液中的细胞与固定剂混合时,可用的固定剂导致了细胞、尤其是细胞质部分的严重收缩(参见实施例)。现有固定剂的另一个未解决的问题是避免血液的蛋白沉淀。FNA样品通常含有大量的全血,高达70%,这取决于样品的类型。当在载玻片上涂片时,沉淀的血液蛋白可以遮盖细胞的形态(参见实施例)。
为了能使来自相同的细针抽吸样品进行分子和传统的细胞学测试,需要一种用于液体基固定的试剂和方法,即使在高含量全血的存在下,也能稳定提供分子内含物并保留液体样品中细胞形态,但不干扰常规细胞学染色方法。
该目的实现如下:通过提供权利要求1所述的无福尔马林固定剂组合物,所述组合物在处理和/或储存含生物细胞的样品中的用途以及处理含细胞液体样品的方法,其中,收集的液体样品与所述固定剂组合物的至少一部分接触并混合。所述固定剂组合物和任选的适用于进行该处理方法的其它器件,可由一试剂盒提供。这种经制备的样品然后可以用于例如采用任何已知方法的生物分子的分离、样品/细胞染色或样品包埋或浸渍。
根据本发明,描述了用于固定和保存含有细胞(如细胞混合物,例如肿瘤细胞、全血及其它不同类型细胞)的液体生物样品的组合物,其细胞形态和生物分子得以保存。此外,所述液体生物样品可以含有小块的固体组织。
此外,描述如何使用所述组合物用于固定含液体细胞的样品,例如用于细胞学染色和生物分子纯化的细针抽吸样本,而不干扰常规诊断工作流程。描述了示例性工作流程,包括使用填充有所述组合物的收集装置。
本发明的另一方面涉及这种制备的样品在处理方法中的应用,如何采用等分试样用于细胞学染色或用于生物分子的提取,例如从固定的样品中的核酸。
本发明无福尔马林的固定剂组合物由一组合物所示,包括
i)30-70体积%的醇,选自乙醇或异丙醇
ii)2-15%的有机酸
iii)10-30%的与i)不同的羟基化合物
iv)至少10、优选至少15%的水
且pH的范围在2-5之间。
优选地,所述组合物不仅不含有任何形式的福尔马林或甲醛,还总体上不含有交联固定剂。此外,所述组合物还不含有丙酮。在其最简单的实施例中,所述组合物由组分i)到iv)组成。然而在任何情况下,任选地除了化合物i)到iv),可采用碱性化合物或缓冲剂对pH进行调节。
化合物i)是醇,其中所述醇选自乙醇或异丙醇。发现两种所述的醇都比例如甲醇造成的细胞收缩较少。一种或多种所述的醇的含量为30至70体积%,其中,如果使用两种类型的醇,则表示组合的量。优选地,所述醇的含量为40至60体积%,更优选为50%。优选的醇是乙醇。
如果在本申请中给出范围,例如“30至70体积%”,应理解,这意味着也公开了所述范围内的任何量,即31、32、33、34、35、36、37、38、39、40、41、42、43、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、68和69体积%。
化合物ii)是有机酸,优选为弱有机酸。本发明的弱酸优选是指pKa值为2至12、更优选为3.5至8、最优选为4至7.5的酸。更优选地,所述有机酸属于氨基酸或羧酸(单-、二-、三-、多元羧酸),例如甲酸、富马酸、马来酸、酒石酸、柠檬酸,最优选乙酸或丙酸,其中特别优选乙酸。所述有机酸在组合物中的含量为2-15%(这也意味着量为3、4、5、6、7、8、9、10、11、12、13或14%或其间的量),优选4-15%,更优选4-10%,最优选6-10%。如果使用一种类型以上的有机酸,则所述的量是总量。应理解,如果使用液体组分,例如冰醋酸,则给定的量为%(v/v),如果加入固体化合物,则以%(wt/v)表示。
化合物iii)是羟基化合物,其是指具有至少一个游离羟基的化合物,然而,优选所述化合物不是糖,特别是不是海藻糖。优选地,化合物iii)是二甘醇单乙醚乙酸酯(DEGMEA),二甘醇单乙醚,二醇或三醇,其中特别优选二甘醇单乙醚乙酸酯(DEGMEA)。
二醇或三醇的例子是1,2-乙二醇、1,2-丙二醇、1,3-丙二醇、2-甲基-1,3-丙二醇、2-甲基-1,2-丙二醇、2,2-二甲基-1,3-丙二醇、1,3-丙二醇、2,2-二乙基-1,3-丙二醇、2-甲基-2-丙基-1,3-丙二醇、2-丁基-2-乙基-1,3-丙二醇、二羟基丙酮、2,2-二丁基-1,3-丙二醇、3-甲氧基-1,3-丙二醇、3-甲氧基-1,2-丙二醇、3-甲氧基-2,3-丙二醇、2-甲氧基甲基-1,3-丙二醇、3-乙氧基-1,3-丙二醇、3-乙氧基-1,2-丙二醇、3-乙氧基-2,3-丙二醇、3-烯丙氧基-1,2-丙二醇、2,3-丁二醇、2,3-二甲基-2,3-丁二醇、3,3-二甲基-1,2-丁二醇、1,2-戊二醇、1,3-戊二醇、1,4-戊二醇、1,5-戊二醇、2,3-戊二醇、2,4-戊二醇、2-甲基-2,4-戊二醇、2,4-二甲基-2,4-戊二醇、2,2,4-三甲基-1,3-戊二醇、1,2-己二醇、1,3-己二醇、1,4-己二醇、1,5-己二醇、1,6-己二醇、2,3-己二醇、2,4-己二醇、2,5-己二醇、3,4-己二醇、2,5-二甲基-2,5-己二醇、2-乙基-1,3-己二醇、1,2-庚二醇、1,3-庚二醇、1,4-庚二醇、1,5-庚二醇、1,6-庚二醇、1,7-庚二醇、1,8-辛二醇、1,2-辛二醇、1,3-辛二醇、1,4-辛二醇、1,5-辛二醇、1,6-辛二醇、1,7-辛二醇、1,2-壬二醇、1,9-壬二醇、1,10-癸二醇、1,2-癸二醇、1,2-十一烷二醇、1,11-十一烷二醇、1,12-十二烷二醇、1,2-十二烷二醇、二乙二醇、二丙二醇、三乙二醇、三丙二醇、四乙二醇、四丙二醇、五乙二醇、五丙二醇、六乙二醇、六丙二醇、七乙二醇、七丙二醇、八乙二醇、八丙二醇,九乙二醇、九丙二醇、十乙二醇、十丙二醇、顺式或反式1,2-环戊二醇、顺式或反式1,3-环戊二醇、顺式或反式1,2-环己二醇、顺式或反式1,3-环己二醇、顺式或反式1,4-环己二醇、顺式或反式1,2-环庚二醇、顺式或反式-1,3-环庚二醇、顺式或反式1,4-环庚二醇、1,2,3-环戊三醇、1,2,4-环戊三醇、1,2,3-环己三醇、1,2,4-环己三醇、1,2,3-环庚三醇、1,2,4-环庚三醇、1,2,3-丙三醇、3-乙基-2-羟甲基-1,3-丙二醇、2-羟甲基-2-甲基-1,3-丙二醇、2-羟甲基-2-甲基-1,3-丙二醇、1,2,3-丁三醇、1,2,4-丁三醇,2-甲基-1,2,3-丁三醇、2-甲基-1,2,4-丁三醇、1,2,3-戊三醇、1,2,4-戊三醇、1,2,5-戊三醇、2,3,4-戊三醇、1,3,5-戊三醇、3-甲基-1,3,5-戊三醇、1,2,3-己三醇、1,2,4-己三醇、1,2,5-己三醇、1,2,6-己三醇、2,3,4-己三醇、2,3,5-己三醇、1,2,3-庚三醇、1,2,7-庚三醇、1,2,3-辛三醇、1,2,8-辛三醇、1,2,3-壬三醇、1,2,9-壬三醇、1,2,3-癸三醇、1,2,10-癸三醇、1,2,3-十一烷三醇、1,2,11-十一烷三醇、1,2,3-十二烷三醇、1,1,12-十二烷三醇、2,2,-双(羟甲基)-1,3-丙二醇、1,2,3,4-丁四醇、1,2,3,4-戊四醇、1,2,3,5-戊四醇、1,2,3,4-己四醇、1,2,3,6-己四醇、1,2,3,4-庚四醇、1,2,3,7-庚四醇、1,2,3,4-辛四醇、1,2,3,8-辛四醇、1,2,3,4-壬四醇、1,2,3,9-壬四醇、1,2,3,4-癸四醇、1,2,3,10-癸四醇、三甲基丙醇、季戊四醇,糖如甘露醇、山梨醇或阿拉伯糖醇、己烷己醇、1,2,3,4,5-戊烷醇和1,2,3,4,5,6-己烷六醇。最优选的其它组分是二醇和/或三醇,如1,3-丁二醇、1,4-丁二醇、1,3-丙二醇、1,2-丙二醇、3-甲基-1,3,5-戊三醇、1,2,6-己三醇、甘油、乙二醇;和聚乙二醇(PEG)。PEG优选具有低于环境温度的熔点。其可以具有约800道尔顿或更小、优选约600道尔顿或更小、更优选约400道尔顿或更小、甚至更优选约300道尔顿或更小的平均分子量;平均分子量可以在0至约800道尔顿之间,在约100至约600道尔顿之间,或在约200道尔顿至约400道尔顿之间。当提及PEG的平均分子量时,术语“约”是指允许10、25或50道尔顿的变化。较高分子量PEG(例如1000平均分子量或更高)不是优选的,尽管它们可以以小于分子量分布的5%、10%或20%的量存在。PEG 400的熔点为约4℃至约8℃,PEG 600为约20℃至约25℃。组合物中使用的PEG的熔点可以为37℃或更低、32℃或更低、27℃或更低、22℃或更低、15℃或更低、10℃或更低、或5℃以下。较低的熔点是优选的。
代表化合物iii)的优选化合物是二甘醇单乙醚乙酸酯(DEGMEA)、二甘醇单乙醚、聚乙二醇或二醇或三醇,所述二醇或三醇优选选自乙二醇、二甘醇、甘油、己三醇、1,3-丁二醇、2,3-丁二醇,1,3-丙二醇,1,5-戊二醇,2-甲基-2,4-戊二醇和二丙二醇,其中特别优选二甘醇单乙醚乙酸酯(DEGMEA)。
组合物中组分iii)的总量为10-30%(包括11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29%),其中可以使用前述化合物的组合。化合物iii)的优选量为15-30%,特别优选20%。应理解,如果使用液体组分,给定的量是以%(v/v)表示,或者如果加入固体化合物,则以%(w/v)表示。
作为化合物iv),组合物包含水,特别是蒸馏或双蒸馏(dd)水或超纯水。“超纯”是指水基本上不含,优选完全不含RNA酶和其它影响细胞或生物材料的生物(大)分子稳定性的残余物。“基本上不含”是指在水中包含小于0.1%、优选小于0.01%、更优选小于0.001%、特别优选小于0.0001%(wt/v或v/v)的污染物。
加入到组合物中的所述水的量至少为10体积%、优选至少15体积%、甚至更优选至少20体积%,组合物中水的加入量最优选为平衡至100%。
最终组合物的pH值应在pH 2至pH 5的范围内(包括范围2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.8、3.0、3.0、3.0,3.5,3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9),(优选在pH 2至pH 4,更优选pH 2.1至3,特别优选pH 2.2至2.5的范围内)。所述pH或由化合物i)至iv)的组合中大量的酸来获得,或者可以通过加入另外的酸或合适的碱性化合物(例如NaOH)来调节。此外,可以通过包含在组合物中的合适的缓冲剂调节pH,在所需的pH范围内进行缓冲,例如醋酸钠。
在最简单的实施方案中,所述组合物不包含如上所述的更多组分,因此,所述组合物基本上由组分(i)至iv)以及任选的pH调节剂组成。“基本上由…组成”是指组合物中包含小于0.1%、优选小于0.01%、更优选小于0.001%、特别优选小于0.0001%(wt/v或v/v)的其它成分或污染物。
所述固定剂组合物可用于治疗和/或储存包含生物细胞的样品,特别是液体样品。这样的样品可以是包含水溶液中细胞的液体样品,例如,缓冲液或细胞培养基;任何体液或体液混合物,例如血液(全血或选择性纯化的血液部分)血清、血浆、脑脊液(液体)、尿液、精液、淋巴液、泪液、唾液、痰液、渗出液、腹水或来自任何固体组织(肿瘤组织)的解离细胞;环境水样;食品或饮料样品或类似物。根据本发明,感兴趣的样品是这样的样品,其包含细胞,特别是人或动物细胞,例如哺乳动物或昆虫细胞;植物细胞;微生物,例如细菌、酵母、原生生物、藻类或真菌。
优选的生物样品选自包括生物分子的细胞,例如核酸,如RNA,特别是mRNA、siRNA、miRNA、snRNA、tRNA、hnRNA或核酶、DNA,特别是基因组、质粒或细胞器DNA、合成或修饰的核酸或PNA(肽核酸);蛋白质或寡肽,特别是酶、激素、生长因子;或其它感兴趣的生物分子。
所述样品还可以包括病毒、类病毒,朊粒、脂质、碳水化合物、寡糖、多糖、蛋白葡聚糖、粪便、头皮、毛发、皮肤碎片、代谢产物、细胞器,例如叶绿体或线粒体、囊泡或类似物。
样品中所含有的细胞可以是单细胞、细胞团块或在组织/组织碎片或其任意的混合物。优选的样品是这样的,包括细胞悬浮液和/或小的组织碎片,如用细针从器官的抽吸液或体腔的灌洗液中吸出。如上所述,细针抽吸是用于研究液体和组织/细胞生物样品的微创性诊断方法。在该技术中,将细的中空针插入团块中以对细胞进行取样。细针抽吸物通常由微小组织样品和体液中(如淋巴液或血液)的单个细胞的混合物组成。通过细针抽吸获得的任何样品均为本发明所优选,其中哺乳动物身体的样品是特别优选的。这样的样品可以包括但不限于,甲状腺、淋巴结、胰腺、乳腺、肺、肝、表面(恰好在皮肤下)肿块或团块、液体、脑、脾、胃、心脏、肠、胆囊、膀胱、肾、肌肉组织、结缔组织。细针抽吸的所有常见处理步骤或特征,例如,如在本申请介绍部分中所述,可以根据本发明进行。
可以通过酶促和/或机械解聚来分离细胞。可以使用细胞悬浮液,其在保存和/或储存之前作为活细胞进行培养以进行维持或繁殖。在与固定溶液接触之前,可以洗涤和/或收集样品的细胞,例如通过离心成团块或任何其它通常已知的手段,它们可以收集在载玻片或其它基片上。
对于血液和其它单细胞悬浮液,可以通过沉降或密度梯度离心、在涂覆或未涂覆的塑料板上淘选、或用其组合来浓缩或收集细胞。优选地,所述细胞是在细针抽吸物中的人或动物体细胞,其可以是癌性(良性或恶性)或癌前的,从受疾病影响或疑似相同(正常或患病)、或受其他疾病影响的动物或人对象中获得。因此,尤其是经稳定、储存和/或处理的细胞优选主要来源于获取它们的机体。然而,这并不排除样品中可能另外含有来源于除获取它们的机体之外的其他来源的细胞,例如,微生物或病毒。可以通过尸检或活检(例如,导管插入或静脉切开术)或其它液体收集法来获得细胞。尤其是预先收集或仍在样品内的细胞,优选在从体内移除或体外培养后1至30分钟内与固定剂组合物接触,但这一时间可通过在冰上冷却而得到延长。此外,可以使用保存和/或储存的细胞,然而这不太可取。
在接触固定剂组合物之前或在固定之后或者两者,可对一部分样本进行细胞学处理。在固定之前,可以将一部分样品涂抹在载玻片上,并可在染色或未染色的情况下用显微镜进行检查。经可检测的比色、酶、荧光、发光、磁性或放射性部分直接或间接标记的抗原或抗体甚至可以在与固定剂组合物接触后与样品细胞接触。可以在与固定剂组合物接触之前或之后,根据经抗体淘选或分选或其它亲和色谱法的抗原表达来鉴定和/或分离细胞。通过DNA/RNA含量、大小、活力、荧光标记抗体的结合或其组合,对这些细胞采用细胞仪分析或细胞分选仪进行分离。磁体可以亲和纯化与抗体包被的磁珠结合的细胞。细胞可以通过细胞周期、分裂、生长或细胞器来表征。可以使用阴性或阳性选择(例如亲和或分选技术)分离细胞群。
此外,所述细胞可以在与固定剂组合物接触之后储存在样品中。所述细胞可以储存几个小时、甚至几天,而基本没有生物分子细胞形态和含量的下降。固定样品的储存可以在室温(20℃±3℃)下进行1小时以上直到约7天,或在较低温度,例如10-4℃下达到14天。
因此,本发明,提供了一种处理含有细胞的液体样品的方法,包括步骤:
a)收集液体样品
b)将所述液体样品的至少一部分与前述固定剂组合物接触
c)将步骤b)的样品进行混合
d)任选地,储存所述样品。
含在液体样品的细胞通过这种方法固定,因此维持了所述细胞的细胞形态特征和含量以及所含有生物分子的完整性。
在步骤a)中,对所述液体样品进行收集。所述收集可以通过本领域任何已知方法进行,但是优选通过采用注射器或移液管吸取液体样品。
在步骤a)和步骤b)之间,部分样品可以经释放(例如,分开样品),如将其在载玻片上涂片或转移到另一个容器中用于进一步的样品含量检测。
在步骤b)中,至少一部分(例如所述液体样品的剩余部分)与上述的固定剂组合物基础。这可以通过例如将所述样品注射到含有固定剂组合物的容器中而完成。
为了固定液体样品中的细胞,将所述液体样品与固定剂组合物以1:10-1:1000的比例接触,其中可以使用所述范围内的任何比例:1:20、1:30、1:40、1:50、1:60、1:70、1:80、1:90、1:100、1:125、1:50、1:200、1:250、1:300、1:400、1:500、1:600、1:700、1:800、1:900或其间的比率。优选的范围为1:20至1:50。
因此,最终样品组合物(液体样品和固定剂组合物的组合)中组分i)至iv)的优选浓度为至少27.3%的醇组分i)、至少1.82%的酸组分ii)、至少9%的羟基化合物iii)和至少15%的水。各成分的浓度可以通过考虑上述各成分的浓度范围和液体样品与固定剂组合物的组合比例计算得出。
在步骤c)中,所述最终样品组合物经混合。所述混合可以通过例如将含有组合物的容器颠倒或搅拌、上下吸取或通过振荡,不受限于此。
根据步骤d),最终样品组合物可以任选地如上述在室温(20℃±3℃)下储存数分钟、数小时或直至七天或在较低温度,例如10-4℃下储存。最终的样品组合物可以储存几个小时、甚至几天,而在所含的细胞中,生物分子的细胞形态和含量基本没有下降。
可以在混合最终样品组合物后直接或在储存后,对含有细胞的样品进行进一步处理或研究。因此,步骤c)或步骤d)之后的最终样品组合物的至少一部分进行以下方法中至少一种进一步处理:细胞学研究、生物分子分离和/或用包埋材料包埋细胞。细胞学检查可能包括细胞分选、细胞离心、涂片、膜过滤、细胞染色、解剖、杂交或免疫组织化学和显微镜;生物分子分离可以包括分离核酸、蛋白质、肽或肽-核酸中的至少一种,其中所指的生物分子的一种可以作为混合物或单独分离(例如,核酸可以作为DNA和RNA的混合物分离或DNA和RNA可以单独第分离,甚至可以分离各种的单一核酸,如从较大的RNA中(分离)小RNA);可以通过将细胞与石蜡、矿物油、非水溶性蜡、纤维素、聚乙二醇、聚乙烯醇、琼脂、明胶、硝化纤维素、甲基丙烯酸树脂、环氧树脂或其他塑料介质中的至少一种进行接触来进行细胞的浸润或包埋。对于所有这些方法,如果需要,可以在处理之前浓缩或收集细胞,例如通过离心或过滤。
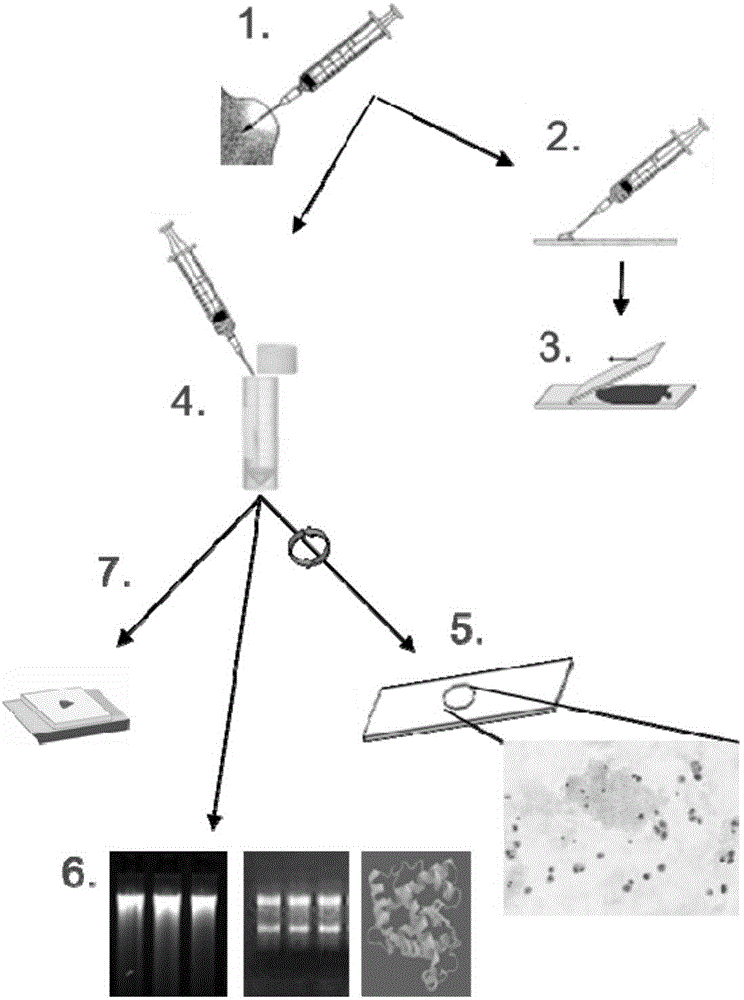
在本发明方法的优选实施方案中,对样品的等分试样采取一种以上的处理或研究方法。例如,包含感兴趣细胞的最终样品组合物可以分成几个等份,并且通过已知的细胞学方法对一个等份进行研究,另一等份用于分离一个或多个(a)感兴趣的生物分子,而第三等份用于将细胞包埋在合适的包埋材料中。当然,也可以仅除去一个或两个等份用于进一步检查,其中将最终样品组合物的剩余部分进行储存。用于处理收集样品的示例性方法,包括对最终样品组合物的进一步处理,如图1所示。
对于前述处理或研究方法,可以使用任何已知的方法,而不对本发明构成限制。例如,任何合适的细胞染色剂可以用于细胞染色,任何合适的核酸探针或任何抗体可以用于杂交或免疫组化方法,可以进行任何已知的核酸分离方法和/或可以采用任何技术用于样品细胞的包埋或浸润。
根据本发明,可以提供试剂盒,包括可用于目前所述方法的溶液、组合物、器件和/或装备。
因此,这样的试剂盒至少包含如上所述的固定剂组合物。此外,所述试剂盒可以包含以下成分中的至少一种:
A)用于收集液体样品的器件,优选注射器、试管、容器、杯、针,穿刺或抽吸装置
B)用于研究样品中所包含细胞的器件,优选载玻片、移液管、膜、过滤器
C)用于生物分子分离的器件和/或溶液
D)用于细胞染色的器件和/或溶液
E)用于样品包埋或浸润的器件和/或溶液
这些任选的附加成分中,特别优选的是,A)用于收集液体样品的任何器件包含在试剂盒中。
根据C)的生物分子分离的器件或溶液可以是,例如用于裂解样品细胞的裂解溶液,用于结合样品的所需生物分子或非所需剩余物的固体支持材料,允许适应样品条件的溶液,所述条件用于将样品中所需/非所需化合物与固体支持材料结合,用于洗涤所需生物分子的洗涤溶液,或任何其它合适的器件。
根据D)的细胞染色的器件或溶液,具体为用于细胞染色预处理的溶液和/或染色溶液,即用于常规细胞学染色的染料或用于免疫细胞化学染色的抗体。
根据E)的用于样品包埋或浸润的器件或溶液,具体为上述的包埋材料,例如石蜡、矿物油、非水溶性蜡、纤维素、聚乙二醇、聚乙烯醇、琼脂、明胶、硝酸纤维素、甲基丙烯酸树脂、环氧树脂或其它塑料介质中的至少一种,以及任选的用于形成所需形状的模具。
另一方面,器件B)、C)、D)和E)也可以在本发明的试剂盒外,然而所述器件分别与本发明的固定剂或固定的生物样品联合使用。例如,用于生物分子分离的器件和/或溶液C)或用于细胞染色的器件和/或溶液D)可以是已知的并且可以用于市场中的所述分离或染色方法。
因此,应理解,本发明也包括用本发明的固定剂组合物固定的样品用于进一步的研究,例如,生物分子分离、样品/细胞染色或样品包埋或浸润。在这些方法中,适合于或用作用于生物分子分离、用于样品/细胞染色、包埋或浸润的手段/溶液的任何器件或溶液可以用于样品的进一步处理。使用先与本发明固定溶液接触的样品的任何这样的进一步处理均被认为包括在本发明中。用于生物分子分离、用于细胞染色和/或用于样品包埋或浸润的试剂盒或溶液在市场上以及各种实施方案中有大量提供,并且可以用于进一步处理本发明的样品。
上文所述的所有材料和方法适于通过至少一种、优选一种以上分析方法对任何来源于相同样品的体外生物材料进行分析。
附图
图1:对收集用于常规细胞学检查的液体生物样品进行固定、细胞学染色和生物分子纯化的方法方案。
图2显示了储存后不同固定溶液中血液蛋白质的沉淀量(见实施例2)。
图3:在不同固定溶液中固定和储存后的肿瘤细胞的显微图像(见实施例3)。
图4显示了不同组分(iii)的本发明固定剂组合物中固定的细胞的形态以及从所述固定细胞中分离的RNA(见实施例4)。
图5显示了组分(i)、(ii)和(iv)含量不同的本发明固定剂组合物中固定的细胞的形态,以及从所述固定细胞中分离的RNA(见实施例5)。
图6显示了不同最终酸浓度的本发明固定剂组合物中固定的细胞的形态(参见实施例6)。
图7显示了组分(ii)和(iv)含量不同的本发明固定剂组合物中固定的细胞形态以及从所述固定细胞中分离的RNA(见实施例7)。
图8显示了不同pH值的本发明固定剂组合物中固定的细胞形态以及从所述固定细胞中分离的RNA(见实施例8)。
图9显示了本发明固定剂组合物固定并由两种不同染色方法染色的细胞的形态,以及从所述固定细胞分离的RNA的RNA分析数据(见实施例9)。
图10显示了采用本发明固定剂溶液(“FNA-Fix”)或中性缓冲福尔马林(“NBF”)固定的固体组织的形态保存(见实施例10)。
图11:用RT-qPCR检测固定细胞中转录水平的ct值(见实施例11)。
图12:在肿瘤、细胞全血和肝脏提取物经固定并制备人工细胞团块后的显微图像(见实施例12)。
实施例
以下实施例通过使用本文所述的组合物和方法描述了包含细胞的液体样品的研究方法和结果。所述实施例应理解为对本发明进行的说明,而非将本发明限制于特别示出的实施方案。
以下实施例中使用的实验方法:
如非另行描述,以下实施例样品经制备和处理如下:
细胞和细胞提取物的制备
人卵巢腺癌(SK-OV3)细胞在McCoy’5A修饰的培养基中进行单层生长。用PBS洗涤细胞、通过EDTA普通处理从板上分离并重悬浮于McCoy’s培养基中从而收获(细胞)。通过Neubauer-Zakkermer计数细胞进行细胞数测定。用培养基进一步稀释细胞以达到计算的浓度,例如106/ml。取等份细胞,例如1ml进行离心,将沉淀重悬于一定体积的液体中,例如100μl的培养基、全血或血浆,以达到计算数量的细胞,例如,106细胞,随后用液体固定剂组合物固定。
大鼠组织提取物的制备:
切片后,将大鼠组织直接挤压通过标准活检盒网格,并与150μl的PBS(磷酸盐缓冲盐水)轻轻混合。或者将组织切成小块。
细胞学染色:
将多至1ml的最终样品组合物(FNA-固定剂和包含样品的生物材料的混合物)装入EZ漏斗中,并用Cytospin 4细胞离心机(Shandon)直接离心到显微镜载玻片上。将载玻片风干几秒钟并根据Papanicoloau(用Papanicolaou苏木精进行细胞核染色1分钟,用Papanicolaou Lsg OG6(2a)进行角蛋白染色3分钟,用Papanicolaou Lsg EA50进行细胞质染色3分钟)或通过H&E染色(30秒苏木精和1分钟伊红),使用来自Merck的试剂盒或染色试剂。
从固定样品中提取RNA:
将多至1ml的最终样品组合物离心。将沉淀用RNeasy裂解缓冲液RLT重悬并用QIAShredder进行匀浆。在用乙醇调节结合条件后,将裂解物加载在RNeasy微型柱上,并通过离心将RNA结合到柱的二氧化硅膜上。经过几个洗涤步骤和任选地用DNA酶消化柱后,用水洗脱RNA。
用FNA-固定剂固定的固体组织的加工和石蜡包埋:
将大鼠组织切成小块,最大厚度为1-2mm。在活检盒中进行固定。用Leica TP1020自动处理器(Leica,Wetzlar,德国),通过在80%、90%、99%(两次)乙醇、然后是异丙醇(两次)、二甲苯(两次)、二甲苯与低熔点石蜡1:1混合物进行孵育后,在低熔点石蜡中浸润并包埋。将4μm厚度的切片置于载玻片上,脱石蜡,再水化并染色以进行显微镜分析
细胞块的制备:
离心1ml等份的最终样品组合物(FNA-固定剂和包含生物材料的样品的混合物)。将所得沉淀与一滴熔化的琼脂糖(来自生命技术公司的5%低熔点超纯琼脂糖)混合,即约50-100μl。硬化后,将含有封闭生物材料的琼脂糖块转移到标准盒中,如上进行处理和石蜡包埋,切片并用H&E染色。
实施例1
实施例1描述了采用如图1所示的几种分析方法对样品可能进行的处理
方法描述:
将细针抽吸样品收集到注射器中且制备了载玻片上的涂片用于风干或醇固定并接着进行细胞学染色之后,将残余样品直接分配到含有本发明固定剂组合物的试管中用于保存细胞形态和生物分子。通过将试管反转10次或通过短涡流步骤将生物样品与固定剂组合物混合。通过采用分子友好的新固定剂进行的这种固定方式不干扰常规诊断。
生物样品的核酸、蛋白质和细胞形态在室温下是稳定的。固定的标本可以通过试管运输和/或储存数天。可以使用细胞离心机将等分试样离心到显微镜载玻片上用于细胞学染色。或者或另外,可将等分试样进行离心,并可将所得细胞沉淀物进行加工和石蜡包埋以制备细胞块。RNA、DNA或包括miRNA的总RNA可利用专用方案经例如来自来RNeasy和QIAamp产品线的缓冲液纯化。
方案概述(方案见图1):
1.收集FNA标本。
2.将足够的抽吸样品分配到载玻片上。
3.制备涂片,风干或用酒精固定,并染色以进行常规细胞学检查。
4.将残留的FNA样品分配到试管或容器中,用固定剂组合物填充以保存液体生物样品中的细胞形态和生物分子。对固定的FNA标本进行运输和/或存储。
5.对固定FNA样品的等分试样进行细胞离心(cytocentrifugation),并进行细胞学检查的染色。
6.从另一等份中提取生物分子。
7.可选:采用等分试样制备石蜡包埋的细胞块
实施例2:在不同固定剂中沉淀的血液蛋白质
在15ml falcon管中,将5ml固定溶液(1-4)与100μl人全血混合,并将混合物在室温下储存并不受干扰。所述固定剂组合物如下:
(1)PAXgene组织固定剂-Tissue Fix(PreAnalytics)
(2)PreservCyt(Cytyc)
(3)95%乙醇p.a.。
(4)本发明的固定剂组合物:50%EtOH、6%乙酸、20%DEGMEA、和100%ddH2O
组合物(1)在24小时后得到500μl棕色沉淀,组合物(2)在24小时后得到2ml棕色沉淀,组合物(3)得到500μl固体,24小时后得红色沉淀,组合物(4)4天后得到200μl白色沉淀。结果如图2所示。
实施例3:血液蛋白沉淀对细胞学染色的影响
在杯中,将1ml固定剂组合物(1-6)分别与来自全血的50μl人血浆和2×105个培养的人卵巢腺癌(SK-OV3)细胞混合;在室温下24小时后,在显微镜载玻片上用细胞离心涂片器离心,并根据Papanicolaou进行染色。在图3中,细胞以400倍原始放大率示出。使用的固定剂组合物:(1)Surepath(BD),(2)PreservCyt(Cytyc),(3)95%乙醇p.a.,(4)PAXgene组织固定剂(PreAnalytics),(5)本发明固定剂组合物(60%[v/v]乙醇,10%[v/v]乙酸,20%[v/v]乙二醇,用ddH2O加至100%),(6)本发明的固定剂组合物(60%[v/v]乙醇,10%[v/v]乙酸,20%[v/v]乙二醇,d 100%,10%[v/v]乙酸,10%[v/v]乙二醇,用ddH2O加至100%)。
对于组合物(1)-(4),肿瘤细胞形态被沉淀的血浆蛋白所掩盖。由于细胞质部分的严重收缩,细胞质和细胞核之间几乎不可能区分。细胞核出现压缩,染色质结构不可识别。
对于组合物(5)-(6),血浆蛋白质形成不会使细胞形态掩盖的薄层。细胞质和细胞核是完整的,染色质结构是完整的,可以清楚地识别核仁和中期染色体。结果如图3所示。
实施例4:与含有不同组分(iii)的本发明固定剂组合物混合的液体样品中的肿瘤细胞的形态学和RNA保存
将106个培养的人卵巢腺癌(SK-OV3)细胞的细胞沉淀用100μl细胞培养基重悬,与4ml的下文所述含不同组分(iii)的本发明固定剂组合物(1)-(11)混合,并在室温下储存4天。将100μl的各等分试样在显微镜载玻片上用细胞离心器离心,并根据Papanicolaou(如图4所示,1000倍原始放大率)进行染色。此外,取相同最终样品组合物的1ml的各等分试样进行离心,将沉淀物重悬在裂解缓冲液中,并如上所述提取RNA。在Agilent Bioanalyzer上分析RNA(分别在细胞图像的右侧显示了三个独立重复的凝胶图像)。
在组合物(1)-(11)中,固定剂组合物由50%[v/v]乙醇、10%[v/v]乙酸、20%[v/v]水和20%[v/v]附加组分(iii)组成,未调节pH。使用以下附加组分(iii):(1)二甘醇单乙醚乙酸酯、(2)甘油、(3)聚乙二醇200、(4)聚乙二醇300、(5)己烷三醇、(7)二甘醇一乙醚、(7)2,3-丁二醇、(8)1,3-丙二醇、(9)2-甲基-2,4-戊二醇、(10)二丙二醇、(11)1,3-丁二醇。
从图4可以看出,肿瘤细胞的形态保存良好。可见细胞质和细胞核。在核内,可以鉴定染色质结构,如核仁和中期染色体。来自固定细胞提取物的RNA在环境温度下储存4天后具有高质量。在由Agilent Bioanalyzer产生的凝胶图像上可以看到核糖体18s和28s rRNA的不同条带,表明为高分子量RNA。
实施例5:与人血浆和含有不同体积的醇、水和酸的固定剂组合物混合的肿瘤细胞的形态学和RNA保存的比较
将2×105个培养的人卵巢腺癌(SK-OV3)细胞的细胞沉淀物与50μl人血浆重悬,与1ml具有不同量的醇、水和酸的固定剂组合物(1)-(7)混合并储存在环境温度下。储存1小时后,用细胞离心涂片机在显微镜载玻片上将储存重复品离心并根据Papanicolaou(图5中显示为400倍原始放大率)染色;各重复品独立存储6天,离心,将沉淀重悬于裂解缓冲液中,并如上所述提取RNA。在Agilet Bioanalyzer上分析RNA(图5中显示了两个独立重复品的凝胶图像)。
(1)60%[v/v]乙醇,10%[v/v]乙酸,20%[v/v]水和10%[v/v]乙二醇
(2)60%[v/v]乙醇,10%[v/v]乙酸,10%[v/v]水和20%[v/v]乙二醇
(3)60%[v/v]乙醇,10%[v/v]乙酸,30%[v/v]乙二醇
(4)60%[v/v]乙醇,15%[v/v]乙酸,10%[v/v]水和15%[v/v]乙二醇
(5)60%[v/v]乙醇,15%[v/v]乙酸和25%[v/v]乙二醇
(6)70%[v/v]乙醇,15%[v/v]乙酸和15%[v/v]水
(7)70%[v/v]乙醇,15%[v/v]乙酸和15%[v/v]乙二醇
从图5中可以看出,肿瘤细胞的形态在所有样品中保存良好。来自全血的血浆蛋白作为薄层可见,但并不掩盖细胞形态。细胞质和细胞核是完整的,可以识别染色质结构,如核仁和中期染色体。
在样品1和2中,来自固定细胞和血浆的提取物RNA在环境温度下储存6天后具有高分子量,如通过Agilent Bioanalyzer所产生的凝胶图像,其显示了核糖体18s和28s rRNA的不同条带。
实施例6:本发明的固定剂中的酸浓度对细胞细胞学保存和染色的影响
将106个培养的人卵巢腺癌(SK-OV3)细胞的细胞沉淀用50μl细胞培养基重悬浮,与4ml如下所述含有不同组分的本发明固定剂组合物(1)-(3)混合,不加入(图6:1-3)或加入40μl人血浆和8μl人全血(图6:4-6)。将培养细胞和固定或培养细胞、血浆、全血和固定剂的混合物在室温下储存7天。存储后,将1ml的各等分试样用细胞离心器在显微镜载玻片上离心,并根据Papanicolaou((图6:1-6)进行染色,400倍原始放大率。
(1)50%[v/v]乙醇,10%[v/v]乙酸,20%[v/v]水和20%[v/v]二甘醇单乙醚乙酸酯
(2)50%[v/v]乙醇,5%[v/v]乙酸,25%[v/v]水和20%[v/v]二甘醇单乙醚乙酸酯
(3)50%[v/v]乙醇,2%[v/v]乙酸,28%[v/v]水和20%[v/v]二甘醇单乙醚乙酸酯
在组合物(1)-(2)中,肿瘤细胞形态得以保存良好。可以将细胞质与细胞核区分开。可在核内进行核定位。可以容易地鉴定有丝分裂细胞(如图6所示,具有箭头的1和2)。相反,在组合物(3)中,酸浓度明显较低的情况下,肿瘤细胞中的染色质看起来被压缩。细胞的总体染色较暗,可以看到的细节较少,这使得有丝分裂细胞的鉴定困难。此外,与用组合物(1)-(2)固定的细胞相比,细胞似乎有收缩且细胞质部分有所减少。
当将人血浆和全血加入细胞和固定剂的混合物中以模拟细针抽吸物时,另一个差异变得明显。在组合物(1)-(2)中,人血浆形成不会掩盖细胞形态的薄层(图6:4和5)。红细胞可以看到是空壳。肿瘤细胞的细胞质和细胞核仍然完整,染色质结构出现分化,可识别核仁和中期染色体。与包括酸量较少的组合物(3)相反,人血浆蛋白似乎有沉淀,红细胞被破坏,并且肿瘤细胞随着细胞质部分的减少而收缩(图6:6)。
实施例7:用根据本发明的具有不同量的水和酸的固定剂组合物与人全血混合的肿瘤细胞的形态学和RNA保存
将5ml的不同本发明固定剂组合物(1)-(6)分别与106个培养的人卵巢腺癌(SK-OV3)细胞和100μl人全血混合。将固定的细胞和血液的混合物在环境温度下储存7天。将100μl的各等分试样用细胞离心器在显微镜载玻片上离心,并根据Papanicolaou(图7中显示,400倍原始放大率)染色;进一步将1ml的各等分试样离心,将沉淀重悬于裂解缓冲液中,并如上所述提取RNA。在Agilent Bioanalyzer上分析RNA(图7显示了三次独立重复实验的凝胶图像)。
(1)25%[v/v]水,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,加入乙醇100%[v/v]
(2)25%[v/v]水,6%[w/v]乙酸,25%[v/v]二甘醇单乙醚乙酸酯,加入乙醇100%[v/v]
(3)20%[v/v]水,6%[w/v]乙酸,25%[v/v]二甘醇单乙醚乙酸酯和加入乙醇100%[v/v]
(4)20%[v/v]水,10%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯和加入乙醇100%[v/v]
(5)25%[v/v]水,10%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,加入乙醇100%[v/v]
(6)25%[v/v]水,10%[w/v]乙酸,15%[v/v]二甘醇单乙醚乙酸酯,加入乙醇100%[v/v]
从图7中可见,肿瘤细胞和白细胞的形态保留良好,细胞质、细胞核和染色质结构可见。白细胞可以与肿瘤细胞区分开,可见红血细胞呈空壳状。红细胞以及血浆蛋白不会掩盖肿瘤细胞的形态。来自固定细胞和全血的提取物RNA在环境温度下储存7天后具有高分子量,如经Agilent Bioanalyzer(参见图7)产生的凝胶图像上的核糖体18s和28s rRNA的不同条带所示。
实施例8:用具有不同pH的本发明固定剂组合物固定的肿瘤细胞和全血的混合物中的形态学和RNA保存
将5ml具有不同pH(用氢氧化钠调节)的本发明固定剂组合物(1)-(3)与100μl人全血和106个培养的人卵巢腺癌(SK-OV3)细胞混合并储存7天。
(1)“FNA-1”:50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,pH未调节,用ddH2O加至100%
(2)“FNA-2”:50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,pH3,用ddH2O加至100%
(3)“FNA-3”:50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,pH3.3,用ddH2O加至100%
将100μl的各等分试样分别用细胞离心器在显微镜载玻片上离心,并根据Papanicolaou染色(图8A,原始放大倍数为1000倍);
将每份1ml的3个重复样品离心,将获得的沉淀重悬于裂解缓冲液RLT中,并如上所述提取RNA。在Agilent Bioanalyzer上分析RNA(图8B)。
肿瘤细胞和白细胞的形态保存良好,细胞质、细胞核和染色质结构可见。不同类型的白细胞,如具有多叶核的嗜中性粒细胞,可以与如淋巴细胞相区别。可见红血细胞呈空壳状。
来自提取物的RNA在环境温度下储存7天后具有高质量。
实施例9:用本发明固定剂组合物固定的肿瘤细胞、全血和大鼠脾细胞提取物的混合物中的形态学和RNA保存
5ml的本发明固定剂组合物(50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,用ddH2O加至100%,pH未调节)与50μl大鼠全血、100μl大鼠脾提取物和106个培养的人卵巢腺癌(SK-OV3)细胞混合并储存7天。
将每份100μl的等分试样用细胞离心涂片器离心到显微镜载玻片上,并根据Papanicolaou(PAP)或用苏木精和伊红(H&E)染色;(见图9A:1000倍原始放大率);
将3份1ml的重复品进行离心,将沉淀重悬于裂解缓冲液RLT中,并如上所述提取RNA。在Agilent Bioanalyzer上分析RNA(图9B)。
肿瘤细胞、白细胞以及脾细胞的形态得以保留,细胞质、细胞核和染色质结构可见。可以在不同细胞类型的混合物内鉴定更大的肿瘤细胞。可以区分染色质结构如核仁或中期染色体。可见红血细胞呈空壳状。在与Papanicolaou或H&E的染色之间似乎不存在定性差异(见图9A)。
实施例10:与用中性缓冲福尔马林(NBF)固定相比,用本发明固定剂组合物固定的实体大鼠组织的保存形态
将大鼠组织(1.脾,2.食道,3.肠)切成最小厚度约1-2mm的小块,并在室温下在10ml本发明的固定剂组合物中固定24小时(50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,加入ddH2O至100%,pH未调节(图10中的“FNA-固定剂))或中性缓冲福尔马林(“NBF”)。将固定的组织置于盒中,在Leica TP1020自动化组织处理器上处理并用石蜡包埋。将具有4μm厚度的切片脱蜡,用H&E染色并用显微镜分析(结果如图10所,400倍原始放大率)。
用NBF保存的不同组织类型和用FNA-固定剂的形态学相当。在脾组织中,红髓和白髓可以分开,在食管中可见不同层的上皮细胞、平滑肌细胞和结缔组织。一般来说,在使用本发明固定剂组合物的情况下,形态呈现出更高的对比度和更好的染色质差异。
实施例11:用本发明固定剂组合物固定的单细胞中转录物水平的冷冻
为了测定RT-qPCR中的相对转录物水平,从培养的人卵巢腺癌(SK-OV3)细胞中分离RNA,将其固定在1ml本发明固定剂组合物中(50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,添加ddH2O至100%,pH未调节)。在5、10、20或60分钟后,从细胞中分离RNA。作为ΔCt值计算的参考,还从在RNeasy裂解缓冲液RLT(凯杰公司-Qiagen)中直接裂解的106个细胞的细胞沉淀中分离RNA,而不在固定剂组合物中孵育。
对来自p53、IL8、cFos、IL1β、β肌动蛋白和18s基因的mRNA中的扩增子进行一步定量RT-PCR测定。Ct值显示为ΔCt。ΔCt计算如下:本发明固定剂组合物中固定5、10、20或60分钟的RNA减去直接裂解细胞RNA获得的Ct值。
RT-qPCR的Δ-Ct值如图11所示。
实施例12:用具有不同pH的本发明固定剂组合物固定的肿瘤细胞、全血和肝提取物的混合物制备细胞块
将5ml的本发明固定剂组合物(50%[v/v]乙醇,6%[w/v]乙酸,20%[v/v]二甘醇单乙醚乙酸酯,其中pH未调节的(A)或用氢氧化钠将pH调节至3的(B)与100μl大鼠全血、大鼠肝提取物和106个培养的人卵巢腺癌(SK-OV3)细胞混合。在环境温度下储存7天后,将每份1ml的等分试样离心,并按如上所述在石蜡中制备细胞块。将4μm的切片进行脱蜡并用H&E染色(图12:400x原始放大率)。
肿瘤细胞、白细胞以及肝细胞的形态得以保存。可以基于不同的染色以及较大的核和细胞核与细胞质的不同比率来鉴定和区分肿瘤细胞与肝细胞。此外,可以鉴定更小的血液白细胞。红细胞呈现为空壳或完全被破坏。可以区分肝和肿瘤染色质内的结构,如核仁或中期染色体。
- 还没有人留言评论。精彩留言会获得点赞!