确定血液或血浆中的抗凝剂的测定的制作方法
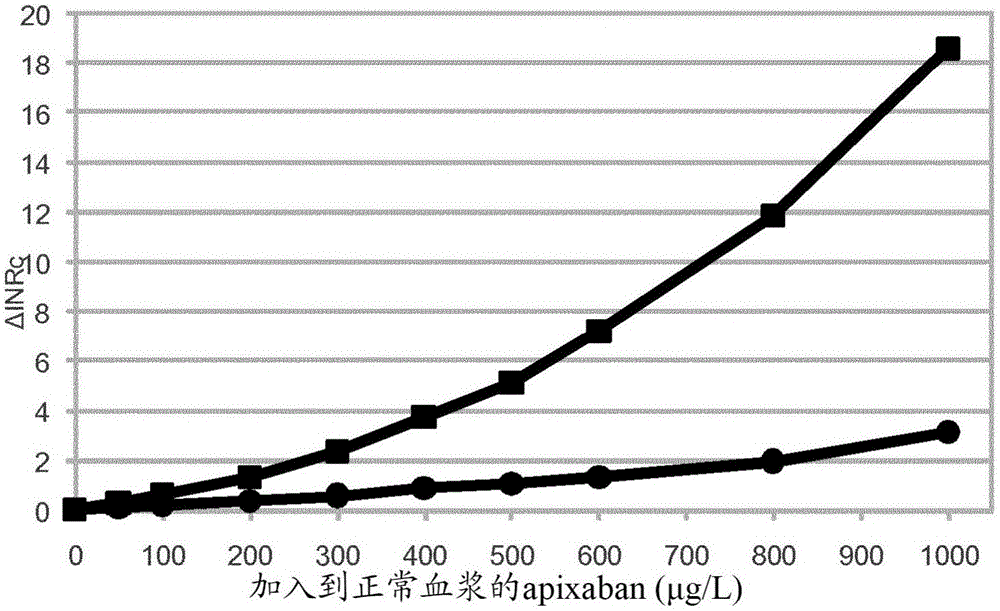
本公开内容涉及确定血液或血浆样品中的抗凝剂的测定。背景抗凝剂是抑制、减少或消除血液或血浆凝结的能力的物质–抗凝剂减少纤维蛋白原被转化为纤维蛋白的速率。一些抗凝剂是天然存在的、内源的,并在限制体内血液凝结的发作、蔓延速度和空间扩展中起到重要的生理作用。其他抗凝剂在病理条件下出现。在蛇毒素和在蚊子、水蛭、蝙蝠和壁虱的分泌物中发现了抗凝剂。一个越来越多的抗凝剂的组是为了治疗和预防血栓栓塞紊乱的目的产生的人造物质。血液凝结是复杂的现象,包括在血浆中或在参与的细胞表面上发现的许多相互作用的分子。存在许多细胞和分子相互作用,包括可被抗凝剂的作用下调或破坏的许多酶催化反应。直接作用的抗凝剂抑制、妨碍或消除凝血过程中关键酶(凝血酶(FIIa)或活化的凝血因子X(FXa))的一种或二者的酶促作用。间接作用的抗凝剂以一些其他方式起作用,其中之一是增强直接作用抑制剂的功效。在一般治疗使用的抗凝剂之中,肝素是间接作用抗凝剂且维生素-K拮抗剂(华法林(warfarin))是凝血因子水平的一般减少者。直接作用抗凝剂是水蛭素(水蛭的一种蛋白)和最近产生的FIIa或FXa的抑制剂。这些新的直接作用抗凝剂,特别是可口服施用的那些,DOAC或还称为NOAC(非维生素K口服抗凝剂),正在导致临床和实验室医学中的显著变化。抗凝剂具有不同作用模式的事实对实验室医学在设计可确定抗凝剂的方法方面构成挑战。在一定程度上,这一挑战被在产生治疗血栓栓塞紊乱的新物质方面的最近药理学成功加剧,参见例如J.Harenburg,S.Marx和R.Determinationoftheanticoagulationeffectsoftheneworalanticoagulants:anunmetneed,ExpertReviewofHaematology,February2012,Vol.5,No.1,Pages107-113。在有许多可用的检测和合格的人员来解释结果的中心医院实验室,检测和确定DOAC表现为相对直接-FIIa抑制剂和FXa抑制剂可分别通过凝血酶时间(TT)检验或FXa检验来测定。如果这些检验的标准变化形式不满足要求,标准变化形式的一些修改或“稀释”将满足要求。在初级护理中心和在医院内但远离中心实验室的位置、场所,“场所外(off-site)”,情况是不同的。在POC场所(床边护理(PointofCare))的实验室医学的特征是,不同的实验室检验的数目是有限的,因为此类实验室场所的物理空间是有限的且因为合格的实验室人员的可用性是有限的。在凝血中,最可用的POC检验是凝血酶原检验(PT-检验),结果以INR(国际归一化比率,即,样品的PT与通过对归一化指数(一种灵敏度指数)加权而归一化的常态PT之间的比率)表示。其他“例行”或“常见”凝血检验是活化的部分促凝血酶原激酶时间(APTT)、活化的凝血时间(ACT)和所提到的TT。凝血领域中理想主义专家希望,这些“例行”或“常见”凝血检验可被调整、修改、“稀释”,以满足测定“新”抗凝剂特别是NOAC中的POC需求。此类想法/希望例如由E.J.Favaloro和G.Lippi,Theneworalanticoagulantsandthefutureofhaemostasislaboratorytesting,BiochemiaMedica2012;22(3):329-41表述。由于PT-INR是用于凝血测量的最常见可用的POC检验,可藉以确定NOAC的修改的PT检验或“稀释的PT”是高度期望的。存在在此类方向的已报道的研究工作。大多数PT检验对于直接FXa抑制剂诸如利伐沙班(rivaroxaban)的低灵敏度是已知的。C.Kluft在EP2405274A1中公开,被某种蛇毒RVV-V影响的PT检验还显示对利伐沙班的灵敏度,并公开了利用此类促凝血酶原激酶的PT检验的使用。发现通过一些PT检验(无论修改与否)确定NOAC的方式的希望,在近年已经下降。在2014年1月,T.Lindahl,瑞典的凝血的外部质量团体(coagulationoftheexternalqualityorganizationofSweden),EQUALIS的专家组成员,报告了由专家组对一种FXa抑制物质aprixaban进行的研究。结论是,许多市售可得的PT或APTT检验都不能用于在临床相关浓度确定血浆中的aprixaban。另一方面,FXa检验针对此目的工作良好。必须提到的是,由于在用维生素K拮抗剂治疗的患者的血液中发现的非功能性凝血因子pivka的可变抗凝作用而校正PT结果的努力。US7,767,459B2(J.Horsti)通过由任何给定PT方法的标准程序测量血浆的PT,和在用生理缓冲液诸如9g/lNaCl预稀释血浆后测量血浆的PT,来提供此。随后将表示为秒或INR的PT结果对最终血浆稀释的程度绘图并外推到零。血浆在零的最终稀释的PT,减去正常血浆的,被作为pivka作用的量度,并用于校正原始PT结果。已经设想了新的凝血检验,目的是确定数种不同种类的抗凝剂,特别是肝素和NOAC。这些努力证明了确定这些抗凝剂的临床重要性。参见CalatzisA,PeletzD,HaasS,SpannaglM,RudinK,WilmerM,Prothromibnase-inducedClottingTimeAssayforDeterminationoftheAnticoagulantEffectsofUFHandLMWH,Fondaparinux,andThrombinInhibitors,AmJClinPathol2008;130:446-454,和SamamaMM,MartinoliJL,LeFlemL,GuinetC,Plu-BureauG,DepasseF,Assessmentoflaboratoryassaystomeasurerivaroxaban–anoral,directfactorXainhibitor,ThrombHaemost2010;103/4:815-825。本发明的相关背景是湿化学方法和干化学方法之间的区别。湿化学定义为在血液或血浆的凝血测定中,混合一定体积的样品和一定体积的试剂。因此,样品在反应混合物中被稀释至某一程度。在干化学中,这种稀释不发生。将样品与干燥形式的试剂物质混合或接触,且无样品的稀释。大多数POC检验是干化学检验,因为它们通常可以容易使用的形式例如条带或芯片展示。操作者通常仅需要加入小体积的样品。干化学方法的缺点是,检验更难以修改。湿化学程序赋予的一个自由度因素,样品稀释的程度的变化,对于干化学不可用。每次提到“例行”检验的“稀释”修改是以湿化学作为前提。概述本公开内容的目的是提供确定血液或血浆样品中的抗凝剂的测定,所述测定包括用至少两种湿化学凝血酶原时间(PT)方法的分析,所述测定被设计以可适用于确定血液或血浆样品中直接和间接抗凝剂二者。本发明由所附的独立权利要求限定。在从属权利要求、附图和以下描述中列出了实施方案。根据第一方面,提供了一种确定血液或血浆样品中的抗凝剂的测定,其中所述测定包括用至少两种湿化学凝血酶原时间(PT)方法的分析。所述测定包括以下步骤:a)在用第一PT方法的第一PT分析中,在包含在第一体积的包含促凝血酶原激酶、纤维蛋白原和凝血因子V的液体试剂中稀释的第一体积的血液或血浆的第一反应混合物中测量PT,b)在用第二PT方法的第二PT分析中,在包含在第二体积的液体试剂中稀释的第二体积的血液或血浆的第二反应混合物中测量PT,其中所述第二反应混合物中血液或血浆的浓度不同于所述第一反应混合物中血液或血浆的浓度。所述至少两种PT方法被校正以当用于分析缺少该测定感兴趣的抗凝剂的参考血液或血浆时给出相同或大致相同的PT结果。所述测定还包括步骤c)计算来自步骤a)和b)中的测量结果的PT差异,其中如果PT差异是1)显著的,这指示血液或血浆样品中抗凝剂的存在,或2)不显著的,这指示血液或血浆样品中不存在高于可检测水平的抗凝剂。用至少两种PT方法的分析在本文是指,该测定可包括用2、3、4、5或多达6种PT方法的分析。PT差异在本文是指绝对差异或相对差异。该测定中使用的至少两种PT方法可以是基本上相同的PT方法,但具有一些可表现不显著的差异。此类差异,除了由本发明提供的差异,即样品体积和试剂体积之间的关系的差异以外,可以是进行测量的温度的差异和反应混合物的离子强度或pH的差异。湿化学PT方法在本文是指Owren型PT方法。反应混合物中血液或血浆的体积与液体试剂的体积之间的比率可取决于PT试剂的特征和样品中待检测的抗凝剂的浓度而大大变化。当实践测定时,不存在血液或血浆样品可在PT试剂中如何少和如何大范围稀释的严格限制,限制是实践性质的。血液或血浆样品稀释在液体试剂中的较低水平是约1:2。在较低稀释度,测定的一些有利的特征可能失去,例如柠檬酸化的样品不再是可分析的。最高的可能的稀释度将是明显较高的,约1:200。如此高的稀释度可以是可能的,由于反应混合物的纤维蛋白原和FV的必需水平不必来自样品。这是因为,Owren类型的液体PT试剂,除了促凝血酶原激酶以外,还包含有效水平的纤维蛋白原和FV。还是对于Owren类型的液体试剂,对最终样品稀释的程度存在实践限制。在反应混合物中非常低水平的血液或血浆样品下,FVII、FX和FII的水平也如此低,以至于凝血时间(PT)变得如此长,以至于检测变得困难或不可能。因此,在实践本发明时,血液或血浆的体积与反应混合物中液体试剂的体积之间的比率可以在1:2和1:200之间变化。优选的比率范围可以是在1:5和1:100之间或1:10和1:50之间。在本测定中,在至少两种反应混合物中分析PT,所述至少两种反应混合物具有在反应混合物中不同浓度的血液或血浆。第一反应混合物中血液或血浆的浓度可以比第二反应混合物中血液或血浆的浓度高约1.5至100倍、1.5至50倍、1.5至25倍、1.5至10倍或1.5至5倍。1.5至5倍的浓度差异对于实现是实际的,并在本测定显示允许确定在临床相关浓度范围中的抗凝剂。然后,第二反应混合物中血液或血浆的浓度可以比可能的第三反应混合物中血液或血浆的浓度高约1.5至100倍、1.5至50倍、1.5至25倍、1.5至10倍或1.5至5倍。尽管反应混合物中血液或血浆浓度的差异,测定的所有两种或更多种不同PT方法被用缺少感兴趣的抗凝剂的相关参考血液或血浆样品校准,以给出相同或大致相同的PT结果。这一PT以使其可能的方式表示。以通常的时间单位表示将不可行,因为这些将在方法之间变化,并是其原样(不能被校准)。具有低浓度的血液或血浆的反应混合物显示长的PT:s且反之亦然。表示PT的一种普通方式是以INR(国际化标准化比率),但其他表达方式,各种合成的(synthetic)时间样单位、或其比率,是可能的。重要的是,提供的缺少抗凝剂的相关样品,经两种或更多种PT方法分析,将产生尽可能接近相同的结果。比较来自一种PT方法的结果与来自另一种PT方法的结果的一个普通方式是平均PT结果和比较的CV(变异系数)。校准是使得,缺少抗凝剂的多个相关样品的平均PT结果对于所有的两种或更多种PT方法应尽可能接近地相同,且比较的CV应尽可能低。至少两种PT方法可被校准,使得当用于分析来自正常个体的参考血液或血浆和此类参考血液或血浆的稀释物时,给出相同或大致相同的PT结果。来自正常个体的参考血液或血浆在本文是指来自未经受抗凝剂处理的一个或数个表面上健康的人的血液或血浆或此类样品的集合(pool)。至少两种PT方法可被校准,使得当用于分析这样的血液或血浆时给出相同或大致相同的PT结果,该血液或血浆缺少本测定感兴趣的抗凝剂(来自单个或许多个体或来自不同个体的样品的集合)且该血液或血浆通过一种或数种已建立的PT方法确定具有高于正常的PT值。在测定的步骤c)中,计算PT测量结果之间PT的绝对或相对差异。术语“显著”和“不显著”在本文以其常规统计学定义提供。然后,显著差异是2倍CV或更多的相对差异,不显著差异小于2倍CV。尽管表述不同,观察到的差异如果在由测定确定缺少抗凝剂的样品群体中具有低的发生概率,则是显著的。这一概率可设置在不同水平。通常水平是5%(p<0.05)或1%(p<0.01)。如果在步骤c)中计算的PT差异是显著的且已知抗凝剂的身份,则可计算血液或血浆样品中抗凝剂的浓度。如果在步骤c)中计算的PT差异是不显著的且已知抗凝剂的身份,则可指定抗凝剂不以高于其的水平存在于所述血液或血浆样品中的水平。如果在步骤c)中计算的PT差异是显著的,则在抗凝剂的不存在下血液或血浆样品中估计的PT是可计算的。仅当抗凝剂的身份是已知的或推测的时,可进行血液或血浆样品中抗凝剂浓度的计算。如果已经进行了用两种PT方法的分析,使用PT结果的差异和来自具有最高样品稀释度的分析的PT结果用于这一计算可以是方便的。在最高稀释度的PT结果将最接近无抗凝剂存在时的PT结果。利用INR形式体系,这一假想的PT结果称为INRo。依据对抗凝剂水平的剂量响应是否是线性的,INRo可通过减去差异的分数或减去差异的函数来获得。由于剂量响应可依赖于这一INRo和依赖于进行确定的温度,差异的大小向抗凝剂浓度的转化可要求许多所谓的标准曲线。可选地,多维函数可被采用来计算INRo和抗凝剂水平。如果用多于两种PT方法的分析已被进行以实践本发明的测定,可计算多于一种差异,且这些若干差异、和在最高样品稀释度获得的PT值,可被用于计算INRo和可能的抗凝剂水平(取决于抗凝剂的身份)。偏好差异之一作为最有用的也是可能的,因为其是用于确定的有利范围。PT测量可在17℃至45℃的范围、优选地在18℃至30℃的范围、更优选地在21℃至30℃的范围,且最优选地在25℃至30℃的范围内的环境温度进行。低于但不远离30℃的此类温度区间是有利的,因为该温度几乎不影响PT,从而改进提供的PT分析的精确度。此外,在以下实施例中,较低的温度增加抗凝剂的测定灵敏度。在本测定中可确定的抗凝剂是包括活化的凝血因子IIa和Xa的直接作用抑制剂的组的成员,其可选自包括达比加群(dabigatran)、apixaban、rivaroxaban或水蛭素的组,或是包括活化的凝血因子IIa和Xa的间接作用抑制剂的组的成员,其可选自包括分级的或未分级的肝素的组。第一反应混合物中液体试剂的第一体积可等于第二反应混合物中液体试剂的第二体积。在液体试剂中稀释的血液或血浆的体积可以是在1至20μL的范围中。可以用端对端毛细管将血液或血浆的体积加入到液体试剂。反应混合物中血液或血浆的体积与液体试剂的体积之间的比率可以是1:2至1:200、1:5至1:100或1:10至1:50。第一反应混合物中血液或血浆的浓度可以比第二反应混合物中血液或血浆的浓度高约1.5至100倍、1.5至50倍、1.5至25倍、1.5至10倍或1.5至5倍。反应混合物可包括在10至50mM的范围、在10至30mM的范围或在10至24mM的范围的最终浓度的钙离子。反应混合物中钙的最终浓度在本文是指反应混合物中的总钙,其主要作为游离Ca2+,但还有络合的钙离子。对于包含所示浓度的钙的反应混合物,凝血抑制剂可通过测定确定的灵敏度可被增强。过度高的钙水平应被避免,由于增加的Ca2+水平将渐进地延长凝血时间,这通常是不利的。反应混合物的克分子渗透压浓度可以是约0.3至0.5Osm/kg、或约0.3至0.4Osm/kg。这样的克分子渗透压浓度水平可通过增加PT试剂中的NaCl水平以使PT试剂高渗(比血浆和其他生理溶液更高的渗透压),因此也使得反应混合物高渗,来获得。这样的克分子渗透压浓度水平可增加抗凝剂测定灵敏度。然而,如果NaCl水平过高,凝血时间可变得过度长。反应混合物中增加的克分子渗透压浓度和增加的钙水平的组合可增加抗凝剂测定的灵敏度以给出最有利的高灵敏度。附图简述图1是显示在正常血浆中用本测定测量的apixaban含量的图。图2是图1的图的部分的放大。图3是显示在正常血浆中用本测定测量的apixaban含量的图(原始数据:PT以秒计)。图4是图3的图的部分的放大。图5是显示在正常血液中用本测定测量的apixaban含量的图。图6是图5的图的部分的放大。图7是显示在正常血液中用本测定测量的达比加群含量的图。图8是图7的图的部分的放大。图9是显示在正常血浆中用本测定测量的肝素含量的图。图10是图9的图的部分的放大。图11是显示,当测量来自正常个体和用华法林治疗的患者的参考样品时,对于5μl和20μl方法,PT20c/PT5c针对平均PTc的相对差异的图。图12是显示,当测量来自正常个体和用华法林治疗的患者的参考样品时,对于5μl和20μl方法,PT20c-PT5c针对平均PTc的绝对差异的图。图13是显示,当测量来自正常个体和用华法林治疗的患者的参考样品和来自用达比加群治疗的患者的样品时,对于5μl和20μl方法,PT20c/PT5c针对平均PTc的相对差异的图。图14是显示,当测量来自正常个体和用华法林治疗的患者的参考样品和来自用达比加群治疗的患者的样品时,对于5μl和20μl方法,PT20c-PT5c针对平均PTc的绝对差异的图。图15是显示,当测量来自正常个体和用华法林治疗的患者的参考样品和来自用达比加群治疗的患者的样品时,对于5μl和20μl方法,PT20/PT5针对平均PT的相对的未校准差异的图。图16是显示,当测量来自正常个体和用华法林治疗的患者的参考样品和来自用达比加群治疗的患者的样品时,对于5μl和20μl方法,PT20c/PT5c针对平均校准的PT的相对的校准差异的图。详细描述提供了以下实施例,并非限制本发明的范围,而是进一步解释和描述本发明,和鼓励在这一重要医学诊断领域中的开发。实验工作用市售可得的环境室温凝血仪器SimpleSimonPTZafenaAB,Sweden进行,其功能在EP1636595B2中描述。对于每种PT方法使用一个仪器或读取器(reader)。可选地,对于所有PT方法可使用相同的仪器。在实施例1至6中,对于三种PT方法即20μL方法、10μL方法和5μL方法的每一种,使用一个特定读取器。在与实验室的环境室温热平衡的实验台上,一起使用彼此相邻放置的三个仪器。对于给定的PT确定,每个仪器以秒展示PT,如在表2中报告的。而且,经由每个读取器的内部数据处理能力,展示了对于每种PT方法,样品INR的粗略估值。这些粗略INR估值在表1、3和4中报告。由于,在每个系列的实验中,还分析了相关参考样品,来自每种PT方法的结果可在完成实验系列后在单独的办公室台阶段(officedesksession)中校准。无论由不同PT方法的两种或更多种确定的原始PT数据如何表示,在利用参考样品校准后,不同的PT方法显示尽可能接近的相同PT。在进行研究工作的实验室中的环境室温在21℃和26℃之间变化。低于但不远离30℃的温度区间是有利的,因为该温度此后几乎不影响PT,从而改进提供的PT分析的精确度。此外,在以下实施例中,较低温度增加抗凝剂的测定灵敏度。然而,在17-45℃的范围中的温度进行测定是可能的。PT试剂是与SimpleSimonPT产品的批次N223M一起分发的PT试剂,是Owren类型的试剂,因此含有有效量的促凝血酶原激酶、纤维蛋白原和FV(兔脑来源的促凝血酶原激酶和牛血浆来源的纤维蛋白原和FV)。也可使用其他Owren类型的试剂。试剂是以200μL的份,向其加入样品柠檬酸化的血液或柠檬酸化的血浆并混合。加入通过安装在管状主体一端的端对端塑料毛细管进行,该管状主体在另一端带有替换机械,这是为了允许方便地混合样品和试剂。带有10μL毛细管的此类Mixxocaps与SimpleSimonPT产品一起供应。为了进行所描述的实验,对一些Mixxocaps安装20μL毛细管或5μL毛细管,代替由制造商与其一起供应的10μL毛细管。可选地,可使用标准移液管或类似物混合血液或血浆样品与液体试剂。实验中使用的血液或血浆体积与液体试剂的体积之间的比率是1:11、1:21和1:41。可使用在1:5与1:100的范围或在1:2与1:200的范围中的其他比率。实验的测定中使用的不同反应混合物之间血液或血浆浓度的差异是在1.5至5倍之间。然而,浓度的差异可以是约1.5倍至100倍。抗凝血的正常血浆是NKP产品GHI-163批次10188,MediRoxAB,Sweden。包含100mg/L的达比加群(Pradaxa,Boehringer-Ingelheim)和apixaban(Eliquis,Bristol-MeyersSquibb)的储备溶液是DepartmentofExperimentalMedicineofUniversity的TomasLindahl教授所赠。未分级肝素是HeparinLeo批次A6888B,LeoPharmaA/S,Ballerup,Denmark。实施例1apixaban是活化的凝血因子X(FXa)的直接作用抑制剂。其是抗凝血药物Eliquis,Bristol-MeyersSquibb的活性化合物。测量血浆中在范围50至1000μg/L中的apixaban是临床上感兴趣的。为了制备合适的样品,将小体积的apixaban储备溶液加入正常血浆即对照血浆NKP,以得到apixaban含量在范围0至1000μg/L中的正常血浆。这些具有apixaban的正常血浆,包括无搀杂的正常血浆(NKP)和在9g/LNaCl中1:2稀释的NKP(NKP1:2),都由SimpleSimonPT来分析,该分析以在200μL试剂中20μL、10μL和5μL的样品添加进行,从而对于三种PT方法,使用根据本发明的反应混合物中的不同样品含量。还相关的是,根据本发明,校准了所有三种PT方法,对于无搀杂的NKP显示INR1.000和,且对于NKP1:2显示INR1.357。所有原始INR值,即在仪器屏幕(对于每种PT方法使用一个仪器或读板器读取器)显示的结果,从而通过式A*INRexp(B)转化为校正的/校准的INRc,其中a和b被选择以分别为NKP和NKP1:2给出其期望值,分别为1.000和1.357。NKP1:2的INR值通过Lindahl等的对于对应50%(等于INR1.000的100%的一半)的PT活性的INR的公式计算。数据处理在表1中示出。在INR校准的列(INRc)上方存在上方数字(uppernumber)和下方数字(lowernumber),这些分别是以上提到的A和B。表1显示了正常血浆的apixaban含量的两种测量结果:更灵敏的量度,即PT方法提供的20μL样品和5μL样品的INRc的差异;和较不灵敏的量度,即10μL和5μL之间的INRc差异。INRc差异在此处显示为绝对差异,但相对INRc差异已经可以同等良好地使用。将INRc差异对正常血浆的apixaban含量绘图,如在图1的图中所示的。正方形符号是20μL方法的结果与5μL方法的结果之间的INRc差异,且圆形符号是10μL方法的结果与5μL方法的结果之间的INRc差异。指出了,在抗凝剂的不存在下估计正常血浆的INR即INRo是可能的。在以上,这以较不复杂的方式进行。从5μL样品方法的INRo结果减去较小INRo差异的部分(56%),结果明显最接近INRo。这些简单的INRo估值令人惊讶地好,只有在最高apixaban含量(1000μg/L)的一个偏离多于十分之一的INR单位。图1和2显示图,其中apixaban含量的测量值的增加速率随着含量增加。然而,对于领会/偏好线性剂量响应关系的那些许多,此类关系在本文由低1个INR单位的apixaban测量值展示,如在图2的图中观察到的,其中图2显示图1的图的部分的放大。图1和2显示的数据处理对于不熟悉INR的环境室温确定的人们可能是令人困惑的。代替已经由仪器/读取器的计算针对温度效应校正的原始INR结果,我们可以改为考虑以秒计的PT。进行此以增加描述本发明的清楚性,尽管由于在进行测定的时间段期间不严格恒定的温度(温度从22.3℃到24.2℃变化)引入误差。尽管存在这一偏差,结果仍然是足够好以令人信服的,并更清楚地解释,因为其允许本领域技术人员熟悉的数据处理,即,通过将PT(以秒计)除以正常PT,和用等价于ISI的归一化常数对比率加权来计算INR。在表2中,显示了对具有加入的apixaban的正常血浆(NKP)进行的测定的结果,但原始数据在此处是以按秒计的PT计的,且数据通过除以正常血浆的PT并将比率经受ISI的加权来转化为INRc,上方数字和下方数字分别在INRc列的上方显示。由于视为相关,上方数字被选择以使NKP1:2显示INRc1.357。在表2中,数据被从顶部的22.3℃到底部的24.2℃运行的温度梯度偏置。然而,这几乎不干扰总的图。使用的PT方法即环境温度Owrens方法,对抑制剂比其他更灵敏,仍然明显的是,单个选择的PT方法在较低水平的apixaban将不会提供较有用的信息。表2假设你利用三种方法中对apixaban最灵敏的方法,具有20μL样品的方法,且你获得35.2秒的PT。这比正常血浆(NKP)的32.8秒要多,但PT的增加是否是由于抗凝剂,或是由于凝血因子的低含量(NKP1:2的PT是36.9秒)?你如何判断?测定的实践,用在反应混合物中具有不同样品含量的PT方法进行两种或更多种PT确定的测定实践,提供了更清楚的描绘。由于被校准以显示相同PT(在本文相同的INR称为INRc,c代表校准的)的方法对于缺少待确定的抗凝剂的样品是不同的,在具有低凝血因子含量的样品的INRc结果之间将存在较少差异或无差异,即无显著差异。在本实施例中,已知样品包含抗凝剂apixaban,因为其已被加入,且出现INRc结果的差异。在本实施例中存在根据本发明使用的三种PT方法,且在INRc结果中存在可被检查的三种差异(三种中的两种在表2中显示),且对于具有50μg/Lapixaban的正常血浆的测定,所有三种差异指示抗凝剂的存在。如果抗凝剂的身份是已知的,其含量可被估计。INRc差异在此处显示为绝对差异,但相对INRc差异已经可以同等良好地使用。还可估计在抑制剂的不存在下样品的预计INRc即INRo。表2显示以秒计的PT,澄清了实践本发明的实用性。预计表2中显示的结果与表1中的那些接近相同,且它们相当良好地一致。对具有最高apixaban含量的样品注意到的差异归咎于温度效应。当进行实验系列时,温度升高约2℃。在报告表1中显示的INR值之前,仪器已经补偿了这一温度转变的效应。当然,表2中显示的PT值(以秒计的凝血时间)未对这一温度效应校正(以秒计的PT是其原样)。因此在表1和表2中显示INR的小差异。在图3和4的图中,已经插入了来自表2的数据。将INRc差异对正常血浆的apixaban含量绘图(由PT方法提供的20μL样品与5μL样品之间的INRc差异(方形)、和10μL与5μL之间的INRc差异(点))。图4中的图是图3的图的部分的放大。实施例2将在0至1000μg/L的范围中的apixaban加入到正常的柠檬酸化的血液。这些血液样品和具有INR2.3的血液样品由SimpleSimonPT利用200μL试剂中20μL、10μL和5μL的样品体积分析。INR的原始结果和在相关校准后的INRc在表3中展示。0,870,931,010,961,101,151,5apixabanINRINRINRINRcINRcINRcΔINRcΔINRcμg/L20μL血液10μL血液5μL血液20μL血液10μL血液5μL血液20μL-5μL10μL-5μLINRo10008,763,502,216,943,692,514,431,180,747146,062,781,874,882,862,082,800,780,915004,582,271,663,732,291,811,920,481,092502,611,641,322,181,601,390,790,211,071251,751,321,131,491,261,160,320,101,02631,411,191,041,211,121,060,150,060,9601,161,060,001,001,001,000,00-0,01N-血液0,371,161,060,991,001,001,000,00-0,01C-血液2,32,762,272,052,302,302,300,000,00表3在这里对所有三种PT方法进行了判定,无apixaban添加的正常血液显示INRc1.00,且由中心医院实验室报告显示INR2.3的柠檬酸化血液在这里显示INRc2.30。如在前面的实施例中的,INRc结果的绝对差异(可选地可使用相对差异)被视为抗凝剂含量(这里是apixaban含量)的量度,并就三种可能的此类差异的两种对已知的apixaban含量绘图和展示在图5和6中。PT方法提供的20μL样品与5μL样品之间的INRc差异显示为方形,且10μL与5μL之间的INRc差异显示为点。图6中的图是图5的图的部分的放大。本发明的抗凝剂方法的剂量响应显示血液中临床上感兴趣的apixaban的范围内的良好阳性剂量响应特征。剂量响应对于小于1的INRc差异也是线性的,参见图6。实施例3达比加群是当含达比加群酯(dabigatran-etexilate)的药物制剂Pradaxa,Boehringer-Ingelheim经口,即口服,施用时,体内形成的活性化合物。感兴趣的临床水平范围从血浆中50至1000μg/L。此类样品通过向正常血浆NKP加入小体积的达比加群储备溶液来产生。结果和数据处理与实施例1的相似,显示在表4中。表4比较表4与实施例1中的表1时,表现为,本发明展示的实施方案对于血浆中的达比加群不如对于apixaban灵敏。当比较图7和8中的图与实施例1的相应图时,这一印象被加强。图(参见图8,图7中的图的部分的放大)的线性部分中更灵敏的INRc差异(20μL减5μL,在图7和8中显示为方形)在约200μg/L达比加群达到0.5,而在约80μg/Lapixaban达到相同数目,参见图2,即,多于两倍的灵敏度差异。而且,50μg/L达比加群的达比加群水平表现为可检测的。不令人惊讶地,确定抗凝剂的测定对不同抗凝剂显示不同的灵敏度。此外,以不同试剂和进行PT分析的不同温度预计不同的灵敏度。实施例4肝素是一种抗凝剂,其难以在护理场所诸如在外科病房可靠地确定。需要更方便的方法。在这方面,本测定确定抗凝剂的实用性在以下示例。本实施例是用未分级的肝素,其通常在大量外科手术中用作抗凝血剂。样品通过向正常血浆NKP加入小体积的肝素储备溶液来制备。在选择的校准中,分别对NKP和NKP1∶2分配INR1.000和INR1.357,这与以上实施例1和3中选择的相关校准相同。实验细节与实施例1和3相同,且结果和数据处理在表5显示。0,950,940,961,321,120,98NKPINRcINRcINRcΔINRcΔINRc0,43肝素U/ml20μL样品10μL样品5μL样品20μL样品10μL样品5μL样品20μL-5μL10μL-5μLINRo56,472,101,3511,172,161,299,880,870,912,52,461,401,133,121,371,082,040,290,961,21,471,191,111,581,141,060,520,081,030,61,261,121,081,291,061,030,260,031,0201,041,061,051,001,001,000,000,001,00NKP1,041,061,051,001,001,00NKP1∶21,311,391,431,361,361,36表5将正常血浆中抗凝剂含量的量度即可能的三种差异的两种的INRc的绝对差异(可选地可使用相对差异)对肝素含量绘图,得到图9和10中的图。如从表5和图9和10观察到的,肝素可在约0.2U/mL被检测到和在浓度范围0.2至5U/mL中确定,这是临床相关的。实施例5根据本抗凝剂测定,两种或更多种PT方法(其中一种在反应混合物中具有比另一种更大比例的样品)被校准以对缺少感兴趣的抗凝剂(即,缺少可被本测定确定的抗凝剂)的参考样品显示尽可能接近相同的PT。在定义上,参考样品的PT是已知的,其作为一组参考样品的平均值或是单独的。在本实施例中参考样品有两种;来自正常个体的血浆样品(n=34)和来自用华法林治疗的患者的血浆样品(n=30)。参考样品的PT是由在UniversityHospitalofSweden的中心实验室进行的参考分析已知的。正常个体和华法林患者的平均参考PT分别是23.1和51.5秒。本抗凝剂测定的两个PT方法,一个是20μL样品加入到200μLPT试剂(反应混合物中较高比例的样品),另一个是5μL样品加入到200μL相同试剂(反应混合物中较低比例的样品)。这两种方法对于正常个体和华法林患者的参考样品分别显示32.8和65.3秒、以及41.8和104.3秒的平均PT。两种PT方法即20μL方法和5μL方法然后被校准以显示相同的平均PT(以合成的(synthetic)秒计),作为用于两组参考样品的参考方法。这通过常数A20和B20、以及A5和B5,由表达式PTc=A*PTexpB分别将20μL方法和5μL方法的PT转化为校准的PT值(PTc)来实现。计算两种方法对每种样品的PTc的差异,表示为比率(PT20c/PT5c)或以绝对方式(PT20c减PT5c),并将其对两种方法的平均PTc绘图,参见图11和12。患者组(图中标为X)中两份参考样品显示统计学上在由其他参考样品(方形)定义的差异的正常分布之外的差异。这些偏离的样品可包含抗凝剂肝素,肝素是可被本抗凝剂测定确定的抗凝剂(参见实施例4),且其在华法林治疗无效时被用于治疗一些住院华法林患者。使用在测定的两种PT方法的校准的PT结果之间的相对差异(图11)或绝对差异(图12)是一种选择。这里,表示为比率的相对差异由于标准偏差在正常的PT范围中与升高的PT范围中大致相同,分别是0.054和0.044,展示了益处,。怀疑含有肝素的患者样品的PTc比率展示与平均值的阳性偏差为由其他28份患者样品定义的标准偏差的3.0和4.5倍。在统计学上,这两个偏离值不太可能是由其他患者样品定义的PTc比率的分布的部分,p<0.05。用于分析正常个体的34份参考血浆和华法林患者的30份参考血浆的相同实验设置也用于分析来自正在经历达比加群(一种抑制凝血酶的NOAC)或将要开始此类治疗的患者的血浆样品(n=13)。13份患者血浆样品来自DepartmentofAcuteInternalMedicineoftheUniversityHospitalofSweden。将表示为比率或绝对数目的患者血浆(标为X)的PT20c和PT5c的差异,引入参考样品(标为方形)的图中,如在图13和14中分别观察到的。3个NOAC患者显示的PTc差异升高在由参考样品定义的正常分布以外。根据确定达比加群的已建立的方法,即稀释的凝血酶时间(dTT)方法,显示升高的PTc差异的三份样品分别含有172、224和350μg/L达比加群。来自NOAC患者的其他10份血浆样品,都未显示升高的PTc差异,根据dTT方法都包含<30μg/L达比加群。有趣的是,在13份达比加群患者样品中有数份样品以20μL方法和5μL方法显示升高的PTc值,但方法之间无显著差异。该发现与华法林治疗的作用而不是达比加群治疗的作用一致。因此,公开的抗凝剂测定能够进行区分。因此,该测定能够估计样品的PT和NOAC(抗凝剂)含量二者。样品对达比加群的不包含,即<30μg/L,由不显著的PTc差异展示。这一发现由用于达比加群确定的已建立方法(dTT)证实。根据dTT确定,通过本测定13份样品中具有不显著的PTc差异的的所有10份,包含<30μg/L。在实践抗凝剂测定时,两种PT方法(一种具有反应混合物中高样品含量和一种具有反应混合物中低样品含量)被校准以数字上显示PT的参考水平。此处,在本实施例中,测定的两种方法的PT结果被校准以显示所谓的合成时间,不是实际的秒,而是反映参考方法的以秒计的PT的数值。如果参考样品的PT以INR表示,则本发明的方法被校准以提供与这些参考样品尽可能地接近的相同INR。如果参考样品的参考PT以正常PT的百分比表示,则这些值被用在校准中。实施例6如以上实施例5中的,本抗凝剂测定的两种或更多种PT方法(一个具有比另一个高的反应混合物中样品含量),都被校准以显示两组参考样品的参考PT结果;34份血浆来自正常个体且30份血浆来自华法林治疗的患者。所有参考PT值由UniversityHospitalofSweden的中心实验室确定。如在实施例5A中的,两种PT方法,一种是20μL样品加入到200μLPT试剂,另一种是5μL样品加入到相同PT试剂。未校准的PT结果称为PT20和PT5,且校准的PT结果分别称为PT20c和PT5c。还由该两种PT方法分析了来自在DepartmentofAcuteInternalMedicineoftheUniversityHospitalofSweden的达比加群治疗的患者的血浆样品(n=20)。根据也在实施例5中提到的已建立的dTT方法,所有20份血浆样品具有高于34μg/L的达比加群水平。在图15和16中,分别在校准之前和之后,将测定的两种PT结果之间的差异(以比率表示)对两种PT结果的平均值绘图。在图中,方形显示参考样品的结果,且X显示NOAC(达比加群)样品的结果。校准前,图15,正常参考样品显示约35秒的平均PT,且华法林患者参考样品显示范围从约65至110秒的平均PT。校准后,图16,正常参考样品的平均PT(平均PTc)是23.1–不是实际的秒而是合成的–且华法林患者参考样品的平均PTc范围从约40至70。校准后,当然,这些平均值和范围与通过参考方法获得的那些非常接近相同,即,它们反映参考值。在比较图15和图16时,明显的是,校准导致本抗凝剂测定的决定性的改进。直接统计分析显示,约80%的临床达比加群样品(参见图16)具有可检测水平的抗凝剂(PTc比率高于正常参考样品的平均值加2*SD)。在校准之前,这是仅70%,参见图15。如果未进行校准,需要设想更复杂、较不直觉的统计分析。校准后,达比加群样品显示范围更宽、更适合定量NOAC确定的PT差异(PTc差异)。并非最不重要的是测定的逻辑,如由操作者构思的。校准后,反应混合物中较高比例样品的一种PT方法将对具有抗凝剂的样品显示比利用较低比例样品的PT方法更高的PT值-如果样品中不存在可检测水平的抗凝剂,两种PT方法当然将显示大致相同。如果没有校准,没有如此直接的逻辑。抗凝剂测定的两种PT方法可被校准以显示参考样品的参考值,无论参考值被如何表示。参考值可(如在本实施例中的)以PT(秒)表示,或它们可以INR表示或表示为正常活性的分数。在所有情形中,校准是可能和有利的。实施例7实施例5和6显示增加使用的抗凝剂测定的灵敏度的需要,因为仅约80%的具有高于30μg/L(根据已建立的达比加群方法(dTT))的达比加群水平的临床样品展示高于测定的检测限值的抗凝剂水平,参见图16(注意,检测限值实际上是沿着1.1的水平线)。本实施例描述目的是改进测定的灵敏度而进行的实验。表6展示来自其中PT液体试剂(批次P161)包含4、8、16或32mM的各种水平的加入的CaCl2的实验的数据。对于每一种试剂,由抗凝剂测定的两种PT方法即20μL方法和5μL方法分析三种样品。两种样品是参考样品即对照血浆NKP和ZAP,分别具有1.00和2.50的已建立的INR值。第三种样品是已向其加入小体积的apixaban储备溶液以得到500μg/L的apixaban浓度的NKP。然后校准每种试剂的结果以对NKP显示1.00的INRc和对ZAP显示2.50的INRc。带有500μg/Lapixaban的NKP(NKP+500)然后显示多种INR20c和INR5c结果。针对每种试剂计算表示为比率INR20c/INR5c的差异,并展示在表6中右边第二列中。为了获得灵敏度的量度,从对NKP+500样品观察的比率INR20c/INR5c估计检测限值。这一估计在以下假设下进行i)对于所有试剂,正常参考血浆的比率的SD是0.052(这一值从实施例6中的数据获得,和ii)比率减一与成比例地从零增加达比加群水平。在这些假设下,对每种试剂的检测限值计算为比率达到一加0.104(2*SD)时的达比加群水平。计算的检测限值在表6的最右列中展示。最高检测限值(最低灵敏度)是约94μg/L,以包含4mMCaCl2的试剂获得。对于包含8mMCaCl2的试剂,灵敏度更高且检测限值是约70μg/L,且对于包含16mMCaCl2的试剂,灵敏度又更高且检测限值是38μg/L。更高的试剂CaCl2含量(24和32mM)不进一步增加灵敏度和检测限值,保持在与试剂中16mMCaCl2大致相同的水平。表6表6显示,PT试剂中范围为约10至50mM的离子化的钙的含量导致本抗凝剂测定的增加的灵敏度。这表现为降低的检测限值。由于试剂仅被样品的加入少量地稀释,反应混合物中离子化钙的水平与PT试剂中的大致相同(20μL方法中稀释约10%,且5μL方法中稀释约3%)。结果是令人惊讶和出乎意料的,因为离子化钙的水平在标准PT方法的反应混合物中通常是约8mM。这一水平通常通过加入可溶的钙盐CaCl2到PT试剂来达到,但其他钙离子来源是可能的,包括氢氧化钙、乳酸钙和其他包含非干扰性阴离子的可溶的钙盐。甚至加入金属钙是可能的,尽管较不实际。PT反应混合物中离子化钙浓度的增加导致达到凝血点所需的时间即凝血时间的逐步增加。对于5μL方法和NKP样品(INR1.00),对于反应混合物中约4、8、16、24和32mM的钙离子浓度,凝血时间分别是42.1、47.4、52.5、70.1和82.1秒。高于测定灵敏度的有利增加所需水平的离子化钙水平的增加,由于增加凝血时间被认为是不利的。因此,优选的离子化钙离子浓度水平在10和30mM之间的范围中,或甚至在10和24mM之间的范围中。在凝血反应中,离子化的镁通常可代替离子化钙的功能。在此处也可以如此。因此,陈述的离子化钙水平的限值可视为离子化钙水平和离子化镁水平的总和的限值。在目的是增加抗凝剂测定的灵敏度的另外的实验中,增加PT试剂中的NaCl水平以使PT试剂高渗(比血浆和其他生理溶液更高的渗透压),因此也使得反应混合物高渗。这增加抗凝剂测定的灵敏度。抗凝剂测定灵敏度被增加的克分子渗透压浓度的增加也在范围上受限,因为如果NaCl水平过高,凝血时间可变的过度长。在实践中,为了增加抗凝剂测定的灵敏度,反应混合物的克分子渗透压浓度可被增加到0.3至0.5Osm/kg的范围,或可甚至更限于0.3至0.4Osm/kg的范围。通常,PT方法的反应混合物的克分子渗透压浓度非常接近生理0.308Osm/kg,这与0.154MNaCl溶液相同。可设想的是,增加抗凝剂测定的灵敏度的以上描述的措施的组合可被组合以提供最有利的高灵敏度。反应混合物可通过加入NaCl到0.3至0.4Osm/kg之间的范围并具有在范围12至30mM的离子化钙水平来变得高渗。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1