采样单元和生物传感器的制作方法
本发明涉及采样单元和生物传感器。
背景技术:
近年来,已经公开了能够在分析中非侵入性地利用活细胞的作为生物传感器的技术(例如,专利文献1)。专利文献1公开了具有这样结构的生物传感器,其中用与唾液酸样品(细胞本身或来源于细胞的糖链)结合的苯硼酸基团覆盖用于检测负电荷之物理性质变化的检测表面。
引用列表
专利文献
专利文献1:日本特许公开号2010-107496。
技术实现要素:
技术问题
专利文献1中描述的上述生物传感器虽然对细胞等没有侵入性,但是在从生物传感器采集细胞时不能说对人体不具有侵入性。也就是说,期望开发能够减轻人体负担的生物传感器,例如能够检测基于泪液、汗液、唾液等检测靶标的生物传感器。应注意,泪液等不仅包含作为待检测物质的葡萄糖,还含有蛋白质(例如白蛋白),并且因此,这样的泪液的问题在于其中包含的蛋白质将变成噪音并降低测量灵敏度。
因此,本发明的一个目的是提供采样单元和生物传感器,其能够基于非侵入性地从人体采集的样品来进行分析。
问题解决方案
根据本发明的采样单元具有接收样品溶液并且彼此分开设置的第一接收部和第二接收部,其中所述第一接收部包含与待检测物质结合且将所述待检测物质与样品溶液中不待检测的物质分开的识别物质,并且第二接收部经由盐桥部与参比电极连接。
根据本发明的生物传感器包含上述采样单元和场效应晶体管,在场效应晶体管中第一接收部分与栅极电极电连接。
本发明的有利效果
根据本发明,通过抑制不待检测物质与第一接收部中包含的识别物质的结合,可以提高测量灵敏度。因此,可以基于非侵入性地从人体采集的样品溶液更可靠地测量待检测物质的浓度。
此外,通过彼此分开地设置第一接收部和第二接收部,并且通过形成所述接收部使得所采集的样品溶液不彼此混合,泪液可以经由盐桥部与参比电极电连接,从而实现小型化。
附图说明
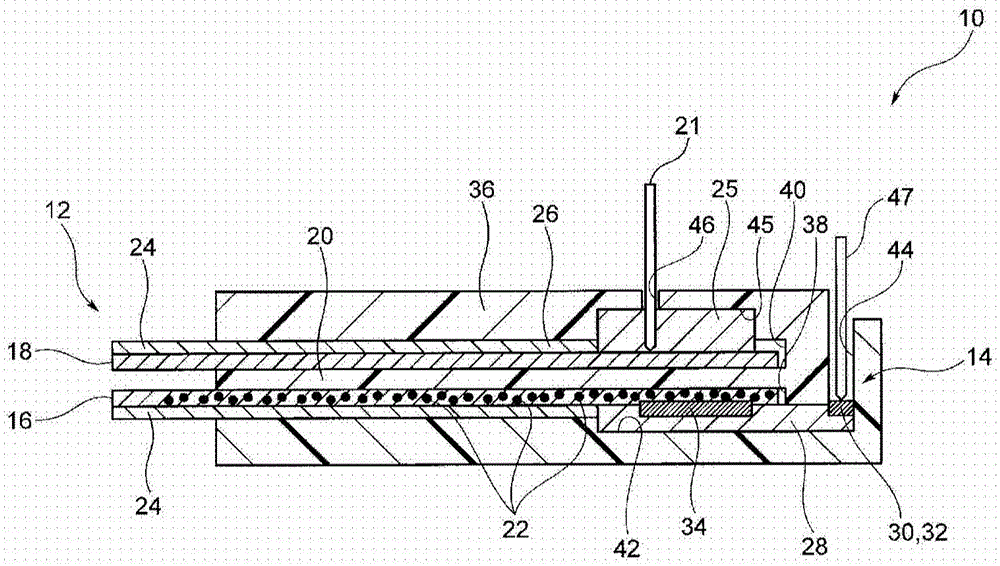
图1是示意性地示出根据第一实施方案的生物传感器的结构的纵截面图。
图2是示出通过测量根据第一实施方案的生物传感器的电学性质获得的结果的图。
图3是示意性地示出根据第二实施方案的生物传感器的结构的局部俯视图。
图4是示意性地示出根据第二实施方案的生物传感器的结构的截面图。图4A是用图3所示的A-A线制成的截面图,且图4B是用图3所示的B-B线制成的截面图。
具体实施方式
在下文中,将参照附图详细描述本发明的一些实施方案。
[第一实施方案]
(整体结构)
图1所示的生物传感器10包含采样单元12和场效应晶体管(FET:Field Effect Transistor)14。生物传感器10识别包含在采样单元12中的样品溶液中作为待检测物质的葡萄糖,并将所识别的信息转换为FET 14中的电信号,以便其检测样品溶液中的葡萄糖的量。在本文中,样品溶液是非侵入性采集的样品溶液,即,除了血液之外的生物溶液,例如汗液、泪液和唾液。这些样品溶液不仅包含葡萄糖,还包含作为蛋白质如白蛋白的不待检测的物质。
采样单元12具有彼此分开设置的两个接收部,即,第一接收部16和第二接收部18。第一接收部16和第二接收部18各自如此形成,使得样品溶液可以从其尖端移动到其基端,并且两个接收部通过分隔部20彼此分开。分隔部20可以防止样品溶液各自从尖端移动到基端而彼此混合。
当第一接收部16允许样品溶液从其尖端移动到其基端的同时,其使葡萄糖与样品溶液中包含的蛋白质分开。在本实施方案的情况下,第一接收部16由被切割成矩形形状的滤纸形成。
第一接收部16在基端侧与FET 14电连接。第一接收部16包含识别物质22。识别物质22具有与样品溶液中所含的葡萄糖结合的功能。可以使用苯硼酸作为该识别物质22,并且识别物质22的另一些例子包括苯硼酸的衍生物(例如具有乙烯基的苯硼酸等)、葡萄糖结合蛋白(GBP),及其衍生物。例如,当苯硼酸与葡萄糖结合时,其产生负电荷。
在本实施方案的情况下,识别物质22承载在载体(图中未示出)上。可以使用导电性颗粒和非导电性颗粒作为这种载体。可以使用的导电性颗粒的实例包括金属颗粒如Au、Pt、Ag或Cu的颗粒,非金属颗粒如氧化铟锡(indium tin oxide,ITO)和导电聚合物的颗粒。此外,本文中可以使用的非导电性颗粒的实例包括SiO2颗粒。例如,将硫醇基(-SH)或二硫基(-S-S-)引入到用作识别物质22的苯硼酸中以形成硫醇或二硫化物衍生物,从而使得苯硼酸可以承载在Au颗粒的表面上。
在第一接收部16中,可以形成弹性部24。在本图的情况下,弹性部24形成在与面向第二接受部18的表面相反的表面上。此外,弹性部24不形成在第一接收部16的基端侧。弹性部24可以由具有生物相容性的材料(例如水凝胶)形成。水凝胶是具有优异吸水性的凝胶状材料,其由于亲水性聚合物链之间的交联而保留大量的水。水凝胶的实例包括琼脂糖、硅酮、聚甲基丙烯酸羟乙酯(Poly-HEMA,也称为聚甲基丙烯酸2-羟乙酯)、聚乙烯吡咯烷酮(PVP)和聚乙烯醇(PVA)。聚-HEMA可以是甲基丙烯酸羟乙酯(HEMA)的均聚物,或者它也可以是与其他单体(例如甲基丙烯酸2,3-二羟丙酯、甲基丙烯酸甘油酯(GMA)等)的共聚物。应注意,当聚-HEMA呈共聚物的形式时,其倾向于具有较高的水含量百分比。此外,PVP可以是N-乙烯基-2-吡咯烷酮(NVP)的均聚物,或者其也可以是通过将HEMA、甲基丙烯酸甲酯(MMA)等和交联剂添加到作为主要成分的NVP中然后使它们聚合而形成的共聚物。
第二接收部18没有特别限制,例如,可以使用纸作为这样的第二接收部18。所述纸通过将例如植物纤维的纤维凝集而制备。植物纤维由纤维素或半纤维素构成。纤维素具有其中所包含的大量羟基通过氢键彼此结合的性质,由此构成纸的植物纤维彼此粘附。另一些纤维的实例包括由矿物、金属、合成树脂和其他材料制成的纤维制品。
第二接收部18在基端侧经由盐桥部25与参比电极21连接。盐桥部25例如通过将氯化钾水溶液与琼脂等固结而形成。由于盐桥部25,移动通过第二接收部18的样品溶液与参比电极21电连接,而不直接与参比电极21接触。
如在第一接收部16的情况下,弹性部24可以形成在第二接收部18中。在本图的情况下,弹性部24形成在与面向第一接收部16的表面相对的表面上。弹性部24不形成在第二接收部18的基端侧,第二接收部18的基端侧上设置盐桥部25。
FET 14包含:与形成在半导体基底28的表面上的源极(图中未示出)电连接的源极电极部30;与形成在其上的漏极(图中未示出)电连接的漏极电极部32;以及形成在半导体基底28、源极电极部30和漏极电极部32上的栅极绝缘膜(图中未示出)。n-MOS和p-MOS两者都可以用于FET 14。在栅极绝缘膜上形成栅极电极34。栅极电极34可以由Au、Ag、Cu等形成。源极电极部30和漏极电极部32与电源和测量仪器电连接,尽管它们未在图中示出。
半导体基底28可以由Si、Ga、As、ITO、IGZO、IZO等形成。或者,可以使用有机半导体、碳半导体(例如,碳纳米管、石墨烯半导体、金刚石半导体等)等作为这种半导体基底28。栅极绝缘膜可以由例如SiO2、Si3N4(SiNx)、Ta2O5或Al2O3的氧化物或氮化物形成。
在本实施方案的情况下,生物传感器10包含容纳采样单元12和FET 14的主体36。主体36是由例如聚对苯二甲酸乙二醇酯(PET)或聚四氟乙烯(PTFE)的合成树脂形成的立方体构件,并具有第一接收部安装部38、第二接收部安装部40、FET安装部42、分隔部20、探针插入孔44和参比电极插入孔46。
在主体36中,在厚度方向的一个表面的顶部和底部上形成两个孔,每个孔沿纵向方向从一端延伸到另一端。下孔是第一接收部安装部38,并且上孔是第二接收部安装部40。在第一接收部安装部38和第二接收部安装部40之间形成有分隔部20。
在第一接收部安装部38的另一端侧,形成有FET安装部42。在FET安装部42中形成有引导向主体36的纵向方向另一端侧表面的探针插入孔44。对于探针插入孔44来说,两个探针插入孔沿垂直于本图的纸面的方向成直线设置。
在第二接收部安装部40的另一端侧形成有盐桥安装部45。在盐桥安装部45中,形成有引导到主体36的纵向方向上的另一端侧的表面的参比电极插入孔46。
在FET安装部42中,FET 14设置成其中源极电极部30和漏极电极部32各自适配于探针插入孔44的状态。在FET 14中,栅极电极34设置在与第一接收部安装部38的连接部处。第一接收部16在其中弹性部24设置在下侧的状态下安装到第一接收部安装部38。此外,第一接收部16的尖端从主体36的一端突出,并且基端侧的表面与FET 14的栅极电极34接触。在各探针插入孔44中插入探针电极47。探针电极47的尖端分别与源极电极部30和漏极电极部32接触,并且它们分别与源极和漏极电连接。
盐桥安装部45填充有盐桥部25。第二接收部18在其中弹性部24设置在上侧的状态下安装到第二接收部安装部40。此外,第二接收部18的尖端从主体36的一端突出,并且基端侧的表面与盐桥部25接触。参比电极21插入参比电极插入孔46中。参比电极21的尖端插入盐桥部25中,因此与盐桥部25电连接。参比电极21用作FET 14中的参比电位。
(作用和效果)
在如此构造的生物传感器10中,首先,在采样单元12中采集样品溶液。例如,允许采样单元12的尖端直接与下眼睑的内侧接触,以采集用作样品溶液的泪液。在本实施方案的情况下,由于弹性部24设置在第一接收部16和第二接收部18的尖端侧,所以可以采集泪液而不损伤眼球或外周皮肤。
在第一接收部16和第二接收部18中的每一个中,采集的泪液从尖端朝向基端渗透。在本实施方案的情况下,第一接收部16由滤纸形成,使得泪液中的葡萄糖比蛋白质更快地渗透到接收部中。葡萄糖与第一接收部16中的识别物质22结合。由此,识别物质22产生负电荷。另一方面,在第二接收部18中,泪液渗透到基端侧,然后到达盐桥部25,使得泪液经由盐桥部分25与参比电极21电连接。
上述负电荷对第一接收部16的基端侧的栅极电极34的表面赋予电荷。由此,改变了栅极电极34上的电荷密度。使用参比电极21上的泪液的电位作为参考,电荷密度的这种变化可以计算为从源极到漏极的漏极电流的变化。实际上,栅极电极34上的电荷密度的变化被计算为栅极电压的变化。
在本实施方案的情况下,第一接收部16由滤纸形成,使得泪液中的葡萄糖比蛋白质更快速地渗透到接收部中,其结果是,葡萄糖比蛋白质更快速地到达第一接收部16的基端侧。由此,生物传感器10可以抑制这些蛋白质与第一接收部16中所包含的识别物质22的结合,或者抑制这些蛋白质与栅极电极34的表面附着,从而可以抑制给予栅极电极34的不必要的负电荷。因此,由于生物传感器10能够额外地提高测量灵敏度,所以基于非侵入性地从人体采集的样品溶液,可以更可靠地测量葡萄糖的量。
此外,生物传感器10如此形成,使得第一接收部16通过分隔部20在其基端侧与第二接收部18分开,并且使得从两个接收部的尖端渗透的样品溶液在基端侧不彼此混合。此外,盐桥部25设置在第二接收部18的基端侧。由此,在生物传感器10中,使用经由盐桥部25与泪液电连接的参比电极21作为参照,并且可以测量与第一接收部16的另一端侧连接的栅极电极34上的电荷密度的变化。
实际上,生产了根据上述实施方案的生物传感器10,并之后测量了允许采样单元12与下眼睑的内侧接触时FET 14的输出电压。
使用纸(由ADVANTEC制备,产品名:定性滤纸131号)作为第一接收部16。使用苯硼酸作为识别物质22,使用金颗粒(粒径:15nm)作为载体。将该纸浸渍在含有载有苯硼酸之金颗粒(浓度:1nM)的溶液中,以产生第一接收部16。
使用纸(由ADVANTEC制备,产品名:定性滤纸131号)作为第二接收部18。使用含有氯化钾(浓度:3.3M)的琼脂糖凝胶作为盐桥部分25。使用Pt电极作为参比电极21。
使用由PTFE形成的厚度为300μm的板状部件作为分隔部20。使用Au电极作为FET 14的栅极电极34。
允许由此制备的生物传感器10的采样单元12与人眼球接触10秒,并且测量栅极电极34上的电荷密度的变化作为漏极和源极之间的电压的变化。结果如图2所示。在本图中,纵轴表示输出电压(V),横轴表示时间(秒)。从本图可以确认,输出电压几乎在采样单元12与眼睛接触的同时改变。从这些结果可以确认,在生物传感器10中,在采样单元12中采集的泪液中的葡萄糖结合到第一接收部16中的识别物质22,并且可以测量由此产生的栅极电极34上的电荷密度的变化。
(修改实例)
本发明不限于上述实施方案,并且可以在本发明主旨范围内适当地修改。
例如,在上述实施方案的情况下,说明了第一接收部16由滤纸形成的情况。然而,本发明不限于该实施方案,并且第一接收部16也可以形成有具有流动通道的结构,例如由合成树脂或有机聚合物制成的无纺织物。
在上述实施方案的情况下,说明了识别物质22承载在载体上的情况。然而,本发明不限于该实施方案,还可以形成包含识别物质22和抑制物质的自组装单层(self-assembled monolayer,SAM)。抑制性物质防止作为不待检测的物质的白蛋白等蛋白质与苯硼酸结合或者防止其到达栅极电极34。术语“SAM”通常用于表示有机薄膜,其中有机分子在固体和液体之间的界面处或在固体和气体之间的界面处自发地彼此聚集,以自发形成单分子膜。在这种情况下,抑制物质由高分子量化合物形成。作为这样的高分子量化合物,可以使用分子链比识别物质22长的寡聚乙二醇,例如也可以使用聚乙二醇。
此外,第一接收部16也可以是通过将识别物质22结合到抑制物质而形成的共聚物。在这种情况下,抑制物质可以用亲水性聚合物形成。亲水性聚合物是具有亲水性官能团(羟基或羧基)的聚合物,亲水性聚合物的实例包括水凝胶、纸和超吸收聚合物(superabsorbent polymer,SAP)。
水凝胶是具有优异的吸水性的凝胶状材料,其由于亲水性聚合物链之间的交联而保留大量的水。水凝胶的实例包括聚甲基丙烯酸羟乙酯(聚-HEMA,也称为聚甲基丙烯酸2-羟乙酯)、聚乙烯吡咯烷酮(PVP)和聚乙烯醇(PVA)。聚-HEMA可以是甲基丙烯酸羟乙酯(HEMA)的均聚物,或者它也可以是与另一种单体(例如甲基丙烯酸2,3-二羟丙酯、甲基丙烯酸甘油酯(GMA)等)的共聚物。应注意,当聚-HEMA呈共聚物的形式时,其倾向于具有较高的水含量百分比。此外,PVP可以是N-乙烯基-2-吡咯烷酮(NVP)的均聚物,或者其也可以是通过向作为主要成分的NVP中添加HEMA、甲基丙烯酸甲酯(MMA)等和交联剂然后使它们聚合而形成的共聚物。
该纸通过将例如植物纤维的纤维凝集而制备。植物纤维由纤维素或半纤维素构成。纤维素具有其中包含的大量羟基通过氢键彼此结合的性质,并且由此构成纸的植物纤维彼此粘附。另一些纤维的实例包括由矿物、金属、合成树脂和其他材料制成的纤维制品。从更牢固地固定识别物质22的角度,优选由植物纤维(纤维素)形成的纸。
SAP是能够吸收和保留比其重量重几百到几千倍的水的聚合物。可以使用丙烯酸聚合物作为这样的SAP。由于这种丙烯酸聚合物具有大量的羧基,所以其具有高亲水性,此外,当SAP交联成精细结构使得它们可以以钠盐的形式加工时,它们变成具有高吸水性的凝胶。
另一些亲水性聚合物的实例包括:纤维素衍生物如羟丙基甲基纤维素(HPMC)、羧甲基纤维素钠(CMC-Na)或羟乙基纤维素(HEC);多糖如藻酸、透明质酸、琼脂糖、淀粉、葡聚糖或支链淀粉及其衍生物;均聚物如羧基乙烯基聚合物、聚环氧乙烷、聚(甲基)丙烯酰胺或聚(甲基)丙烯酸;所述均聚物与多糖的共聚物;以及构成上述均聚物的单体和其他单体的共聚物;蛋白质如胶原或明胶,及其衍生物;以及多糖或粘多糖,例如选自肝素、透明质酸、硫酸软骨素、硫酸皮肤素、硫酸葡聚糖、硫酸角质素和硫酸乙酰肝素的糖胺聚糖,壳多糖和壳聚糖。
此外,可以使用亲水性聚合物,例如1-乙烯基-2-吡咯烷酮、丙烯酸2-甲酯、邻苯二甲酸单甲基丙烯酰氧基乙酯、甲基丙烯酸铵硫酸乙酯、N-乙烯基吡咯烷酮、N,N-二甲基丙烯酰胺或2-(甲基丙烯酰氧基乙基)-2-(三甲基铵乙基)磷酸盐。
上述示例性亲水性聚合物可以单独使用或以两种或更多种组合使用。
可以适时选择并使用已知的自由基聚合促进剂作为聚合引发剂。优选使用具有水溶性或水分散性并且均匀包含在整个体系中的自由基聚合促进剂。具体而言,聚合引发剂的实例包括水溶性过氧化物,例如过二硫酸钾或过二硫酸铵,水溶性偶氮化合物如VA-044、V-50或V-501(所有这些均由Wako Pure Chemical Industries,Ltd.制造),以及Fe2+和过氧化氢的混合物。
可以使用N,N′-亚甲基双丙烯酰胺、乙二醇二甲基丙烯酸酯、甲基丙烯酸乙烯酯等作为交联剂。
在上述实施方案中,第一接收部16具有其中第一接收部从尖端侧到基端侧完全包含识别物质22的结构,但是结构不限于此。可以采用这样的结构,其中结合葡萄糖的识别物质22包含在第一接收部16的基端侧,而在第一接收部16的尖端侧,含有并非葡萄糖的物质(例如,蛋白质如白蛋白)优先附着其上的物质,具体而言含有容易与硫醇基结合的物质、金颗粒或铂颗粒。通过采用这种结构,可以优选地提高测量灵敏度。
此外,在上述实施方案的情况下,说明了分隔部20与主体36一体形成的情况。然而,本发明不限于该实施方案,并且分隔部20也可以独立于主体36单独地形成。
在上述实施方案的情况下,说明了其中主体36容纳采样单元12和FET 14,使得其与采样单元12和FET 14一体配置的情况。然而,本发明不限于该实施方案,并且生物传感器可以配置有容纳采样单元12的第一主体36和容纳FET 14的第二主体36。因此,在生物传感器中,仅可以将采样单元更换为另一个。
在上述实施方案的情况下,说明了被检测物质是葡萄糖的情况。然而,本发明不限于该实施方案。例如,本发明可以应用于用作待检测物质的钠离子或钾离子。在这种情况下,识别物质可以是冠醚。
在上述实施方案的情况下,说明了将参比电极21插入盐桥部25的情况。然而,本发明不限于该实施方案,并且参比电极也可以通过在盐桥部上直接形成薄膜而形成在盐桥部25上。
在上述实施方案的情况下,说明了第二接收部18由纸形成的情况。然而,本发明不限于该实施方案,并且第二接收部也可以由水凝胶形成。在这种情况下,弹性部24不一定设置在第二接收部18上。
[第二实施方案]
(完整构造)
如图3中的局部俯视图所示的生物传感器50,包含在具有矩形形状的基底54上彼此分开形成的测量电极60和参比电极62。测量电极60和参比电极62沿着基底54的长边形成,且两个电极的基端60b和62b到达基底54的端部。在测量电极60的尖端上设置第一接收部56,并且在参比电极62的尖端上设置第二接收部58。第一接收部56和第二接收部58分开设置,并且第一接收部56和第二接收部58构成采样单元52,如后所述。如同在第一实施方案的情况下,生物传感器50识别包含在采样单元52中的样品溶液中的葡萄糖作为被检测物质,并在图中未示出的FET中将识别的信息转换为电信号,使得其检测样品溶液中的葡萄糖的量。
例如可以使用玻璃作为这样的基底54。测量电极60可以例如由金电极形成。测量电极60的基端60b侧与图中未示出的FET电连接。在本实施方案中,测量电极60的基端60b侧可以用作FET的栅极电极。由于测量电极60在其尖端具有第一接收部56,所以生物传感器50中的FET的栅极电极与第一接收部56连接。
在采样单元52中,第一接收部56和第二接收部58彼此分开地设置。因此分开设置的第一接收部56和第二接收部58由多孔弹性层70覆盖。多孔弹性层70可以由具有生物相容性的材料形成,例如,由通过制造多孔水凝胶而制备的多孔凝胶形成。这种水凝胶的一个实例是聚甲基丙烯酸羟乙酯,如第一实施方案中所述。
如图4A所示,通过在测量电极60的尖端60a的表面上设置MIP(分子印迹聚合物)凝胶层66来制备第一接收部56。MIP凝胶层66是包含识别物质的凝胶层,凝胶层由水凝胶形成。与第一实施方案的情况相同,可以使用具有与样品溶液中所含葡萄糖结合的功能的化合物作为这样的识别物质。此外,水凝胶的实例是聚甲基丙烯酸羟乙酯,如第一实施方案中所述。
在第一接收部56的MIP凝胶层66中,渗透通过多孔弹性层70的样品溶液中的葡萄糖与蛋白质分开。
在图中所示的第一接收部56中,在测量电极60中的尖端60a和MIP凝胶层66之间设置阻挡层64。阻挡层64包含抑制物质。抑制物质具有消除蛋白质的作用,例如,可以使用白蛋白的单分子膜。如在第一实施方案中说明的,抑制物质防止作为不待检测物质的蛋白质到达栅极电极。
如图4B所示,第二接收部58具有导体部62a被盐桥部68覆盖的构造。在该实施方案中,导体部62a与参比电极62一体形成,且参比电极62的尖端作为这样的导体部62a使用。第二接收部58经由盐桥部68与参比电极62连接。参比电极62可以例如通过用银/氯化银覆盖金电极来形成。本文中使用的金电极可以与测量电极60的金电极相同。盐桥部68优选是比多孔弹性层70的情况更难以使水通过的凝胶层。与第一实施方案一样,盐桥部68通过使氯化钾水溶液与琼脂等固结而形成。当样品溶液渗透通过多孔弹性层70并到达第二接收部58时,与第一实施方案的情况相同,样品溶液与作为参比电极62的尖端的导体部分62a电连接而并不彼此直接接触(由于盐桥部分68)。图中未示出的参比电极62的基端62b与测量仪器连接。
FET在图中未示出,其基本上具有与第一实施方案相同的结构。如上所述,在本实施方案中,与第一接收部56连接的测量电极60的基端60b侧用作FET的栅极电极。与第二接收部58连接的参比电极62用作FET中的参比电位。
(作用与效果)
在这样构成的生物传感器50中,首先,在采样单元52中采集样品溶液。例如,允许多孔弹性层70的表面直接与下眼睑接触,以采集用作样品溶液的泪液。在本实施方案的情况下,由于覆盖第一接收部56和第二接收部58的多孔弹性层70设置在采样单元52中,可以采集泪液而不损伤眼球或外周皮肤。
采集的泪液朝向第一接收部56和第二接收部58渗透到多孔弹性层70中。在本实施方案的情况下,由于多孔弹性层70由多孔凝胶形成,所以包含在泪液中的葡萄糖比蛋白质更快速地渗透到多孔弹性层70中,并且葡萄糖到达第一接收部56。在第一接收部56中,葡萄糖结合于MIP凝胶层66中的识别物质。由此,识别物质产生负电荷。作为不待检测的物质的蛋白质被阻挡层64阻挡。另一方面,在第二接收部58中,泪液经由盐桥部68与参比电极62电连接。
在第一接收部56中,识别物质包含在MIP凝胶层66中。由于包含在泪液中的葡萄糖被并入MIP凝胶层66中的分子模板中,因此也可以获得更可靠地识别葡萄糖的效果。
应注意,由白蛋白的单分子膜组成的阻挡层64不具有带平坦表面的精确结构。白蛋白的单分子膜具有表面复杂的结构,且在膜内部存在空隙。作为不待检测物质的蛋白质被这样复杂的结构捕获。此外,在单分子膜中的空隙中,引入形成MIP凝胶层66的凝胶,使得MIP凝胶层66与测量电极60的尖端60a部分地连接。在MIP凝胶层66中产生的负电荷移动通过该凝胶,然后可以到达测量电极60的尖端60a。
如同第一实施方案的情况,在第二实施方案中,负电荷也给栅极电极的表面赋予电荷。在第二实施方案中,上述负电荷从第一接收部56通过测量电极60移动到测量电极60的基端60b侧的栅极电极的表面,从而对其赋予电荷。由此,改变栅极电极上的电荷密度。使用参比电极62上的泪液的电位作为参考,电荷密度的这种变化可以计算为从源极到漏极通过的漏极电流的变化。实际上,栅极电极上的电荷密度的变化作为栅极电压的变化计算。
在本实施方案的情况下,由于多孔弹性层70由多孔凝胶形成,所以包含在泪液中的葡萄糖比蛋白质更快速地渗透到多孔弹性层70中,并且葡萄糖到达第一接收部56。在第一接收部56中,泪液渗透通过含有识别物质的MIP凝胶层66进入含有抑制物质的阻挡层64。如上所述,在MIP凝胶层66中,包含在泪液中的葡萄糖结合于识别物质,使得识别物质产生负电荷。通过阻挡层64中包含的抑制物质,防止作为不待检测物质的蛋白质到达栅极电极。
由于在生物传感器50中可以抑制蛋白质粘附到栅极电极的表面,因此可以抑制给予栅极电极的不必要的负电荷。因此,由于生物传感器50能够提高测量灵敏度,所以基于非侵入性地从人体采集的样品溶液,可以更可靠地测量葡萄糖的量。
此外,在生物传感器50中,第一接收部56和第二接收部58彼此分开设置,并且由多孔凝胶组成的多孔弹性层70被设置成覆盖第一接收部56和第二接收部58。通过多孔弹性层70的存在,泪液可以高速渗透,并且可以快速到达第一接收部56和第二接收部58。
如同在第一实施例的情况下,通过彼此分开地设置第一接收部56和第二接收部58,使用与泪液电连接的参比电极62作为参考,可以测量在测量电极60的另一端60b侧的栅极电极上的电荷密度的变化。
实际上,生产根据第二实施方案的生物传感器50,然后允许采样单元52与眼球接触,然后确认运动。
在由玻璃组成的基底54上根据溅射法彼此分开地形成两个金电极。一个金电极用作测量电极60。另一个金电极用银/氯化银覆盖并用作参比电极62。测量电极60的尖端60a经UV-臭氧处理,然后在5g/L白蛋白溶液中浸渍过夜。在用水洗涤所得物之后,将其干燥以在测量电极60的尖端60a处形成阻挡层64。
使用含有乙烯基苯硼酸(0.01g)作为识别物质的单体溶液作为原料,在阻挡层64上形成MIP凝胶层66。制备单体溶液后,将0.2g甲基丙烯酸羟乙酯(HEMA)、0.1g N-3-(二甲基氨基)丙基甲基丙烯酰胺、0.02gN,N′-亚甲基双丙烯酰胺、300μL6.7重量%的丙烯酸钠(pH 7.3)、0.009g葡萄糖和0.01g乙烯基苯硼酸彼此混合。向所得混合物中添加100mM磷酸钠缓冲液(pH 10.0),以将总量调节至1g,并将混合物溶解在缓冲液中。另外,作为聚合引发剂,向所得溶液添加10μL的50mg/mL的过二硫酸钾溶液(Wako Pure Chemical Industries,Ltd.制造)和2μL的四亚甲基二胺(Tokyo Chemical Industry,Co.,Ltd.制造),从而制备用作MIP凝胶层66的原料的单体溶液。
将15μL所获得的单体溶液滴加到阻挡层64的表面以形成涂膜。将该涂膜用PET膜覆盖后,在氮气气氛下在室温下进行聚合12小时,以产生水凝胶。聚合反应完成后,将水凝胶浸入0.1M盐酸/甲醇溶液中过夜。由此,除去剩余的单体组分和葡萄糖,并形成MIP凝胶层66。因此,在测量电极60的尖端60a的表面上设置阻挡层64和MIP凝胶层66,从而产生第一接收部56。
将银/氯化银油墨(由BAS制造,产品名称:011464用于参比电极的氯化银油墨)施加到金电极上以用作参比电极62,然后在空气中干燥24小时。干燥完成后,用含有氯化钾(浓度:3.3M)的琼脂糖凝胶覆盖作为用银/氯化银覆盖的测量电极62之尖端的导体部分62a,以形成盐桥部68,从而获得第二接收部58。在基底54上,第一接收部56和第二接收部58彼此分开地设置。
使用单体溶液,如下用多孔弹性层70覆盖第一接收部56和第二接收部58。本文中,除了不添加乙烯基苯硼酸作为识别物质之外,以与用于MIP凝胶层的原料相同的方式制备单体溶液。然后,向单体溶液中添加0.5g氯化钠以获得至少饱和水溶液,从而制备用于多孔弹性层70的原料溶液。
用水凝胶保护基底54(除了采样单元52之外的区域)的表面,其上彼此分开地设置第一接收部56和第二接收部58,并且还以与上述相同的方式保护基底54的背面和侧面。将其中仅暴露采样单元52的区域的基底54浸渍在用于多孔弹性层70的原料溶液中,并且然后在氮气气氛下,在室温下进行12小时的聚合反应,从而在基底54上产生水凝胶。聚合反应结束后,将基底54浸渍在超纯水中4小时,从而除去残留的单体组分和氯化钠结晶。因此,具有阻挡层64和MIP凝胶层66的第一接收部56和具有盐桥部68的第二接收部58被多孔弹性层70覆盖,从而形成采样单元52。
将测量电极60的另一端60b用作FET的栅极电极,以产生生物传感器50。允许所得到的生物传感器50的采样单元52与人眼球接触,然后以与第一实施方案的情况相同的方式测量栅极电极上的电荷密度的变化。结果,可以确认在生物传感器50中,采集在采样单元52中的泪液中包含的葡萄糖结合到包含在MIP凝胶层66中的识别物质上,并且可以测量由此产生的栅极电极上的电荷密度的变化。
(修改实例)
本发明不限于上述实施方案,并且可以在本发明主旨范围内适当地修改。
例如,分隔部可以设置在采样单元52中的第一接收部56和第二接收部58之间的基底54上。分隔部还可以设置在测量电极60和参比电极62之间。通过设置这样的分隔部,可以可靠地防止非所需物质到达参比电极62处。分隔部可以例如通过例如使用疏水材料如聚二甲基聚硅氧烷(PDMS)或环氧树脂的热固性的手段形成。
基底54由玻璃形成,但是基底的材料不限于此。只要其是具有生物相容性的柔性材料即可,例如,可以使用PDMS作为基底54。
第一接收部56以金电极形成。然而,第一接收部的材料不限于此,其也可以由银、铜、铂、钯、汞等形成。另一方面,第二接收部58不仅能通过用银/氯化银覆盖金电极来形成,还可以通过用银/氯化银覆盖由例如银或铜组成的电极来形成。
如在第一实施例中说明的,用于在第一接收部56的表面上设置的MIP凝胶层66的原料可以通过将与样品溶液(识别物质)中所包含的葡萄糖相结合的化合物与水凝胶任意组合来制备,然后将目的物质(葡萄糖)混合在其中。如此制备原料,使得可以获得所需的分子模板,然后采用通常使用的手段,以形成MIP凝胶层66。
应注意,在上述实施方案中,包含识别物质的凝胶层是包含分子印迹聚合物的MIP凝胶层,但是凝胶层不必限于此。在一些情况下,将识别物质添加到不包含分子印迹聚合物的凝胶层中,并且将所获得的混合物设置在阻挡层64上,以构造第一接收部56。
在MIP凝胶层66和第一接收部56之间设置的阻挡层64可以阻挡作为不待检测的物质的蛋白质。如第一实施方案中所述,使用任何给定的抑制物质如聚乙二醇,可以形成阻挡层64。
第二接收部58中的盐桥部68不限于琼脂糖凝胶。只要可以获得比多孔弹性层70硬并且样品溶液可以渗透通过的层,那么盐桥部68也可以例如使用HEMA形成。
如果第二接收部58中的导体部62a与参比电极62电连接,则其可以起到其作用。因此,导体部62a可以不总是与参比电极62一体地形成。
覆盖第一接收部56和第二接收部58的多孔弹性层70可以是水凝胶,例如HEMA。使用取决于水凝胶类型的合适的盐制备单体溶液,使得可以获得至少饱和水溶液,并将如此制备的单体溶液用作多孔弹性层70的原料。例如,当将HEMA用作水凝胶时,氯化钠可以用作这样的盐。
如同在第一实施方案的情况下,第二实施方案也可以应用于用作待检测物质的钠离子或钾离子。在这种情况下,使用冠醚作为识别物质,可以通过取决于所需待检测物质的方式来制备MIP凝胶层66。
附图标记列表
10 生物传感器
12 采样单元
16 第一接收部
18 第二接收部
20 分隔部
21 参比电极
22 识别物质
24 弹性部
25 盐桥部
50 生物传感器
52 采样单元
54 基底
56 第一接收部
58 第二接收部
60 测量电极
62 参比电极
64 阻挡层
66 MIP凝胶层
68 盐桥部
70 多孔弹性层
- 还没有人留言评论。精彩留言会获得点赞!