具有信号增强的薄膜体声波谐振器的制作方法
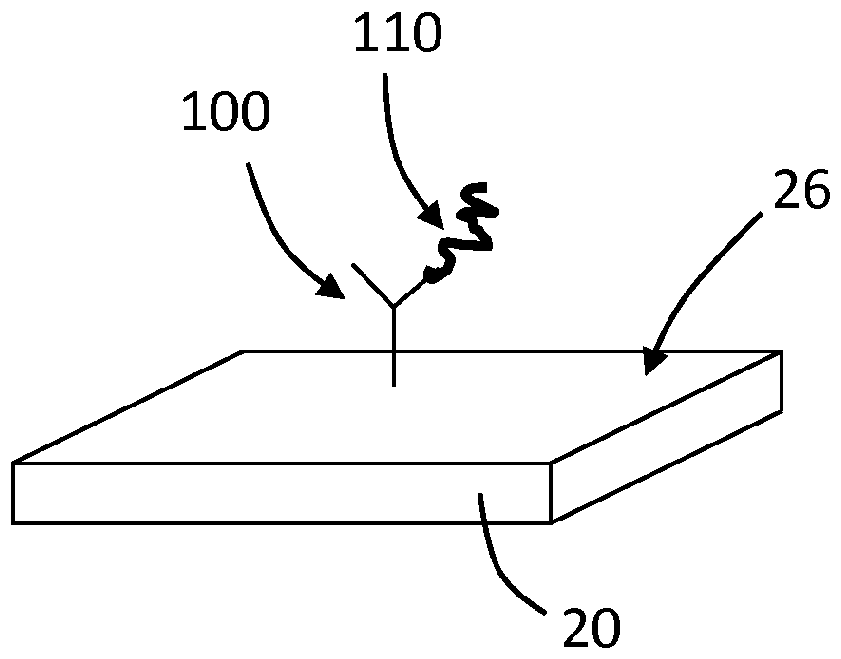
相关申请本申请要求于2014年9月15日提交的美国临时专利申请第62/050,589号的权益,该申请以不与本文的公开内容相冲突的程度通过引用结合到本文中。领域本公开总体上尤其涉及通过放大成分介导的质量负载的薄膜体声波谐振器(tfbar)的信号增强。背景压电装置例如薄膜体声波谐振器(tfbar)和类似技术(例如石英晶体微量天平(qcm))已经被用作质量检测器一段时间。压电谐振器的一个应用是检测非常少量的材料。在这种应用中用作传感器的压电谐振器有时被称为“微量天平”。压电谐振器通常被构造为夹在两个电极层之间的晶体或多晶压电材料薄平层。当用作传感器时,谐振器暴露于被检测材料,使得该材料结合在谐振器表面上。检测结合在感测谐振器表面上的材料的量的一种常规方式是将操作谐振器作为在其谐振频率的振荡器。由于被检测材料结合在谐振器表面上,谐振器的振荡频率降低。测量据推测由材料在谐振器表面上的结合引起的谐振器的振荡频率的变化,并用于计算结合在谐振器上的材料的量或材料在谐振器表面上积累的速率。作为材料传感器的压电谐振器在空气中的灵敏度理论上与谐振频率的平方成正比。因此,基于流行的石英晶体谐振器的材料传感器的灵敏度受其相对低的振荡频率的限制,该振荡频率通常在数mhz至约100mhz的范围内。薄膜谐振器(tfr)技术的发展可潜在地产生具有显著改善的灵敏度的传感器。通过在基材上沉积诸如aln或zno的压电材料的薄膜来形成薄膜谐振器。由于薄膜谐振器中的压电层的小厚度(其为数微米的数量级),薄膜谐振器的谐振频率在1ghz的数量级。高谐振频率和相应的高灵敏度使得薄膜谐振器可用于材料感测应用。然而,即使薄膜谐振器的质量灵敏度可能对于检测某些分析物、例如生物分析物是受限的。先前已经描述了压电谐振器传感器在免疫测定中的使用。通常基于压电的免疫测定(其中质量变化可归因于抗原和抗体之间的免疫反应)在某些情况下可能具有差的灵敏度和差的检测限。因此,本领域需要基于压电的特异性结合测定,其中可以放大分子识别组分和其靶分析物之间的反应以提供更灵敏的测定。一个这样的实例在1991年3月12日授予ward的美国专利第4,999,284号中给出,其公开了使用石英晶体微量天平测定的方法,其中通过包括酶的缀合物检测分析物与在石英晶体微量天平(qcm)上或附近的表面的结合。该酶能够催化底物向产物的转化,所述产物能够积聚在qcm表面上或与qcm表面反应,导致质量变化,从而导致谐振频率的改变。概述本公开尤其描述了信号放大以增强在高频下操作的tfbar的灵敏度。在实施方案中,用于检测样品中的分析物的方法包括,使分析物或分析物和连接有标签的分析物分子、第一识别组分和连接有信号放大成分的第二识别组分接触,以产生包含第一识别组分和连接有信号放大成分的第二识别组分的复合物。第一识别组分相对于薄膜体声波谐振器(tfbar)表面固定,并且被构造为选择性地结合以下一种或多种:分析物、连接有标签的分析物分子或标签、或结合到第二识别组分的这些分子中的任何一种。连接有信号放大成分的第二识别组分被构造为选择性地结合以下一种或多种:分析物、连接有标签的分析物分子或标签、或结合到第一识别组分的这些分子中的任何一种、或其组合。所述方法还包括在将前体转化为在tfbar表面处增加质量的放大分子的条件下,使连接的信号放大成分与一种或多种放大前体接触。增加的质量可以由以下产生:放大分子在表面上的沉积;放大分子与以下一种或多种结合:分析物、连接有标签的分析物分子、第一识别组分或连接有放大成分的第二识别组分等。所述方法还包括获得与在tfbar表面处增加的质量(例如,分析物、连接有信号放大成分的第二识别组分和放大分子的质量)相关的测量结果。分析物或分析物和连接有标签的分析物分子、第一识别组分和连接有信号放大成分的第二识别组分可以以任何合适的顺序接触。例如,分析物或分析物和连接有标签的分析物分子可在与相对于tfbar表面固定的第一识别组分接触之前与连接有信号放大成分的第二识别组分接触。作为另一个实例,分析物或分析物和连接有标签的分析物分子可以在与连接有信号放大成分的第二识别组分接触之前与第一识别组分接触。作为又一个实例,分析物或连接有标签的分析物分子、第一识别组分和连接有信号放大成分的第二识别组分可以同时接触。信号放大成分可以在任何合适的时间连接到第二识别组分。在一些实施方案中,信号放大成分在与分析物或连接有标签的分析物分子接触之前连接到第二识别组分。在一些实施方案中,信号放大成分在第二识别组分与分析物或连接有标签的分析物接触之后连接到第二识别组分。在一些实施方案中,信号放大成分通过共价键连接到第二识别组分。在一些实施方案中,信号放大成分和第二识别组分包括以高亲和力结合的部分。作为实例,第二识别组分可以是生物素化的,且信号放大成分可以与抗生物素蛋白或链霉亲和素缀合;或相反亦然。在tfbar表面处增加的质量可以通过任何合适的方法测量。在实施方案中,测定该质量,做法是:(i)将输入电信号耦合到tfbar,所述输入电信号具有一定的相位并且具有在压电谐振器的谐振带内的频率,其中所述频率为约500mhz或更大(例如约700mhz或更大、约800mhz或更大、约900mhz或更大、约1ghz或更大、约1.2ghz或更大、约1.4ghz或更大、约1.5ghz或更大、1.8ghz或更大、约2ghz或更大、约2.2ghz或更大、约2.4ghz或更大、约2.5ghz或更大、约500mhz至约4ghz、约800mhz至约3ghz、约800mhz至约10ghz、或约2ghz至约2.5ghz);(ii)传送所述输入电信号通过tfbar以产生具有一定频率和一定相位的输出电信号;(iii)接收来自tfbar的输出电信号;以及(iv)确定由在tfbar表面处的增加的质量所引起的输出电信号的频率或相位的变化,其中在相位频率方面的变化用作对在tfbar表面处增加的质量的量度。本文所述的设备、系统或方法的一个或多个实施方案对于检测少量分析物提供了优于现有的传感器、装置、系统或方法的一个或多个优点。如本文所述,与在较低频率下相比,在较高频率下用放大成分介导的质量负载令人意外地观察到较大的tfbar信号放大。因此,当与信号放大组合使用时,更高频率的优点似乎甚至进一步得到增强。本领域技术人员将从以下详述容易地理解该优点和其他优点。附图简述图1a-1c是说明薄膜体声波谐振器(tfbar)感测装置的实施方案的操作原理的示意图。图2是示出用于检测分析物的tfbar系统的部件的示意图。图3a-d是示出薄膜谐振器(tfr)表面上的信号放大的一个实施方案的示意图。图4a-d是示出tfr表面上的信号放大的一个实施方案的示意图。图5a-b是结合到tfr表面的第一结合配偶体(5a)和结合到与第一结合配偶体连接的第二结合配偶体的识别组分(5b)的一个实施方案的示意图,图6a是在tfbar的一个实施方案上的直接分析物结合和酶放大分析物结合随时间的响应的图。图6b是示出图4a中给出的图的一部分的细节的图。图7是说明如实施例2所述结合到tfr表面的各种多核苷酸组分的一个实施方案的示意图。示意图不必按比例绘制。在附图中使用的相同的数字表示相同的部件、步骤等。然而,应当理解,使用数字来指代给定附图中的部件不旨在将在另一附图中的该部件限定为用相同数字标记。另外,使用不同数字来指代部件并不旨在表示不同编号的部件不能是相同或相似的。详细描述在下面的详细描述中,公开了化合物、组合物、产品和方法的若干具体实施方案。应当理解,在不脱离本公开的范围或精神的情况下,可以考虑其他实施方案并可以进行其他实施方案。因此,下面的详细描述不应被视为限制性的。本公开总体上尤其涉及用于检测分析物的方法、装置、传感器和系统。所述方法、装置、传感器和系统使用薄膜体声波谐振器(tfbar),薄膜体声波谐振器测量由分析物在谐振器表面上的结合引起的谐振器的频率或相位变化。通过放大成分介导的质量负载增强结合信号。具有一定相位并且具有在压电谐振器的谐振带内的一定频率的输入电信号(在本公开的一些实施方案的情况下,可以是约500mhz或更大、例如约1.5ghz或更大)耦合到并传送通过谐振器以产生输出电信号,所述输出电信号相对于输入信号出现频率偏移或相移,原因是在谐振器表面上被检测材料的结合、沉积等以及由于放大成分介导的质量负载导致的放大。分析从压电谐振器接收的输出电信号以确定由在谐振器表面上的分析物的结合和放大成分介导的质量沉积所引起的频率或相位的变化。测得的频率或相位的变化提供关于结合到谐振器表面的分析物(或连接有标签的分析物分子)的定量信息。传感器、装置和系统本文公开的传感器包括至少一个薄膜谐振器传感器,例如薄膜体声波谐振器(tfbar)传感器。tfbar传感器包括压电层、或压电基材以及输入和输出变换器。tfbar传感器是小型传感器,使得该技术适用于手持设备。因此,包括本文所述的传感器的用于检测靶分析物的手持装置在考虑范围内。现在转向附图,参考图1a和1b,示出了用作检测分析物的传感器的体声波压电谐振器20的一个实施方案的一般操作原理。谐振器20通常包括压电材料的平面层,该平面层在相对侧上连接有形成谐振器的电极的两个相应的金属层。当谐振器被谐振器的谐振带内的信号驱动时,谐振器的这两个表面自由地经历振动运动。当谐振器用作传感器时,则其表面中的至少一个适于为被检测材料提供结合位点。谐振器表面上的材料的结合改变谐振器的谐振特性,并且检测和解释谐振特性的变化以提供关于被检测材料的定量信息。作为实例,可以通过检测由被检测材料在谐振器表面上的结合引起的谐振器的插入或反射系数相移的变化来获得这种定量信息。这种传感器不同于将谐振器作为振荡器操作并监视振荡频率的变化的那些传感器。相反,这种传感器将谐振器插入预选频率信号的路径中并且监测由在谐振器表面上被检测材料的结合引起的插入或反射系数相移的变化。当然,也可以根据本文所述的信号放大来采用监测振荡频率的变化的传感器。更详细地,图1a示出了在被检测材料结合到其表面26之前的谐振器20。所描述的谐振器20电耦合到信号源22,信号源22提供具有在谐振器的谐振带内的频率f的输入电信号21。输入电信号耦合到谐振器20并且传送通过谐振器以提供输出电信号23。在所描述的实施方案中,输出电信号23处于与输入信号21相同的频率,但是相位与输入信号相差相移,其取决于谐振器的压电特性和物理尺寸。输出信号23耦合到相位检测器24,相位检测器24提供与插入相移相关的相位信号。图1b示出了在其表面26上结合有被检测材料的感测谐振器20。相同的输入信号耦合到谐振器20。因为谐振器的谐振特性由于作为扰动的材料结合而改变,所以输出信号25的插入相移变为。由相位检测器24检测到由于材料的结合引起的插入相移的变化。所测得的相移变化与结合在谐振器表面上的材料的量相关。图1c示出了测量谐振器的插入相位的替代方案。定向耦合器(directionalcoupler)27被添加在信号源22和谐振器20之间,相反电极接地。相位检测器28被构造为测量作为结合到谐振器表面的材料的结果的反射系数的相移。可以与本文所述的信号放大方面一起使用的其他tfbar相移传感器包括在例如题为“resonatoropertingfrequencyoptimizationforphase-shiftdetectionsensors(对于相移监测传感器的谐振器操作频率优化)”的美国专利第8,409,875号中描述的那些,该专利以不与本文的公开内容相冲突的程度通过引用结合到本文中。例如,传感器设备可以包括:(i)包括与分析物的结合位点的感测谐振器;(ii)驱动电路,其被构造成驱动感测谐振器进行振荡运动;(iii)测量电路,其被布置为耦合到感测谐振器并且被构造为测量表示感测谐振器的振荡运动的谐振特性的一个或多个谐振器输出信号;和(iv)与所述驱动和测量电路可操作地耦合的控制器。控制器可以与包含指令的数据存储器界面连接,所述指令在被执行时使得控制器调整驱动电路驱动感测谐振器的频率以维持感测谐振器的谐振点。因此,可以如下所述实现感测:驱动tfbar进行振荡运动;测量表示tfbar的振荡运动的谐振特性的一个或多个谐振器输出信号;以及调整感测谐振器的驱动频率以维持tfbar的谐振点。在实施方案中,驱动电路驱动感测谐振器的频率是最大群延迟的频率。这种相位检测方法可以有利地用于具有不同谐振频率的压电谐振器。在各种实施方案中,用于本文所述的方法、设备和系统的tfbar具有约500mhz或更大的谐振频率,例如约700mhz或更大、约900mhz或更大、约1mhz或更大、1.5ghz或更大、约1.8gh或更大、约2ghz或更大、2.2ghz或更大、2.5ghz或更大、约3ghz或更大或约5ghz或更大,当其与放大成分介导的质量负载一起使用时,可以提供增强的灵敏度,这将在下面更详细地描述。在实施方案中,tfbar具有从约500mhz至约5ghz,例如从约900mhz至约3ghz,或从约1.5ghz至约2.5ghz的谐振频率。这些频率中的一些显著地高于先前描述的压电谐振器的频率。本文描述的感测谐振器是薄膜谐振器。薄膜谐振器包括沉积在基材上的压电材料的薄层,而不是使用例如at-切割石英。压电膜通常具有小于约5微米、例如小于约2微米的厚度,并且可以具有小于约100纳米的厚度。薄膜谐振器通常是优选的,因为它们的高谐振频率和理论上更高的灵敏度。根据应用,可以形成用作感测元件的薄膜谐振器以支持纵向或剪切体声波谐振模式。优选地,形成感测元件以支持剪切体声波谐振模式,因为它们更适合用于液体样品中。关于可以采用tfr的传感器装置和系统的其他细节在例如1999年8月3日授予drees等人的美国专利第5,932,953号中描述,该专利以不与本文的公开内容相冲突的程度通过引用整体结合到本文中。tfr传感器可以以任何合适的方式和任何合适的材料制成。作为实例,谐振器可以包括基材诸如硅晶片或蓝宝石、bragg镜层或其它合适的声学隔离装置、底电极、压电材料和顶电极。任何合适的压电材料可以用于tfr。合适的压电基材的实例包括钽酸锂(litao3)、铌酸锂(linbo3)、氧化锌(zno)、氮化铝(aln)、钛酸锆酸铅(pzt)等。电极可由任何合适的材料形成,例如铝、钨、金、钛、钼等。电极可以通过气相沉积来沉积,或者可以通过任何其它合适的工艺形成。任何合适的装置或系统可以采用如本文所述的薄膜谐振器和放大。作为实例并参考图2,用于检测分析物的系统可包括容器10(或多于一个的容器)、薄膜谐振器20、驱动电路22、测量电路29和控制电子器件30。流体路径将所述一个或多个容器10连接到谐振器20。控制电子器件30可操作地耦合到驱动电路和测量电路。在实施方案中,控制电子器件30被构造为基于来自测量电路29的输入来改变驱动电路22使谐振器20振荡的频率。仍然参考图2,容器10(或多于一个容器)可以容纳放大分子、连接有放大成分的第二识别组分或其多个组分、以及任选标签、分析物分子和第一识别组分的一种或多种。这些试剂中的每一种在下文更详细地描述。控制电子器件30可以控制这类试剂从容器10到谐振器20的流动;例如通过泵、真空等。可以采用任何合适的控制电子器件30。例如,控制电子器件可以包括处理器、控制器、存储器等。存储器可以包括计算机可读指令,当由处理器或控制器执行时,使得设备和控制电子器件执行归于本文描述的设备和控制电子设备的各种功能。存储器可以包括任何易失性、非易失性、磁性、光学或电学介质,例如随机存取存储器(ram)、只读存储器(rom)、非易失性ram(nvram)、电可擦除可编程rom(eeprom)、闪存或任何其它数字介质。控制电子器件30可以包括微处理器、控制器、数字信号处理器(dsp)、特定应用集成电路(asic)、现场可编程门阵列(fpga)或等效的离散或集成逻辑电路中的任何一个或多个。在一些实例中,控制电子器件30可以包括多个部件,例如一个或多个微处理器、一个或多个控制器、一个或多个dsp、一个或多个asic或一个或多个fpga以及其他离散或集成逻辑电路的任何组合。归属于本文中的控制电子器件的功能可以软件、固件、硬件或其任何组合的形式体现。分子识别和信号放大包含显著背景信号的样品的分子识别可以通过信号的放大来促进。本文所述的传感器、系统和方法采用包含放大成分例如连接酶的第二识别组分。在本文所述的较高频率范围,tfbar传感器非常有效地响应由于被酶切割的底物的沉淀而导致的传感器表面的质量增加。现在参考图3a-d,示出了tfbar上酶放大的示意图。如图3a所示,被构造为结合分析物的分子识别组分100固定在谐振器20表面26上。具有固定的分子识别组分100的谐振器20可以与包含分析物110的组合物接触,分析物110可以结合分子识别组分100(参见图3b)。具有与分析物110结合的固定的分子识别组分100的谐振器20可以与包含连接到放大成分130例如酶的第二分子识别组分120的组合物接触。第二分子识别组分120被构造成结合分析物110,使得第二分子识别组分120和连接的放大成分130相对于表面26固定(参见图3c)。在所描绘的实施方案中,可溶性底物140可以通过放大成分130转化为不溶性产物150,沉淀并积聚在传感器20表面26上,籍此放大作为结合的分析物110的量或浓度的函数的质量信号(参见图3d)。应当理解,图3a-3d中描绘的系列事件是为了说明的目的而示出的,并且可以采用任何其它合适的事件顺序。例如,分析物110可以在分析物(具有结合的第二分子识别组分)与谐振器20的表面26(分子识别组分100相对于谐振器20的表面26是固定的)接触之前与第二分子识别组分120(和结合的放大成分130)接触。底物140可以在第二分子识别组分120-放大成分130加入的同时存在或可以后来添加。在任何情况下,可以在放大之前进行洗涤。靶分析物的非限制性实例包括核酸、蛋白质、肽、抗体、酶、碳水化合物、化学化合物或感染性物类例如细菌、真菌、原生动物、病毒等。在某些应用中,靶分析物能够结合多于一种分子识别组分。任何合适的分子识别组分(例如,图3中的100)可以结合到谐振器表面。分子识别组分优选选择性地结合感兴趣的分析物。例如,分子识别组分可以选自核酸、核苷酸、核苷、核酸类似物如pna和lna分子、蛋白质、肽、抗体包括iga、igg、igm、ige、凝集素、酶、酶辅因子、酶底物、酶抑制剂、受体、配体、激酶、蛋白a、polyu、polya、聚赖氨酸、三嗪染料、硼酸、硫醇、肝素、多糖、考马斯蓝、天青a、金属结合肽、糖、碳水化合物、螯合剂、原核细胞和真核细胞。可以使用用于将分子识别组分固定在tfbar表面上的任何合适的方法。例如,可以使用气相沉积工艺将环氧硅烷的均匀涂层沉积在传感器表面上。然后可以使用例如基于压电的纳米分配技术将测试和对照分子识别组分(例如抗体)沉积到测试和对照谐振器上。抗体上的伯胺与将抗体共价结合到传感器表面的环氧基团反应。再例如,如果存在,分子识别组分的巯基结合到tfbar表面。tfbar表面可以根据需要进行修饰,以允许分子识别组分的结合。任何合适的分子识别组分,例如上述那些,可以用作第二分子识别组分(例如,图3中的120)。第二分子识别组分可以连接到任何合适的放大成分,例如酶。优选地,第二分子识别组分是抗体并且放大成分是酶。任何合适的放大成分可以连接到第二分子识别组分。在实施方案中,放大成分是可活化的聚合引发剂,例如光引发剂、化学引发剂或热引发剂。聚合引发剂可以在一种或多种单体的存在下活化,以使聚合物从第二分子识别组分接枝。在实施方案中,放大成分是酶。在实施方案中,酶能够将在测定环境中可溶的底物转化为在传感器表面上沉淀的不溶性产物。合适的酶的实例包括碱性磷酸酶(alp)、辣根过氧化物酶(hrp)、β半乳糖苷酶和葡萄糖氧化酶。能够产生能够在tfbar表面上累积的不溶性产物的酶/底物体系的实例包括碱性磷酸酶和5-溴-4-氯-3-吲哚基磷酸酯/硝基蓝四唑鎓氯化物(bcip/nbt)。bcip的酶促催化水解产生不溶性二聚体,其可沉淀在传感器表面上。具有用这样的水解可解离官能团诸如半乳糖、葡萄糖、脂肪酸、脂肪酸酯和氨基酸置换的磷酸酯部分的其它类似底物可与其互补酶一起使用。其它酶/底物体系包括过氧化物酶,例如辣根过氧化物酶(hrp)或髓过氧化物酶,和下列之一:联苯胺、联苯胺二盐酸盐、二氨基联苯胺、邻联甲苯胺、邻联茴香胺和四甲基亚联苯胺、咔唑、特别是3-氨基-9-乙基咔唑和各种酚类化合物,据报道所有这些物质在与过氧化物酶反应时形成沉淀。此外,氧化酶例如α-羟基酸氧化酶、醛氧化酶、葡萄糖氧化酶、l-氨基酸氧化酶和黄嘌呤氧化酶可以与可氧化底物体系例如吩嗪硫酸甲酯-氮蓝四唑鎓(phenazinemethosulfate-nitribluetetrazolium)混合物一起使用。应当理解,可以采用任何类型的竞争测定法。还应当理解,分析物可以被修饰以包括可被第一或第二识别复合物识别的标签,例如链霉亲和素标签;生物素标签;壳多糖结合蛋白标签;麦芽糖结合蛋白标签;谷胱甘肽-s-转移酶标签;聚(his)标签;表位标签,例如myc标签、ha标签或v5标签;等。还应当理解,连接有标签的分析物可以包括分析物的变体或衍生物。变体或衍生物是可被构造成识别分析物的第一或第二分子识别组分选择性识别的变体或衍生物。在一些情况下,可能需要变体或衍生物分析物对第一或第二分子识别组分的亲和力不同于未连接有标签的分析物的亲和力。分析物的变体或衍生物可以是允许容易地制造连接有标签的分析物的变体或衍生物。例如,连接有标签的分析物可以包含重组多肽等当进行使用连接有标签的分析物分子的竞争测定时,连接有标签的分析物分子而不是分析物,或者除了分析物之外还有连接有标签的分析物分子,可以结合固定在谐振器表面上的第一分子识别组分。现在参考图4,描述了信号放大测定的实施方案。图4的许多组分与图3中所示的组分相同或相似。如果没有对图4的特定元件进行具体论述,则参考上文中图3的该编号的元件。信号放大成分130可以在任何合适的时间连接到第二识别组分120。在一些实施方案中(图4中未示出),信号放大成分130在与分析物110或连接有标签的分析物分子接触之前连接到第二识别组分120。在一些这样的实施方案中,信号放大成分130共价地结合到第二识别组分120。在一些实施方案中(例如,如图4c-d所示),在第二识别组分120与分析物110或连接有标签的分析物接触之后,信号放大成分130连接到第二识别组分120。例如,第二识别组分120可以包括被构造为选择性地结合信号放大成分130的第二结合配偶体的第一结合配偶体123。第一结合配偶体123优选与第二识别组分120共价结合。第二结合配偶体135优选共价结合到信号放大成分130。第一结合配偶体123和第二结合配偶体135优选以高亲和力结合。可以使用第一结合配偶体123和第二结合配偶体135的任何合适的组合。作为一个实例,第二识别组分120可以是生物素化的,信号放大成分130可以与链霉亲和素缀合;或者反之亦然。作为另一个实例,第一和第二结合配偶体之一可以是聚组氨酸(his)标签,第一和第二结合配偶体中的另一个可以是例如镍或铜螯合剂,例如用于镍的亚氨基二乙酸(ni-ida)和次氮基三乙酸(ni-nta)以及用于钴的羧基甲基天冬氨酸(co-cma),其中聚(his)标签可以微摩尔的亲和力结合。通常镍基树脂具有较高的结合能力,而钴基树脂提供最高的纯度。作为又一个实例,第一和第二结合配偶体之一可以是谷胱甘肽-s-转移酶(gst)标签,第一和第二结合配偶体中的另一个可以是谷胱甘肽。作为又一个实例,第一和第二结合配偶体之一可以是结合有麦芽糖的蛋白标签,第一和第二结合配偶体中的另一个可以是直链淀粉或麦芽糖。作为另一个实例,第一和第二结合配偶体之一可以是结合有壳多糖的蛋白标签,第一和第二结合配偶体中的另一个可以是壳多糖。应当理解,上面提供的结合配偶体仅仅是可以与第二识别组分或信号放大成分缀合的高亲和力结合配偶体的实例,并且本文考虑其他结合配偶体。此外,应当理解,可以采用多于一组的结合配偶体来将第二识别组分连接到信号放大成分。结合配偶体可以通过任何合适的技术与第二识别组分或信号放大成分缀合。例如,可以采用化学缀合或重组技术将结合配偶体视情况连接到第二识别组分或信号放大成分。这样的技术是本领域技术人员公知的。例如,可以如本领域技术人员公知使用利用nhs-酯和马来酰亚胺官能团的杂双官能(heterobifunctional)交联剂。应当理解,如果信号放大成分和第二识别组分包括互补结合配偶体,则信号放大成分可以在任何合适的时间通过结合配偶体与第二识别组分连接。例如,如图4c-d所示,信号放大成分130可以在第二识别组分120与分析物110或连接有标签的分析物接触之后连接到第二识别组分120。在一些实施方案中,在第二识别组分120与分析物110或连接有标签的分析物接触之前或在第二识别组分120引入谐振器的同时,使包含第二结合配偶体135的信号放大成分130与包含第一结合配偶体123的第二识别组分120接触。现在参考5a-b,第一分子识别组分100可以经由一个或多个中间体结合到tfbar20的表面26。例如,第一结合配偶体99可以结合到表面26,并且第一分子识别组分100可以包括被构造为选择性地结合到第一结合配偶体99的第二结合配偶体101。结合配偶体99、101可以是如上所述的结合配偶体(例如,关于图4所述)。第一识别组分100可以在任何合适的时间,例如在传感器20被结合到设备或系统中之前,或者在传感器20被结合到设备或系统中之后,通过结合配偶体99、101结合到表面26。例如,作为分析物检测试验的第一步骤或在分析物检测试验期间,第一识别组分100可以通过结合配偶体99、101结合到表面26。tfbar的放大成分介导的质量负载/信号放大已经注意到,随着谐振频率增加,质量检测的灵敏度也应该增加。然而,这在实践中并不总是被观察到。理论上,具有约2.2ghz的谐振频率的tfbar应当提供足够的灵敏度以检测低浓度的分析物,而无需使用如本文所述的信号放大/质量负载。然而,本发明人发现,即使具有这样高的谐振频率,tfbar传感器对检测低水平的分析物也不够灵敏。然而,通过利用本文所述的放大/质量负载技术,可以实现通过在较高频率下操作赋予的灵敏度方面的更多理论增益。对噪声的敏感性与上文理论上讨论的信号传播相关。在较高频率下,信号传播较短的距离,从而产生邻近过滤器(proximityfilter)。也就是说,你只测量邻近表面的物质。然而,构成邻近位置的物质将随着频率而改变,并且在对背景噪声的敏感性方面可以具有重要的实际分歧。在较高频率下用质量负载操作不仅导致增强的信号灵敏度,而且还导致对噪声的较低敏感性。这可以在功能上转化为例如较不严格的洗涤需求,因为未结合到谐振器表面(例如,经由结合到第一分子识别组分的分析物)的连接有放大器的第二分子识别组分不应该在邻近谐振器表面处增加显著的质量。此外,发现在阴性样品中获得稳定基线读数的洗涤要求对于较高频率tfbar来说不那么严格,这也可能是由于在较高频率下信号传播距离较短。令人意外的是,已经发现在较高频率下观察到比在较低频率下更大的信号放大。参见例如在下面的实施例中的表2,其中与900mhz谐振器相比,在2250mhz下观察到用酶介导的质量负载(相对于直接结合)更大的信号放大。在较高频率下可获得较大水平的信号放大是预料不到的,因为不同的谐振器(900mhz和2250mhz)被构建为含有相同浓度或量的第一识别组分,测定使用相同浓度和量的分析物,并且使用相同浓度和量的连接有酶的第二分子识别组分和底物。因此,理论上,预期实际发生的放大的量是相同的(预期沉淀在表面上的产物的量是相同的)。然而,在较高频率下观察到较大量的信号放大。用途本文所述的传感器、装置和系统可用于检测样品中的分析物。所述传感器可用于众多化学、环境、食品安全或医药应用中。作为示例,待测试的样品可以是或可以衍生自血液、血清、血浆、脑脊液、唾液、尿液等。不是流体组合物的其他测试组合物可以溶解或悬浮在适当的溶液或溶剂中用于分析。定义除非另有规定,否则本文使用的所有科学和技术术语具有本领域常用的含义。本文提供的定义是为了便于理解本文中经常使用的某些术语,而不意味着限制本公开的范围。如本说明书和所附权利要求书中所使用的单数形式“一”、“一个”和“该”包括具有复数指代物的实施方案,除非上下文另有明确指示。如本说明书和所附权利要求中所使用的术语“或”通常以其包括“和/或”的含义使用,除非上下文另有明确规定。术语“和/或”表示所列出的要素中的一个或全部或任何两个或更多个所列元件的组合。本文所用的“具有(have)”、“具有(having)”、“包括(include)”、“包括(including)”、“包含(comprise)”、“包含(comprising)”等以其开放式意义使用,并且通常表示“包括但不限于”。应当理解,“基本上由......组成”、“由...组成”等被包含在“包括(comprising)”等中。如本文所用,当涉及组合物、产品、方法等时,“基本上由…...组成”是指组合物、产品、方法等的组分限于所列举的组分以及不会实质上影响组合物、产品、方法等的基本和新颖特性的任何其它组分。词语“优选的”和“优选地”是指在某些情况下可以提供某些益处的本发明的实施方案。然而,在相同或其他情况下,其它实施方案也可以是优选的。此外,对一个或多个优选的实施方案的叙述并不意味着其他实施方案不是可用的,并且不旨在将其它实施方案排除在本公开(包括权利要求)的范围之外。并且在本文中,通过端点对数值范围的叙述包括包含在该范围内的所有数值(例如,1至5包括1、1.5、2、2.75、3、3.80、4、5等,或者10或更小的值包括10、9.4、7.6、5、4.3、2.9、1.62、0.3等)。当值的范围“至多”为某一特定值时,该值包括在该范围内。本文中为了清楚起见参考附图描述了本文中提到的任何方向,例如“顶”、“底”、“左”、“右”、“上”、“下”和其他方向和取向,并且不限制实际的设备或系统或设备或系统的用途。如本文所描述的装置或系统可以在多个方向和取向上使用。本文使用的“结合事件”是指靶分析物与固定在传感器表面中的分子识别组分的结合。实施例以下非限制性实施例用于更全面地描述使用上述传感器、方法、装置和系统的方式。应当理解,这些实施例决不用于限制本公开或随后的权利要求的范围,而是出于说明的目的而给出。实施例1:酶放大的概念证明进行概念研究的初步证明,使用抗牛igg测定法且碱性磷酸酶(alp)作为缀合酶,bcip/nbt作为沉淀底物。简言之,将山羊抗牛和山羊抗大鼠抗体固定在测试和参比谐振器上,做法是,使用压电分配器将350μm的点分配在谐振频率为2.2ghz的涂有环氧硅烷的传感器上。将传感器在4℃、高湿度环境中温育过夜。在测试之前用鱼皮明胶阻断传感器。然后从测试信号中减去参比信号,并将该δ信号用作结合响应。所有测试均使用浸在微量滴定板中的传感器进行。通过使用搅拌棒实现样品搅拌。测试顺序如下,将传感器暴露于1μg/ml牛igg历时60秒,接着漂洗30秒并暴露于兔抗牛igg-碱性磷酸酶缀合物60秒。然后将传感器漂洗2次,历时30秒,并暴露于bcip/nbt底物历时60秒。传感器电连接到网络分析仪,该网络分析仪用于监测装置的频率偏移。在这种情况下,跟踪产生最大群延迟的相位,并测定随着质量变化维持该相位的输入频率的变化。对于测试和参比谐振器,以每秒2个样品的采样速率收集谐振频率附近的50mhz窗口。该数据经后处理以确定测试和参比谐振器两者的频率偏移与时间的函数关系。然后将从直接抗原结合观察到的频率偏移与在酶底物中观察到的信号进行比较。该初始研究的结果显示在图4a中,图4b是图4a中呈现的曲线图的一部分的详细视图。如所示,相对于不添加底物的直接结合,alp-酶放大导致灵敏度的显著改进。如下表1所示,作为酶放大的结果,观察到响应和斜率超过100倍的放大。表1:alp-放大的结果直接结合酶放大响应(积分)-9,024-1,094,473放大(倍数)121斜率-3.24-374.77斜率放大115.71使用抗牛igg测定和辣根过氧化物酶(hrp)作为缀合酶进行类似的研究。在该反应中沉淀底物是过氧化氢和对羟基肉桂酸(数据未显示)。还进行了使用抗大鼠igg测定用bcip/nbt对alp增强的进一步分析(数据未显示)。随后采用alp和bcip/nbt体系的研究工作包括了对各种其他的评价。沉淀放大的益处似乎是频率依赖性的。用山羊抗大鼠f(ab')片段涂覆具有2250mhz和850mhz的操作频率的装置。该还原的f(ab')上的天然巯基用于连接到金谐振器表面,形成配位(dative)硫金键。然后用鱼皮明胶阻断这些传感器,并在阴性缓冲液样品或1μg/ml大鼠igg中测试,随后与山羊抗大鼠碱性磷酸酶缀合的抗体温育。随后将传感器漂洗两次,并暴露于bcip/nbt底物。如先前所述对直接结合事件和底物放大两者的数据进行约化(reduce)。2250mhztfbar与900mhztfbar的比较证明了,相对于850mhz装置,具有较高频率(2250mhz)的信号放大增加为2.5倍。此外,在阴性样品中在850mhz装置中观察到的背景水平显著更高。当数据以khz/秒的响应分析时,情况正是如此,但是当通过用频率偏移响应除以操作频率将结果转化为ppm/秒时,差异变得更加显著。在使底物暴露之前增加两个额外的洗涤步骤将850mhz装置中的背景信号的量减少到与在2250mhz装置中见到的那些相当的水平(数据未示出)。表2:用850mhztfbar和2250mhztfbar的放大的比较频率(mhz)2250850在阴性样品中的背景信号(ppm/秒)-0.86-23.11直接结合(khz/秒)-3.26-0.70放大信号(khz/秒)-233.7-22.3放大(倍数)71.731.9实施例2:dna的可行性证明对于dna与传感器表面的结合,将10μm5'-胺标记的27-聚体(与靶寡核苷酸的3'端互补)和10μm错义27-聚体都溶解在3x盐水-柠檬酸钠(3xssc)中并点样在环氧硅烷官能化的传感器上分别作为测试和参比(2150mhztfbar)。125-聚体寡核苷酸用作模型靶。将该靶寡核苷酸与6nm对该125-聚体靶的5'端互补的3'生物素标记的18-聚体混合缓冲液(5xssc,10%甲酰胺,0.1%sds)中混合并与传感器表面在39℃下反应4分钟。结合到传感器表面的27-聚体和结合到生物素化的18-聚体的靶125-聚体的示意图示于图7。然后进行两个洗涤步骤(含有0.01%sds的1xssc和hepes缓冲盐水加去污剂),并在含有1mg/ml鱼皮明胶(fsg)的hepes缓冲液中将传感器暴露于2μg/ml的购自jacksonimmuo(partnumber016-050-084)的链霉亲和素-碱性磷酸酶缀合物历时2分钟。用hepes加去污剂进行两个另外的洗涤步骤,并将传感器暴露于购自thermo(partnumber34042)的沉淀底物nbt/bcip。在39℃下收集频率偏移数据历时1.5分钟,并在下表3中给出。使用零响应加上3个标准偏差的估计检出限获得0.6pm的值。表3:频率偏移数据dna靶(pm)平均响应(khz/秒)00.930.8-0.484-2.9340-38.15400-111.61实施例3:白细胞介素-6(il-6)两步免疫测定试剂:通常如上文针对实施例1中的抗体所讨论,将亲和力纯化的山羊抗il-6(r&dsystemspartnumberaf-206-na)点样到环氧硅烷活化的传感器(2175mhztfbar)上。根据制造商的说明书用5x摩尔过量的磺基-nhs-lc-生物素(thermoscientific)标记抗il-6的小鼠单克隆抗体(r&dsystemspartnumbermab206)。通过脱盐除去过量未结合的生物素试剂。通过将10%(v/v)鸡血清(equitech,经炭去除(charcoalstripped),热失活)与磷酸盐缓冲盐水(pbs)加0.1%叠氮化钠混合来制备校准物基质。通过在校准物基质中稀释重组人il-6(r&dsystemspartnumber206-il)制备校准物。与碱性磷酸酶缀合的链霉亲和素(sa-alp)购自jacksonimmuno(partnumber016-050-084)。洗涤缓冲液是hepes缓冲盐水加去污剂。底物是购自thermoscientific(partnumber34042)的1-步nbt/bcip。测定:在含有鱼皮明胶的hepes缓冲液(hepes/fsg)中将生物素化的小鼠抗il-6稀释至8.3μg/ml的工作浓度。将sa-alp在hepes/fsg中稀释至1μg/ml的工作浓度。将60μl生物素化的小鼠抗il-6与40μl校准物混合,并在传感器上来回通过16分钟。然后从微流体通道中除去反应混合物,并使sa-alp在传感器上来回通过2分钟。然后用洗涤缓冲液洗涤传感器三次,随后加入bcip/nbt底物。将在底物步骤期间的谐振频率的变化速率相对于il-6浓度作图。结果示于下表4中,包括分析灵敏度(零响应加上3个标准偏差)的估计。表4:il-6测定的频率偏移因此,公开了具有信号增强的薄膜体声波谐振器的实施方案。本领域技术人员将理解,可以用除了所公开的那些之外的实施方案来实践本文所描述的引导(lead)、装置(诸如信号发生器)、系统和方法。所公开的实施方案是出于说明而非限制的目的而呈现。还将理解,关于本文的附图和实施方案的描绘和描述的引导的部件可以是可互换的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1