一种高灵敏度可回收纳米生物传感器及其制备方法与应用与流程
本发明属于生物传感器制造领域,涉及一种高灵敏度可回收纳米生物传感器及其制备方法与应用。
背景技术:
阿尔茨海默症是一种起病隐匿的进行性发展的神经系统退行性疾病,其患者脑中Tau蛋白总量多于正常人,因此,可通过检测患者脑脊液中Tau蛋白含量来诊断阿尔茨海默症。
目前,在人类体液的蛋白质检测方面,免疫分析方法因其特异性和高选择性而得到了广泛应用。特别是酶联免疫分析法(ELISA)几乎是体液中蛋白质检验的唯一方法。因为体液中各种物质含量复杂,难以使用其他化学方法对特定的某一种目标蛋白进行检测。而抗体对抗原的特异性识别,可以使得抗体有效地从复杂的成分中识别并俘获抗原,对原料的前处理要求比较少,可以进行直接检验。基于这个原理的ELISA分析方法,理论上可以检测任何蛋白质。但是该方法在设计上存在以下缺陷:首先,是抗体被包覆在聚苯乙烯酶标板上的工艺问题,因为聚苯乙烯与抗体之间仅仅是分子间力吸附而不是化学连接,这使得抗体不能有效地附着在酶标板上;其次,ELISA需要一些清洗过程,在清洗的过程中,已经连接上去的抗体和抗原会再次掉落;最后,二抗和抗原的识别并不是一对一的,一个抗原有可能吸附多个二抗,而只有二抗才会提供信息,这就使得二抗的量只能大约指示抗原的量。上述问题都导致了ELISA的检测精度和重现度较低。故ELISA只能停留在实验室研究阶段,难以被临床应用。
石墨烯是一种由碳原子构成的单层片状结构的新材料,具有非同寻常的导电性能、超出钢铁数十倍的强度和极好的透光性,可被广泛应用于电子科技、新能源及基因测序等领域。石墨烯还可以吸附和脱附各种原子和分子,在化学及生物等领域有许多潜在的应用。
申请公布号为CN 102590309 A的中国发明专利公布了一种石墨烯晶体管及其生物传感器的制作与应用方法,该方法针对石墨烯晶体管传感器选择性较差的问题,提出了制作基于石墨烯晶体管的生物传感器的方法,该方法是在石墨烯晶体管表面生长氧化锌纳米线或金属纳米颗粒,而这些晶体管表面的纳米材料有利于吸附具有专一识別功能力的生物活性物质(如酶,DNA,RNA,适体,抗原或抗体等),使得石墨烯晶体管通道具有选择性吸附目标分析物的能力,提高了基于石墨烯晶体管通道传感器的灵敏度和选择性。上述专利公布的技术方案中,晶体管表面的纳米材料表层通过静电作用吸附生物活性物质,通过吸附目标分析物后石墨烯的电阻特性变化来检测样本中的微量目标分析物。其中抗体和晶体管的这种吸附不具备特异性,只要是结构上具有和碳的六元环相似的物质都能被吸附,而且这种吸附是可逆的,这使得在运用中已经吸附的抗体容易被待测样品中的某些物质替换,从而影响检测精度。因此在实际应用上对待测样品的前处理要求很高。不同于上述专利,本发明是通过抗体与石墨烯之间形成肽键,来增强石墨烯对抗体的结合力,抗体结合效率更高更牢固,且采用免疫竞争反应检测样品的蛋白浓度,对抗体的要求较低,可以直接使用多克隆抗体代替单克隆抗体,降低了成本。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种灵敏度高、与抗体结合牢固,检测效率高,经济成本低的高灵敏度可回收纳米生物传感器及其制备方法与应用。
本发明的目的可以通过以下技术方案来实现:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
所述的纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。
所述的抗体为单抗或多抗中的一种。
所述的抗体包括但不限于Tau蛋白抗体。
一种高灵敏度可回收纳米生物传感器的制备方法,该方法具体包括以下步骤:
(1)将氧化石墨烯或羧基化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应1-12小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应1-8小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应1-2小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中所述的氧化石墨烯或羧基化石墨烯与偶联剂、催化剂的质量比为1-5:1-10:1-10;
步骤(5)中所述的抗体与氧化石墨烯或羧基化石墨烯的质量比为1-3:100000-500000。
所述的酸性缓冲溶液包括MES(2-吗啉代乙磺酸)、MEST(2-吗啉代乙磺酸-吐温)、Bis-Tris(二(2-羟乙基)三亚氨基(羟甲基)甲烷)、HEPES(羟乙基哌嗪乙硫磺酸)、PIPES(哌嗪-1,4-二乙磺酸)、MOPS(3-吗啉丙磺酸)或甘氨酸-盐酸缓冲液中的一种;
所述的偶联剂为碳二亚胺类偶联剂,包括EDC(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺),DCC(二环己基碳二亚胺)或DIC(N,N-'二异丙基碳二亚胺)中的一种;
所述的催化剂包括NHS(N-羟基琥珀酰亚胺)或DMAP(4-二甲氨基吡啶)中的一种;
所述的碱性缓冲溶液包括TAE(三羟甲基氨基甲烷,乙二胺四乙酸二钠,冰醋酸缓冲液)、TPE(三羟甲基氨基甲烷,乙二胺四乙酸二钠,磷酸缓冲液)、tris-HCl(三羟甲基氨基甲烷-盐酸)、PBS(磷酸-磷酸盐缓冲液)或磷酸氢二钠-氢氧化钠中的一种;
所述的封闭液包括BSA(牛血清蛋白)、HSA(人血清白蛋白)或明胶中的一种。
所述的酸性缓冲溶液的pH为0-5,所述的碱性缓冲溶液的pH>7。
一种高灵敏度可回收纳米生物传感器的应用,所述的生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
本发明生物传感器中,抗体在纳米级石墨烯上的负载量由待测样品的估计浓度来确定。例如,人体待检测的Tau蛋白含量在0-1000pg/mL之间,那么抗体的负载量应为该浓度范围的0.5-2倍。
本发明生物传感器制备方法的反应机理是经典的碳二亚胺偶联机理,具体反应机理的一种典型化学式为:
上述化学反应式中,1代表氧化石墨烯或羧基化石墨烯,2代表抗体。氧化石墨烯或羧基化石墨烯的羧基与偶联剂发生反应,脱去羧基上的羟基基团,与偶联剂形成一个中间产物A;生成的中间产物A再与抗体反应,并生成产物B,即为所述的纳米生物传感器。以上化学式仅为一种典型的实施例,根据偶联剂及其稳定剂的不同,可以有一定的变化。
本发明生物传感器在实际应用时,以免疫竞争反应代替二抗标记,具体步骤为:
(a)将待检测蛋白的标准品按不同浓度配成10个样品;
(b)分别加入一定量的抗体-石墨烯复合材料的溶液,培养0-2小时后,再分别加入一定量的带有荧光标记(包括但不局限于各种辣根类、异硫氰酸酯类荧光染料)的蛋白标准品并继续培养0-2小时;
(c)采用步骤(b)对待测样品进行处理;
(d)将培养结束后的蛋白标准品,使用荧光仪检测荧光强度,并重复5-10次,绘制浓度-荧光强度标准曲线;
(e)将待测样品的荧光强度与浓度-荧光强度标准曲线进行拟合,即可计算出待测样品中的蛋白浓度。
本发明采用纳米级石墨烯作为载体,结合免疫识别、荧光共振技术,构建了一种超灵敏,高选择性,低检测下限的纳米生物传感体系,所采用的制备方法是独创的有别于ELISA的新的检测手段,免除分离步骤,比传统酶联免疫ELISA方法操作更加简便,灵敏度高,误差低,适合应用于临床诊断检测分析,可以用于检测人体体液中的蛋白质。
与现有技术相比,本发明具有以下特点:
1)石墨烯与抗体之间是形成肽键的化学结合,而不是ELISA的ps板与抗体之间的一般吸附,使得抗体结合效率更高更牢固,更能经受住清洗;
2)以纳米级别的石墨烯代替ELISA板,表面积更大,富集能力更强;
3)除抗体-石墨烯复合材料的制备中需要清洗外,实际检测过程中不需要任何清洗步骤,避免了ELISA的清洗步骤带来的误差;
4)以免疫竞争反应代替二抗标记,避免了二抗与抗原之间的识别问题造成的误差,能够实现检测什么就标记什么;
5)本发明正因为避免了二抗与抗原之间的识别问题,实际上只要第一抗体能够抓住抗原就可以实现准确的检测,对抗体的要求较低,可以直接使用多克隆抗体代替单克隆抗体,降低了检测成本;
6)本发明的检测下限可以达到100pg/ml以下,回收率99%以上,有望开发成为临床诊断试剂盒。
附图说明
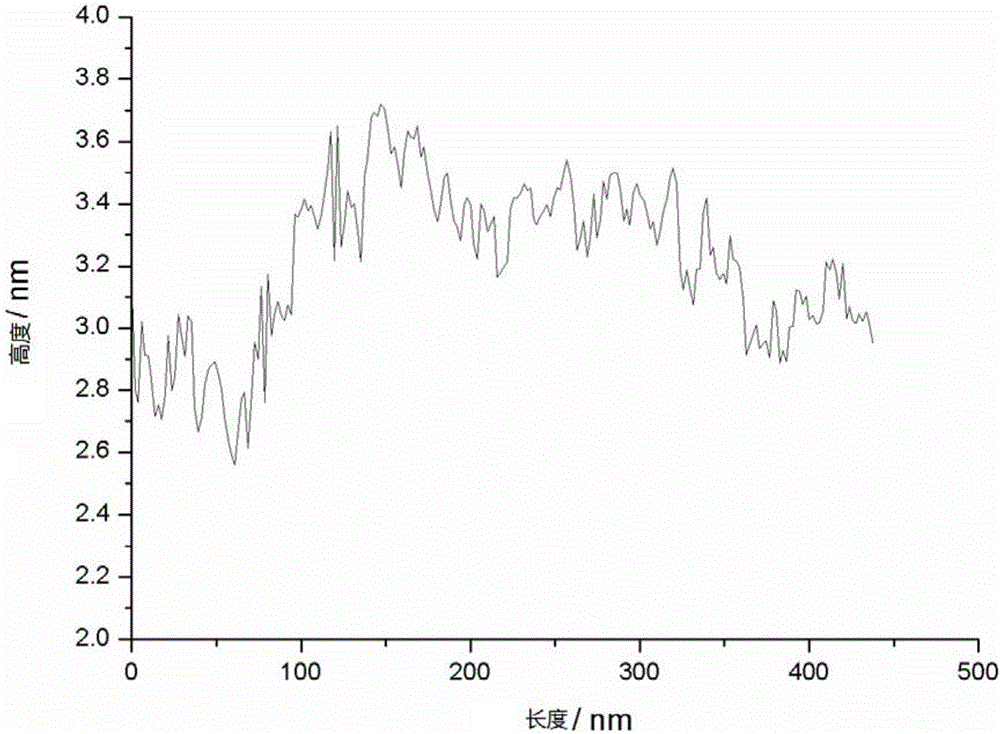
图1-a为实施例1制备抗体-石墨烯复合材料生物传感器反应前复合物的AFM图;
图1-b为实施例1制备抗体-石墨烯复合材料生物传感器反应前复合物AFM图中某纵截面的高度分布曲线图;
图2-a为实施例1制备抗体-石墨烯复合材料生物传感器活化后复合物的AFM图;
图2-b为实施例1制备抗体-石墨烯复合材料生物传感器活化后复合物AFM图中某纵截面的高度分布曲线图;
图3-a为实施例1制备抗体-石墨烯复合材料生物传感器接上抗体后复合物的AFM图;
图3-b为实施例1制备抗体-石墨烯复合材料生物传感器接上抗体后复合物AFM图中某纵截面的高度分布曲线图;
图4为实施例1所绘制浓度-荧光强度标准曲线;
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例1:
将0.2mg氧化石墨烯分散在一定浓度的pH<6的MES溶液中,加入0.5mg的EDC溶液和0.5mg的NHS溶液,在10℃以下反应1小时。接着离心分离清液,留下固体,加入pH>7的一定浓度的PBS溶液。用超声波清洗后再次离心去除清液,将固体再次分散在PBS溶液中。加入1-3ng Tau蛋白抗体,并持续振荡反应2小时。接着加入一定浓度的BSA溶液,反应1小时以封闭石墨烯上可能的剩余活性基团,清洗后,待用。
由图1-a、1-b分析可得,反应前的石墨烯厚度为1nm以下,由图2-a、2-b分析可得,活化后的石墨烯厚度约为4nm,由图3-a、3-b分析可得,接上抗体后的石墨烯厚度约为6nm。
配制浓度在0-200pg的10个Tau蛋白标准样品。分别加入制得的纳米生物传感器,在37℃下培养1小时。接着在每个样品中加入100pg的带有荧光标记的Tau蛋白标准样品。持续培养1小时后,使用荧光仪检测荧光强度并绘制标准曲线,如图4所示。
将待测样按上述步骤处理,测得荧光强度,与该标准曲线作对比,以得出待测样的浓度。
实施例2:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
其中,纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。抗体为Tau蛋白抗体。
本实施例高灵敏度可回收纳米生物传感器的制备方法,具体包括以下步骤:
(1)将氧化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应12小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应8小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应2小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中,氧化石墨烯与偶联剂、催化剂的质量比为5:10:10;
步骤(4)中,剩余固体I在碱性缓冲溶液中的质量浓度≤1mg/mL;
步骤(5)中,抗体与氧化石墨烯的质量比为3:500000;
步骤(7)中,剩余固体II在封闭液中的质量浓度≤1mg/mL;
步骤(8)中,剩余固体III在碱性缓冲溶液中的质量浓度≤1mg/mL。
本实施例所采用的酸性缓冲溶液为Bis-Tris,偶联剂为DCC,催化剂为DMAP,碱性缓冲溶液为TPE,封闭液为HSA。
在实际制备时,控制酸性缓冲溶液的pH为0-5,碱性缓冲溶液的pH>7。
本实施例制得的高灵敏度可回收纳米生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
实施例3:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
其中,纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。抗体为Tau蛋白抗体。
本实施例高灵敏度可回收纳米生物传感器的制备方法,具体包括以下步骤:
(1)将氧化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应1小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应1小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应1小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中,氧化石墨烯与偶联剂、催化剂的质量比为1:3:5;
步骤(4)中,剩余固体I在碱性缓冲溶液中的质量浓度≤1mg/mL;
步骤(5)中,抗体与氧化石墨烯的质量比为1:100000;
步骤(7)中,剩余固体II在封闭液中的质量浓度≤1mg/mL;
步骤(8)中,剩余固体III在碱性缓冲溶液中的质量浓度≤1mg/mL。
本实施例所采用的酸性缓冲溶液为MEST,偶联剂为DIC,催化剂为NHS,碱性缓冲溶液为tris-HCl,封闭液为明胶。
在实际制备时,控制酸性缓冲溶液的pH为0-5,碱性缓冲溶液的pH>7。
本实施例制得的高灵敏度可回收纳米生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
实施例4:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
其中,纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。抗体为Tau蛋白抗体。
本实施例高灵敏度可回收纳米生物传感器的制备方法,具体包括以下步骤:
(1)将氧化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应6小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应4小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应2小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中,氧化石墨烯与偶联剂、催化剂的质量比为1:1:1;
步骤(4)中,剩余固体I在碱性缓冲溶液中的质量浓度≤1mg/mL;
步骤(5)中,抗体与氧化石墨烯的质量比为3:200000;
步骤(7)中,剩余固体II在封闭液中的质量浓度≤1mg/mL;
步骤(8)中,剩余固体III在碱性缓冲溶液中的质量浓度≤1mg/mL。
本实施例所采用的酸性缓冲溶液为HEPES,偶联剂为WSCD,催化剂为NHS,碱性缓冲溶液为PBS,封闭液为BSA。
在实际制备时,控制酸性缓冲溶液的pH为0-5,碱性缓冲溶液的pH>7。
本实施例制得的高灵敏度可回收纳米生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
实施例5:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
其中,纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。抗体为Tau蛋白抗体。
本实施例高灵敏度可回收纳米生物传感器的制备方法,具体包括以下步骤:
(1)将氧化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应10小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应3小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应2小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中,氧化石墨烯与偶联剂、催化剂的质量比为3:7:8;
步骤(4)中,剩余固体I在碱性缓冲溶液中的质量浓度≤1mg/mL;
步骤(5)中,抗体与氧化石墨烯的质量比为2:300000;
步骤(7)中,剩余固体II在封闭液中的质量浓度≤1mg/mL;
步骤(8)中,剩余固体III在碱性缓冲溶液中的质量浓度≤1mg/mL。
本实施例所采用的酸性缓冲溶液为PIPES,偶联剂为WSCI,催化剂为NHS,碱性缓冲溶液为磷酸氢二钠,封闭液为BSA。
在实际制备时,控制酸性缓冲溶液的pH为0-5,碱性缓冲溶液的pH>7。
本实施例制得的高灵敏度可回收纳米生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
实施例6:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
其中,纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。抗体为Tau蛋白抗体。
本实施例高灵敏度可回收纳米生物传感器的制备方法,具体包括以下步骤:
(1)将羧基化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应8小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应5小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应2小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中,羧基化石墨烯与偶联剂、催化剂的质量比为2:5:6;
步骤(4)中,剩余固体I在碱性缓冲溶液中的质量浓度≤1mg/mL;
步骤(5)中,抗体与羧基化石墨烯的质量比为1:400000;
步骤(7)中,剩余固体II在封闭液中的质量浓度≤1mg/mL;
步骤(8)中,剩余固体III在碱性缓冲溶液中的质量浓度≤1mg/mL。
本实施例所采用的酸性缓冲溶液为MOPS,偶联剂为EDC,催化剂为NHS,碱性缓冲溶液为tris-HCl,封闭液为BSA。
在实际制备时,控制酸性缓冲溶液的pH为0-5,碱性缓冲溶液的pH>7。
本实施例制得的高灵敏度可回收纳米生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
实施例7:
一种高灵敏度可回收纳米生物传感器,该生物传感器是以纳米级石墨烯为载体,通过抗体与纳米级石墨烯之间形成肽键,将抗体负载在纳米级石墨烯上。
其中,纳米级石墨烯的厚度≤0.9nm,长度≤100nm,宽度≤100nm。抗体为Tau蛋白抗体。
本实施例高灵敏度可回收纳米生物传感器的制备方法,具体包括以下步骤:
(1)将羧基化石墨烯加入酸性缓冲溶液中,超声分散均匀;
(2)再加入偶联剂及催化剂,反应8小时;
(3)待反应结束后,离心分离,除去上层清液,保留剩余固体I;
(4)将剩余固体I加入到碱性缓冲溶液中,超声分散均匀;
(5)再加入抗体,反应5小时;
(6)待反应结束后,离心分离,除去上层清液,保留剩余固体II;
(7)将剩余固体II加入到封闭液中,超声分散均匀后,继续反应2小时,随后离心分离,除去上层清液,保留剩余固体III;
(8)将剩余固体III加入到碱性缓冲溶液中,超声分散均匀,保存。
步骤(2)中,羧基化石墨烯与偶联剂、催化剂的质量比为1:3:5;
步骤(4)中,剩余固体I在碱性缓冲溶液中的质量浓度≤1mg/mL;
步骤(5)中,抗体与羧基化石墨烯的质量比为1:400000;
步骤(7)中,剩余固体II在封闭液中的质量浓度≤1mg/mL;
步骤(8)中,剩余固体III在碱性缓冲溶液中的质量浓度≤1mg/mL。
本实施例所采用的酸性缓冲溶液为甘氨酸-盐酸缓冲液,偶联剂为DCC,催化剂为NHS,碱性缓冲溶液为磷酸氢二钠-氢氧化钠缓冲液,封闭液为BSA。
在实际制备时,控制酸性缓冲溶液的pH为0-5,碱性缓冲溶液的pH>7。
本实施例制得的高灵敏度可回收纳米生物传感器基于免疫竞争反应用于检测包括Tau蛋白在内的人体体液蛋白质。
- 还没有人留言评论。精彩留言会获得点赞!