一种最优超平面的构建方法、动态优化系统和构建装置与流程
本发明涉及癌症检测领域,具体涉及一种最优超平面的构建方法、动态优化系统和构建装置。
背景技术:
肿瘤标记物检测已经成为常规的肿瘤检测手段之一,在对肿瘤的筛选、诊断和判断预后以及实现个体化治疗中扮演着重要的角色。目前常用的肿瘤标志物检测方法有酶联免疫吸附法(ELISA)、基因芯片、蛋白芯片、mRNA转录检测以及肿瘤细胞代谢物(标志物)检测等。
酶联免疫吸附法(ELISA)是不同的免疫测定法中最常用的方法之一。它是指将可溶性的抗原或抗体吸附到聚苯乙烯等固相载体上。ELISA法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅进行定性或定量分析。该方法特点灵敏度高,特异性强,但操作步骤复杂,需要从事人员受一定的专业训练,同时大量检测相当费时,实验周期长,且一种试剂仅针对一种蛋白表达程度,无法达到大量不同蛋白同时检测目的。
基因芯片是基于核酸互补杂交原理将大量的探针分子按二维结构固定于固相支持物上,与标记的样品分子进行杂交反应,通过对杂交信号的监测分析获取样品分子的数量和序列信息,是对高危易感人群中患特定癌症危险性预测,实际上是检测患者对癌症相关基因的敏感度,由于此方法涉及血清分离基因测序等技术所需费用极高,存在一定的假阳性,灵敏度低,尚无法进行定量检测。
蛋白芯片是一种高通量监测系统,通过靶分子和捕捉分子相互作用来监测蛋白分子之间的相互作用。蛋白芯片是以蛋白质代替DNA作为检测对象,与在mRNA水平上的检测基因表达的基因芯片不同,它直接在蛋白水平上检测表达模式。它的基本原理是将各种蛋白质有序地固定于载玻片等各种介质载体上成为检测的芯片,然后,用标记了有特定荧光物质的抗体与芯片作用,与芯片上的蛋白质相匹配的抗体将与其对应的蛋白质结合,抗体上的荧光将指示对应的蛋白质及其表达数量。在将未与芯片上的蛋白质互补结合的抗体洗去之后利用荧光扫描仪或激光共聚扫描技术,测定芯片上各点的荧光强度,通过荧光强度分析蛋白质与蛋白之间相互作用的关系,由此达到测定各种基因表达功能的目的。为了实现这个目的,首先必须通过一定的方法将蛋白质固定于合适的载体上,同时能够维持蛋白质天然构象,也就是必须防止其变性以维持其原有的特定生物的活性。检测过程需要标记探针来实现的,操作繁琐,而蛋白芯片检测的结果不是蛋白的绝对含量而是被检目的蛋白在两个样品之间的相对丰度。由于抗体抗原结合的差异、标记差异等原因,根据芯片结果信号的强弱判断同一样品中两种不同蛋白的多少是不恰当的。
mRNA转录检测法是通过一条被标记的DNA单链作为基因探针来实现的。这个探针具体的做法是:用目的基因转录出的mRNA为模板,以被放射性同位素标记的脱氧核苷酸为原料,用逆转录的方法合成一条被标记的DNA,然后把模板的mRNA水解,这样就得到一条被标记的DNA单链,此即为探针。它的特点就是可以和目的基因转录的mRNA互补配对(即能形成杂交带),并将探针放在受体细胞中,如发现有杂交带产生,就认为目的基因转录了。此过程异常繁杂,且花费不贷,更是无法同时检测数种癌症相关的蛋白表达(差异)。
肿瘤细胞代谢物(标志物)检测,从病理学上,肿瘤组织比正常组织代谢旺盛,尤以恶性肿瘤更为明显。如大量的文献报道说明,癌症患者尿液中不仅络氨酸含量增加明显,色氨酸含量也显著增高,常用的代谢物检测是基于癌症患者尿液中某些氨基酸(如色氨酸、络氨酸)及其代谢衍生物的含量异常增高,并且这些物质可与其试剂发生特异性反应而生成具有特征性颜色的沉淀物,根据沉淀物的颜色与比色板相对照从而判定结果。其特点操作简单,无创性检测,方便易行,但由于此方法结果由目测确定,主观性较强,个体差异较大,操作者本身素质也对检测结果具有一定影响,需要提高不断检测结果的准确度和重复性,减少漏检率。
以上方法如果只针对单项肿瘤标志物进行检测个体肿瘤的临床结果,存在很多的假阴性,多种肿瘤标志物联合动态监测是提高肿瘤诊断可行性策略。有临床价值的许多生物标志物已经通过在基因组学,蛋白质组学和分子病理学领域的进步中得到鉴定,并且它们促进了各种个性化肿瘤治疗。值得注意的是,随着检测水平提高,越来越多的研究者考虑使用多变量预测模型(组合现有的肿瘤标志物)以便提高检测的准确率,有研究报告显示:多变量模型的敏感性与准确率高于单独检测的特异性。而微流控芯片技术被列为本世纪七项改变世界的技术,也叫“芯片上实验室LAB ON CHIP”。它采用微细加工技术,把生物和化学等领域中所涉及的样品制备、反应、分离、检测等基本操作单元集成或基本集成到一块几平方厘米(甚至更小)的芯片上,用以完成不同的生物或化学反应过程,并对其产物进行分析,是真正意义上的芯片。它的特点是微小型化、少量样品、分析结果时间短,进样,分离,标记和检测可在几分钟内完成,实现了高通量特异性和灵敏度检测。
从相关关键词索引资料发现,基于微流控芯片应用的疾病检测技术涉及:基于微流控芯片的循环肿瘤细胞检测、基于ELISA的微流控芯片检测、早期癌症诊断的生物标志物检测、肿瘤代谢物检测等。
(1)基于微流控芯片的循环肿瘤细胞(CTCS)检测
CTCs被定义为因诊疗操作或自发由实体肿瘤或转移灶释放而进入外周血循环的肿瘤细胞。当前较为常用的CTCs微流控芯片技术有:基于循环肿瘤细胞大小、基于循环肿瘤细胞介电性、基于纳米颗粒。上述各种检测方式,虽然它们各自具有检测优势,但仍存在一系列问题,例如依赖抗原抗体的免疫学检测法有高度的特异性而缺乏足够的敏感性,非免疫学检测法则有敏感性高而特异性不足的问题。CTCs在外周血中的数量极少,通常在每106~107个白细胞中才能寻找出仅有的数个肿瘤细胞,因而要进行CTCs检测通常必须先进行细胞富集,操作繁琐。同时基于循环肿瘤细胞的检测从医理学角度上属于细胞层面上的检测手段,非早期检测,检测样品需求量大,这些都限制了CTCs的检测技术广泛应用。
(2)基于ELISA试剂盒的微流控芯片检测
以高分子聚合物PDMS芯片为分析平台,采用具有蛋白吸附功能的PDMS通道表面作为固相载体进行的免疫反应,该技术自动化、集成化,特异性敏感度高、所需样品少、反应时间。但目前还没有一种100%特异性的肿瘤生物标记。多通道芯片产生的多种肿瘤生物标志物的分析主要依赖医生主观诊断较多,限制了ELISA方法在肿瘤临床诊断方面上的广泛应用。
(3)基于数学模型进行的生物标志物微流控芯片早期癌症诊断
在基因组和蛋白组学的不断取得最新进展技术的条件下,人们已经有可能应用建立数学模型的计算方法以检测蛋白表达变化及其关联的疾病,从而更加精确地对相关肿瘤疾病进行定性、定量分析,即多元预测模型组合现有的肿瘤标志物检测。已有常用的多元预测模型方法有:(非)线性回归统计法、主因子分析法、贝叶斯估计判别准则法与支持向量机方法等,但这些方法都依赖于设计者的主观因素(算法),导致识别正确率无法提高,容易产生机器过度学习问题,影响输出结果的准确率。
综上现有常用的多种肿瘤标志物联合检测方法一般存在以下问题和缺陷:
1)检测费用高:为了保证肿瘤诊断的准确性,检测往往需要增加肿瘤标志物的种类,然而,常规检测往往只能对一种肿瘤标志物进行检测,多种检测材料成本、人力成本也随之提高。
2)检测时间长:常规的检测需专业的检验人员通过一系列取样、化验、分析,得出结论,检测技术专业性要求高,无法快速实现在数量众多的、条件有限的医院(诊所)的实验室进行检测,难以保证肿瘤诊断的准确性。
3)检测所需样品量大:常规的肿瘤标志物检测大多用于辅助医生进行癌症患者治疗结果的评价手段,对患者大量、多次的提取血样无益于患者术后治疗,影响了其身体的及时康复。
4)诊断结果的准确度低:目前常用的肿瘤标志物检测方法存在一定的假阳性,分析结果存在误差,缺乏统一、灵敏的分析系统,难以保证肿瘤诊断的准确性。
技术实现要素:
本发明要解决的技术问题在于,针对现有技术的上述缺陷,提供一种最优超平面的构建方法,减低癌症检测的误差、提高检测效率、降低检测费用。
本发明要解决的技术问题在于,针对现有技术的上述缺陷,提供一种最优超平面的动态优化系统,提高癌症检测的识别准确率,优化检测系统。
本发明要解决的技术问题在于,针对现有技术的上述缺陷,提供一种最优超平面的构建装置,减低癌症检测的误差、提高检测效率、降低检测费用。
本发明解决其技术问题所采用的技术方案是:提供一种最优超平面的构建方法,包括步骤:选取若干正常人与癌症患者为样本,获得所有样本中的蛋白信息;利用蛋白信息建立所有样本的蛋白信息特征数据空间;计算各样本在蛋白信息特征数据空间中的对应数据点之间的距离度量,以及计算正常人样本集合与癌症患者样本集合之间的Tanimoto距离;根据Tanimoto距离,由蛋白信息特征数据空间的距离度量出发,利用判别函数获得非线性可分模式,构造最优超平面,该最优超平面作为识别正常人与癌症患者的分类器。
其中,较佳方案是,建立所有样本的蛋白信息特征数据空间的方式是:利用蛋白信息建立所有样本的蛋白信息特征向量空间;将所有样本的蛋白信息投影到蛋白信息特征向量空间中,获得所有样本的蛋白信息特征数据矩阵,并获得所有样本的蛋白信息特征数据空间。
其中,较佳方案是,建立所有样本的蛋白信息特征向量空间的方式还包括:对蛋白信息特征数据空间按列进行归一化处理,得到所有样本归一化之后的蛋白信息特征数据空间。
其中,较佳方案是,建立所有样本的蛋白信息特征向量空间的方式是:根据蛋白信息建立蛋白信息矩阵X=[X1,X2,...Xi...,XT],及获得蛋白信息矩阵的协方差矩阵,并获得协方差矩阵的特征值λi和与特征值λi相对应的特征向量Φi,其中Xi(i=1,2,...,T)是一个n维向量,表示第i个样本的蛋白信息,n表示所有样本的蛋白信息的采样点数,T表示所有样本的总数;对若干特征值λi按从大到小的顺序排列,与每个特征值λi相应的特征向量Φi按照特征值λi的调整顺序作相应调整,并建立特征向量矩阵Φ'=[Φ'1,Φ'2,...Φ'i...,Φ'T],其中,Φ'i表示与调整顺序后的Φi;对特征向量矩阵进行单位正交化,并由单位正交化得到的矩阵的各列向量所确定的空间作为所有样本的蛋白信息特征向量空间。
其中,较佳方案是,计算距离度量的方式是:利用parzen窗函数扩展到以样本点x为中心,进行包含Pn个样本为止的扩张;根据闵可夫斯基距离度量,在蛋白信息特征数据矩阵及蛋白信息特征数据空间中建立距离度量;其中,x,y为蛋白信息特征数据空间中样本的向量。
其中,较佳方案是,对线性可分类样本构造最优超平面的方式是:引入T个线性可分类样本,设置期望输出值dT=±1,利用偏置与负阈值概念,设置WT·XT+b>0,dT=1,WT·XT+b<0,dT=-1,获得一个分类边缘最大的超平面;采用laglang系数方法解决约束最优问题;其中,W为新加入样本的蛋白信息矩阵。
其中,较佳方案是:对不能满足约束条件dT(WT·XT+b)≥1并出现分类误差的样本的蛋白信息矩阵,构造最优超平面的方式是:引入松弛变量ξT≥0,设置dT(WT·XT+b)≥1-ξT;当0≤ξT≤1时,样本的数据点落入分类区域的内部,且在分类超平面的正确一侧;当ξT=0时,样本的数据点为离超平面最近的特殊样本数据点;当ξT>1时,样本的数据点在分类超平面的错误一侧;
其中,较佳方案是:对非线性可分类样本构造最优超平面的方式是:对给定的训练样本寻找W和B的最优值,在约束条件dT(WT·XT+b)≥1下,最小化关于W和松弛变量ξT的代价函数,其计算式为:采用laglang系数方法解决约束最优问题;其中,W为新加入样本的蛋白信息矩阵,C为选定的正参数。
其中,较佳方案是:采用基本迭代最小平方误差聚类算法和多层次聚类算法,获得多层次聚类结构及聚类中心,作为被蛋白信息的数据点与各类不同癌症聚类中心点的距离判别标准。
本发明解决其技术问题所采用的技术方案是:提供一种早期癌症检测的动态修正系统,包括:若干分类器,根据样本的蛋白信息矩阵中的不同蛋白信息组合,建立多种不同的蛋白信息特征数据空间,以及与蛋白信息特征数据空间相对应的最优超平面,作为不同种类的分类器;权重模块,该权重模块设置在对应的分类器上,该权重模块包括新增样本的蛋白信息矩阵,该新增样本蛋白信息矩阵的蛋白信息组合与对应分类器的蛋白信息组合相同;其中,该分类器均给出一个影响估计输出的函数,若错判时,根据修改对应的权重模块中的权重值大小,以及作为构建最优超平面的原始蛋白信息之一,动态优化最优超平面。
本发明解决其技术问题所采用的技术方案是:提供一种最优超平面的构建装置,包括蛋白信息检测单元和微流控芯片,该蛋白信息检测单元选取若干正常人与癌症患者为样本,并对样品的血样进行特异蛋白自动检测,实现特定参数的检测,获得各样本中的蛋白信息;该微流控芯片包括:蛋白信息获取模块,该蛋白信息获取模块与蛋白信息检测单元连接,该蛋白信息获取模块用于获得所有样本中的蛋白信息;处理器模块,该处理器模块利用蛋白信息建立所有样本的蛋白信息特征数据空间,并计算各样本在蛋白信息特征数据空间中的对应数据点之间的距离度量,以及计算正常人样本集合与癌症患者样本集合之间的Tanimoto距离,根据Tanimoto距离,由蛋白信息特征数据空间的距离度量出发,利用判别函数获得非线性可分模式,构造最优超平面。
本发明的有益效果在于,与现有技术相比,本发明通过设计一种最优超平面的构建方法,根据样本的蛋白信息构建最优超平面,作为识别正常人与癌症患者的分类器;同时,将蛋白信息和蛋白信息特征数据空间进行分类,并引入在蛋白信息特征数据空间中闵可夫斯基距离度量和松弛变量ξT,以改进最优超平面的构建,最后通过动态的组合分量分类器设计,以实现系统的智能化与准确率最优化;同时,不依赖于设计者的经验知识,有良好的泛化能力,不产生超学习状态,避免机器学习时间过长,影响效率,通过循环迭代算法,克服了现有识别技术正确率低的缺陷。
附图说明
下面将结合附图及实施例对本发明作进一步说明,附图中:
图1是本发明早期癌症的检测方法的流程示意图;
图2是本发明建立所有样本的蛋白信息特征数据空间的流程示意图;
图3是本发明建立所有样本的蛋白信息特征向量空间的流程示意图;
图4是本发明构造最优超平面的流程示意图;
图5是本发明早期癌症检测的动态修正系统的结构示意图;
图6是本发明蛋白信息检测装置的结构示意图;
图7是本发明蛋白信息检测单元微流控芯片的结构框图。
具体实施方式
现结合附图,对本发明的较佳实施例作详细说明。
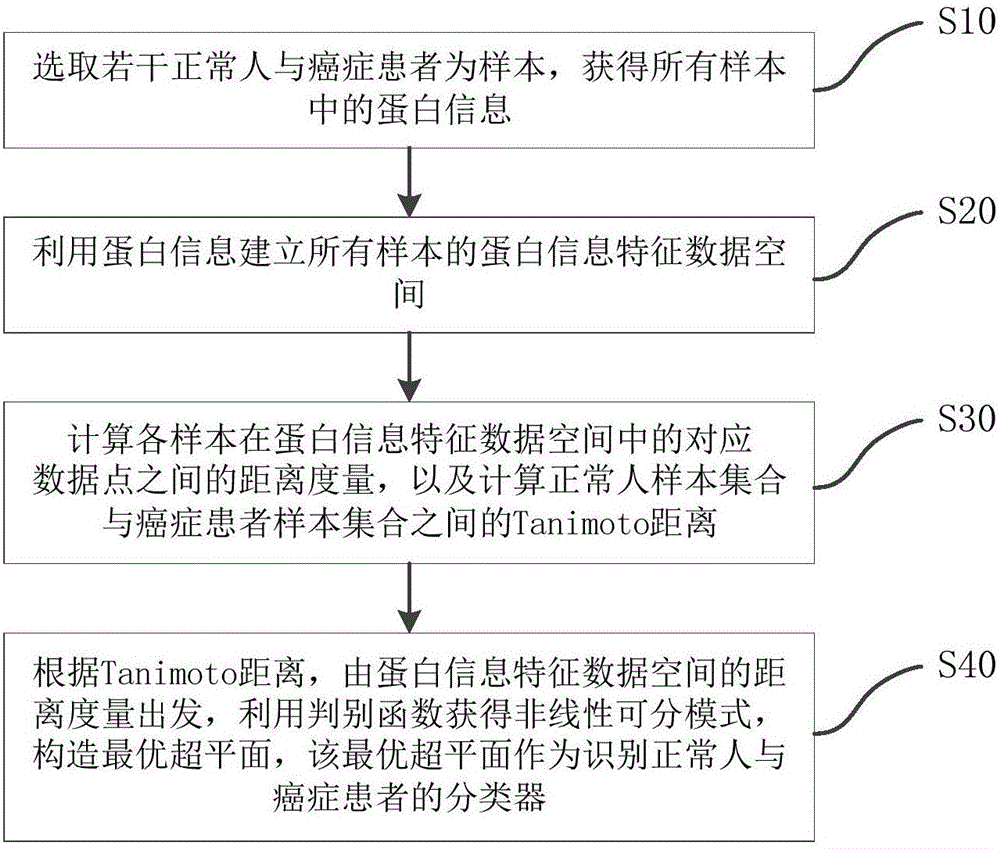
如图1所示,本发明提供一种最优超平面的构建方法的优选实施例。
一种最优超平面的构建方法,该最优超平面用于早期癌症检测,包括步骤:
S10、选取若干正常人与癌症患者为样本,获得所有样本中的蛋白信息;
S20、利用蛋白信息建立所有样本的蛋白信息特征数据空间;
S30、计算各样本在蛋白信息特征数据空间中的对应数据点之间的距离度量,以及计算正常人样本集合与癌症患者样本集合之间的Tanimoto距离;
S40、根据Tanimoto距离,由蛋白信息特征数据空间的距离度量出发,利用判别函数获得非线性可分模式,构造最优超平面,该最优超平面作为识别正常人与癌症患者的分类器。
在步骤S10中,本实施例的检测方法是在微流控芯片,以及具有独立于算法的数字信号集成芯片的支持下实现的;即在微流控芯片的多通道里运行免疫检测,以提取样本的蛋白信息。
进一步地,对样本(血样)进行提取,优选为0.05ml,并进行预处理;通过微流控芯片控制的ELISA免疫反应通道,完成样本的免疫反应;用酶标仪测定A595或560-610nm之间吸光度,并由芯片检测计算出样本中蛋白浓度,通过采样处理,获得所有样本中的蛋白信息。
一般而言,本发明优先采用八项肿瘤标志物,即八种蛋白信息;也可以根据实际情况,获得所有样本中的更多种蛋白信息,或更少种蛋白信息。
如图2所示,本发明提供一种建立所有样本的蛋白信息特征数据空间的较佳实施例。
建立所有样本的蛋白信息特征数据空间的方式包括步骤:
S21、利用蛋白信息建立所有样本的蛋白信息特征向量空间;
S22、将所有样本的蛋白信息投影到蛋白信息特征向量空间中,获得所有样本的蛋白信息特征数据矩阵,并获得所有样本的蛋白信息特征数据空间。
进一步地,还包括步骤S23、对蛋白信息特征数据空间按列进行归一化处理,得到所有样本归一化之后的蛋白信息特征数据空间。
如图3所示,本发明提供一种建立所有样本的蛋白信息特征向量空间的较佳实施例。
建立所有样本的蛋白信息特征向量空间的方式包括步骤:
S31、根据蛋白信息建立蛋白信息矩阵X=[X1,X2,...Xi...,XT],及获得蛋白信息矩阵的协方差矩阵,并获得协方差矩阵的特征值λi和与特征值λi相对应的特征向量Φi,其中Xi(i=1,2,...,T)是一个n维向量,表示第i个样本的蛋白信息,n表示所有样本的蛋白信息的采样点数,T表示所有样本的总数;
S32、对若干特征值λi按从大到小的顺序排列,与每个特征值λi相应的特征向量Φi按照特征值λi的调整顺序作相应调整,并建立特征向量矩阵Φ'=[Φ'1,Φ'2,...Φ'i...,Φ'T],其中,Φ'i表示与调整顺序后的Φi;
S33、对特征向量矩阵进行单位正交化,并由单位正交化得到的矩阵的各列向量所确定的空间作为所有样本的蛋白信息特征向量空间。
在步骤S31中,蛋白信息矩阵X=[X1,X2,...Xi...,XT]的协方差矩阵Cf,其第i行j列的元素表示为:
∑ij=E[(Xi-ui)·(Xj-uj)];
其中,ui和uj分别表示矩阵X=[X1,X2,...Xi...,XT]的第i个列向量Xi的均值和第j个列向量Xj的均值,E为数学期望,因此,协方差矩阵Cf为:
同时,利用等式Cf·Φi=λi·Φi(1≤i≤T),求协方差矩阵Cf的特征值λi和与特征值λi相对应的特征向量Φi,并构成特征向量矩阵Φ=[Φ1,Φ2,...,ΦT]。
如图4所示,本发明提供一种构造最优超平面的较佳实施例。
构造最优超平面的步骤包括:
S41、利用parzen窗函数扩展到以样本点x为中心,进行包含Pn个样本为止的扩张;
S42、根据闵可夫斯基距离度量,在蛋白信息特征数据矩阵及蛋白信息特征数据空间中建立距离度量;其中,x,y为蛋白信息特征数据空间中样本的向量。
S431、对线性可分类样本构造最优超平面的方式是:引入T个线性可分类样本,设置期望输出值dT=±1,利用偏置与负阈值概念,设置WT·XT+b>0,dT=1,WT·XT+b<0,dT=-1,获得一个分类边缘最大的超平面;采用laglang系数方法解决约束最优问题;其中,W为新加入样本的蛋白信息矩阵。
S432、对不能满足约束条件dT(WT·XT+b)≥1并出现分类误差的样本的蛋白信息矩阵,构造最优超平面的方式是:引入松弛变量ξT≥0,设置dT(WT·XT+b)≥1-ξT;当0≤ξT≤1时,样本的数据点落入分类区域的内部,且在分类超平面的正确一侧;当ξT=0时,样本的数据点为离超平面最近的特殊样本数据点;当ξT>1时,样本的数据点在分类超平面的错误一侧;
S433、对非线性可分类样本构造最优超平面的方式是:对给定的训练样本寻找W和B的最优值,在约束条件dT(WT·XT+b)≥1下,最小化关于W和松弛变量ξT的代价函数,其计算式为:
S44、采用laglang系数方法解决约束最优问题;其中,W为新加入样本的蛋白信息矩阵,C为选定的正参数。
S45、获得最优超平面,该最优超平面作为识别正常人与癌症患者的分类器。
在本实施例中,在蛋白信息特征数据矩阵及蛋白信息特征数据空间中建立的距离度量,其是最优非线性超平面的建立的基本支撑;通过建立最优非线性超平面,设立一个识别正常人与癌症患者的标准,即分类器,新的样本的蛋白信息,通过代入分类器,识别其是正常人还是癌症患者。
同时,采用基本迭代最小平方误差聚类算法和多层次聚类算法,获得多层次聚类结构及聚类中心,作为被蛋白信息的数据点与各类不同癌症聚类中心点的距离判别标准。
基本迭代最小平方误差聚类算法的具体步骤是:
begin initialize n,c,m1,m2,...,mc
do随机选取一个样本
(分类x)
if ni≠1then计算,
If pk≤pj对于所有j then转移到Dk
重新计算Je,mi,mk
until在n此计算中Je不在改变
return m1,m2,...,mc。
基本合并的层次聚类算法的具体步骤是:
begin initialize c,Di←{xi},i=1,...,n
求最接近的聚类,例如Dj和Di
合并Dj和Di
Return c个聚类。
如图5所示,本发明提供一种早期癌症检测的动态修正系统的优选实施例。
一种早期癌症检测的动态修正系统,包括:
若干分类器,根据样本的蛋白信息矩阵中的不同蛋白信息组合,建立多种不同的蛋白信息特征数据空间,以及与蛋白信息特征数据空间相对应的最优超平面,作为不同种类的分类器;
权重模块,该权重模块设置在对应的分类器上,该权重模块包括新增样本的蛋白信息矩阵,该新增样本蛋白信息矩阵的蛋白信息组合与对应分类器的蛋白信息组合相同;
其中,该分类器均给出一个影响估计输出的函数δi,若错判时,根据δi修改对应的权重模块中的权重值大小,实现优化检测准确率。
具体的,例如建立的非线性超平面矩阵,在自修正的优化决策过程中,根据大数定律(切比雪夫定理),利用“分量分类器”或专家组成的混合动态组分类器的结构方法,在相同的训练样本条件下,使识别癌症患者或正常人的正确率达到最大化。
参考图5,k个分类器,Q1,Q2,....,Qk,或专家组成的混合动态组分类器,其权重分别为W1,W2,...,Wk。每一个分类器都给出一个影响估计输出的函数δi(类别隶属度),在错判时,即将癌症患者的蛋白信息判断为正常,将正常人的蛋白信息判断为患有癌症,以δi修改权重,选样子模块20将错误的蛋白信息赋予到对应分类器的权重中,并送入决策模块10中,然后输出包含正确判断信息的权重的分类器,实现早期癌症检测的系统的优化。
如图6所示,本发明提供一种蛋白信息检测装置的较佳实施例。
蛋白信息检测装置包括样品入口31、试剂入口32、混合结构33、观察槽34和废液出口35,样品入口31和试剂入口32分别加入样品血样和试剂,在混合结构33中,实现备样—加样—反应—5次冲洗—加酶标—反应—5次冲洗—显色试剂—反应—终止液的特异蛋白自动检测过程,并通过观测槽34的分光光度计测量,实现特定参数的检测,最后通过废液出口35排出,进入下一轮的检测反应中。
如图7所示,本发明提供一种构建最优超平面的装置的较佳实施例。
一种构建最优超平面的装置,包括蛋白信息检测单元和微流控芯片,该蛋白信息检测单元选取若干正常人与癌症患者为样本,并对样品的血样进行特异蛋白自动检测,实现特定参数的检测,获得各样本中的蛋白信息。
进一步地,该微流控芯片包括蛋白信息获取模块和处理器模块,该蛋白信息获取模块与蛋白信息检测单元连接,该蛋白信息获取模块用于获得所有样本中的蛋白信息;该处理器模块利用蛋白信息建立所有样本的蛋白信息特征数据空间,并计算各样本在蛋白信息特征数据空间中的对应数据点之间的距离度量,以及计算正常人样本集合与癌症患者样本集合之间的Tanimoto距离,根据Tanimoto距离,由蛋白信息特征数据空间的距离度量出发,利用判别函数获得非线性可分模式,构造最优超平面。
其中,微流控芯片微流控芯片技术是把生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程。由于它在生物、化学、医学等领域的巨大潜力,已经发展成为一个生物、化学、医学、流体、电子、材料、机械等学科交叉的崭新研究领域。
以上所述者,仅为本发明最佳实施例而已,并非用于限制本发明的范围,凡依本发明申请专利范围所作的等效变化或修饰,皆为本发明所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!