一种带有表面固化多肽探针的电化学传感器的制备方法与流程
本发明涉及电化学传感器技术领域,具体涉及一种带有表面固化多肽探针的电化学传感器的制备方法。
背景技术:
电化学传感器是一种以电化学信号检测样品中靶向分析物含量或者浓度的传感器,电化学信号是由法拉第电流的变化或者交流电阻抗等性质的变化产生。通常一个电化学传感器由至少一个工作电极,一个对电极及参比电极组成,且工作电极上带有可与检测样品中的靶向分析物产生结合或者化学反应的探针分子。
目前可选择的探针分子包括核糖核酸链,酶,多肽抗体或其他可与分析物结合的蛋白质等等,其中,酶,抗体等蛋白质可统称为多肽探针,是最常见的探针分子。在理想状态下,为保证传感器的敏感度,可靠度和信噪比,探针分子应该仅存在于工作电极表面且不会被检测样本稀释或移除。因此探针分子需要固化在工作电极的表面上。现有的常见固化方式包括多肽交联工艺,自组装单层膜工艺,紫外光敏包埋工艺等等。
此外,在体内环境使用的电化学传感器通常还会在探针分子层之上覆盖一层高生物相容性的选择性渗透膜,使得目标分析物相较于其他干扰分子更易于渗透到工作电极表面,以提高传感器的检测精度。由于渗透膜的生物相容性要求,其物理和化学性质可能与探针分子层差异很大,使得两层物质的粘合度较差,因此有时需要在两层之间做一些粘结处理,例如加涂生物相容性胶水或者通过化学反应生成探针分子层与渗透膜层之间的共价键等等。
现有的多种探针分子固化工艺均有所不足,主要体现在:多肽交联工艺通常使用戊二醛作为交联介质促使多肽分子与相邻分子间产生共价交联,其不足之处是会改变多肽的三阶和四阶结构,显著降低探针分子,尤其是酶分子的活性和敏感度;而且戊二醛是一种极易燃易挥发的有毒物质,不利于大批量安全生产。自组装单层膜工艺主要通过在平整的金属电极表面生成由链型分子自组装成单层膜,多肽探针分子可在链型分子成膜之前或之后通过共价键反应连接固化到单层膜上。其不足之处在于对金属电极表面的平整度要求极高,且只能实现单层固化,所以固化探针分子密度较低,传感器的敏感度性能较差。紫外光敏包埋工艺通过采用单体光敏胶由紫外曝光聚合反应而产生的网状多聚分子将多肽探针分子包埋在网状结构内。其不足之处是大多数光敏胶有一定的生物毒性,不适合在体内传感器中使用,而且精密紫外曝光设备价格昂贵,显影工艺较复杂,使得其制造成本较高。
在传感器渗透膜的镀膜工艺中常用的粘结方法为加添胶水层或产生化学反应或者这两种方法的结合。其中胶水层需要达到生物相容性和可以粘结两层物理化学属性完全不同的物质的两方面要求,所以选择非常有限,且常常需要根据探针分子层和渗透膜层的具体属性另行研制,导致制造成本很高。而化学反应工艺由于多肽探针分子对温度,溶液酸碱度和有机或腐蚀性溶剂等反应条件的高度敏感性,为了保证探针分子不会被破坏,可实际操作的化学反应选择也非常有限。
技术实现要素:
本发明目的是提供一种带有表面固化多肽探针的电化学传感器的制备方法,以解决现有技术的不足。
本发明采用以下技术方案:
一种带有表面固化多肽探针的电化学传感器的制备方法,包括如下步骤:
步骤一、在基材上制备电化学传感器的电极;
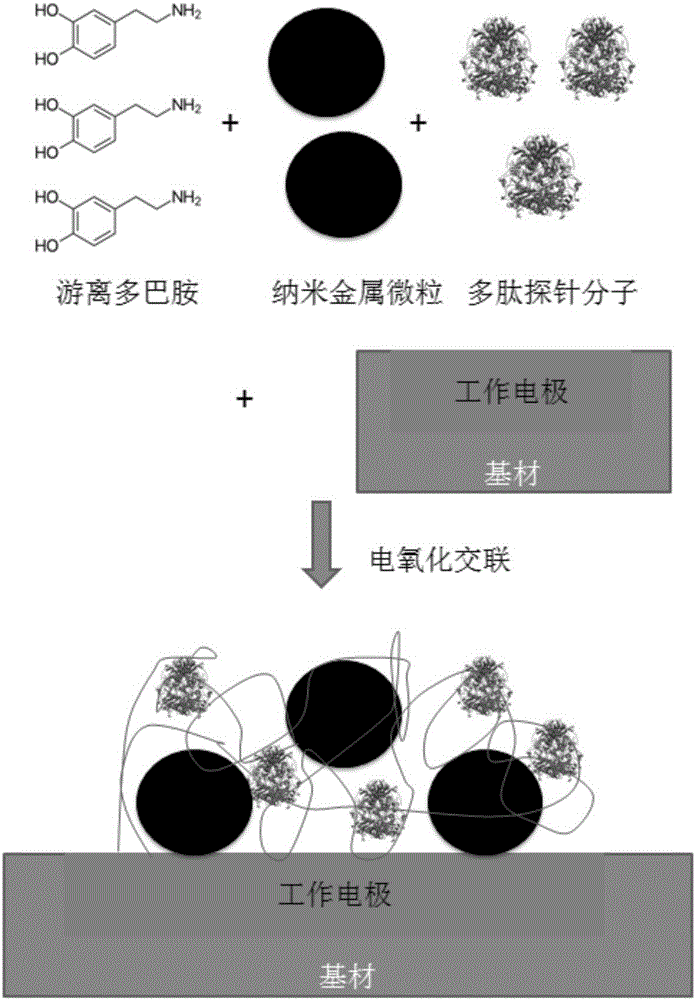
步骤二、利用氧化多巴胺进行交联纳米金属微粒和多肽探针分子,并附到工作电极上,即工作电极上形成聚多巴胺探针层;
步骤三、将渗透膜溶液镀于聚多巴胺探针层上并烘干,形成渗透膜层。
进一步地,步骤二工作电极上形成聚多巴胺探针层,通过方案a或方案b实现:
方案a:将多肽探针分子、多巴胺分子和具氧化剂效果的金属酸加入到水中进行反应,生成表面固化氧化聚多巴胺和多肽探针分子的纳米金属微粒;再将步骤一的基材放入到该混合溶液中,通过电化学氧化反应将所述纳米金属微粒沉积到工作电极表面;
方案b:将纳米金属微粒、多肽探针分子和多巴胺分子加入到水中,并将步骤一的基材浸入,通过电化学氧化反应在工作电极表面生成含有纳米金属微粒和多肽探针分子的聚多巴胺网状结构固化层。
进一步地,a方案中:反应溶液中多肽探针分子的质量浓度为0.1-10mg/mL;多巴胺分子的质量浓度为1-10g/L;具氧化剂效果的金属酸的质量浓度为0.1-1mg/L;具氧化剂效果的金属酸包括氯铂酸、氯金酸或氯铱酸;反应溶液在pH为7-9、溶氧饱和度低于1%、20-40℃的条件下进行反应;电化学氧化反应时工作电极上施加的电压相对于溶液中的银/氯化银参比电极为0-0.8伏。
进一步地,b方案中:反应溶液中纳米金属微粒的大小为1-100纳米,纳米金属微粒的质量浓度为1000-50000ppm;多肽探针分子的质量浓度为0.1-10mg/mL;多巴胺分子的质量浓度为1-10g/L;反应溶液在pH为7-9、溶氧饱和度低于1%、20-40℃、工作电极上施加的电压相对于溶液中的银/氯化银参比电极为0-0.8伏的条件下进行反应。
进一步地,步骤二和步骤三之间还包括在聚多巴胺探针层与渗透膜层之间增加一层不含纳米金属微粒和多肽探针分子的聚多巴胺粘结层以增加紧密度。
进一步地,不含纳米金属微粒和多肽探针分子的聚多巴胺粘结层通过以下方案实现:将多巴胺分子加入到水中,多巴胺分子的质量浓度为1-10g/L,并将步骤二的基材浸入,通过自氧化聚合反应形成聚多巴胺粘结层,反应溶液在pH值为7-9、溶氧饱和度在50%-100%、20-40℃下进行反应。
进一步地,步骤一通过金属镀膜蚀刻或者导电浆丝印工艺在基材上制备电化学传感器的电极,其中,工作电极为碳、石墨烯、金或者铂。
进一步地,步骤二中多肽探针分子包括酶类蛋白质、抗体类蛋白质或其它含有多肽链的聚合分子。
进一步地,步骤二中的多巴胺分子替换为多巴胺的还原或氧化衍生物,还原衍生物包括左旋多巴,氧化衍生物包括二羟吲哚。
进一步地,步骤三中渗透膜溶液通过喷涂或者甩胶机旋涂镀于在聚多巴胺探针层上,渗透膜溶液包括溶于有机溶剂的聚醚胺、聚脲、聚丙二醇、聚环氧乙烷或聚甲基丙烯酸羟乙酯或者上述材料混合物的溶液。
本发明的有益效果:
1、本发明将电极改性,多肽探针分子固化,和添加粘结层等多种目的通过多巴胺氧化多聚反应在同一工序同时实现,极大地简化了制造工艺,降低了制造成本。与多肽交联工艺相比,本发明拥有更好的探针分子活性保存和选择性固化的优点;而与自组装单层膜工艺相比,本发明可实现多层,高密度的探针分子沉积,产生更高的传感器敏感度;与紫外光敏包埋工艺相比,极大地简化了工艺流程,实现了一步生成选择性固化图样,可大幅降低生产成本。
2、本发明采用具氧化剂效果的金属酸作为多巴胺氧化多聚反应的氧化剂,同时实现了金属纳米微粒的生成和沉积,可以在同一反应步骤中高效率地对电极表面改性,增大电极与探针分子的接触面积,有效地提高了传感器的最大可承受电流密度和敏感度。
3、聚多巴胺具有良好的生物相容性,并同时实现了极佳的粘合剂效果,可以与几乎任何类型的表面紧密粘合。因此制作工艺可以省略添加生物相容性粘合剂或者在渗透膜镀膜后做粘结处理的需要,简化了生产工艺和成本。
4、本发明总体工艺流程不会用到极端的化学反应条件,如高温高压,强酸强碱或者有毒有害溶剂气体,可以最大限度的保留探针分子的有效活性和传感器敏感度,而且适合安全批量生产。
综上,本发明提出了一种低成本、高可靠度的生产工艺,从而简单、有效地制造适用于体内环境的多层结构电化学传感器。
附图说明
图1为方案a工艺流程示意图。
图2位方案b工艺流程示意图。
具体实施方式
下面结合实施例和附图对本发明做更进一步地解释。下列实施例仅用于说明本发明,但并不用来限定本发明的实施范围。
一种带有表面固化多肽探针的电化学传感器的制备方法,包括如下步骤:
步骤一、采用常规的电极加工工艺在基材上制备电化学传感器的电极;常规的电极加工工艺包括金属镀膜蚀刻或者导电浆丝印工艺,基材包括无机基材如玻璃,硅晶圆等或者有机基材如聚亚胺,聚二甲基硅氧烷等,,其中,工作电极为碳、石墨烯、金或者铂。
步骤二、利用氧化多巴胺进行交联纳米金属微粒和多肽探针分子,并附到工作电极上,即工作电极上形成聚多巴胺探针层;多肽探针分子包括酶类蛋白质(例如葡萄糖氧化酶,葡萄糖脱氢酶,辣根过氧化物酶等氧化还原酶)、抗体类蛋白质(例如乙肝病毒抗体)或其它含有多肽链的聚合分子。多巴胺分子可替换为多巴胺的还原或氧化衍生物,还原衍生物包括左旋多巴,氧化衍生物包括二羟吲哚。
工作电极上形成聚多巴胺探针层,通过方案a或方案b实现:
方案a如图1所示:将多肽探针分子、多巴胺分子和具氧化剂效果的金属酸加入到水中进行反应,生成表面固化氧化聚多巴胺和多肽探针分子的纳米金属微粒;再将步骤一的基材放入到该混合溶液中,通过电化学氧化反应将所述纳米金属微粒沉积到工作电极表面;其中,反应溶液中多肽探针分子的质量浓度为0.1-10mg/mL;多巴胺分子的质量浓度为1-10g/L;具氧化剂效果的金属酸的质量浓度为0.1-1mg/L;具氧化剂效果的金属酸包括氯铂酸、氯金酸、氯铱酸或其他含有贵金属离子的氧化剂;反应溶液在pH为7-9、溶氧饱和度低于1%、20-40℃的条件下进行反应;电化学氧化反应时工作电极上施加的电压相对于溶液中的银/氯化银参比电极为0-0.8伏。
方案b如图2所示:将纳米金属微粒、多肽探针分子和多巴胺分子加入到水中,并将步骤一的基材浸入,通过电化学氧化反应在工作电极表面生成含有纳米金属微粒和多肽探针分子的聚多巴胺网状结构固化层;其中,反应溶液中纳米金属微粒的大小为1-100纳米,纳米金属微粒的质量浓度为1000-50000ppm;多肽探针分子的质量浓度为0.1-10mg/mL;多巴胺分子的质量浓度为1-10g/L;反应溶液在pH为7-9、溶氧饱和度低于1%、20-40℃、工作电极上施加的电压相对于溶液中的银/氯化银参比电极为0-0.8伏的条件下进行反应。
步骤二将电极改性,多肽探针分子固化,和添加粘结层等多种目的通过多巴胺氧化多聚反应在同一工序同时实现,极大地简化了制造工艺,降低了制造成本。同时,此步骤不需要高温高压,强酸强碱或者有毒有害溶剂气体等极端反应条件,可以最大限度地保留多肽探针分子的活性,而且适合安全批量生产。
步骤三、将渗透膜溶液通过喷涂或者甩胶机旋涂镀于聚多巴胺探针层上并烘干,形成渗透膜层。渗透膜溶液包括溶于有机溶剂的聚醚胺、聚脲、聚丙二醇、聚环氧乙烷或聚甲基丙烯酸羟乙酯或者上述材料混合物的溶液。该步骤是为传感器加装渗透膜,由于聚多巴胺的粘合剂效应,渗透膜可直接与底层的探针分子层紧密结合,不需要添加其它的粘合胶或者共价交联工序。
步骤二和步骤三之间还可包括在聚多巴胺探针层与渗透膜层之间增加一层不含纳米金属微粒和多肽探针分子的聚多巴胺粘结层以增加紧密度。不含纳米金属微粒和多肽探针分子的聚多巴胺粘结层通过以下方案实现:将多巴胺分子加入到水中,多巴胺分子的质量浓度为1-10g/L,并将步骤二的基材浸入,通过自氧化聚合反应形成聚多巴胺粘结层,反应溶液在pH值为7-9、溶氧饱和度在50%-100%、20-40℃下进行反应。
实施例1
一种带有表面固化多肽探针的电化学传感器的制备方法,包括如下步骤:
步骤一、采用金属镀膜蚀刻工艺在玻璃基材上制备电化学传感器的电极,其中,工作电极为铂。
步骤二、将多肽探针分子(葡萄糖氧化酶)、多巴胺分子和氯铂酸加入到水中,多肽探针分子的质量浓度为5mg/mL,多巴胺分子的质量浓度为5g/L,氯铂酸的质量浓度为5mg/L;在pH为8、溶氧饱和度低于1%、30℃的条件下进行反应,生成表面固化氧化聚多巴胺和多肽探针分子的纳米金属微粒;再将步骤一的基材放入到该混合溶液中,通过电化学氧化反应将所述纳米金属微粒沉积到工作电极表面,电化学氧化反应时工作电极上施加的电压相对于溶液中的银/氯化银参比电极为0.4伏。
步骤三、将聚丙二醇的四氢呋喃溶液通过喷涂镀于聚多巴胺探针层上并烘干,形成渗透膜层。
本实施例制备的电化学传感器可用于检测样本溶液中的葡萄糖含量,该电化学传感器制作简便,并且拥有非常高的敏感度和探测极限。
实施例2
一种带有表面固化多肽探针的电化学传感器的制备方法,包括如下步骤:
步骤一、采用导电浆丝印工艺在聚二甲基硅氧烷基材上制备电化学传感器的电极,其中,工作电极为金。
步骤二、将金纳米微粒、多肽探针分子(乙肝病毒抗体)和多巴胺分子加入到水中,金纳米微粒的大小为50纳米左右,金纳米微粒的质量浓度为25000ppm,多肽探针分子的质量浓度为4mg/mL,多巴胺分子的质量浓度为6g/L;并将步骤一的基材浸入,在pH为7、溶氧饱和度低于1%、35℃、工作电极上施加的电压相对于溶液中的银/氯化银参比电极为0.6伏的条件下进行电化学氧化反应,在工作电极表面生成含有纳米金微粒和多肽探针分子的聚多巴胺网状结构固化层。
步骤三、将多巴胺分子加入到水中,多巴胺分子的质量浓度为4g/L,并将步骤二的基材浸入,在pH值为9、溶氧饱和度在80%、40℃下通过自氧化聚合反应形成聚多巴胺粘结层。
步骤四、将聚环氧乙烷的异丁醇溶液通过甩胶机旋涂镀于聚多巴胺探针层上并烘干,形成渗透膜层。
本实施例制备的电化学传感器可用于通过电化学阻抗测量检测血液样本中的乙肝表面抗原的存在,该电化学传感器制作简便,特异性强。
- 还没有人留言评论。精彩留言会获得点赞!