利用亚甲基蓝与G‑四链体的结合进行电化学检测端粒酶活性的方法与流程
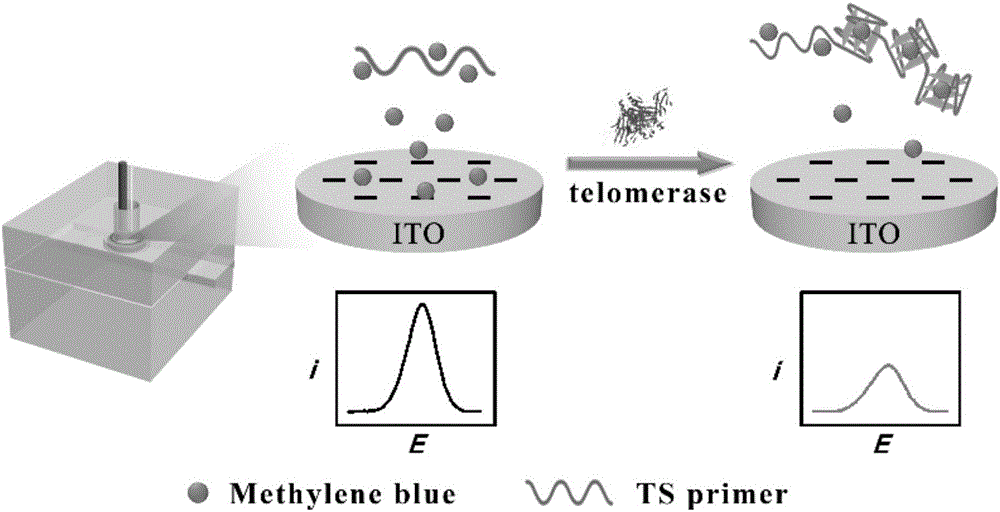
本发明属于生物传感技术领域,具体涉及利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的方法。
背景技术:
近半个世纪以来,肺癌的发病率及死亡率均在逐年增加。世界卫生组织定期公布的资料显示,肺癌的发病率和死亡率在世界各国均呈明显上升的趋势,发达国家更为明显。世界各国都投入大量的人力物力研究肺癌的早期检测和治疗。端粒酶与人类恶性肿瘤之间的紧密联系使它成为目前已知的最为广泛的肿瘤分子标记物之一,端粒酶的检测对癌症的早期发现、发展和预后有重大意义。
端粒酶是合成染色体末端的端粒的酶。端粒(telomere)是真核细胞染色体的天然末端,由上千个6碱基重复序列(TTAGGG)组成,是细胞必需的遗传组分。它的作用是维持端粒有足够的长度,保证基因信息在复制过程中的准确性,以防止染色体末端遗传信息的丢失。在正常情况下,每个细胞分裂周期都会使端粒变的越来越短,当端粒短到一定程度时就会发出信号,细胞停止分裂。端粒酶由RNA和蛋白质亚基组成,是基本的核蛋白逆转录酶,在细胞染色体复制过程中,能够以自身RNA为模板,在染色体3’末端合成重复序列,维持端粒的长度。端粒酶在正常体细胞中的活性被抑制,但是大量的资料表明在一些恶性肿瘤中的表达高达85%。由于端粒酶特异地表达于各种肿瘤细胞,并且是大多数肿瘤细胞持续分裂所必需的。因此,端粒酶活性是诊断多数恶性肿瘤、判断愈后的良好指标。
传统的端粒酶活性检测方法主要有端粒重复序列延伸法、端粒重复序列扩增法(TRAP)、荧光实时定量法(RT-PCR)。此方法系最早建立的方法,稳定性好,特异性高;缺点是需要样品量较大,灵敏性差,检测时间长,不适合临床标本的大量检测,另外在实验中同位素的用量较大,对试验人员的身体有危害。TRAP分析法能够实现高通量高灵敏度的检测,无疑是一个功能强大的测定方法,但保留着PCR放大技术带来的缺点。此外,TRAP法需要使用昂贵的设备和试剂,相当耗时。再加上抑制端粒酶活性已被提议作为人类癌症治疗的潜在方法,而TRAP在筛选有效的端粒酶抑制剂如G-四联体配体时易受PCR派生产物的影响,因此,该方法存在很多局限性。荧光实时定量法(RT-PCR)测定端粒酶催化亚单位(hTERT)mRNA,具有灵敏度高、准确性好的优点,但由于检测手段繁琐,需要精密仪器,成本较高,限制了其在临床上的应用。近年来,为替代传统的TRAP分析法,研究者们已经开发了许多PCR-free分析方法并将之应用到端粒酶活性的检测中,例如光学传感器、表面等离子共振、电致化学发光、电化学检测和指数等温扩增分析等,然而,上述大多数策略因为端粒酶引物的固定化、成本高、灵敏度低和操作复杂等问题在应用时或多或少受到了限制。此外,当前的大多数检测方法都使用细胞提取物来分析端粒酶活性,于临床应用较为不符,而能够实现原位分析和动态监测细胞内端粒酶活性的检测方法则凤毛麟角。端粒酶活性的检测对癌症的早期诊断具有重要的生物学意义,对临床上癌症的预警和治疗这一复杂科学问题的研究起到促进作用。因此,对端粒酶活性分析的简单、灵敏、低成本的原位实时监测和抑制剂筛查技术仍然是当前亟待解决的问题。
技术实现要素:
发明目的:本发明所要解决的技术问题是提供了一种利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的方法。本发明中针对端粒酶作用于端粒酶引物产生G-四链体,G-四链体与亚甲基蓝的结合降低了溶液中自由存在的亚甲基蓝的浓度,通过由此引发的电化学信号的变化测定端粒酶活性,它具有方便快捷、灵敏度高、准确性好、无标记等优点。
技术方案:为了解决上述技术问题,本发明所采用的技术方案为:一种利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的方法,包括以下步骤:
1)细胞的培养以及端粒酶的提取得到裂解后的细胞溶液;
2)在含有端粒酶引物的缓冲溶液中加入裂解后的细胞溶液进行扩增得到重复的富G序列,在钾离子的存在下得到含有G-四链体的扩增溶液;
3)在含有G-四链体的扩增溶液中加入亚甲基蓝使其与G-四链体结合得到溶液;
4)利用差分脉冲伏安法(DPV)对溶液中的亚甲基蓝进行检测。
其中,上述步骤1)的细胞为HeLa细胞。
其中,上述步骤2)的具体步骤如下:在45μL含有0.1~2μM端粒酶引物的端粒酶缓冲溶液中加入5μL裂解后的HeLa细胞,在30~37℃下进行扩增反应1~4小时,并在钾离子的存在下形成G-四链体的扩增溶液。
其中,上述步骤2)的缓冲溶液为含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始浓度为1.5mM,KCl初始浓度为63mM,Tween 20初始浓度为0.005%(v/v),EGTA初始浓度为1mM,dNTPs初始浓度为1~2mM。
其中,上述步骤2)中所述的端粒酶引物序列为5’-AAT CCG TCG AGC AGA GTT-3’,此为端粒酶进行扩增的特异性识别序列。
其中,上述步骤3)的亚甲基蓝的加入量为50μL,浓度为1~10mM。
其中,上述步骤4)的差分脉冲伏安法的步骤是通过三电极体系进行检测,具体步骤如下:首先,将ITO电极依次浸泡在丙酮,乙醇和超纯水中,并分别超声15~20分钟进行清洗;之后,将清洗后的ITO电极浸泡在1mM NaOH中进行修饰;4~6小时后,将完成修饰的ITO电极放入超纯水中超声清洗15~20分钟,得到了表面带有负电荷的ITO工作电极;然后将表面带有负电荷的ITO工作电极放入电解池下半部分的凹槽内,之后,将带有直径为6mm孔的电解池上半部分固定在工作电极上方,在他们之间放入O型密封圈防止漏液,在直径为6mm的孔中加入步骤3)得到的溶液,将一根铂丝作为对电极,银/氯化银电极作为参比电极插入溶液中,与工作电极形成三电极体系并通过DPV法进行电化学检测。
其中,上述HeLa细胞在端粒酶缓冲溶液中的数量为10~10000个细胞。
有益效果:与现有技术相比,本发明具有如下的特色及优点:
1)本发明没有复杂的电极修饰过程,操作简单,避免了因电极修饰而来带的繁琐以及耗时长的缺点。
(2)本发明无需标记DNA,可避免现有技术中对DNA进行标记而导致检测成本高的缺点。
(3)本发明利用端粒酶对其引物的特异性识别进行扩增延伸,可以提高该方法的特异性。
(4)电化学生物传感器具有高灵敏度、高兼容性和成本低廉等优点,降低了实验的检测限。
(5)该方法可用于实际样品的检测,具有一定的临床意义。
附图说明
图1显示了利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的方法的流程图。
图2显示了端粒酶活性检测实验验证图。a:只存在亚甲基蓝时的DPV曲线;b:加入了端粒酶引物并与亚甲基蓝结合产生的DPV曲线;c:端粒酶引物与端粒酶进行扩增并形成G-四链体后与亚甲基蓝结合产生的DPV曲线。
图3显示了定量检测端粒酶活性的DPV曲线。图3A:在不同量的HeLa细胞作用下,得到的DPV曲线(HeLa细胞的个数:(a)0、(b)10、(c)50、(d)100、(e)200、(f)500、(g)1000、(h)2000、(i)5000、(j)10000);图3B:DPV电流峰值降低值与细胞个数的标准曲线图;插图:DPV电流峰值降低值与细胞个数的对数的线性关系。
图4为不同细胞中的端粒酶活性,端粒酶的特异性检测和重复性实验的结果。图4A显示了从不同细胞中(HeLa细胞,加热后的HeLa细胞,A549细胞,MCF-7细胞)提取出的端粒酶的活性;图4B显示了不同的酶(端粒酶,葡萄糖氧化酶,牛血清蛋白,辣根过氧化物酶)与端粒酶引物作用后DPV电流峰值降低值。
具体实施方式
下面通过具体的实施例和附图对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
本实验中用到的试剂和仪器:
HeLa细胞,A549细胞、MCF-7细胞等其他细胞购买于上海复祥生物科技有限公司,ITO电极,端粒酶(telomerase),亚甲基蓝、牛血清蛋白(BSA),葡萄糖氧化酶(GOD),辣根过氧化物酶(HRP),电化学工作站(CHI660)等均为市面上购买。
端粒酶引物序列:5’-AAT CCG TCG AGC AGA GTT-3′
端粒酶引物来自上海生物工程技术服务有限公司合成;
实施例1:
利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的分析方法,检测步骤是:
1)细胞培养和端粒酶提取:HeLa细胞接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺酰氟)中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中,得到裂解后的HeLa细胞,快速冷冻并储存在-80℃的冰箱中;
2)在含有端粒酶引物的缓冲溶液中加入裂解后的HeLa细胞进行扩增得到重复的富G序列,在钾离子的存在下得到含有G-四链体的扩增溶液:在45μL含有2μM端粒酶引物的端粒酶缓冲溶液中加入5μL稀释后的裂解后的HeLa细胞,约100个,在37℃下进行扩增反应2小时,并在钾离子的存在下形成G-四链体的扩增溶液;其中,所述端粒酶缓冲溶液为含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始浓度为1.5mM,KCl初始浓度为63mM,Tween 20初始浓度为0.005%(v/v),EGTA初始浓度为1mM,dNTPs初始浓度为1mM。
3)在含有G-四链体的扩增溶液加入亚甲基蓝使其与G-四链体结合得到溶液:含有G-四链体的扩增溶液中加入亚甲基蓝使其与G-四链体结合:将得到的含有G-四链体的扩增溶液与50μL浓度为4μM的亚甲基蓝混合,使亚甲基蓝与G-四链体进行结合得到溶液。
4)修饰工作电极使其表面带有负电荷:首先,将ITO电极依次浸泡在丙酮,乙醇和超纯水中,并分别超声15分钟进行清洗。之后,将清洗好的ITO电极浸泡在1mM NaOH中进行修饰。4小时后,将完成修饰的ITO电极放入超纯水中超声清洗15分钟,得到了表面带有负电荷的ITO工作电极。
5)所述利用差分脉冲伏安法(DPV)对溶液中的亚甲基蓝进行检测的具体步骤如下:自制一个电解池作为检测元件。将表面带有负电荷的ITO工作电极放入电解池下半部分的凹槽内,之后,将带有直径为6mm孔的电解池上半部分固定在ITO工作电极上方,在他们之间放入O型密封圈防止漏液。在直径为6mm的孔中加入扩增后的溶液,将一根铂丝作为对电极,银/氯化银电极作为参比电极插入溶液中,与ITO工作电极形成三电极体系并通过DPV法进行电化学检测。设置参数:扫描电压-0.5~0V,脉冲高度0.05V,脉冲宽度0.05s,脉冲增量0.004V,脉冲周期0.5s。检测结束后,得到了图3A中的d曲线。
实施例2
利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的分析方法,检测步骤是:
1)细胞培养和端粒酶提取:HeLa细胞接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA,0.5%(w/v)CHAPS,10%(v/v)glycerol,0.1mM PMSF)中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中,得到裂解后的HeLa细胞,快速冷冻并储存在-80℃的冰箱中;
2)在含有端粒酶引物的缓冲溶液中加入裂解后的HeLa细胞进行扩增得到重复的富G序列,在钾离子的存在下得到含有G-四链体的扩增溶液:在45μL含有2μM端粒酶引物的端粒酶缓冲溶液中加入5μL稀释后的裂解后的HeLa细胞,约1000个,在30℃下进行扩增反应2小时,并在钾离子的存在下形成G-四链体。其中,所述端粒酶缓冲溶液为含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始浓度为1.5mM,KCl初始浓度为63mM,Tween 20初始浓度为0.005%(v/v),EGTA初始浓度为1mM,dNTPs初始浓度为1mM。
3)在扩增后的溶液中加入亚甲基蓝使其与G-四链体结合:将得到的扩增后的溶液与50μL浓度为4μM的亚甲基蓝混合,使亚甲基蓝与G-四链体进行结合。
4)修饰工作电极使其表面带有负电荷:首先,将ITO电极依次浸泡在丙酮,乙醇和超纯水中,并分别超声20分钟进行清洗。之后,将清洗好的ITO电极浸泡在1mM NaOH中进行修饰。6小时后,将完成修饰的ITO电极放入超纯水中超声清洗20分钟,得到了表面带有负电荷的ITO工作电极。
5)利用差分脉冲伏安法(DPV)对溶液中的亚甲基蓝进行检测的具体步骤如下:自制一个电解池作为检测元件。将表面带有负电荷的ITO工作电极放入电解池下半部分的凹槽内,之后,将带有直径为6mm孔的电解池上半部分固定在ITO工作电极上方,在他们之间放入O型密封圈防止漏液。在直径为6mm的孔中加入扩增后的溶液,将一根铂丝作为对电极,银/氯化银电极作为参比电极插入溶液中,与ITO工作电极形成三电极体系并通过DPV法进行电化学检测。设置参数:扫描电压-0.5~0V,脉冲高度0.05V,脉冲宽度0.05s,脉冲增量0.004V,脉冲周期0.5s。检测结束后,得到了图3A中的g曲线。
实施例3
利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的分析方法,检测步骤是:
1)细胞培养和端粒酶提取:HeLa细胞接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA,0.5%(w/v)CHAPS,10%(v/v)glycerol,0.1mM PMSF)中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中,得到裂解后的HeLa细胞,快速冷冻并储存在-80℃的冰箱中;
2)在含有端粒酶引物的缓冲溶液中加入裂解后的HeLa细胞进行扩增得到重复的富G序列,在钾离子的存在下得到含有G-四链体的扩增溶液:在45μL含有2μM端粒酶引物的端粒酶缓冲溶液中加入5μL稀释后的裂解后的HeLa细胞,约5000个,在37℃下进行扩增反应2小时,并在钾离子的存在下形成G-四链体。其中,所述端粒酶缓冲溶液为含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始浓度为1.5mM,KCl初始浓度为63mM,Tween 20初始浓度为0.005%(v/v),EGTA初始浓度为1mM,dNTPs初始浓度为1mM。
3)在扩增后的溶液中加入亚甲基蓝使其与G-四链体结合:将得到的扩增后的溶液与50μL浓度为4μM的亚甲基蓝混合,使亚甲基蓝与G-四链体进行结合。
4)修饰工作电极使其表面带有负电荷:首先,将ITO电极依次浸泡在丙酮,乙醇和超纯水中,并分别超声17分钟进行清洗。之后,将清洗好的ITO电极浸泡在1mM NaOH中进行修饰。5小时后,将完成修饰的ITO电极放入超纯水中超声清洗17分钟,得到了表面带有负电荷的ITO工作电极。
5)所述利用差分脉冲伏安法(DPV)对溶液中的亚甲基蓝进行检测的具体步骤如下:自制一个电解池作为检测元件。将表面带有负电荷的ITO工作电极放入电解池下半部分的凹槽内,之后,将带有直径为6mm孔的电解池上半部分固定在ITO工作电极上方,在他们之间放入O型密封圈防止漏液。在直径为6mm的孔中加入扩增后的溶液,将一根铂丝作为对电极,银/氯化银电极作为参比电极插入溶液中,与ITO工作电极形成三电极体系并通过DPV法进行电化学检测。设置参数:扫描电压-0.5~0V,脉冲高度0.05V,脉冲宽度0.05s,脉冲增量0.004V,脉冲周期0.5s。检测结束后,得到了图3A中的i曲线。
将DPV电流峰值降低值定义为-Δip,则最终得到了DPV电流峰值降低值与细胞个数的对数之间的线性关系,即-Δip=0.1276-0.0517log N。线性范围为10~10000个细胞,相关系数为0.9904。计算得到最低检测限为3个细胞。
实施例4:
利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的分析方法,检测步骤是:
1)细胞培养和端粒酶提取:HeLa细胞,A549细胞,和MCF-7细胞分别接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺酰氟)中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中,分别得到各自裂解后的细胞,快速冷冻并储存在-80℃的冰箱中;
2)在含有端粒酶引物的缓冲溶液中加入裂解后的细胞进行扩增得到重复的富G序列,在钾离子的存在下得到含有G-四链体的扩增溶液:在45μL含有2μM端粒酶引物的端粒酶缓冲溶液中分别加入5μL稀释后的裂解后的细胞,加热失活后的HeLa细胞,A549细胞,MCF-7细胞,约1000个,在37℃下进行扩增反应2小时,并在钾离子的存在下形成G-四链体的扩增溶液;其中,所述端粒酶缓冲溶液为含有MgCl2、KCl、Tween20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始浓度为1.5mM,KCl初始浓度为63mM,Tween 20初始浓度为0.005%(v/v),EGTA初始浓度为1mM,dNTPs初始浓度为1mM。
3)在含有G-四链体的扩增溶液加入亚甲基蓝使其与G-四链体结合得到溶液:含有G-四链体的扩增溶液中加入亚甲基蓝使其与G-四链体结合:将得到的含有G-四链体的扩增溶液与50μL浓度为4μM的亚甲基蓝混合,使亚甲基蓝与G-四链体进行结合得到溶液。
4)修饰工作电极使其表面带有负电荷:首先,将ITO电极依次浸泡在丙酮,乙醇和超纯水中,并分别超声15分钟进行清洗。之后,将清洗好的ITO电极浸泡在1mM NaOH中进行修饰。4小时后,将完成修饰的ITO电极放入超纯水中超声清洗15分钟,得到了表面带有负电荷的ITO工作电极。
5)所述利用差分脉冲伏安法(DPV)对溶液中的亚甲基蓝进行检测的具体步骤如下:自制一个电解池作为检测元件。将表面带有负电荷的ITO工作电极放入电解池下半部分的凹槽内,之后,将带有直径为6mm孔的电解池上半部分固定在ITO工作电极上方,在他们之间放入O型密封圈防止漏液。在直径为6mm的孔中加入扩增后的溶液,将一根铂丝作为对电极,银/氯化银电极作为参比电极插入溶液中,与ITO工作电极形成三电极体系并通过DPV法进行电化学检测。设置参数:扫描电压-0.5~0V,脉冲高度0.05V,脉冲宽度0.05s,脉冲增量0.004V,脉冲周期0.5s。检测结束后,得到了图4A。
从图中可以看出,利用A549和HeLa细胞检测出的电流变化较大,这说明A549和HeLa细胞中的端粒酶活性较高,MCF-7中的端粒酶活性与这两种细胞中的端粒酶活性相比偏低,而加热的HeLa细胞由于加热导致酶失活,电流信号的降低非常微弱。
实施例5:
利用亚甲基蓝与G-四链体的结合进行电化学检测端粒酶活性的分析方法,检测步骤是:
1)细胞培养和端粒酶提取:HeLa细胞,A549细胞,和MCF-7细胞分别接种在含有10%胎牛血清,青霉素和链霉素的DMEM培养基中,并在5%CO2,37℃培养箱中培养。所有细胞都是收集于指数生长时期。将100万个细胞分装于1.5mL的EP管中,用冰冷的磷酸盐缓冲溶液(pH=7.4)洗涤两次,并重新分散在200μL冰冷的CHAPS裂解缓冲液(10mM Tris-HCl,pH 7.5,1mM MgCl2,1mM EGTA(乙二醇双(2-氨基乙基醚)四乙酸),0.5%(w/v)CHAPS(3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐),10%(v/v)glycerol(甘油),0.1mM PMSF(苯甲基磺酰氟)中。将细胞在冰上孵育30分钟,然后在4℃,12000rpm的转速下离心20分钟。离心后将澄清的裂解液小心地转移到新的EP管中,分别得到裂解后的细胞,快速冷冻并储存在-80℃的冰箱中;
2)在含有端粒酶引物的缓冲溶液中加入裂解后的HeLa细胞进行扩增得到重复的富G序列,在钾离子的存在下得到含有G-四链体的扩增溶液:在45μL含有2μM端粒酶引物的端粒酶缓冲溶液中分别加入5μL稀释后的裂解后的HeLa细胞,约1000个,5μL GOD,5μL BSA,和5μL HRP,约100μg,在37℃下进行扩增反应2小时,并在钾离子的存在下形成G-四链体的扩增溶液;其中,所述端粒酶缓冲溶液为含有MgCl2、KCl、Tween 20、EGTA和dNTPs的pH=8.3的20mM Tris-HCl溶液,所述MgCl2初始浓度为1.5mM,KCl初始浓度为63mM,Tween 20初始浓度为0.005%(v/v),EGTA初始浓度为1mM,dNTPs初始浓度为1mM。
3)在含有G-四链体的扩增溶液加入亚甲基蓝使其与G-四链体结合得到溶液:含有G-四链体的扩增溶液中加入亚甲基蓝使其与G-四链体结合:将得到的含有G-四链体的扩增溶液与50μL浓度为4μM的亚甲基蓝混合,使亚甲基蓝与G-四链体进行结合得到溶液。
4)修饰工作电极使其表面带有负电荷:首先,将ITO电极依次浸泡在丙酮,乙醇和超纯水中,并分别超声15分钟进行清洗。之后,将清洗好的ITO电极浸泡在1mM NaOH中进行修饰。4小时后,将完成修饰的ITO电极放入超纯水中超声清洗15分钟,得到了表面带有负电荷的ITO工作电极。
5)所述利用差分脉冲伏安法(DPV)对溶液中的亚甲基蓝进行检测的具体步骤如下:自制一个电解池作为检测元件。将表面带有负电荷的ITO工作电极放入电解池下半部分的凹槽内,之后,将带有直径为6mm孔的电解池上半部分固定在ITO工作电极上方,在他们之间放入O型密封圈防止漏液。在直径为6mm的孔中加入扩增后的溶液,将一根铂丝作为对电极,银/氯化银电极作为参比电极插入溶液中,与ITO工作电极形成三电极体系并通过DPV法进行电化学检测。设置参数:扫描电压-0.5~0V,脉冲高度0.05V,脉冲宽度0.05s,脉冲增量0.004V,脉冲周期0.5s。检测结束后,得到了图4B。
从图4B中可以看出,只有加入了HeLa细胞后电流才有了明显的降低,而加入葡萄糖氧化酶,牛血清蛋白,和辣根过氧化物酶的样品,由于其中没有端粒酶的存在而导致电流的降低非常微弱。由此说明,该检测方法具有较好的特异性。
与目前现有检测方法相比,该方法的检测限具有明显优势。例如,武汉轻工大学生物与制药工程学院利用有限延伸法检测端粒酶活性的方案,检测限达到250个细胞;河北大学化学与环境科学学院基于杂交链式反应信号放大和磁分离技术进行荧光检测端粒酶活性的方法,检测限为1×105个细胞;河北大学化学与环境科学学院基于恒温指数扩增反应高灵敏度检测端粒酶活性的方法,检测限为50个细胞。
上述仅为本发明优选的实施例,并不限制于本发明。对于所属领域的技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。这里无需也无法对所有的实施例来举例说明。而由此方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种活性炭基无机‑有机复合型材料的制备方法及用途与流程
- 一种腐蚀产物中氧化亚铁的测定方法与制造工艺
- 利用亚甲基蓝与G‑四链体的结合进行电化学检测端粒酶活性的方法与制造工艺
- 一种煤基复合染料的制造方法与工艺
- 一种聚吡咯功能化的钴配合物复合材料的合成方法及其应用与制造工艺
- 一种催化降解有机染料的钨氧簇化合物的制备方法及应用与制造工艺
- 一种Ag@CdSe/Al2TiO5复合光催化剂的制备方法及其用途与制造工艺
- 一种可调控亚甲基蓝单体释放速度的羟基磷灰石/单宁酸复合颗粒的制备方法与制造工艺
- 基于聚腺嘌呤‑亚甲基蓝电化学传感器检测铜离子的方法与制造工艺
- 一种利用紫外‑可见分光光度法同时测定溶液中亚甲基蓝和二价铜离子的三波长光谱方法与制造工艺