用于检测HBs抗原的样品的预处理方法及其利用与流程
【
技术领域:
】本发明涉及用于检测作为B型肝炎病毒的表面抗原的HBs抗原的样品的预处理方法及利用该方法的HBs抗原的检测方法。另外,本发明涉及用于检测HBs抗原的预处理用试剂盒。
背景技术:
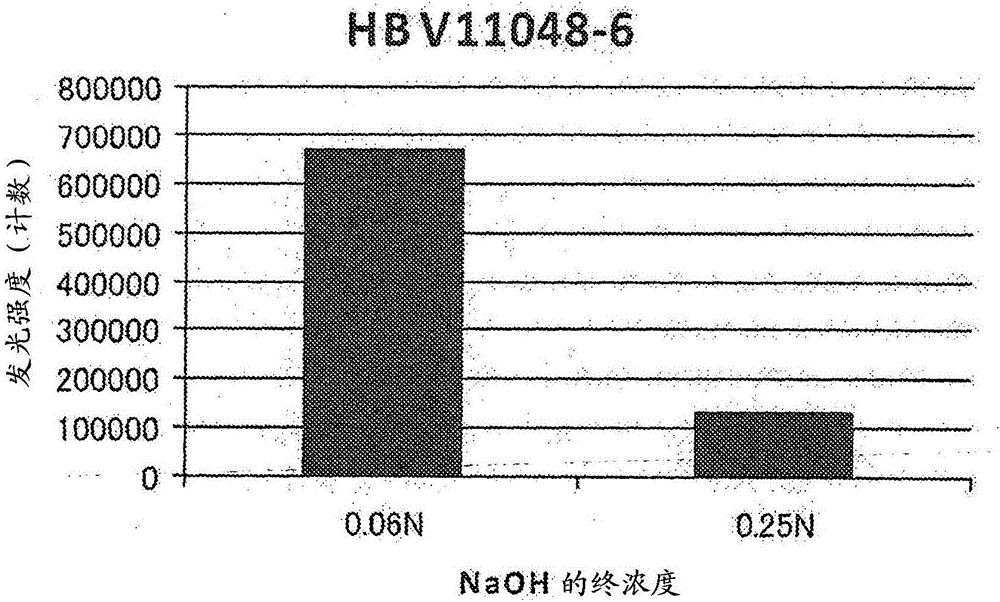
:B型肝炎是由B型肝炎病毒(HBV)引起的肝脏的疾病。HBV是主要由包膜部分及核心部分构成的球状的病毒。在包膜部分存在HBs抗原,在核心部分存在基因组DNA、HBc抗原及HBe抗原等。被HBV感染,则HBs抗原被释放到宿主的血液中,其量伴随肝炎的进行而增加。所以,在B型肝炎的检查中,首先测定血液中的HBs抗原。检查的结果,当是HBs抗原阳性时,显示受试者被HBV感染。相反,当是HBs抗原阴性时,显示受试者未被HBV感染。另一方面,B型肝炎发症后,在宿主的体内产生作为HBs抗原的中和抗体的HBs抗体。通过本B型肝炎的检查中也测定HBs抗体,可研究受试者的过去的感染的有无。在临床上,当是HBs抗原阴性并且HBs抗体阳性时,被认为B型肝炎被治愈。但是,根据最近的研究得知,B型肝炎即使被治愈,HBV的基因之一部分残留在肝脏或末梢单核细胞。于是,近年知,对于过去曾被HBV感染的恶性肿瘤患者或类风湿患者使用治疗用免疫抑制剂时,HBV再活化而引起重症肝炎。那样的肝炎被称为“新生B型肝炎”,与通常的B型肝炎比,显示剧症化的频度及死亡率高。在这样的新生B型肝炎的剧症化的预防中,认为发症的初期开始治疗是有效的。为此,在其初期阶段发现病毒的再活化变得重要。但是,在再活化的初期阶段,认为不仅HBV的病毒量尚是微量,也存在患者来源的HBs抗体。患者来源的HBs抗体与HBs抗原结合而是妨碍该抗原的检测的要因,所以为了HBV的再活化的早期发现,需要非常高的灵敏度的检查。作为HBV的检测灵敏度高的检查,已知利用PCR法的检查。在此检查中,通过将HBV的DNA用PCR法扩增来检测HBV。但是,一般而言,此检查多是将待测样品送到可实施该检查的机关而进行,所以至得到检查结果需要时间。另外,检查所耗的成本也高。另一方面,由免疫学方法的HBs抗原的检查与由PCR法的检查比,至得到检查结果的时间短,另外成本也低。作为由那样的免疫学方法的HBs抗原的检测方法,例如,在专利文献1中记载了通过使用碱剂或表面活性剂等的变性剂预处理样品,使患者来源的HBs抗体变性之后,使用检测用的指定的抗HBs抗体检测HBs抗原的方法。【现有技术文献】【专利文献】专利文献1:国际公开第2006/033368号技术实现要素:【发明要解决的技术课题】在由免疫学方法检测样品中的HBs抗原的方法中,受试者来源的HBs抗体成为HBs抗原的检测的妨碍,所以有将其预先灭活的必要。例如,在专利文献1中记载的方法中记载,为了使患者来源的HBs抗体变性,作为处理时的浓度,以0.25~1N的氢氧化钠有效果。另一方面,氢氧化钠也作用于HBs抗原而使变性,所以有该抗原的抗原性丧失,HBs抗原的检测灵敏度降低的情况。如HBV的再活化的初期阶段一样,当不仅HBs抗原是微量,不得不从被认为也存在受试者来源的HBs抗体的样品检测该抗原时,需求可不实质上损害HBs抗原的抗原性,使受试者来源的HBs抗体变性而灭活,并且以高的灵敏度的HBs抗原的检测的方法。本发明,鉴于这样的情况,以提供可不实质上损害HBs抗原的抗原性,使受试者来源的HBs抗体变性灭活,并且以高的灵敏度的HBs抗原的检测的样品的预处理方法及HBs抗原的检测方法作为目的。另外,本发明以提供可在那样的方法中适宜地使用的样品的预处理用试剂盒作为目的。【解决课题的技术方案】本发明人令人惊讶地发现,通过将含HBs抗原和受试者来源的HBs抗体的样品用终浓度0.012~0.15N的极其低的浓度的碱性物质处理,可不实质上受受试者来源的HBs抗体的影响,以高灵敏度检测HBs抗原,从而完成本发明。即,本发明提供用于检测HBs抗原的样品的预处理方法,其包括:通过将疑似含HBs抗原的样品和含有碱性物质的预处理液混合至该碱性物质的终浓度成0.012~0.15N而处理该样品的工序,将处理工序中得到的样品用含有酸性物质的试剂中和的工序。另外,本发明提供HBs抗原的检测方法,其包括:通过将疑似含HBs抗原的样品和含有碱性物质的预处理液混合至该碱性物质的终浓度成0.012~0.15N而处理该样品的工序,将处理工序中得到的样品用含有酸性物质的试剂中和的工序,向中和工序中得到的样品添加与HBs抗原结合的标记抗体、载体粒子、以及与HBs抗原及该载体粒子结合的第1抗体,使在上述的载体粒子上形成含HBs抗原、该标记抗体及该第1抗体的复合物的工序,选择性地回收形成工序中得到的样品中的载体粒子的工序,使回收工序中得到的载体粒子上的复合物游离,转移到与该载体粒子不同的固相的工序,测定转移工序中得到的固相上的复合物中含的标记抗体的标记的工序,基于测定工序的结果,检测疑似含上述的HBs抗原的样品中的HBs抗原的工序。再者,本发明提供用于检测HBs抗原的预处理用试剂盒,其含:含有碱性物质的第1试剂,和含有对于中和碱性物质而言充分的量的酸性物质的第2试剂。【发明效果】上述的本发明的样品的预处理方法及利用该方法的本发明的HBs抗原的检测方法可不使样品中含的检测对象的HBs抗原实质上变性而灭活妨碍HBs抗原的检测的HBs抗体。从而,由这些本发明的方法,即使HBs抗原是微量,且是也存在受试者来源的HBs抗体的样品,也可以良好的灵敏度检测HBs抗原。另外,本发明的样品的预处理用试剂盒可在那样的方法中适宜地使用。【附图说明】【图1】是显示将HBV阳性患者的血清(HBV6290-6)在碱性物质的存在下预处理,将该血清中的HBs抗原使用标记抗体检测时的结果(发光强度)的坐标图。【图2】是显示将HBV阳性患者的血清(HBV11048-6)在碱性物质的存在下预处理,将该血清中的HBs抗原使用标记抗体检测时的结果(发光强度)的坐标图。【图3】是显示将HBV阳性患者的血清(HBV6272-6)在碱性物质的存在下预处理,将该血清中的HBs抗原使用标记抗体检测时的结果(发光强度)的坐标图。【实施方式】在本说明书中,“预处理”是指,在将疑似含HBs抗原的样品供于该抗原的检测方法前,将该样品处理成对于检测适宜的状态。另外,本发明的样品的预处理方法,例如,可将以下说明的“处理工序”和“中和工序”用手动方法进行,或者也可将“处理工序”用手动方法进行,将“中和工序”用装置进行。在本发明的样品的预处理方法(以下也称为“预处理方法”)中,首先,通过将疑似含HBs抗原的样品和含有碱性物质的预处理液混合至该碱性物质的终浓度成0.012~0.15N而进行处理该样品的工序(以下也称为“处理工序”)。在此处理工序中,由预处理液中含的碱性物质的作用,样品中的HBs抗体被变性而灭活。再有,处理工序中的碱性物质的终浓度只要在上述的范围内,就不特别限定,例如,可举出0.012、0.013、0.014、0.015、0.016、0.017、0.018、0.019、0.020、0.030、0.040、0.050、0.060、0.070、0.080、0.090、0.10、0.11、0.12、0.13、0.14及0.15N。疑似含HBs抗原的样品只要是活体样品或自该活体样品制备的样品,就不特别限定。作为那样的活体样品,可举出组织、细胞、体液、分泌物及排泄物等。具体而言,可举出全血、血浆、血清、淋巴液、骨髓液、胆汁、胃肠分泌物、精液、唾液、母乳、尿、粪便等。另外,作为自活体样品制备的样品,可举出该活体样品的稀释液、悬浮液、提取液、匀浆物。例如,可举出组织或细胞的提取液、或者组织或细胞的匀浆物。在本发明的实施方式中,预处理液中的碱性物质优选为现有技术中公知的强碱。那样的强碱可从碱金属及碱土金属的氢氧化物、氢化物及酰胺化物选择至少1种。在它们之中,特别优选为氢氧化钠、氢氧化钾及氢氧化镁。预处理液中的碱性物质的浓度只要是在混合该预处理液和疑似含上述的HBs抗原的样品时,可使该碱性物质的终浓度成0.012~0.15N的浓度,就不特别限定。从而,当样品是液体时,预处理液中的碱性物质的浓度可根据该样品和预处理液的混合比(体积比)适宜设定。例如,当将样品和预处理液以体积比表示1:1混合时,该预处理液中的碱性物质的浓度设为0.024~0.3N即可。在本发明的实施方式中,处于液体的形态的样品和预处理液的混合比不特别限定,但优选为,以体积比表示1:1~1:0.5。在本发明的实施方式中,为了由碱性物质的作用除去灭活的HBs抗体及/或其他夹杂物,上述的预处理液优选为再含非离子性表面活性剂。那样的非离子性表面活性剂不特别限定,但优选为选自公知的聚氧乙烯系非离子性表面活性剂。作为聚氧乙烯系非离子性表面活性剂,例如,可举出聚氧乙烯烷基醚(Brij(注册商标)35、Brij(注册商标)45等)、聚氧乙烯烷基苯基醚(Triton(注册商标)X-100、Triton(注册商标)X-114、NP-40(注册商标)等)、聚氧乙烯山梨坦脂肪酸酯(Tween(注册商标)-20、Tween(注册商标)-80等)等,可使用它们之中的至少1种。在它们之中,也特别优选为聚氧乙烯烷基醚。预处理液中的非离子性表面活性剂的浓度不特别限定,但优选为是混合该预处理液和样品时HBs抗原不实质上变性的浓度。例如,当预处理液含Brij(注册商标)35时,其浓度只要是,混合该预处理液和样品时,Brij(注册商标)35的终浓度可成0.05~0.5%的浓度即可。在本发明的实施方式中,为了由碱性物质的作用除去灭活的HBs抗体及/或其他夹杂物,上述的预处理液优选为再含离液剂。其中,离液剂是指有不稳定化蛋白质的分子结构的作用的物质。那样的离液剂不特别限定,例如,可举出尿素、胍盐酸盐、水杨酸钠、硫代氰酸钠、过氯酸钠、乙酰胺、甲酰胺等,可使用它们之中的至少1种。在它们之中,也特别优选为尿素。预处理液中的离液剂的浓度不特别限定,但优选为是混合该预处理液和样品时HBs抗原不实质上变性的浓度。例如,当预处理液含尿素时,其浓度只要是,混合该预处理液和样品时,尿素的终浓度可成0.05~1M的浓度即可。在本发明的实施方式中,上述工序中的处理温度及处理时间可根据预处理液的组成、样品的种类、预处理液和样品的混合量等的条件适宜设定。通常而言,混合预处理液和样品的后,只要混合物在15~25℃的温度下静置5~10分钟即可。在本发明的预处理方法中,进行将上述的处理工序中得到的样品用含有酸性物质的试剂中和的工序(以下也称为“中和工序”)。在此中和工序中,优选将上述的处理工序中得到的样品和含有酸性物质的试剂混合至中和后的样品的pH成6.5~8。在本发明的实施方式中,中和工序中使用的试剂中的酸性物质的种类不特别限定。作为那样的酸性物质,例如,可举出柠檬酸、醋酸、乳酸、苹果酸、琥珀酸、磷酸、蚁酸、富马酸、酒石酸、盐酸及硫酸等,可使用它们之中的至少1种。在它们之中,也特别优选为柠檬酸。在本发明的实施方式中,试剂中的酸性物质的浓度只要是在混合上述的处理工序中得到的样品和含有酸性物质的试剂时,使得到的样品的pH成6.5~8的浓度,就不特别限定。那样的浓度可根据该酸性物质的种类、处理工序中得到的样品的量等适宜决定。例如,作为酸性物质使用柠檬酸时,试剂中的柠檬酸浓度优选为0.03~0.16M。在本发明的实施方式中,中和工序中的处理温度及处理时间不特别限定,但通常是,将上述的处理工序中得到的样品和含有酸性物质的试剂混合后,将混合物在15~25℃的温度下静置1~10分钟即可。在本发明的实施方式中,将预处理方法在后述的HBs抗原的检测方法中利用时,上述的预处理液、或者含有酸性物质的试剂,优选再含还原剂。由此,还原剂的存在可在后述的回收工序中抑制载体粒子的凝集。那样的还原剂优选为有使蛋白质的二硫键解离的作用的还原剂。例如,可举出巯基乙基胺、巯基乙醇、二硫代苏糖醇、半胱氨酸、二硫代赤藓糖醇、硼氢化钠、膦等。在它们之中,特别优选为巯基乙基胺、二硫代苏糖醇及半胱氨酸盐酸盐。在本发明的实施方式中,预处理液、或者含有酸性物质的试剂中的还原剂的浓度只要是不给后述的形成工序带来影响的浓度,就不特别限定。例如,使用巯基乙基胺时,其浓度优选为10~60mM。在本发明的实施方式中,将预处理方法在后述的HBs抗原的检测方法中利用时,上述的预处理液、或者含有酸性物质的试剂优选再含无机盐类。由此,无机盐类的存在,可在后述的回收工序中抑制载体粒子的凝集。作为那样的无机盐类,例如,可举出氯化钠、氯化钾、氯化镁、硫酸钠等。在它们之中,也特别优选为氯化钠、氯化钾及硫酸钠。在本发明的实施方式中,预处理液、或者含有酸性物质的试剂中的无机盐类的浓度只要是不给后述的形成工序带来影响的浓度,就不特别限定。例如,使用氯化钠时,其浓度优选为0.1~1M。在本发明的范围内,也包括利用上述的本发明的预处理方法的HBs抗原的检测方法。作为HBs抗原的检测方法,只要是公知的免疫测定法,就不特别限定。在本发明的检测方法中,以下说明的含“转移工序”的免疫复合物转移测定法在使用本发明的预处理方法以高灵敏度检测HBs抗原的方面特别优选的。接下来,对于本发明的HBs抗原的检测方法(以下也称为“检测方法”)进行说明。在本发明的检测方法中,使用将疑似含HBs抗原的样品由本发明的预处理方法处理而得到的样品,经后述的各工序检测HBs抗原。从而,本发明的检测方法中的疑似含HBs抗原的样品的预处理工序、及其随后的中和工序的具体性的顺序等与对本发明的预处理方法的说明中所述的同样。继上述的2个工序之后,在本发明的检测方法中,向中和工序中得到的样品添加与HBs抗原结合的标记抗体、载体粒子、以及与HBs抗原及该载体粒子结合的第1抗体,进行使含HBs抗原、该标记抗体及该第1抗体的复合物在上述的载体粒子上形成的工序(以下也称为“形成工序”)。在本发明的实施方式中,与HBs抗原结合的标记抗体(以下也简称为“标记抗体”)只要是可与HBs抗原特异性地结合、并且用在免疫学方法中惯用的公知的标记物质标记的抗体,就不特别限定。那样的标记抗体可由使用适当的交联剂或市售的标记试剂盒等的公知的方法,通过使抗HBs抗体和标记物质结合或连结来制作。再有,标记的抗体也可为Fab、F(ab')2等的抗原结合性抗体片段或其衍生物。在本发明的实施方式中,标记物质只要是可发可检测或测定的信号的物质,就不特别限定,例如,可举出酶、荧光物质、放射性同位元素等。作为酶,可举出碱性磷酸酶、过氧化物酶、葡萄糖氧化酶、酪氨酸酶、酸性磷酸酶、萤光素酶等。作为荧光物质,可举出异硫氰酸荧光素(FITC)等的荧光染料、绿色荧光蛋白质(GFP)等的荧光蛋白质等。作为放射性同位元素,可举出125I、14C、32P等。在它们之中,作为标记物质特别优选为酶。在本发明的实施方式中,载体粒子可选自在免疫学方法中惯用的公知的粒子。作为那样的载体粒子,例如,可举出磁性粒子、乳胶粒子、红细胞、明胶粒子等。在它们之中,特别优选为磁性粒子。其中,磁性粒子是指将有磁性的材料作为基材含有的粒子。这样的磁性粒子是现有技术中公知的,作为基材,可举出含Fe2O3及/或Fe3O4、钴、镍、千枚岩、磁铁矿等的粒子。在本发明的实施方式中,与HBs抗原及载体粒子结合的第1抗体(以下简称为“第1抗体”)只要是和与上述的标记抗体所结合的HBs抗原的表位不同的表位由抗原抗体反应特异性地结合,并且可上述的与载体粒子结合的抗体,就不特别限定。其中,该第1抗体和载体粒子的结合样式只要是可解离的结合,就不特别限定,例如,可举出物理吸附、离子键等。另外,也可使用介于第1抗体和载体粒子之间的物质,使两者结合。作为那样的物质,优选为互相特异性地结合,并且可解离的2个物质的组合(为方便起见、将2个物质各自称为“物质A”及“物质B”)。例如,通过使物质A作为“与载体粒子的结合部位”与第1抗体结合,使物质B与载体粒子结合,利用物质A和物质B的亲和性,可使第1抗体和载体粒子结合。那样的物质A及物质B的组合是现有技术中公知的,例如,可举出抗原(除HBs抗原之外)及其抗体、配体及其受体、寡核苷酸及其互补链、生物素(或者脱硫生物素)和亲和素(或者链霉亲和素)、镍和组氨酸标签、谷胱甘肽和谷胱甘肽-S-转移酶等的组合。再有,作为抗原和其抗体的组合,优选为半抗原和抗半抗原抗体、及生物素(或者脱硫生物素)和抗生物素抗体(另外抗脱硫生物素抗体)。另外,作为半抗原和抗半抗原抗体的组合,特别优选为2,4-二硝基苯酚(DNP)和抗DNP抗体。在本发明的实施方式中,上述的物质A及物质B之中,使任一方与第1抗体或载体粒子结合不特别限定,但使用抗原和其抗体的组合时,优选使该抗原与第1抗体结合,使针对该抗原的抗体与载体粒子结合。再有,使上述的物质与抗体及载体粒子结合的方法是现有技术中公知的。例如,使抗体和生物素结合时,已知使用与该抗体中的氨基或巯基反应的交联剂(例如,马来酰亚胺、N-羟基琥珀酰亚胺等)的方法。另外,作为使上述的物质和载体粒子结合的方法,已知物理吸附法、共价键法、离子键法等。在本发明的优选的实施方式中,作为载体粒子,通过使用固定与第1抗体结合的第2抗体的载体粒子,经第2抗体使第1抗体和载体粒子结合。其中,第1抗体和第2抗体的结合样式优选为是可解离的结合。例如,优选为使用固定使半抗原(例如DNP等)或生物素(或者脱硫生物素)结合的第1抗体和与该半抗原或生物素(或者脱硫生物素)特异性地结合的第2抗体的载体粒子。此时,将与半抗原或生物素(或者脱硫生物素)特异性地结合的抗体作为与第1抗体结合的第2抗体使用。在特别优选的实施方式中,使用固定使DNP结合的第1抗体和抗DNP抗体的载体粒子。在此形成工序中,HBs抗原和上述的标记抗体由抗原抗体反应结合,上述的第1抗体由抗原抗体反应再与之结合,从而形成含“标记抗体-HBs抗原-第1抗体”的复合物。于是,通过该复合物中含的第1抗体和载体粒子结合,在该载体粒子上形成含“标记抗体-HBs抗原-第1抗体”的复合物。在本发明的优选的实施方式中,作为载体粒子,通过使用固定与第1抗体结合的第2抗体的载体粒子,在该载体粒子上形成含“标记抗体-HBs抗原-第1抗体-第2抗体”的复合物。在本发明的实施方式中,标记抗体、载体粒子及第1抗体的添加量不特别限定,可根据样品的量等适宜确定。另外,可将标记抗体、第1抗体及载体粒子以各自顺序添加到样品,也可同时添加全部。其中,将标记抗体、第1抗体及载体粒子以各自顺序添加到样品时,可将标记抗体及第1抗体之任何先添加,但优选将载体粒子在这些抗体之后添加。或者,第1抗体和载体粒子也可在进行形成工序之前预先结合。在本发明的实施方式中,形成工序中的反应温度及反应时间不特别限定,但通常在20~45℃的温度下静置15~30分钟,或者温和搅拌即可。再有,将标记抗体、第1抗体及载体粒子以各自顺序添加到样品时,也可在每次添加各剂时设定反应时间。在本发明的检测方法中,进行选择性地回收上述的形成工序中得到的样品中的载体粒子的工序(以下也称为“回收工序”)。在该样品中,使上述的复合物形成的载体粒子之外,还存在预处理液的构成成分、剩余的标记抗体及第1抗体等的夹杂物,但在此回收工序中,该载体粒子从那样的夹杂物分离而被回收。从而,由此回收工序,可除去给后述的测定工序带来恶影响的夹杂物。选择性地回收样品中的载体粒子的方法本身是现有技术中公知的,可根据使用的载体粒子的种类适宜确定。例如,使用磁性粒子时,由磁分离,可选择性地回收样品中的载体粒子。具体而言,使磁石接近放入形成工序中得到的样品的容器的壁面,使样品中的磁性粒子固定到容器的壁面,通过吸除液相,可选择性地回收该粒子。另外,使用明胶粒子或乳胶粒子时,可通过由离心分离使该粒子沉淀之后,吸除液相而选择性地回收。在本发明的实施方式中,回收工序可再含清洗回收的载体粒子的工序。载体粒子的清洗,例如,可向回收的载体粒子添加清洗液而悬浮的后,将该载体粒子如上述一样通过从清洗液选择性地回收来进行。作为清洗液,优选为不损害在载体粒子上形成的复合物的缓冲液。作为那样的清洗液,特别优选为含表面活性剂的缓冲液,例如,可举出TBS-T(含有0.05%Tween20的Tris缓冲生理盐水)及PBST(含有0.05%Tween20的磷酸缓冲生理盐水)等。另外,也可使用HISCL清洗液(Sysmex株式会社制)等的市售的清洗液。在本发明的检测方法中,进行使上述的回收工序中得到的载体粒子上的复合物游离,转移到与该载体粒子不同的固相的工序(以下也称为“转移工序”)。其中,使载体粒子上的复合物游离的方法本身是现有技术中公知的。例如,可举出将可使形成工序中得到的复合物中的第1抗体和载体粒子的结合解离的物质作为游离剂使用的方法。那样的游离剂是现有技术中公知的,可根据第1抗体和载体粒子的结合样式适宜选择。例如,复合物中的第1抗体和载体粒子由物理性吸附结合时,作为游离剂,可使用含表面活性剂的溶液使该复合物游离。另外,离子键的情况中,可使用含离子的溶液使该复合物游离。第1抗体和载体粒子利用上述的物质A和物质B的亲和性结合时,也可通过将可使该物质A和物质B的结合解离的物质作为游离剂使用,使复合物游离。那样的游离剂也是现有技术中公知的,可根据物质A和物质B的组合适宜选择。例如,在半抗原和抗半抗原抗体的结合的情况中,作为游离剂,可使用该半抗原或其衍生物。另外,在生物素(或者脱硫生物素)和亲和素(或者链霉亲和素)的结合的情况中,作为游离剂,可使用生物素。上述的形成工序中得到的复合物经第1抗体和第2抗体的结合与载体粒子结合时,作为游离剂,可通过使用第2抗体特异性地识别的抗原,使该复合物游离。使用游离剂使复合物游离时,处理温度及处理时间不特别限定,但通常是在20~45℃的温度下静置3~8分钟,或者温和搅拌即可。在转移工序中,如上述一样,通过使从载体粒子游离的复合物和与载体粒子不同的固相接触而结合,将该复合物转移到该固相。其中,在本说明书中,“与载体粒子不同的固相”是指与自在上述的形成工序中添加时起存在的载体粒子不同的固相(以下也简称为“固相”)。即,在此转移工序中,不旨在使游离的复合物再结合于自在形成工序中添加时起存在的载体粒子。从而,在本发明的实施方式中,优选回收从载体粒子游离的复合物,使与新准备的固相接触。例如,从载体粒子使复合物游离之后,与上述的回收工序同样地将该载体粒子固定到容器的壁面或底部。然后,可回收含该复合物的液相,使其与上述的固相接触。在本发明的实施方式中,与载体粒子不同的固相只要是可与上述的复合物结合的固相,就不特别限定,可选自在免疫学方法中惯用的公知的固相。作为那样的固相的材料,例如,可举出乳胶、橡胶、聚乙烯、聚丙烯、聚苯乙烯、苯乙烯-丁二烯共聚物、聚氯乙烯、聚醋酸乙烯酯、聚丙烯酰胺、聚甲基丙烯酸酯、苯乙烯-甲基丙烯酸酯共聚物、聚缩水甘油基甲基丙烯酸酯、丙烯醛-乙二醇二甲基丙烯酸酯共聚物、聚亚乙烯二氟化物(PVDF)、硅酮、琼脂糖、明胶、红细胞、硅胶、玻璃、无活性氧化铝、磁性体等。另外,也可使这些中的1种或2种以上组合。作为固相的形状,例如,可举出微滴定板、试管、粒子等,在它们之中,也特别优选为粒子。在本发明的实施方式中,固相和复合物的结合样式不特别限定,但优选为使用介于复合物中的第1抗体和固相之间的物质使两者结合。作为那样的物质,可举出上述的物质A及物质B的组合。例如,可通过将物质A作为“与固相的结合部位”预先与第1抗体结合,使物质B与固相结合,利用物质A和物质B的亲和性,使复合物中的第1抗体和固相结合。作为那样的物质A及物质B的组合,优选为生物素(或者脱硫生物素)和亲和素(或者链霉亲和素)。再有,用于第1抗体和固相的结合的物质A及物质B的组合优选为与用于该第1抗体和载体粒子的结合的组合不同。例如,可举出使用使DNP及生物素结合的第1抗体、固定抗DNP抗体的载体粒子、及固定抗生物素抗体的固相。用于将复合物转移到固相的处理温度及处理时间不特别限定,但通常是在20~45℃的温度下静置1~30分钟,或者温和搅拌即可。特别是,固相的形状是粒子时,静置1~5分钟,或者温和搅拌即可。在本发明的检测方法中,进行测定上述的转移工序中得到的固相上的复合物中含的标记抗体的标记的工序(以下也称为“测定工序”)。其中,测定标记抗体的标记的方法本身是现有技术中公知的。在本发明的实施方式中,可选择根据上述的标记抗体中使用的标记物质来源的信号的种类的适宜的测定方法。例如,该标记物质是酶时,可通过使用公知的装置测定通过使针对该酶的底物反应发生的光、色等的信号来进行。作为那样的测定装置,可举出分光光度计、发光计等。再有,酶的底物可根据该酶的种类自公知的底物适宜选择。例如,作为酶使用碱性磷酸酶时,作为底物,可举出CDP-Star(注册商标)(4-氯-3-(甲氧基螺[1,2-二氧杂环丁烷-3,2'-(5'-氯)三环[3.3.1.13,7]癸烷]-4-基)苯基磷酸2钠)、CSPD(注册商标)(3-(4-甲氧基螺[1,2-二氧杂环丁烷-3,2-(5'-氯)三环[3.3.1.13,7]癸烷]-4-基)苯基磷酸2钠)等的化学发光底物;p-硝基苯基磷酸酯、5-溴-4-氯-3-吲哚基磷酸(BCIP)、4-硝基蓝四唑鎓氯化物(NBT)、碘硝基四唑鎓(INT)等的发光底物;4-甲基伞形花酰磷酸酯(4MUP)等的荧光基质;5-溴-4-氯-3-吲哚基磷酸(BCIP)、5-溴-6-氯-吲哚基磷酸2钠、p-硝基苯基磷等的显色基质。标记物质是放射性同位素时,可使用闪烁计数器等的公知的装置测定作为信号的放射线。另外,标记物质是荧光物质时,可使用荧光酶标仪等的公知的装置测定作为信号的荧光。在本发明的检测方法中,基于上述的测定工序中得到的结果,进行检测上述的样品中的HBs抗原的工序(以下也称为“检测工序”)。具体而言,在测定工序中,在测定到复合物中的标记抗体来源的标记时,在自受试者得到的样品中检测到HBs抗原。相反,测定不到该标记时,在自受试者得到的样品中检测不到HBs抗原。在本发明的实施方式中,作为阴性对照及阳性对照,优选各自使用不含HBs抗原的样品(例如,自健康者得到的活体样品)、及含HBs抗原的样品(例如,自B型肝炎患者得到的活体样品)。在本发明的实施方式中,也可比较测定工序中得到的测定值和预先设定的阈值,检测自受试者得到的样品中的HBs抗原。即,测定值与阈值相同或相比阈值更大时,在自受试者得到的样品中检测到HBs抗原。相反,测定值相比阈值更小时,在自受试者得到的样品中检测不到HBs抗原。再有,阈值可如下设定。首先,使用不含HBs抗原的样品及含HBs抗原的样品,根据本发明的检测方法的至测定工序的顺序,取得各自的测定值。再有,各样品优选为有各自多个待测样品。然后,可将可区别含HBs抗原的样品的组和不含HBs抗原的样品的组的值作为阈值设定。作为那样的阈值,例如,可举出可将含HBs抗原的样品的组和不含HBs抗原的样品的组二等分的中位值。在本发明的范围内,也包括可在本发明的预处理方法及检测方法中适宜地使用的预处理用试剂盒。接下来,对于用于检测本发明的HBs抗原的预处理用试剂盒(以下也称为“试剂盒”)进行说明。本发明的试剂盒含:含有碱性物质的第1试剂,和含有酸性物质的第2试剂。其中,本发明的试剂盒的第1试剂及第2试剂,各自是与本发明的预处理方法中使用的“含有碱性物质的预处理液”及“含有酸性物质的试剂”相当的试剂。从而,本发明的试剂盒的第1试剂及第2试剂的组成及使用方法等与对本发明的预处理方法中使用的预处理液、及含有酸性物质的试剂的说明中所述的同样。在本发明的别的实施方式中,可将上述的预处理用试剂盒和在HBs抗原的检测中使用的试剂等组合而作为HBs抗原检测用试剂盒。即,本发明的HBs抗原检测用试剂盒含:含有碱性物质的第1试剂,含有酸性物质的第2试剂,含有与HBs抗原结合的标记抗体的第3试剂,含有载体粒子的第4试剂,含与HBs抗原及该载体粒子结合的第1抗体的第5试剂,及该与载体粒子不同的固相。上述的第3试剂中含的“与HBs抗原结合的标记抗体”、第4试剂中含的“载体粒子”、第5试剂中含的“与HBs抗原及载体粒子结合的第1抗体”及“与载体粒子不同的固相”各自与本发明的检测方法中使用的标记抗体、第1抗体、载体粒子及固相相当。从而,对于本发明的HBs检测用试剂盒的标记抗体、第1抗体、载体粒子及固相的种类、结构、使用方法等与对本发明的检测方法的说明中所述的同样。在本发明的实施方式中,第3试剂、第4试剂及第5试剂也可再含适当的缓冲液。那样的缓冲液只要是在pH6.5~8有缓冲作用的缓冲液,就不特别限定,例如可举出磷酸缓冲液(PBS)、咪唑缓冲液、三乙醇胺盐酸盐缓冲液(TEA)、Good缓冲液等。作为Good缓冲液,可举出MES、Bis-Tris、ADA、PIPES、Bis-Tris-Propane、ACES、MOPS、MOPSO、BES、TES、HEPES、HEPPS、Tricine、Tris、Bicine、TAPS等的缓冲液。另外,在本发明的实施方式中,根据需要,缓冲液也可含蛋白质稳定化剂(BSA等)、防腐剂(叠氮化钠、苯基甲磺酰氟等)、无机盐类(氯化镁、氯化锌等)等的公知的添加物。接下来,由实施例详细地说明本发明,但本发明不限于这些实施例。【实施例】【实施例1:使用血清转换面板的预处理效果的探讨】【1.材料】【(1)样品】将自HBV阳性患者得到的血清转换面板(PHM935B:BostonBiomedica,Inc.)作为样品使用。此血清转换面板是从1名HBV阳性患者定期采集的血清,各血清中含的HBs抗体的浓度是已知的。在本实施例中,将各样品由血清编号27~32识别。血清编号30~32的样品是HBs抗体浓度增加,被认为血清转化的血清。再有,作为阳性对照使用HISCLHBsAg校准物(HBs抗原浓度0.025IU/mL:Sysmex株式会社)、及作为阴性对照使用健康人血清(国际生物株式会社)。【(2)预处理液(第1试剂)】将以0.3N的浓度含氢氧化钠(Nacalaitesque株式会社)、以0.4%的浓度含Brij(注册商标)35(和光纯药工业株式会社)、及以1.2M的浓度含尿素(岸田化学株式会社)的水溶液作为预处理液使用。【(3)含酸性物质的试剂(第2试剂)】将以0.11M的浓度含柠檬酸(岸田化学株式会社)、以20mM的浓度含NaCl(MANAC株式会社)及巯基乙基胺(Nacalaitesque株式会社)的水溶液作为含酸性物质的试剂使用。【(4)标记抗体试剂(第3试剂)】作为标记抗体,使用2种用碱性磷酸酶(ALP)标记的抗HBs抗体片段(以下,各自称为“ALP标记HBs85Fab'”及“ALP标记HBs149Fab'”)。其中,ALP标记HBs149Fab'由自以保藏号FERMBP-10583,于2006年3月27日,在独立行政法人制品评价技术基盘机构专利生物保藏中心(邮政编码292-0818、日本国千叶县木更津市上总镰足2-5-8120号室)保藏的杂交瘤产生的单克隆抗体制作。ALP标记HBs85Fab'由自以保藏号NITEBP-1483,于2012年12月13日,在独立行政法人制品评价技术基盘机构专利微生物保藏中心(邮政编码292-0818、日本国千叶县木更津市上总镰足2-5-8122号室)保藏的杂交瘤产生的单克隆抗体制作。具体的标记抗体试剂的制作顺序如下。将各单克隆抗体胃蛋白酶消化及还原,得到Fab'片段。另外,将ALP(ORIENTAL酵母株式会社)使用EMCS(N-(6-马来酰亚胺己酰氧基)琥珀酰亚胺)(株式会社同仁化学研究所)马来酰亚胺化。然后,使该片段与马来酰亚胺化的ALP混合而反应,得到标记抗体。将得到的标记抗体用稀释液(0.1MMES(pH6.5)、0.15MNaCl、1.0%BSA、0.1%NaN3、10mMMgCl2、1mMZnCl2)稀释。将各标记抗体的稀释液以1:1混合,制备标记抗体试剂(ALP浓度0.4U/mL)。【(5)载体粒子试剂(第4试剂)】使作为第2抗体的抗DNP抗体(DNP-1753)固定化到磁性粒子(MicromerM:Micromod公司制),得到载体粒子。将得到的载体粒子用稀释液(0.1MMES(pH6.5)、0.15MNaCl、0.25%BSA、0.1%NaN3)稀释,制备载体粒子试剂(粒子浓度0.5%)(以下也称为“磁性粒子试剂”)。其中,向磁性粒子的抗体的固定化使用Sulfo-SMCC(Pierce公司)进行。再有,上述的DNP-1753抗体是自以保藏号NITEP-845,于2009年11月25日,在独立行政法人制品评价技术基盘机构专利微生物保藏中心保藏的杂交瘤产生的单克隆抗体。【(6)第1抗体试剂(第5试剂)】作为第1抗体,使用2种用生物素及DNP修饰的抗HBs抗体(以下,各自称为“生物素/DNP标记HBs1053”及“生物素/DNP标记HBs628”)。其中,生物素/DNP标记HBs1053由自以保藏号FERMBP-10582,于2006年3月27日,在独立行政法人制品评价技术基盘机构专利生物保藏中心保藏的杂交瘤产生的单克隆抗体制作。生物素/DNP标记HBs628由自以保藏号NITEBP-1484,于2012年12月13日,在独立行政法人制品评价技术基盘机构专利微生物保藏中心保藏的杂交瘤产生的单克隆抗体制作。具体的标记抗体试剂的制作顺序如下。将生物素化试剂(EZ-Link(注册商标)Sulfo-NHS-LC-生物素试剂:Pierce公司)添加到BSA(Proliant公司),接下来,通过添加DNP标记试剂(DNP-XacidSE:ABDBioquest公司),制备用生物素及DNP修饰的BSA(生物素/DNP标记BSA)。将生物素/DNP标记BSA使用EMCS(同仁化学)马来酰亚胺化。然后,使上述的各单克隆抗体和马来酰亚胺化的生物素/DNP标记BSA混合而反应,得到第1抗体。将得到的第1抗体用稀释液(0.1MMES(pH6.5)、0.15MNaCl、1.0%BSA、0.1%NaN3)稀释。将各抗体的稀释液以1:1混合,制备第1抗体试剂(各抗体浓度0.5μg/mL)。【(7)游离剂】作为用于解离与第1抗体结合的DNP和第2抗体的结合的游离剂,使用DNP-Lys溶液。此DNP-Lys溶液是将N-(2,4-二硝基苯基)-L-赖氨酸(东京化成工业株式会社)用稀释液(0.1MMES(pH6.5)、0.25%BSA、0.1%NaN3)稀释至终浓度成5mM而制备。【(8)固相】作为上述的与载体粒子不同的固相,使用链霉亲和素固定化微平板(Nunc公司)。【2.样品的预处理】【(1)处理工序】混合样品(60μL)和预处理液(50μL),通过以室温温育7分钟,将该样品在终浓度约0.136N的氢氧化钠的存在下处理。【(2)中和工序】混合上述的处理工序中得到的样品和含酸性物质的试剂(50μL),通过以室温温育8分钟,中和该样品。再有,将中和后的样品的pH由pH试验纸(Whatman公司)进行研究,确认pH是7~7.5。【(3)比较用样品的制备】为了探讨预处理的效果,制备不经历上述的处理工序及中和工序的比较用样品。即,混合上述的各样品(60μL)和HISCL待测样品稀释液(Sysmex株式会社)(100μL)而得到比较用样品。【3.HBs抗原的检测】【(1)形成工序】在反应比色杯(HISCL用反应比色杯:Sysmex株式会社制)内混合中和工序中得到的样品(160μL)和标记抗体试剂(100μL),于42℃温育8分钟。向此反应比色杯添加第1抗体试剂(100μL),于42℃温育8分钟。再者,向此反应比色杯添加磁性粒子试剂(50μL),于42℃温育10分钟,进行形成工序。另外,对于不进行上述的预处理工序的比较用样品,也进行同样的操作。【(2)回收工序】在含形成工序中得到的样品的反应比色杯中,使用集磁装置(MINITUBEMAGSEPARATOR:SPHEROTECH公司制)进行磁分离,通过除去该比色杯内的上清,回收载体粒子。向此反应比色杯添加清洗液(350μL)(HISCL清洗液:Sysmex株式会社),再进行磁分离而清洗载体粒子。将同样的清洗操作重复2次,回收载体粒子。【(3)转移工序】向含回收工序中得到的样品的反应比色杯添加游离剂(40μL),于42℃温育5分钟。接下来,使用上述的集磁装置进行磁分离,回收上清而移到固相。通过将该固相于室温温育20分钟,实施转移工序。于是,从固相除去上清,添加HISCL清洗液(300μL),再通过除去上清进行清洗。将同样的清洗操作重复5次。【(4)测定工序】向转移工序中得到的固相添加HISCLR4试剂(17.5μL)和HISCLR5试剂(17.5μL)(Sysmex株式会社),于42℃温育5分钟。于是,使用OPTIMA(BMGLABTECH公司)进行发光强度(counts)的测定(3secatgain3960)。测定结果示于以下的表1。【表1】【(5)检测工序】由对于阳性对照及阴性对照的测定结果知,用本发明的HBs抗原的检测方法可检测样品中的HBs抗原。对于受试者来源的HBs抗体的浓度低的血清编号27~29的样品而言,不进行本发明的预处理方法也可检测HBs抗原。但是,对于HBs抗体的浓度增加的血清编号27~29的样品而言,进行本发明的预处理方法之时的发光强度成不进行之时的发光强度的约2倍。从而,由本发明的预处理方法,排除受试者来源的HBs抗体的影响而检测HBs抗原变得可能。【参考例1:HBs抗原的检测方法的灵敏度的探讨】【1.样品】阶段性地稀释自HBV阳性患者得到的血清(HBV6292-11:ZeptoMetrix公司)而制作血清稀释液,将这些作为样品使用。各样品中含的HBs抗原的浓度是已知的。在本实施例中,将这些由样品编号7~12识别。再有,作为阳性对照使用HISCLHBsAg校准物(HBs抗原浓度0.025IU/mL:Sysmex株式会社)、及作为阴性对照使用健康人血清(国际生物株式会社)。【2.检测灵敏度的探讨】除了作为样品使用上述的血清稀释液以外,与实施例1同样地进行预处理及检测的顺序,对于该样品检测HBs抗原。结果示于下表2。再有,表中的“S/N比”是由以下的式算出的值。(S/N比)={(样品的发光强度)-(阴性对照的发光强度)}/(阴性对照的发光强度)【表2】样品HBs抗原浓度(IU/mL)发光强度(计数)S/N比血清编号70.014787045152.3血清编号80.007393555425.9血清编号90.003701831612.8血清编号100.0018597076.3血清编号110.0009256013.2血清编号120.0004637281.8阴性对照01323-阳性对照0.02595864-从表2知,在本发明的HBs检测方法中,即使是HBs抗原浓度是0.00046IU/mL的HBs抗原是微量的样品,也可检测HBs抗原。其中,在使用以往的HBs抗原检测用试剂的方法中,HBs抗原浓度0.05IU/mL被设为是最小检测灵敏度。从而提示,本发明的HBs抗原的检测方法是相比使用以往试剂的方法,检测灵敏度高约100倍的方法。【参考例2:由预处理液对HBs抗原的影响的探讨】【1.材料】【(1)样品】将HISCLHBsAg校准物(Sysmex株式会社)作为样品使用。该样品中含的HBs抗原的浓度是已知的。再有,作为阴性对照使用健康人血清(国际生物株式会社)。【(2)预处理液】为了与实施例1中使用的预处理液比较,制备使各成分的浓度增加的比较用预处理液。即,将以0.5N的浓度含氢氧化钠(Nacalaitesque株式会社)、以4%的浓度含Brij(注册商标)35(和光纯药工业株式会社)、及以6M的浓度含尿素(岸田化学株式会社)的水溶液作为比较用预处理液使用。【2.对HBs抗原的影响的探讨】除了作为样品使用上述的血清,及,作为预处理液使用实施例1的预处理液或上述的比较用预处理液以外,与实施例1同样地进行预处理及检测的顺序,对于该样品检测HBs抗原。即,在样品的预处理的处理工序中,将样品在终浓度0.136N或0.227N的氢氧化钠的存在下处理。结果示于下表3。【表3】从表3知,使用比较用预处理液的检测方法也可检测样品中的HBs抗原,但S/N比与使用实施例1的预处理液的本发明的检测方法比,显著地减少。这提示,由比较用预处理液而HBs抗原变性,其抗原性丧失。对此,在利用本发明的预处理方法的HBs抗原的检测方法中,S/N比成为高的值,认为预处理液对HBs抗原的影响小。【实施例2:使用血清转换面板的预处理效果的探讨(2)】【1.材料】【(1)样品】阶段性地稀释自HBV阳性患者得到的血清(HBV11000-9:ZeptoMetrix公司)而制作血清稀释液,将这些作为样品使用。在本实施例中,将这些样品由样品编号1~4识别。各样品中含的HBs抗原的浓度是已知的。再有,将自该HBV阳性患者得到的血清用健康人血清(以约23.4mIU/mL的浓度含有HBs抗体)稀释。阶段性地稀释自HBV阳性患者得到的血清(HBV11048-6:ZeptoMetrix公司)而制作血清稀释液,将这些作为样品使用。在本实施例中,将这些样品由样品编号5~8识别。各样品中含的HBs抗原的浓度是已知的。再有,将自该HBV阳性患者得到的血清用健康人血清(以约23.4mIU/mL的浓度含有HBs抗体)稀释。【(2)预处理液】将以0.03N的浓度含氢氧化钠(Nacalaitesque株式会社)、以0.4%的浓度含Brij(注册商标)35(和光纯药工业株式会社)、及以1.2M的浓度含尿素(岸田化学株式会社)的水溶液作为预处理液使用。【2.样品的预处理】【(1)处理工序】混合样品(120μL)和预处理液(100μL),通过以室温温育7分钟,将该样品在终浓度0.014N的氢氧化钠的存在下处理。【(2)中和工序】混合上述的处理工序中得到的样品和含与实施例1相同的酸性物质的试剂(80μL),通过以室温温育5分钟,中和该样品。【3.HBs抗原的检测】【(1)形成工序】在反应比色杯(HISCL用反应比色杯:Sysmex株式会社制)内混合中和工序中得到的样品(300μL)和实施例1和相同的标记抗体试剂(100μL),于42℃温育9分钟。向此反应比色杯添加与实施例1相同的第1抗体试剂(100μL),于42℃温育9分钟。再者,向此反应比色杯添加与实施例1相同的载体粒子试剂(75μL),于42℃温育10分钟而进行形成工序。【(2)回收工序】在含形成工序中得到的样品的反应比色杯中,使用集磁装置(MINITUBEMAGSEPARATOR:SPHEROTECH公司制)进行磁分离,通过除去该比色杯内的上清,回收载体粒子。向此反应比色杯添加清洗液,再进行磁分离而清洗载体粒子。其中,进行2次由600μL的清洗液的清洗、进行1次由150μL的清洗液的清洗。再有,通过向HISCL清洗液(Sysmex株式会社)添加NaCl而使NaCl浓度成0.4M而得到此工序中使用的清洗液。【(3)转移工序】向含回收工序中得到的样品的反应比色杯添加与实施例1相同的游离剂(33μL),于38℃温育5分钟。接下来,使用上述的集磁装置进行磁分离,回收上清33μL。此后,测定工序使用HISCL2000i(Sysmex株式会社制)进行。具体而言,在HISCL2000i中进行以下操作。首先,向回收的上清添加与实施例1相同的载体粒子试剂(60μL),通过于42℃温育约6分钟,实施转移工序。再有,在本实施例中,其中添加的载体粒子试剂中的磁性粒子对应于固相。于是,从固相除去上清,添加上述(2)的回收工序中使用的清洗液(300μL),再通过除去上清而进行清洗。将同样的清洗操作重复5次。【(4)测定工序】向转移工序中得到的固相添加HISCLR4试剂(50μL)和HISCLR5试剂(100μL)(Sysmex株式会社),于42℃温育5分钟。然后,进行发光强度(counts)的测定。测定结果示于以下的表4及表5。【表4】【表5】如表4及表5所示,由2SD法知,用本发明的HBs的检测方法,在从血清转换面板制备的含有HBs抗体的样品中,即使是HBs抗原浓度是0.0002IU/mL的HBs抗原微量,也可检测HBs抗原。【实施例3:预处理液的碱性物质的浓度的差异对于HBs抗原的灵敏度的影响的探讨】【1.材料】【(1)样品】将自HBV阳性患者得到的3种血清(HBV6290-6、HBV11048-6及HBV6272-6:均获自ZeptoMetrix公司)作为样品使用。【(2)预处理液】【(i)预处理液1】将以0.15N的浓度含氢氧化钠(Nacalaitesque株式会社)、以0.4%的浓度含Brij(注册商标)35(和光纯药工业株式会社)、及以1.2M的浓度含尿素(岸田化学株式会社)的水溶液作为预处理液1使用。【(ii)预处理液2】将以0.625N的浓度含氢氧化钠(Nacalaitesque株式会社)、以0.4%的浓度含Brij(注册商标)35(和光纯药工业株式会社)、及以1.2M的浓度含尿素(岸田化学株式会社)的水溶液作为预处理液2使用。【2.样品的预处理】【(1)处理工序】混合样品(120μL)和预处理液1(100μL),通过以室温温育7分钟,将该样品在终浓度0.06N的氢氧化钠的存在下处理。另外,对于相同的样品,代替预处理液1而使用预处理液2进行同样的操作。即,混合样品(120μL)和预处理液2(80μL),通过以室温温育7分钟,将该样品在终浓度0.25N的氢氧化钠的存在下处理。【(2)中和工序】混合上述的处理工序中得到的样品和含与实施例1相同的酸性物质的试剂(80μL),通过以室温温育5分钟,中和该样品。【3.HBs抗原的检测】【(1)形成工序】在反应比色杯(HISCL用反应比色杯:Sysmex株式会社制)内混合中和工序中得到的样品(300μL)和实施例1和相同的标记抗体试剂(100μL),于42℃温育9分钟。向此反应比色杯添加与实施例1相同的第1抗体试剂(100μL),于42℃温育9分钟。再者,向此反应比色杯添加与实施例1相同的载体粒子试剂(75μL),于42℃温育10分钟,进行形成工序。【(2)回收工序】在含形成工序中得到的样品的反应比色杯中,使用集磁装置(MINITUBEMAGSEPARATOR:SPHEROTECH公司制)进行磁分离,通过除去该比色杯内的上清,回收载体粒子。向此反应比色杯添加清洗液,再进行磁分离而清洗载体粒子。其中,将由600μL的清洗液的清洗进行2次、将由150μL的清洗液的清洗进行1次。再有,向HISCL清洗液(Sysmex株式会社)添加NaCl而使NaCl浓度成0.4M而得到此工序中使用的清洗液。【(3)转移工序】向含回收工序中得到的样品的反应比色杯添加与实施例1相同的游离剂(33μL),于38℃温育5分钟。接下来,使用上述的集磁装置进行磁分离,回收上清33μL。此后、测定工序使用HISCL2000i(Sysmex株式会社制)进行。具体而言,在HISCL2000i中进行以下操作。首先,向回收的上清添加与实施例1相同的载体粒子试剂(60μL),通过于42℃温育约6分钟,实施转移工序。再有,在本实施例中,其中添加的载体粒子试剂中的磁性粒子对应于固相。然后,从固相除去上清,添加上述(2)的回收工序中使用的清洗液(300μL),再通过除去上清进行清洗。将同样的清洗操作重复5次。【(4)测定工序】向转移工序中得到的固相添加HISCLR4试剂(50μL)和HISCLR5试剂(100μL)(Sysmex株式会社),于42℃温育5分钟。然后,进行发光强度(counts)的测定。另外,对于用上述的预处理液2处理的样品,也进行与用预处理液1处理的样品同样的检测操作。测定结果示于图1~图3。从图1~图3,通过使用预处理液1的本发明的HBs抗原的检测方法,与使用如预处理液2一样的碱物质的浓度高的预处理液的HBs抗原的检测方法比,得到2.5倍以上的发光强度。从而知,由本发明的HBs抗原的检测方法可以更高灵敏度检测HBs抗原。本申请与2013年1月28日申请的日本国专利申请特愿2013-013167号相关,这些专利权利要求、说明书、附图及摘要全部通过引用并入本说明书中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1