生物传感器和生物传感器的制造方法与流程
本发明涉及生物传感器和制造生物传感器的方法。
背景技术:
常规上已知生物传感器具有设置于在绝缘基板上形成的两个或更多个电极上的、至少包含氧化还原酶和电子传递介质(还称作“电子传递物质”、“电子载体”)的试剂层。在该类型的生物传感器中,电子首先在要测量的物质与氧化还原酶之间交换,接着该电子经由电子传递介质进一步传递至电极,由此,测量所生成电流的值。
生物传感器的示例(其使用如上所述的包含电子传递介质的试剂层)包括这样的生物传感器,即,将包含葡萄糖脱氢酶作为酶和铁氰化钾等作为电子载体的试剂层形成在对电极、测量电极以及检测器电极上(例如,参见专利文献1)。在该生物传感器中,包含酶和电子载体的试剂层溶解在吸收在样品供应通道的血液中,允许以血液中作为底物的葡萄糖进行酶反应,由此,将电子载体还原,以形成还原电子载体。该还原电子载体被以电化学方式氧化,从而基于在氧化期间获取的电流值测量血液中的葡萄糖浓度。
使用包含电子传递介质的试剂层的生物传感器的灵敏度取决于溶解试剂层的样本与工作电极并且在其间交换电子的接触面积。为此,如果样本与工作电极的接触面积不一致,则生物传感器的灵敏度改变。然而,该试剂层溶解在样本中并试剂随后扩散,结果,使得难于保持样本与工作电极的接触面积始终一致。考虑到这些问题,例如,存在这样一种生物传感器,即,其设置有包含酶和电子传递物质(例如,钌络合物和铁络合物)的试剂层,并且包括用于调节在工作电极处与样本的接触面积的第一调节部件,和用于调节用于在工作电极和对电极中的至少一个处交换电子的有效面积的第二调节部件(例如,参见专利文献2)。在专利文献2所描述的生物传感器中,因为使工作电极处的有效面积保持一致,所以降低了灵敏度的不一致性。
与本申请有关的另一现有技术包括下面的电极条。该电极条包含被形成得比基本单元层更小的试剂形成层,在第一条端部与通气孔之间具有至少三个保持切口,具有该基本单元层的包括在第二条端部处暴露的至少三个电极的一部分,并且铺设在该基本单元层上以便使所述至少三个电极在所述至少三个保持切口处暴露。该电极条还包含:第一试剂,该第一试剂设置在所述至少三个保持切口当中的、暴露所述至少三个电极当中的参比电极的所述保持切口内,并且使所述至少三个电极当中的第一工作电极和第二工作电极起作用;第二试剂,该第二试剂设置在所述至少三个保持切口当中的、暴露第二工作电极的所述保持切口内,并且包含作用于作为底物的样品的酶;以及第三试剂,该第三试剂设置在所述至少三个保持切口当中的、暴露第一工作电极的所述保持切口内,并且不包含酶(例如,参见专利文献3)。应注意到,专利文献3中描述的生物传感器也是使用包含电子传递介质的试剂层的生物传感器类型,并且描述了使用二茂铁、铁氰化钾和其它二茂铁衍生物中的至少一种作为电子传递介质(氧化还原介质)。
最近发现一种利用生物传感器来测量物质的方法,该生物传感器中将样本引入到电化学测量池中,其中,将包含至少一种氧化还原酶的试剂层设置在形成在绝缘基板上的两个或更多个电极中的至少一个电极上,对这些电极施加电压,检测因电子从样本中要测量的物质传递至电极而产生的电荷传递限制电流,以及基于电荷传递限制电流确定包含在样本中的要测量的物质的浓度。在上述测量方法中,使用了不包含电子传递介质的试剂层(例如,参见专利文献4)。
[引文列表]
[专利文献]
[专利文献1]日本专利特开no.2005-147990
[专利文献2]国际公报no.wo2009/057791
[专利文献3]日本专利no.4060078
[专利文献4]国际公报no.wo2015/020149
技术实现要素:
本发明要解决的问题
在如专利文献1中公开的测量电荷传递限制电流的酶电极(称作“电荷传递限制酶电极”)中,响应电流值根据试剂层与电极的接触面积而改变。由此,例如,在电荷传递限制酶电极的制造步骤中,当简单地通过将试剂滴落到电极上来形成试剂层时,试剂层与电极的接触面积变得不一致。结果,响应电流值在酶电极(生物传感器)之间不一致,换句话说,不可能实现令人满意的测量准确度(有时称作同时再现性)。
应注意到,专利文献3中公开的技术不使用电荷传递限制酶电极,而且响应电流的测量方法不同。在专利文献3所公开的技术中,根据测量方法的差异,分别将第一试剂、第二试剂以及第三试剂涂敷至参比电极、第一工作电极以及第二工作电极。另外,出于修正因诸如抗坏血酸,尿酸或对乙酰氨基酚等干扰物质所造成的影响的目的,设置所述至少三个保持切口,从而使在所述保持切口处暴露的第一工作电极和第二工作电极的面积相同。由此,更不建议利用电荷传递限制酶电极来对所要测量的物质进行测量的方法。
本发明的目的是提供一种能够改进要测量的物质的测量准确度的生物传感器和生物传感器的制造方法。
[用于解决这些问题的手段]
本发明的一个方面是生物传感器。该生物传感器包含:包括工作电极在内的多个电极,和检测层,该检测层包含用于与所述工作电极交换电子的酶、交联剂以及导电聚合物,并且与所述工作电极具有根据预定面积限定的接触面积。
在所述生物传感器中,以所述预定面积上涂敷在所述工作电极上的用于所述检测层的材料可以在所述工作电极上固化。
所述生物传感器还可以包含绝缘层,该绝缘层覆盖所述工作电极,留下暴露所述工作电极的开孔,其中,所述开孔填充有所述检测层。
在所述生物传感器中,所述检测层可以在与所述酶的反应速率相对应的接触面积上被固定在所述工作电极上。本发明的另一方面包括生物传感器单元,该生物传感器单元包括:多个生物传感器,其中每一个生物传感器都是如上所述的生物传感器,其中,每一个生物传感器中的所述酶都可以具有相同的反应速率,并且所述接触面积近似相同。
本发明的另一方面包括提供一种制造生物传感器的方法,该方法包括以下步骤:在绝缘基板上形成包括工作电极在内的多个电极;和在所述工作电极上形成检测层,该检测层包含用于与所述工作电极交换电子的酶、交联剂以及导电聚合物,并且与所述工作电极具有根据预定面积限定的接触面积。
在所述制造生物传感器的方法中,所述在所述工作电极上形成所述检测层的步骤可以包括以下步骤:将用于所述检测层的材料涂敷在所述工作电极上。
在所述制造生物传感器的方法中,所述在所述工作电极上形成所述检测层的步骤可以包括以下步骤:以绝缘层覆盖所述工作电极的上部,留下暴露所述工作电极的开孔,并且以用于所述检测层的所述材料填充所述开孔。
本发明的效果
根据本发明,提供了一种能够改进要测量的物质的测量准确度的生物传感器。
附图说明
图1是例示根据实施方式的生物传感器的构造的实例的图;
图2是图1所示生物传感器的沿线a-a截取的截面图;
图3是例示测量装置的构造的实例的图;
图4是例示通过该测量装置执行的处理序列的实例的流程图;
图5是例示比较例1的生物传感器的构造的实例的图;
图6是描绘利用实施例1的生物传感器执行的计时安培分析法测量的结果的图形;
图7是描绘利用比较例1的生物传感器执行的计时安培分析法测量的结果的图形;
图8是描绘利用实施例2的生物传感器执行的计时安培分析法测量的结果的图形;以及
图9是描绘利用比较例2的生物传感器执行的计时安培分析法测量的结果的图形。
具体实施方式
下面,参照附图,对本发明的实施方式进行描述。下列实施方式的构造是例示性的,而且本发明不限于此。
根据该实施方式的生物传感器包括:包括工作电极在内的多个电极,和检测层,该检测层包含用于与该工作电极交换电子的酶、交联剂以及导电聚合物,并且固定在该工作电极上,且与该工作电极的接触面积受到控制。
要通过该实施方式的生物传感器测量的物质未特别限制,只要该物体可利用该生物传感器来测量即可。要测量的物质优选为生物来源的物质,并且可以是用于疾病或健康状态的指示物。要测量的物质的示例包括葡萄糖和胆固醇等。该样本没有特别限制,只要其包含要测量的物质即可。该样本优选为生物样本。生物样本的示例包括血液和尿液等。
根据该实施方式的生物传感器的测量目标是基于从要测量的物质向该电极传递的电子的电荷传递限制电流。该电荷传递限制电流是在电子因酶与要测量的物质反应而从酶向电极传递时所产生的电流。该电荷传递限制电流是不依赖时间的稳态电流,并且优选为因电双层充电而产生瞬态电流之后的稳态电流。
该电荷传递限制电流用下面的公式(1)表示。公式(1)揭示,该电流与底物的浓度和酶反应速率常数成比例。当该常数项被定义为x时,可以将公式(1)展开成公式(2)。应注意到,该常数项x可以包括修正系数(尽管未出现在公式(1)和(2)中)等。
[公式(1)]
i:电流(a),
n:反应电子数(eq/mol),
f:法拉第常数(96485c/eq),
a:电极面积(cm2),
c0s:底物(s)的浓度(mol/cm3),
τe:氧含量(mol),
kcat/km:氧反应速率常数
考虑到酶反应的初始速率公式和从酶至电极的电子传递速率的公式,在这些公式的值相等时,通过扩展这些公式,来导出公式(1)。根据该实施方式的生物传感器,例如,利用上述公式(1)和(2),来测量要测量的物质(底物)的浓度。
[公式(2)]
该公式(1)是电荷传递限制电流的公式,其不包括在酶反应的初始速率公式的cottrell电流中所包括的扩散系数。如公式(1)所揭示的,该电流与酶反应速率常数成比例。在根据该实施方式的要测量的物质的测量方法中,电子被传递至电极,而不通过诸如电子受体物质等介质由氧化还原反应介导。由此,揭示了该电荷传递限制电流不受该物质的扩散影响或者不取决于时间。
应注意到,该电极系统可以通过利用循环伏安法来检查存不存在因电压的扫描方向而造成电流增加的峰值和模式,而确认为电荷传递限制。
根据该实施方式的生物传感器的检测层包含酶、交联剂以及导电聚合物,但没有电子传递介质。为了测量电荷传递限制电流,工作电极优选为“直接电子传递型酶电极”。如在此使用的“直接电子传递型酶电极”指这样的酶电极:电子在酶与电极之间交换,从而使得通过检测层(试剂层)中的酶反应所生成的电子被直接传递至电极,而不涉及诸如电子传递介质等氧化还原物质(在某些情况下,由导电聚合物介导)。
在该检测层内,酶的分子用交联剂交联,并且还具有因导电聚合物而造成的复杂交织结构。通过酶反应而产生的电子可以直接或者沿着具有导电性的导电聚合物传递至电极。如上所述,在根据该实施方式的生物传感器中,电子通过检测层中的直接电子传递而在酶与电极之间交换。
应注意到,在生理反应系统中,发生直接电子传递的限制距离被认为是1nm至2nm。即使在由电极和酶构成的电化学反应系统中的电子传递方面,对于电极与酶之间的距离远大于上述限制距离的情况来说,电极上的电子交换也变得难于检测,除非涉及介质的传递(例如,通过扩散来传递)。从而,在该检测层内,酶的活性位点(因酶反应而产生电子的位点)和导电聚合物的导电点位于适于电子传递的距离内。具体来说,该导电点和活性位点位置足够接近,以使电子在其间合适地传递。
在根据该实施方式的生物传感器中,将与工作电极具有根据预定面积限定的接触面积的检测层形成在该工作电极上。具体来说,限定工作电极与检测层的接触面积。检测层与工作电极的接触面积可以通过将检测层材料涂敷(涂抹)至多个电极当中的工作电极(但不是简单地滴落液体检测层材料)来限定。利用该过程,可以限定公式(1)中的“a:电极表面积”和“n:反应电子数”。由此,降低了各生物传感器之间的响应电流的不一致性,并且可以改进同时再现性。
为了限定检测层与工作电极的接触面积,在形成有该电极的绝缘基板上形成绝缘层可以被呈现为实例。该绝缘层被形成为使得工作电极在其底表面暴露,并且具有填充了绝缘层材料的开孔。该开孔具有连接内壁表面,以在该开孔内调节用以填充该开孔的检测层材料的扩散范围。当用以填充该开孔的检测层的材料通过干燥等固化时,形成填充该开孔(填埋该开孔)的检测层。开孔的底部面积具有匹配检测层与工作电极的接触面积的尺寸,并且该开孔按至少充分填埋开孔的底部的量填充了检测层材料。通过该过程,可以容易地在该工作电极上形成与工作电极具有限定接触面积(在预定面积上接触该工作电极)的检测层。可以,例如通过利用不导电墨水(还称作抗蚀剂墨水)进行丝网印刷来形成绝缘层。除了丝网印刷以外,还可以通过利用各种抗蚀剂(如光致抗蚀剂)和绝缘带等的工序来形成绝缘层,只要可以形成能够限定工作电极与检测层的接触面积的开孔即可。
作为另一用法,可以对应于酶的反应速率来确定检测层与工作电极的接触面积。酶的反应速率可以随着不同的特定活性而按批次(bylots)改变。为此,预先通过实验等来确定对应于酶的反应速率的检测层与工作电极的面积,并且在与按每批酶的反应速率相对应的接触面积上形成检测层。利用该过程,可以降低按批次的同时再现性的不一致性。
下面,对根据实施方式的生物传感器的实例进行描述。
<生物传感器的构造>
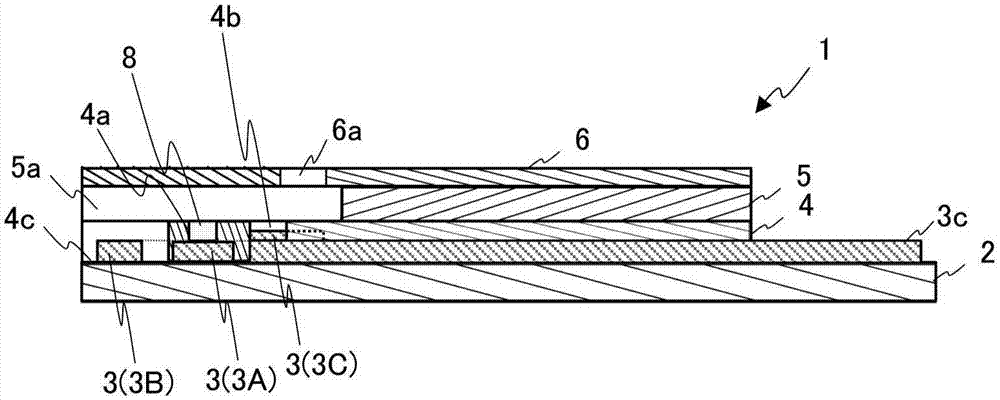
图1是示意性地例示根据实施方式的包括酶电极的生物传感器的构造的图,而图2是图1所示生物传感器当沿线a-a截取时处于层叠状态的截面图。
如图1和图2所示,生物传感器1包括:包括绝缘基板2、形成在该绝缘基板2上的多个电极3(工作电极3a、对电极3b、参比电极3c),以及覆盖所述多个电极3的一部分的绝缘层4(图1中虚线所绘)的酶电极,间隔体5以及盖子6。生物传感器1通过层叠和集成该酶电极、间隔体5以及盖子6来形成。绝缘基板2和电极3的组合被称作“基材”。
<酶电极>
如上所述的酶电极由绝缘基板2、电极3以及绝缘层4构成。
(绝缘基板)
该绝缘基板2采用具有纵向方向和宽度方向的平板的形式来形成。该绝缘基板2例如由诸如聚醚酰亚胺(pei),聚对苯二甲酸乙酯(pet)以及聚乙烯(pe)等热塑性树脂、诸如聚酰亚胺树脂和环氧树脂等各种树脂(塑料),或者诸如玻璃、陶瓷以及纸张等绝缘材料来制成。
(电极)
电极3被形成在绝缘基板2的一个表面上。电极3由工作电极3a和对电极3b,以及参比电极3c构成,工作电极3a和对电极3b皆为沿绝缘基板2的宽度方向延伸的带状。该工作电极3a、对电极3b以及参比电极3c按这样的次序设置:该对电极3b、工作电极3a以及参比电极3c沿绝缘基板2的纵向方向从一个端部(图1中的下端部)朝着另一端部(图1中的上端部)设置。
该工作电极3a和对电极3b由沿着绝缘基板2的纵向方向延伸的导引单元3a和导引单元3b一体化形成。该参比电极3c形成在沿着绝缘基板2的纵向方向延伸的导引单元3c的一个端部部分(图1中的下端部)上。
该工作电极3a、对电极3b以及导引单元3a、3b以及3c中的每一个都可以例如利用诸如金(au)、铂(pt)、银(ag)或钯等金属材料,或者诸如碳等碳材料来形成。该参比电极3c例如利用银/氯化银(ag/agcl)来形成。该参比电极3c也可以利用与工作电极3a和对电极3b相同的材料来形成。
应注意到,还可以将各种已知材料应用为构成电极3的电极材料和用于绝缘基板2的材料。电极3和绝缘基板2的尺寸和厚度可以适当确定。
(绝缘层)
如图1所示,绝缘基板2的形成电极3的一个表面覆盖有绝缘层4。绝缘层4具有开孔4a、开孔4b以及开孔4c。开孔4a形成在工作电极3a上,以暴露工作电极3a的一部分。
如图2所示,开孔4a是用于形成检测层8的空间,并且检测层8形成在该开孔4a内。在图2的实施例中,开孔4a形成为具有圆形平面形状和连接内壁表面(圆筒状侧表面)的构造。开孔4a的底部面积按匹配检测层8的接触面积的方式形成在工作电极3a上,检测层8接触工作电极3a。当检测层8利用具有限定底部面积的开孔4a形成时,就限定了工作电极3a与检测层8的接触面积。稍后,对形成检测层8的组成部件的细节进行描述。
开孔4a的平面形状在图1所示实施例中为圆形,并且内壁表面为圆筒状侧表面。然而,开孔4a可以形成为内壁表面为截锥状侧表面的锥形形状。开孔4a的平面形状和内壁表面的形状可以适当确定,只要能够形成连接内壁表面即可,其调节填充开孔的检测层材料的扩散范围。例如,开孔4a的平面形状可以是椭圆形、三角形、四边形或者由五条或更多条边构成的多边形。另外,开孔4a的内壁表面的形状可以是与该平面形状相对应的柱状侧表面,或者不与该平面表面相对应的柱状侧表面。具体来说,开孔4a的形状可以适当确定,只要检测层8与工作电极3a的接触面积可以被限定成预定面积即可。
形成开孔4b,从而暴露参比电极3c的一部分和绝缘基板2的一部分。类似的是,形成开孔4c,从而暴露对极3b的一部分和绝缘基板2的一部分。不需要特别限定开孔4b和开孔4c的面积。应注意到,绝缘基板2的纵向方向的另一端部未覆盖绝缘层4,并且暴露的导引单元3a、3b以及3c中的每一个都被用作电极引出单元。
绝缘层4例如利用抗蚀剂模墨水(非导电墨水)通过丝网印刷形成,或者利用绝缘膜来形成。可应用的抗蚀剂墨水的示例包括绝缘树脂聚酯墨水(由asahichemicalresearchlaboratoryco.,ltd.制造的uvf系列)。可应用的绝缘膜的示例包括zeocoatcp1010(zeoncorporation)。另选的是,可想到的是,在间隔体5与电极3之间设置其上形成有与开孔4a、4b以及4c对应的槽口的树脂板。
《间隔体》
间隔体5形成为具有纵向方向和宽度方向的平板形状,并且在其一个端部(图1中的下端部)处形成有狭缝5a。间隔体5被层叠并固定化在绝缘层4上。这时,对电极3b和参比电极3c在狭缝5a内暴露,并且暴露形成(固定)在开孔4a内的检测层8。
《盖子》
盖子6形成为具有纵向方向和宽度方向的平板形状,并且形成与间隔体5的狭缝5a相对应的气孔6a。盖子6层叠并固定化在间隔体5上。由此,插入间隔体5与盖子6之间的空间起到毛细管的作用。从由狭缝5a形成的开孔(图2中的生物传感器1的一个端部(图2中的左侧端部))引入的样本通过朝着气孔6a的毛细作用引入该毛细管中。
《检测层》
如图2所示,检测层8被形成(固定化)在开孔4a内。检测层8至少包含酶、交联剂以及导电聚合物。检测层8还可以包含糖和导电颗粒中的至少一种。
(酶)
酶的示例包括氧化还原酶。氧化还原酶的示例包括:葡萄糖氧化酶(god)、半乳糖氧化酶、胆红素氧化酶、丙酮酸氧化酶、d-或l-氨基酸氧化酶、胺氧化酶、胆固醇氧化酶、胆碱氧化酶、黄嘌呤氧化酶、肌氨酸氧化酶、l-乳酸氧化酶、抗坏血酸氧化酶、细胞色素氧化酶、醇脱氢酶、谷氨酸脱氢酶、胆固醇脱氢酶、醛脱氢酶、葡萄糖脱氢酶(gdh)、果糖脱氢酶、山梨醇脱氢酶、乳酸脱氢酶、苹果酸脱氢酶、丙三醇脱氢酶、17b羟基类固醇脱氢酶、雌二醇17b脱氢酶、氨基酸脱氢酶、甘油醛-3-磷酸脱氢酶、3-羟基类固醇脱氢酶、心肌黄酶、细胞色素氧化还原酶、过氧化氢酶、过氧化物酶和谷胱甘肽还原酶等。其中,糖的氧化还原酶是优选的。糖的氧化还原酶的示例包括:葡萄糖氧化酶(god)、半乳糖氧化酶、葡萄糖脱氢酶(gdh)、果糖脱氢酶以及山梨糖醇脱氢酶。
作为催化亚单元和催化域,氧化还原酶还可以包含吡咯喹啉醌(pqq)和黄素腺嘌呤二核苷酸(fad)中的至少一种。包含pqq的氧化还原酶的示例包括pqq葡萄糖脱氢酶(pqqgdh)。包含fad的氧化还原酶的示例包括细胞色素葡萄糖脱氢酶(cy-gdh)和葡萄糖氧化酶(god),其具有含fad的α-亚单元。
氧化还原酶还可以包含电子传递亚单元或电子传递域。电子传递亚单元的示例包括含有具有电子交换功能的血红素的亚单元。包含这种含血红素的亚单元的氧化还原酶的示例包括那些包含细胞色素的酶,并且例如,可以使用葡萄糖脱氢酶以及pqqgdh和细胞色素的融合蛋白。
包含电子传递域的酶的示例包括胆固醇氧化酶和喹啉并血红素(quinoheme)乙醇脱氢酶(qhedh(pqqethanoldh))。对于电子传递域来说,还优选的是,使用包含细胞色素(具有电子交换功能的血红素)的域。示例包括:“qhgdh”(融合酶;具有qhgdh的血红素域的gdh)、山梨醇脱氢酶(山梨醇dh)、d-果糖脱氢酶(果糖dh)、根癌农杆菌来源的葡萄糖-3-脱氢酶(来自根癌农杆菌的g3dh)以及纤维二糖脱氢酶。
应注意到,例如,在国际公报wo2005/030807中公开了pqqgdh和细胞色素的上述融合蛋白(其是包含细胞色素的亚单元的示例)和pqqgdh的细胞色素域(其是包含细胞色素的域的示例)。
而且,对于氧化还原酶来说,可以使用由至少催化亚单元和包含细胞色素(含有具有电子受体功能的血红素)的亚单元组成的寡聚酶。
应注意到,要测量的物质可以是氧化还原酶的任何底物。例如,纤维二糖脱氢酶氧化纤维二糖,但也氧化葡萄糖,因此该葡萄糖还可以用作要测量的物质。
(导电聚合物)
导电聚合物的示例包括:聚吡咯、聚苯胺、聚苯乙烯磺酸酯、聚噻吩、多异硫茚、聚乙烯二氧噻吩(聚(3,4-乙烯二氧噻吩)聚(苯乙烯磺酸盐)),及其组合等。作为聚吡咯,其商业产品的示例包括“sspy”(乙基-3-甲基-4-吡咯羧酸酯)(由kakensangyoucorporation制造)等。作为聚苯胺,示例包括“aquapass01-x”(由tachemicalco.,ltd.制造)等。作为聚苯乙烯磺酸,示例还包括“poly-nass”(由tosohorganicchemicalco.,ltd.制造)等。作为聚噻吩,示例包括:“espacer100”(由tachemicalco.,ltd.制造)等。作为多异硫茚,示例包括“espacer300”(由tachemicalco.,ltd.制造)等。作为聚乙烯二氧噻吩(聚(3,4-乙烯二氧噻吩)聚(苯乙烯磺酸酯)),示例包括“pedot-pss”(polyscience,inc.)等。另外,可以使用具有各种特性(例如,水溶性)的导电聚合物。导电聚合物的官能团优选具有羟基或磺基。
(交联剂)
具体作为含醛基的化合物,交联剂(粘合剂)类型的示例包括戊二醛、甲醛、丙二醛、对酞醛、异丁醛、戊醛、异戊醛、肉桂醛、烟碱醛、甘油醛、乙醇醛、丁二醛、己二醛、间酞醛、对酞醛等。作为含碳二亚胺基的化合物,示例包括:六亚甲基二异氰酸酯、氢化亚二甲苯基二异氰酸酯、亚二甲苯基二异氰酸酯、2,2,4-三甲基六亚甲基二异氰酸酯、1,12-二异氰酸酯十二烷、降冰片烷二异氰酸酯、2,4-双-(8-异氰酸酯辛基)-1,3-二辛基环丁烷、4,4'-二环己基甲烷二异氰酸酯、四甲基苯二亚甲基二异氰酸酯、异佛尔酮二异氰酸酯等。
含碳二亚胺基的化合物还可在下列名称之下商业获得:carbodilitev-02、carbodilitev-02-l2、carbodilitev-04、carbodilitev-06、carbodilitee-02、carbodilitev-01、carbodilitev-03、carbodilitev-05、carbodilitev-07、carbodilitev-09(全部是产品名称,由nisshinbochemical,inc.制造)等。
作为含马来酰亚胺基的化合物,示例包括:间马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯、磺基琥珀酰亚胺4-(对-马来酰亚胺苯基)丁酸酯、间马来酰亚胺苯甲酰磺基琥珀酰亚胺酯、n-γ-马来酰亚胺丁酰氧基琥珀酰亚胺酯、琥珀酰亚胺4-(n-马来酰亚胺甲基)环己烷-1-甲酸酯、n-琥珀酰亚胺-2-马来酰亚胺基乙酸、n-琥珀酰亚胺基-4-马来酰亚胺丁酸、n-琥珀酰亚胺基-6-马来酰亚胺己酸、n-琥珀酰亚胺基-4-马来酰亚胺甲基环己烷-1-羧酸、n-磺基琥珀酰亚胺基-4-马来酰亚胺甲基环己烷-1-羧酸、n-琥珀酰亚胺基-4-马来酰亚胺甲基苯甲酸酯、n-琥珀酰亚胺基-3-马来酰亚胺苯甲酸酯、n-琥珀酰亚胺基-4-马来亚氨基苯基-4-丁酸、n-磺基琥珀酰亚胺基-4-马来亚氨基苯基-4-丁酸、n,n-'-氧二亚甲基-二马来酰亚胺、n,n'-邻亚苯基二马来酰亚胺、n,n'-间亚苯基二马来酰亚胺、n,n'-对亚苯基二马来酰亚胺、n,n'-六亚甲基二马来酰亚胺、n-琥珀酰亚胺马来酰亚胺羧酸酯等。示例还包括商业产品,如sanfelbm-g(由sanshinchemicalindustryco.,ltd.制造)等。
作为含噁唑啉基的化合物,示例包括噁唑啉化合物,如:2,2'-双-(2-噁唑啉)、2,2'-亚甲基-双-(2-噁唑啉)、2,2'-乙烯-双(2-噁唑啉)、2,2'-三亚甲基-双-(2-噁唑啉)、2,2'-四亚甲基双(2-噁唑啉)、2,2'-六亚甲基-双-(2-噁唑啉)、2,2'-八亚甲基-双-(2-噁唑啉)、2,2'-乙烯双-(4,4'-二甲基-2-噁唑啉)、2,2'-对-亚苯基-双-(2-噁唑啉)、2,2'-间亚苯基-双(2-噁唑啉)、2,2'-间亚苯基-双-(4,4'-二甲基-2-噁唑啉)、双-(2-噁唑啉基环己烷)硫醚、双-(2-噁唑啉基降冰片烷)硫醚等。
作为加成聚合性噁唑啉化合物,示例包括:2-乙烯基-2-噁唑啉、2-乙烯基-4-甲基-2-噁唑啉、2-乙烯基-5-甲基-2-噁唑啉、2-异丙烯基-2-噁唑啉、2-异丙基-4-甲基-2-噁唑啉、2-异丙烯基-5-乙基-2-噁唑啉等,并且可以使用其中一种或更多种的聚合或共聚化合物。
含噁唑啉基的化合物还可在下列名称之下商业获得:epocrosws-500、epocrosws-700、epocrosk-1010e、epocrosk-1020e、epocrosk-1030e、epocrosk-2010e、epocrosk-2020e、epocrosk-2030e、epocrosrps-1005、epocrosras-1005(全部由nipponshokubaico.,ltd.制造)、nklinkerfx(由shin-nakamurachemicalco.,ltd.制造)等。
作为含环氧基的化合物,示例具体包括:山梨糖醇聚缩水甘油醚、聚甘油聚缩水甘油醚、双甘油聚缩水甘油醚、甘油聚缩水甘油醚、三羟甲基丙烷聚缩水甘油醚、乙二醇二缩水甘油醚、聚乙二醇二缩水甘油醚、丙二醇二缩水甘油醚、聚丙二醇二缩水甘油醚等,并且还可以组合使用这些化合物中的两种或更多种。含环氧基的化合物还可在下列名称之下商业获得:denacolex-611、denacolex-612、denacolex-614、denacolex-614b、denacolex-512、denacolex-521、denacolex-421、denacolex-313、denacolex-314、denacolex-321、denacolex-810、denacolex-811、denacolex-850、denacolex-851、denacolex-821、denacolex-830、denacolex-832、denacolex-841、denacolex-861、denacolex-911、denacolex-941、denacolex-920、denacolex-145以及denacolex-171(全部是产品名称,由nagasechemtexcorporation制造),sr-pg、sr-2eg、sr-8eg、sr-8egs、sr-glg、sr-dge、sr-4gl、sr-4gls以及sr-sep(全部是产品名称,由sakamotoyakuhinkogyoco.,ltd.制造),epolite200e、eepolite400e以及epolite400p(全部由kyoeishachemicalco.,ltd制造)等。
交联剂的类型不限于上述化合物和商业产品,而可以是包含醛基、马来酰亚胺基、碳二亚胺基、噁唑啉基和环氧基中的至少一种官能团的化合物。交联剂的形式没有限制,而是可以采用单体或聚合物的形式。
(糖)
所述糖是不充当酶底物的糖,而且该糖的构成糖的数量例如为1至6,并且优选为2至6。该糖可以是d-形或l-形,或其混合物,并且可以单一使用或者适当组合使用其中两种或更多种。然而,对于诸如葡萄糖等糖被用作测量目标的情况来说,与要作为测量目标的糖不同并且不充当酶底物的糖被用作所述糖。
二糖的示例包括:木二糖、琼脂二糖、角叉藻二糖、麦芽糖、异麦芽糖、槐二糖、纤维二糖、海藻糖、新海藻糖、异海藻糖、菊粉二糖(inulobiose)、巢菜糖、异樱草糖(isoprimeverose)、山姆卜二糖(sambubiose)、樱草糖、茄双糖、蜜二糖、乳糖、番茄二糖、表纤维二糖(epicellobiose)、蔗糖、松二糖、麦芽酮糖、乳果糖、表位二糖(epigentibiose)、洋槐二糖、硅烷二糖(silanobiose)、芸香糖等。
三糖的示例包括:葡糖基海藻糖、纤维三糖、马铃薯三糖、龙胆三糖、异麦芽三糖、异潘糖(isopanose)、麦芽三糖、甘露三糖、松三糖、潘糖、车前糖、棉子糖、茄三糖、伞形糖等。
四糖的示例包括:麦芽糖基海藻糖、麦芽四糖、水苏糖等。五糖的示例包括:麦芽三糖海藻糖、麦芽五糖、毛蕊花糖等。六糖的示例包括麦芽六糖等。
(导电颗粒)
检测层8还可以包含导电颗粒。对于导电颗粒来说,可以使用诸如金、铂、银或钯的金属颗粒;或者由碳材料制成的高级结构体。该高级结构体例如可以包含从导电炭黑、碳纳米管(cnt)以及富勒烯中选择的一种或更多种细颗粒(碳细颗粒)。导电炭黑的示例包括:ketjenblack(由degussaag制造)、blackpearl(cabotcorporation)等。
工作电极3a上的检测层8还可以包含导电大分子(导电聚合物)。导电大分子优选为水溶性的那些大分子,并且示例包括:聚苯胺、聚乙烯二氧噻吩等,并且以由mitsubishirayonco.,ltd.制造的磺化聚苯胺水溶液(商品名称aquapass)作为代表例。
<用于制造生物传感器的方法>
上述生物传感器1例如按以下方式制造。具体来说,充任电极3的碳层形成在绝缘基板2的一个表面上。例如,将碳墨水采用具有预定厚度(例如,大约100μm)的膜形式丝网印刷在绝缘基板2的一个表面上。由此,形成具有希望厚度(例如,大约10μm)的碳膜。代替碳层地,还可以通过用物理气相淀积(pvd,例如,溅射)或化学汽相淀积(cvd)淀积金属性材料来形成膜,从而形成具有希望厚度(例如,大约30nm)的金属层。
接下来,将绝缘层4形成在电极3上。绝缘层4例如利用抗蚀剂墨水通过丝网印刷进行图案化从而形成。
接下来,将检测层8形成在电极3上。具体来说,制备包含酶、导电聚合物和交联剂等的溶液(试剂)。该试剂可以包含糖和导电颗粒中的至少一种。如果包含糖,则该糖的浓度优选为0.1至2wt%,并且更优选为0.2至2wt%。将该溶液(试剂)滴落到绝缘层4的开孔4a中,并且填充该开孔4a。当开孔4a中的溶液(试剂)通过干燥在工作电极3a上固化时,在工作电极3a上形成检测层8。
另选的是,检测层8可以利用膏或凝胶形式的试剂填充开孔4a并固化该试剂来形成。还可以在不形成绝缘层4的情况下,通过在工作电极3a上丝网印刷膏或凝胶形式的检测层8,以使工作电极3a与检测层8的接触面积具有预定面积,然后通过干燥固化来形成检测层8。
在形成检测层8之后,可以将间隔体5与基材对齐并粘合在基材上,并将将盖子6与间隔体5对齐并粘合在间隔体5上,从而获取生物传感器1。
还可以形成设置有多个生物传感器1(其具有上述构造)的生物传感器单元。在这种情况下,将该生物传感器单元形成为,使得每一个生物传感器中的酶具有相同反应速率,并且检测层8接触工作电极3a的面积近似相同。“近似相同”意指,例如,每一个生物传感器中的工作电极与检测层的接触面积相对于指定的预定面积(指定值(还称作理论值))在8%的误差范围之内。然而,误差范围可以在4%之内或者在2%之内。
<测量装置>
图3是例示测量装置的构造的实例的图,其利用生物传感器1来测量要测量的物质的浓度。图3所示葡萄糖传感器17是生物传感器1的实例,并且具有利用图1和图2描述的构造。该测量装置b是葡萄糖测量装置,其利用葡萄糖传感器17来测量葡萄糖(血糖)浓度。然而,下述测量装置b的构造是实例,并且本发明的测量装置不限于下面的实施方式。
图3例示了容纳在测量装置b中的主要电子组件的构造的实例。在图3中,控制计算机18、恒电位仪19以及电源装置11被设置在容纳在壳体中的基板20上。
作为硬件,该控制计算机18包括诸如cpu(中央处理单元)等处理器、诸如存储器(例如,ram(随机存取存储器)和rom(只读存储器))等记录介质以及通信单元。当该处理器将存储在记录介质(例如,rom)上的程序加载至ram并且执行该程序时,该控制计算机18充任包括输出单元10、控制单元12、算术单元13以及检测单元14的装置。控制计算机18还可以包括辅助存储器,如半导体存储器(eeprom或闪速存储器)或者硬盘。
控制单元12控制施加电压的时机、和要施加的电压值等。电源装置11包括电池16,并且向控制计算机18和恒电位仪19供电以供操作。还可以将电源装置11设置在壳体外侧。
恒电位仪19是相对于参比电极3c来保持工作电极3a的电位恒定的装置,并且通过控制单元12控制。恒电位仪19利用各自对应于对电极3b、参比电极3c以及工作电极3a的端子c、r、w,在葡萄糖传感器17的对电极3b与工作电极3a之间施加预定量的电压,测量在端子w处获取的、工作电极3a的响应电流,并将该响应电流的测量结果发送给检测单元14。
算术单元13基于所检测电流的值来计算并存储要测量的物质(葡萄糖)的浓度。输出单元10执行与显示单元15的数据通信,并将要测量的物质(葡萄糖)的浓度的计算结果(其由算术单元13提供)发送给显示单元15。显示单元15例如能够按预定格式在显示屏上显示从测量装置b接收的葡萄糖浓度的计算结果。
图4是例示通过控制计算机18执行的葡萄糖浓度测量的处理顺序的实例的流程图。控制计算机18的cpu(控制单元12)接收用于开始测量葡萄糖浓度的指令。控制单元12控制恒电位仪19向工作电极3a施加预定量的电压,并且开始测量来自工作电极3a的响应电流(步骤s01)。应注意到,检测葡萄糖传感器17安装至测量装置b可以被用作开始浓度测量的指令。
用于向电极施加电压的方法没有特别受限。优选梯度施加,以有效测量电荷传递限制电流。要施加的电压优选为600mv或以下,并且更优选为100mv或以下。该下限没有特别受限,并且例如为10mv或以上。
接下来,恒电位仪19基于向该电极传递的从样本中要测量的物质(在此为葡萄糖)导出的电子,来测量通过施加电压而生成的响应电流,具体为电荷传递限制电流,并将该测量电流发送至检测单元14(步骤s02)。作为电荷传递限制电流,测量因电双层充电而产生瞬态电流之后(例如,在施加电压之后的1至20秒钟)的稳态电流。
算术单元13基于该电流值执行算术处理,并且计算葡萄糖浓度(步骤s03)。例如,用于计算葡萄糖浓度的公式或者葡萄糖浓度校准曲线的数据(其对应于包含在设置在工作电极3a上的检测层8中的酶(例如,葡萄糖脱氢酶))被预先安装至控制计算机3中的算术单元13。该算术单元13利用这些计算公式或校准曲线来计算葡萄糖浓度。
该算术单元13例如可以基于公式(1),根据所测量的电流值来计算要测量的物质(葡萄糖)的浓度。另选的是,可以利用具有已知浓度的样本预先生成校准曲线,并且基于该校准曲线,根据所测量电流值来计算浓度。样品的浓度还可以通过将公式(1)乘以通过测试等找到的修正系数来计算。在这种情况下,该修正系数也包括在公式(2)的常数项x中。可以连续或间歇地执行响应电流的测量。
输出单元10经由向显示单元15提供的通信链路将葡萄糖浓度的计算结果发送至显示单元15(步骤s04)。此后,控制单元12确定是否存在检测到的任何测量错误(步骤s05),如果没有错误,则完成该测量,并将该葡萄糖浓度显示在显示单元上。如果存在任何错误,则显示错误通知,并接着完成图4所示流程顺序。
[测试1]
[实施例1]
作为用于电极3的材料,使用导电碳墨水(ftu系列,由asahichemicalresearchlaboratoryco.,ltd.)。导电碳墨水通过在作为绝缘基板2的聚对苯二甲酸乙二醇酯片(e-22,由trayindustries,inc.制造)(长度50mm、宽度5mm、厚度250μm)的一个表面上丝网印刷来图案化,以形成三个电极图案。而且,在实施例1中,将银-氯化银墨水(由basinc.制造)涂敷至三个电极图案中的一个上,在80℃干燥20分钟,以形成银-氯化银电极,作为参比电极3c。
接下来,绝缘层4通过丝网印刷绝缘树脂聚酯墨水(uvf系列,由asahichemicalresearchlaboratoryco.,ltd.制造)来形成,并在以上电极3上形成开孔4a、4b以及4c。开孔4a的底部面积设置成0.5mm2。
制备酶试剂,其包含含细胞色素的葡萄糖脱氢酶(cygdh)、导电颗粒(ketjenblack)、作为导电助剂的导电大分子(聚苯胺)以及粘合剂(含噁唑啉基的水溶性聚合物,将其0.04μl该酶试剂滴落到开孔4a中,并且在100℃干燥120分钟,以形成检测层8。该酶试剂具有如下最终浓度。
(酶试剂的配方)
·kjb:0.60wt%
·酶(cy-gdh):7mg/ml
·磷酸缓冲液:5mm(ph5.8)
·交联剂(粘合剂)(epocrosws-700,由nipponshokubaico.,ltd.制造)3.00%(w/v)
·聚苯胺(aquapass,由mitsubishirayonco.,ltd.制造)0.20%(w/v)
·海藻糖0.25wt%(用作酶的保护材料)
[比较例1]
图5中例示了根据比较例1的生物传感器的构造的示例。图5例示了构成生物传感器的一部分的酶电极(绝缘基板2、电极3、绝缘层4)的构造。绝缘层4具有不同于实施例(图1)的印刷图案,并且工作电极3a、对电极3b以及参比电极3c通过开孔4d暴露。将利用上述配方制备的0.04μl液体试剂滴落到工作电极3a上,并且在100℃干燥120分钟,以形成检测层。除了上述以外,比较例1的材料、构造以及尺寸与实施例1相同。在比较例1中,不控制工作电极与检测层的接触面积。
<计时安培分析法测量>
实施例1和比较例1的葡萄糖传感器的电极响应性通过计时安培分析法测量来评价。将具有100mg/dl、300mg/dl以及600mg/dl葡萄糖浓度的全血引入到葡萄糖传感器的样本引入单元中并且随后按梯度方式向工作电极施加200mv电压以测量响应电流,从而执行计时安培分析法测量。
表1中呈现了在从电压施加开始起之后5秒钟的cv值(同时再现性),而表2呈现了在从电压施加开始起之后30秒钟的cv值。
[表1]
[表2]
在这些浓度中的任一个中,与比较例1的cv值相比,实施例1的cv值获取令人满意的值。由此,揭示了当控制工作电极上的检测层(试剂层)的面积时,改进了cv值,具体来说,降低了生物传感器之间的误差并且稳定化了准确度。
进而,分别将具有0、100mg/dl、300mg/dl、600mg/dl以及800mg/dl葡萄糖浓度的全血引入到实施例1和比较例1的传感器的样本引入单元中,并且随后按梯度方式向工作电极施加200mv电压以测量响应电流。图6中呈现了实施例1的计时安培分析法测量的结果(样本数n=5至6),而图7中呈现了比较例1的计时安培分析法测量的结果(样本数n=5)。
如图6和图7中所揭示,响应电流波形在比较例1的样本之间不一致,而实施例1中的波形比比较例1更一致(更接近)。这揭示了,在实施例1中,样本之间的响应电流的不一致性可以通过检测层8的面积控制来降低。
[测试2]
[实施例2]
对于实施例2来说,将具有实施例1中描述的配方的液体试剂滴落(分配)到如比较例1描述的酶电极的工作电极上,以获取实施例2的生物传感器。作为实施例2的生物传感器,制备试剂面积占据工作电极(w电极)整个面积的生物传感器、试剂占据工作电极的1/2面积的生物传感器,以及试剂占据工作电极的1/4面积的生物传感器。
[比较例2]
对于比较例2来说,将具有实施例1中描述的配方(从中去除了交联剂)的液体试剂滴落(分配)到如比较例1描述的酶电极的工作电极上,以获取比较例2的生物传感器。作为比较例2的生物传感器,制备试剂面积占用工作电极(w电极)整个面积的生物传感器、试剂占用工作电极的1/2面积的生物传感器,以及试剂占用工作电极的1/4面积的生物传感器。在实施例2和比较例2两者中,将试剂以不位于工作电极之外的方式进行分配。
对于实施例2和比较例2中的每一个传感器来说,将各具有030mg/dl和600mg/dl葡萄糖浓度的全血引入传感器的样本引入单元中,并且随后按梯度方式向工作电极施加200mv电压,以测量经过20秒钟之后的响应电流。
图8呈现了在向实施例2的生物传感器施加电压之后20秒钟的响应电流值的测量结果的比率,而图9呈现了在向比较例2的生物传感器施加电压之后20秒钟的响应电流值的测量结果的比率。
如图8和图9中呈现的,确认与比较例2相比(和葡萄糖浓度无关),在实施例2中响应电流值与占据工作电极的试剂面积的百分比成比例地降低。具体来说,在实施例2中,揭示了当使用包含交联剂的试剂(检测层)时,可以获取具有合适地取决于试剂面积的响应电流值的生物传感器。
- 还没有人留言评论。精彩留言会获得点赞!