一种快速定量检测微量白蛋白的均相荧光免疫试剂及制备与检测方法与流程
本发明属于医学检验领域,具体涉及一种快速定量检测微量白蛋白的均相荧光免疫试剂及制备与检测方法。
背景技术:
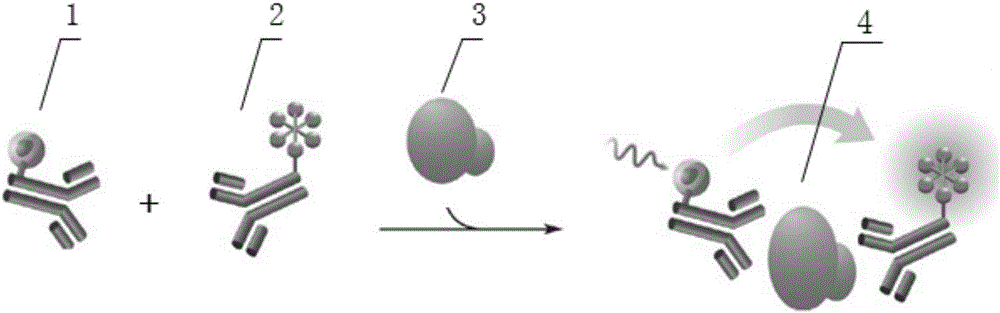
:血清白蛋白部分可由肾小球通过,但几乎皆被肾小管重吸收,当肾小球病变时其滤过量增多,以致超过肾小管的重吸收而从尿中排出,便形成尿微量白蛋白(MAU)。尿微量白蛋白是指尿中白蛋白的排泄率每分钟超过20mg或24h超过30mg,浓度为30-200mg/L,用常规方法无法检出。大量研究已证明尿微量白蛋白阳性是肾损伤尤其是肾小球损伤的早期标志,其排出量的多少与肾小球基底膜损伤的程度呈正相关,与1型糖尿病、2型糖尿病的预后有密切关系。近年来的大量研究表明,MAU同时也是高血压、冠心病、自身免疫性疾病等造成肾损伤的早期诊断指标,在临床上受到越来越广泛的重视。糖尿病(DM)患病率逐年增加,早期发病多隐匿无症状,晚期因严重并发症而危及人的健康和生命,因此,其早期发现、诊断和治疗至关重要。对糖尿病患者尿分别用于化学试纸法进行蛋白定性及免疫透射比浊法进行尿微量白蛋白定量检测,结果发现,尿蛋白定性试验的阳性率仅为8.46%,而尿微量白蛋白的阳性率为53.7%,说明MAU的检测更能及早地提示糖尿病性肾损伤。近年来,有关原发性高血压的研究越来越深入,特别是高血压造成的靶器官损害已成为中老年人致死致残的主要因素,业已证明,高血压也是加重肾功能恶化的重要因素之一,25%的终末期肾病与高血压有关。原发性高血压引起的小动脉病变常累及肾血管,使肾小球滤过膜损害,造成尿MAU的排出量增加。高血压患者伴有MAU较为普遍,且随着年龄、病程和高血压的严重程度而升高。有报道在正常高值血压人群和高血压人群,MAU的发生率分别为15.O%和26.2%,明显高于正常血压者的6.5%。因此,对高血压病人的前瞻性研究中MAU被认为是一个预测心血管发病率和死亡率的较好的早期标志。一些研究表明微量白蛋白尿可作为一项评价内皮功能不全以及动脉粥样硬化的可靠指标,它的出现提示发生冠心病的危险性将明显增加。测定非糖尿病的冠心病患者尿中自蛋白的含量,发现其MAU水平明显高于对照组患者,并且随着冠状动脉病变数量和程度的增加,MAU的阳性率均进行性升高,提示MAU与动脉粥样硬化的发生、发展和病变程度关系密切,MAU可能是冠状动脉粥样硬化的标志。因此,MAU的检测不仅对肾脏疾病的诊断有重要价值,而且与非肾源性疾病如糖尿病、心血管疾病等有着密切的联系,因此,将MAU作为一项常规检测,对这些疾病的早期诊断、病情发展、预后以及临床指导用药等有着重要的临床意义。临床实验室常采用放射免疫测定法(RIA)、免疫比浊法(IT)、荧光免疫测定(FIA)、酶免疫测定(EIA)、时间分辨荧光免疫测定法(TRFIA)、间接胶乳凝集试验、Micral-Test和溴酚蓝(BPB)染料结合法测定尿MAU,这些方法的参考值范围变动很大,从5mg/L到超过200mg/L。随着人们对于低水平MAU与心血管疾病关系的认识,这些测定方法的灵敏度远远不能满足要求。疾病的早期诊断和及时治疗是至关重要的。但目前的检测方法,要么需要昂贵的仪器设备和试剂,要么只是半定量的手工方法,操作规范性差。因此,建立一种检测时间尽量缩短,并且检测除了能在实验室进行外,还要求能够进行床旁检测,同时能定量测定MAU方法,从而为临床提供准确的诊断依据,是十分必要的。均相荧光分析法(homogeneousfluoroimmunoassay,HFIA)是在时间分辨荧光免疫分析(time-resoluedfluoroimmunoassay,TRFIA)技术的基础上形成的一种新的荧光免疫分析技术。TRFIA技术采用的荧光物质与传统的荧光染料完全不同,采用的是镧系元素铕(Eu)、锝(Tb)等作为荧光材料,灵敏度非常高,稳定性好,低温条件可保存三年,因而成为二十一世纪最热门的免疫分析技术。均相荧光免疫检测法是用同一抗原的两个抗体分别标记Eu3+和荧光染料Alexa647。Eu3+标记抗体在游离状态时,受到340nm光线激发,只发射平均波长为615nm荧光,而在抗原、抗体复合物形成时,发生能量传递,激发荧光染料Alexa647发射出665nm荧光。标记抗体直接与待测样品进行抗原、抗体反应,如果能形成抗原、抗体复合物,则在665nm出可测得荧光信号。这种方法省却了酶联免疫法反复孵育和洗板等烦琐操作步骤,几分钟就能获得结果,省时省力。并且,此法也相应地避免了许多人为操作因素和试剂、环境等外界因素的干扰,稳定性和重复性都较好,能较真实地反映被测物质的含量。此外,Eu3+和Alexa647这对荧光物质的最大发射光波长之间相差较大,未发生抗原抗体反应的本底荧光值就非常低。而人血清中非特异性物质产生的300~500nm荧光,不能激发Alexa647发射荧光信号650nm激发光。因此,非特异性荧光非常低。中国专利文件CN103115904A(申请号:201310027507.1)公开了尿微量白蛋白检测方法、系统和试剂盒。包括:(1)配制尿微量白蛋白浓度不同的多个溶液样本,其中每个所述溶液样本中含有相同浓度的菁染料;(2)检测采集波长处的荧光强度值;(3)获得尿微量白蛋白浓度的标准曲线;(4)在待测液体样品中加入菁染料、含有钾离子或钠离子的缓冲溶液,以使待测液体样品中的菁染料的浓度以及pH值与步骤(1)中的溶液样本一致,从而得到测试溶液,并记录待测液体样品被稀释的比例;(5)检测所述采集波长处的荧光强度值;(6)在标准曲线中找到对应的测试溶液的尿微量白蛋白浓度值,计算出待测样品的尿微量白蛋白浓度;其中所述采集波长在550nm至650nm的范围。该方法是依据颜色深浅变化来测定微量白蛋白含量,检测易受到尿液中一些药物及其代谢产品的影响,特异性较差。中国专利文件CN105301257A(申请号:201510227240.X)公开了一种尿微量白蛋白(mAlb)检测方法,所述检测方法基于胶乳增强免疫比浊法,为液体双试剂,包括试剂R1与R2,所述试剂R1为反应剂,试剂R2为含有白蛋白免疫胶乳颗粒的溶液,其特点在于应用化学方法交联,通过水溶性碳化二亚胺(EDC)与N-羟基琥珀酰亚胺(NHS)使羊抗人白蛋白抗体(也称羊抗人mAlb抗体)与羧化聚苯乙烯胶乳共价交联,形成mAlb抗体胶乳试剂。该方法受乳胶颗粒的均一性的影响,批间差异较大。技术实现要素:针对现有MAU检测技术的不足,本发明提供一种快速检测MAU的均相荧光免疫试剂及制备与检测方法。本发明根据免疫荧光技术特点和MAU抗原抗体系统特点,设计新的原材料,试剂和工艺流程,应用本发明提供的试剂检测MAU水平,具有简单,快速,灵敏和特异性好等特点,可同时定量检测高值和低值样品,并且性价比高,适用于临床快速检测。本发明的技术方案如下:一种快速定量检测微量白蛋白的均相荧光免疫试剂,包括稀土元素螯合物标记的anti-MAU、近红外荧光化合物标记的另一个anti-MAU和系列浓度的MAU校准品。根据本发明,优选的,所述的稀土元素螯合物为铕离子(Eu3+)螯合物,进一步优选BHHCT-Eu3+、BHHBCB-Eu3+。稀土元素螯合物标记的anti-MAU独立包装。根据本发明,优选的,所述的近红外荧光化合物为Alexa或系列染料,进一步优选AlexaFluor647、DyLight-DY647或CF647的染料。近红外荧光化合物标记的另一个anti-MAU独立包装。根据本发明,优选的,所述的MAU校准品是用磷酸盐缓冲液稀释溶解MAU纯品得到;进一步优选的,磷酸盐缓冲液的浓度为0.01mol/L,磷酸盐缓冲液中含有0.01%-0.5%PEG、1%-5%BSA、0.01%-0.05%表面活性剂,均为质量百分比含量;优选的,所述的表面活性剂为吐温20。系列浓度的MAU校准品独立包装,于4℃保存。根据本发明,优选的,所述的MAU校准品的浓度分别为5mg/L、25mg/L、50mg/L、100mg/L、250mg/L。根据本发明,所述的稀土元素螯合物标记的anti-MAU的制备方法,包括步骤如下:将鼠抗人MAU溶液透析后,加入NaHCO3,调pH至9.1,得抗体溶液;将BHHCT或BHHBCB的甲醇溶液滴加到抗体溶液中,搅拌反应,离心除去不溶物后,色谱柱分离标记蛋白质和游离的标记物;紫外/可见分光光度计检测各收集液的A330值,合并含有标记抗体的溶液;加入最终质量百分比浓度为0.1%的BSA和0.05%的NaN3,调pH至6.2;加入EuC13溶液,即得稀土元素螯合物标记的anti-MAU。根据本发明,所述的近红外荧光化合物标记的另一个anti-MAU的制备方法,包括步骤如下:将anti-MAU单克隆抗体,用碳酸氢钠溶液稀释,加入近红外荧光化合物溶解液,搅匀,室温孵育;过柱分离纯化,收集标记好的荧光化合物标记抗体,用磷酸盐缓冲液稀释混匀,即得近红外荧光化合物标记的另一个anti-MAU。根据本发明,所述的系列浓度的MAU校准品的制备方法,包括步骤如下:用含质量百分比浓度为0.01%-0.5%PEG1000、1%-5%BSA、0.01%-0.05%表面活性剂的磷酸盐缓冲液,按照5mg/L、25mg/L、50mg/L、100mg/L、250mg/L的浓度稀释溶解MAU纯品,混合均匀,即得系列浓度的MAU校准品。根据本发明,利用上述均相荧光免疫试剂快速定量检测微量白蛋白的方法,包括步骤如下:先将稀土元素螯合物标记anti-MAU溶液加入反应微孔中,再加入近红外荧光化合物标记的另一个anti-MAU溶液,最后加入MAU校准品,37℃反应20分钟后,用均相荧光免疫分析仪检测荧光强度,依据相对荧光强度数据,制作MAU浓度-荧光强度的标准曲线;将临床检测样品代替MAU校准品,重复上述过程,根据相对荧光强度数据对应标准曲线,得到微量白蛋白含量。本发明的原理:本发明提供的快速定量检测MAU的均相荧光免疫法,其反应原理为双抗体夹心法的均相荧光免疫法。待测样品与适当比例的Eu3+和荧光标记抗体在液相均质介质中充分混和均匀,在此过程中样品中的MAU既能专一性地与Eu3+标记抗MAU抗体充分结合,也能与荧光标记MAU抗体充分反应,形成的Eu3+-anti-MAU1—MAU—anti-MAU2-AlexaFluor647免疫复合物,荧光强度可用均相荧光免疫分析仪器定量测定,荧光强度与样品中MAU浓度成正比。本发明的有益效果如下:1、本发明采用均相荧光免疫快速检测技术,利用荧光的高灵敏特点,同样也避免了胶体金或者荧光MAU干式免疫试纸中的硝酸纤维素膜本身孔隙不均一特性对检测准确度和重复性的不良影响。由于均相荧光免疫检测中样品与荧光标记抗体全过程都在液相中全面接触,反应充分,因此可大幅度提高检测灵敏度和线性范围,最低检测限可达0.5mg/L,线性范围为5-250mg/L。同时反应在液相进行也增加了样品的稀释倍数,消除了样品的基质效应影响,使定量结果有很好的可重复性,提高了定量结果的精密度和准确度,可满足临床诊断大规模检测的要求。2、应用本发明提供的试剂检测人体内MAU水平,成本低廉,操作简单、快速、灵敏,且特异性好,只需要配套专用均相荧光免疫检测仪,因此可广泛应用于各级医疗检验场所,尤其是基层医疗机构,包括乡镇卫生院等均可开展。3、本发明可同时检测高值和低值MAU,尤其是低值MAU,其对于心脑血管事件发生的预防有极为重要的意义。附图说明图1为本发明免疫检测原理结构示意图。其中,1:Eu3+标记anti-MAU;2:Alexa647标记anti-MAU;3:校准品或待测样本中MAU;4:Eu3+-anti-MAU—MAU—anti-MAU-Alexa647免疫复合物。图2为本发明试验例1中MAU浓度的标准曲线。图3为本发明试验例2中MAU相关性分析曲线。具体实施方式下面结合具体实施方式对本发明作进一步说明,凡依照本发明公开内容所作出的本领域等同替换,均属于本发明的保护范围。实施例中“%”均为质量百分比。实施例1:定量检测微量白蛋白(MAU)均相荧光免疫试剂的制备方法,包括如下步骤:1、标记用anti-MAU的准备:选用纯化的基因工程表达的抗MAU单克隆抗体。Eu3+标记用抗MAU单克隆抗体商品编号为19C7;荧光素标记用抗MAU单克隆抗体商品编号为16A11和560。2、稀土元素螯合物标记anti-MAU的制备:用3L0.9%NaCl于4℃透析鼠抗人MAU单抗19C7溶液(3mg/mL)两次,每次24hr。加水调浓度至1.5mg/mL。取0.6mL该抗体溶液,加入1mLNaHCO3(0.2mol/L),并用1mol/LNaOH调pH至9.1。将20μlBHHCT甲醇溶液(30μg/mL)滴加到搅拌下的抗体溶液中,并继续搅拌反应lhr。离心(10000rpm,10min)除去不溶物后,上SephadexG-50柱,用0.05mol/LNH4HCO3(pH=8.0)洗脱,分离标记蛋白质和游离的标记物。紫外/可见分光光度计检测各收集液的A330值,合并含有标记抗体的溶液。加入终浓度为0.1%的BSA和0.05%的NaN3,用1mol/LHCl调pH至6.2。分装后-20℃储存备用。用于免疫分析前,加入EuC13溶液(BHHCT与Eu3+等摩尔浓度)。用于免疫分析时,用标记物稀释液稀释使用,2-8℃分装保存。3、Alexa647标记抗体的制备:将抗MAU单克隆抗体16A11、560,分别用0.1mol/L碳酸氢钠溶液稀释至1mg/mL,各取5mL抗体溶液,分别加入30mg荧光素Alexa647溶解液,搅匀,室温孵育1小时,每隔15分钟混匀一次。最后用G25凝胶柱过柱分离纯化,收集标记好的荧光素标记抗体,用含0.01%PEG、1%BSA、5%甘油、0.01%表面活性剂的0.01mol/L磷酸盐缓冲液稀释,用塑料瓶密封包装,于4℃保存。4、系列浓度MAU校准品的制备:用含0.08%PEG1000、4.5%BSA、0.045%表面活性剂的0.01mol/L磷酸盐缓冲液,按照5mg/L、25mg/L、50mg/L、100mg/L、250mg/L的浓度稀释溶解MAU纯品,混匀后于4℃保存。实施例2:本实施例的制备方法与实施例1基本相同,不同点在于:步骤2中,稀土元素螯合物标记anti-MAU的制备方法是:用3L0.9%NaCl于4℃透析鼠抗人MAU溶液(3mg/mL)两次,每次24hr。加水调浓度至1.5mg/mL。取0.6mL该抗体溶液,加入1mLNaHCO3(0.2mol/L),并用1mol/LNaOH调pH至9.1。将20μLBHHBCB甲醇溶液(30μg/mL)滴加到搅拌下的抗体溶液中,并继续搅拌反应lhr。离心(10000rpm,10min)除去不溶物后,上SephadexG-25柱,用0.05mol/LNH4HCO3(pH=8.0)洗脱,分离标记蛋白质和游离的标记物。紫外/可见分光光度计检测各收集液的A330值,合并含有标记抗体的溶液。加入终浓度为0.1%的BSA和0.05%的NaN3,用1mol/LHCl调pH至6.2。分装后-20℃储存备用。用于免疫分析前,加入EuC13溶液(BHHBCB与Eu3+等摩尔浓度)。用于免疫分析时,用标记物稀释液稀释使用,2-8℃分装保存。实施例3:本实施例的制备方法与实施例1基本相同,不同点在于:步骤3中,将抗MAU单克隆抗体16A11、560,分别用0.1mol/L碳酸氢钠溶液稀释至1mg/mL,各取5mL抗体溶液,分别加入40mg荧光素DyLight-DY647溶解液,搅匀,室温孵育1.5小时,每隔15分钟混匀一次。最后用G25凝胶柱过柱分离纯化,收集标记好的荧光素标记抗体,用含0.05%PEG600、3.5%BSA、10%甘油、0.05%表面活性剂的0.01mol/L磷酸盐缓冲液稀释,用塑料瓶密封包装,于4℃保存。实施例4:本实施例的制备方法与实施例1基本相同,不同点在于:步骤3中,将抗MAU单克隆抗体16A11、560,分别用0.1mol/L碳酸氢钠溶液稀释至1mg/mL,各取5mL抗体溶液,分别加入50mg荧光素CF647溶解液,搅匀,室温孵育2小时,每隔15分钟混匀一次。最后用G25凝胶柱过柱分离纯化,收集标记好的荧光素标记抗体,用含0.03%PEG、5%BSA、10%甘油、0.05%表面活性剂的0.01M磷酸盐缓冲液稀释,用塑料瓶密封包装,于4℃保存。实施例5:在临床检测中,实验步骤为:先将50μL的稀土元素螯合物标记anti-MAU溶液加入反应微孔中,再加入50μL的近红外荧光化合物标记的另一个anti-MAU溶液,最后分别加入50μL的MAU校准品,37℃反应20分钟后,用均相荧光免疫分析仪检测荧光强度,依据相对荧光强度数据,制作MAU浓度-荧光强度的标准曲线;将临床检测样品代替MAU校准品,重复上述过程,根据相对荧光强度数据对应标准曲线,得到微量白蛋白含量。用均相荧光免疫分析仪检测判读结果。试验例1:用均相荧光免疫分析仪检测荧光强度,各浓度校准品检测结果如下:MAU浓度(mg/L)52550100250相对荧光强度418876153728926168依据相对荧光强度数据,制作MAU的标准曲线,如图2所示,线性范围为5-250mg/L。MAU的标准曲线计算公式为Y=23.51X+355.7,R2=0.997。对浓度为5mg/L校准品进行系列稀释检测,本方法最低检测限可达0.5mg/L。试验例2:采用本发明方法试剂,用均相荧光免疫分析仪检测43例临床冠心病患者血清样本,同步采用瑞士Roche公司的电化学法MAU试剂进行对比检测,进行相关性分析,如图3所示。由图3可知,本发明与已上市产品检测结果一致,具有临床等效性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1