细胞信息获取方法以及细胞信息获取装置与流程
本发明涉及细胞信息获取方法以及细胞信息获取装置。
背景技术:
以细胞的增殖、分化为首的各种生命现象中,蛋白质、mRNA、microRNA等各种分子在细胞中局部存在。在解析细胞中的各种分子的局部存在时,期待分子的功能解析、蛋白质间相互作用的解析、信号传递路径的解析等大量的生命现象的解明。
在国际公开第2005/098430号中,公开了通过荧光显微镜以及成像流式细胞仪来解析细胞内的分子的局部存在的方法。
即使是来历相同的同种的细胞,各个细胞也是多种多样的,所以,例如,既有如图23(a)所示特定的分子在特定的部位局部存在的细胞,也有如图23(b)所示特定的分子在其它部位局部存在的细胞。另外,例如,还存在如图23(c)所示分子的量由于各种因素而在细胞之间不均匀的情况。另外,发明人发现了如果想要从细胞中的分布以及量多种多样的分子获取信息,则在获取结果中会产生偏差。因此,期望精度良好地解析这样细胞中的分布以及量多种多样的分子的手法。
技术实现要素:
本发明的范围仅由所附的权利要求书限定,不受此发明内容说明的任何影响。
本发明的第1方案涉及细胞信息获取方法。在本方案的细胞信息获取方法中,使荧光波长相互不同的多个荧光物质与细胞中包含的被检测物质结合,对细胞照射光而使得从多个荧光物质产生波长以及强度不同的荧光,根据产生的各荧光获取多个荧光信息。
在本方案的细胞信息获取方法中,“荧光波长相互不同的多个荧光物质”是指,在被照射了光时多个荧光物质分别发出相互不同的波长的荧光。为了使得从多个荧光物质产生波长以及强度不同的荧光,例如在多个荧光物质中,激励用的光的波长相互不同的情况下,针对细胞照射波长以及强度不同的多个光。荧光信息例如是基于荧光的图像。此外,“使多个荧光物质与被检测物质结合”是指,也可以未必是细胞中包含的同种的被检测物质的各分子全部与多个荧光物质结合,多个荧光物质特别地与至少一部分的同种的被检测物质的分子结合即可。
在细胞中的被检测物质的分布以及量是多种多样的情况下,存在从荧光物质产生的荧光的强度过强的情况、过弱的情况,所以使用1个荧光信息未必能够适当地判别被检测物质的分布状况等。然而,根据本方案的细胞信息获取方法,使得从与被检测物质结合的多个荧光物质产生强度不同的荧光,能够根据强度不同的荧光获取多个荧光信息。由此,即使利用一个荧光信息时由于荧光过强而无法适当地判别被检测物质的分布状况等的情况下,如果使用其它荧光信息,就能够适当地判别被检测物质的分布状况等。因此,只要使用某一个荧光信息就能够适当地判别被检测物质的分布状况等,所以即使细胞中的被检测物质的分布以及量是多种多样,也能够精度良好地解析被检测物质。
本发明的第2方案涉及细胞信息获取方法。在本方案的细胞信息获取方法中,使基质与细胞中包含的被检测物质接触来使得产生荧光波长相互不同的多个荧光物质,对细胞照射光而使得从多个荧光物质产生波长以及强度不同的荧光,根据产生的各荧光获取多个荧光信息。
在本方案的细胞信息获取方法中,使基质与细胞中包含的被检测物质接触来使得产生荧光波长相互不同的多个荧光物质,由此用多个荧光物质标识被检测物质。在本方案的细胞信息获取方法中,也与第1方案同样地,只要使用某一个荧光信息就能够适当地判别被检测物质的分布状况等,所以能够精度良好地解析被检测物质。
本发明的第3方案涉及细胞信息获取方法。在本方案的细胞信息获取方法中,使荧光物质与细胞中包含的被检测物质结合,对细胞照射光而使得从荧光物质产生荧光,从产生的荧光获取波长以及强度不同的多个荧光,根据获取的各荧光获取多个荧光信息,根据多个荧光信息,判别细胞中的被检测物质的分布状况。
在本方案的细胞信息获取方法中,1种荧光物质与被检测物质结合。为了从产生的荧光获取波长以及强度不同的多个荧光,例如,使从荧光物质产生的荧光通过透射波长段不同的多个滤光片部件而分离。此外,在本方案的细胞信息获取方法中,荧光信息也是例如基于荧光的图像。另外,也可以未必是细胞中包含的同种的被检测物质的各分子全部与荧光物质结合,荧光物质特别地与至少一部分的同种的被检测物质的分子结合即可。在本方案的细胞信息获取方法中,也与第1方案同样地,只要使用某一个荧光信息就能够适当地判别被检测物质的分布状况等,所以能够精度良好地解析被检测物质。
本发明的第4方案涉及细胞信息获取方法。在本方案的细胞信息获取方法中,使基质与细胞中包含的被检测物质结合来使得产生荧光物质,对细胞照射光而使得从荧光物质产生荧光,从产生的荧光获取波长以及强度不同的多个荧光,根据获取的各荧光获取多个荧光信息,根据多个荧光信息,判别细胞中的被检测物质的分布状况。
在本方案的细胞信息获取方法中,通过使基质与细胞中包含的被检测物质接触来使得产生荧光物质,用荧光物质标识被检测物质。在本方案的细胞信息获取方法中,也与第3方案同样地,只要使用某一个荧光信息就能够适当地判别被检测物质的分布状况等,所以能够精度良好地解析被检测物质。
本发明的第5方案涉及细胞信息获取装置。本方案的细胞信息获取装置具备:光照射部,对包含结合了荧光波长相互不同的多个荧光物质的被检测物质的细胞照射光,使得从多个荧光物质产生波长以及强度不同的荧光;受光部,接受从多个荧光物质产生的各荧光;以及获取部,根据强度不同的荧光获取多个荧光信息。
根据本方案的细胞信息获取装置,能够起到与第1方案同样的效果。
本发明的第6方案涉及细胞信息获取装置。本方案的细胞信息获取装置具备:光照射部,对包含结合了荧光物质的被检测物质的细胞照射光而使得从荧光物质产生荧光;受光部,接受从荧光物质产生的波长及强度不同的多个荧光;获取部,根据所接受到的多个荧光,获取多个荧光信息;以及解析部,根据多个荧光信息,判别细胞中的被检测物质的分布状况。
根据本方案的细胞信息获取装置,能够起到与第3方案同样的效果。
本发明的第7方案涉及细胞信息获取装置。本方案的细胞信息获取装置具备:光照射部,对包含通过与基质接触而使得产生荧光物质的被检测物质的细胞照射光而使得从荧光物质产生荧光;受光部,接受从荧光物质产生的波长及强度不同的多个荧光;获取部,根据所接受到的多个荧光,获取多个荧光信息;以及解析部,根据多个荧光信息,判别细胞中的被检测物质的分布状况。
根据本方案的细胞信息获取装置,能够起到与第4方案同样的效果。
根据本发明,能够精度良好地解析细胞中的分布以及量多种多样的分子。
附图说明
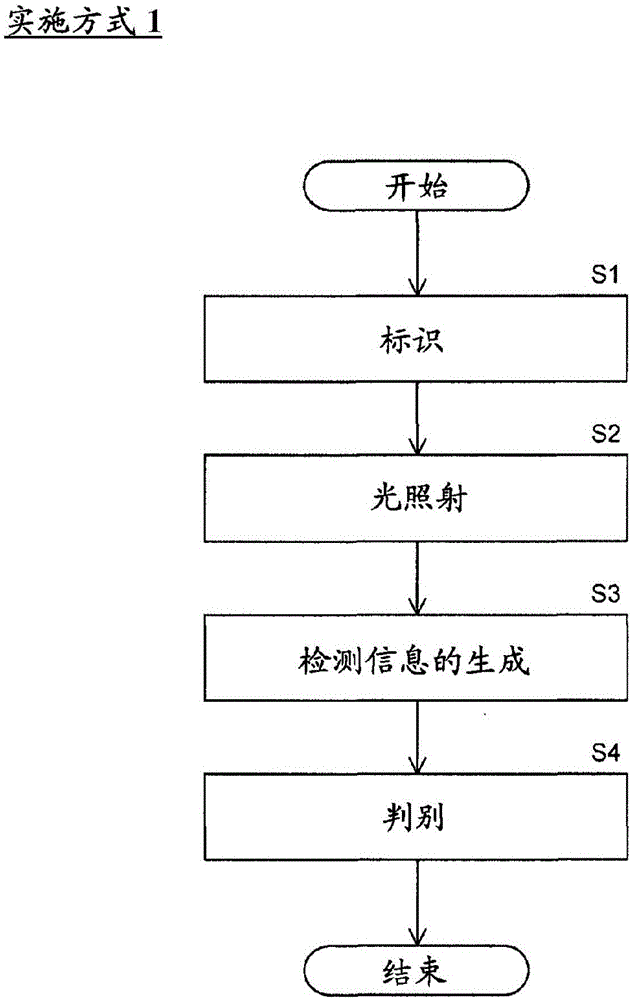
图1是示出实施方式1的细胞信息获取方法的流程图。
图2是示出实施方式1的荧光获取的概要的图。
图3是示出根据实施方式1的高强度的荧光以及低强度的荧光获取的图像的概念图。
图4(a)是示出在实施方式1的验证中获取的图像的图。图4(b)是示出在实施方式1的验证中获取的数值的图。
图5是示出实施方式1的装置的结构的框图。
图6是示出实施方式1的光学检测部的结构的图。
图7是示出实施方式1的变更例的光学检测部的结构的图。
图8是示出实施方式1的利用细胞信息获取装置进行的处理的流程图。
图9是示出在实施方式1的显示部中显示的画面的图。
图10是示出根据实施方式1的变更例的高强度的荧光以及低强度的荧光获取的图表的概念图。
图11是示出实施方式2的荧光获取的概要的图。
图12是示出实施方式3的荧光获取的概要的图。
图13是用于说明实施方式3的滤光片部件的透射波长段以及获取的荧光的波长段的图。
图14是示出在实施方式3的验证中获取的图像的图。
图15是示出实施方式3的光学检测部的结构的图。
图16是示出实施方式4的荧光获取的概要的图。
图17是示出实施方式4的光学检测部的结构的图。
图18是示出实施方式5的荧光获取的概要的图。
图19是示出实施方式5的光学检测部的结构的图。
图20是示出实施方式6的荧光获取的概要的图。
图21是示出在实施方式6的验证中获取的图像的图。
图22是示出实施方式7的荧光获取的概要的图。
图23是用于说明发明想要解决的课题的示意图。
具体实施方式
以下将参考附图描述本发明的优选实施例。
<实施方式1>
在实施方式1中,在使荧光波长相互不同的多个荧光物质与细胞中包含的被检测物质相结合并根据从荧光物质产生的多个荧光来判别被检测物质的局部存在状况的细胞信息获取方法中,应用了本发明。在实施方式1中,被检测物质是NF-κB。作为转录因子的NF-κB在与IκB形成了复合体的状态下存在于细胞质内,认为通过由于各种刺激引起的IκB的分解而转移到核的内部。在实施方式1中,进行如下解析:将NF-κB作为被检测物质,用荧光物质特别地标识,根据来自荧光物质的荧光,判定NF-κB存在于细胞质和核中的哪一个。此外,被检测物质也可以是NF-κB以外的蛋白质、分子。例如,被检测物质也可以是NF-κB以外的转录因子,例如,也可以是STAT(Signal Transducer and Activator of Transcription,信号转导与转录激活因子)、NFAT(nuclear factor of activated T cells,活化T细胞的核因子)、HIF(hypoxia-inducible factor,缺氧诱导因子)。另外,被检测物质也可以是mRNA、microRNA。另外,“使多个荧光物质与被检测物质结合”是指,未必是细胞中包含的同种的被检测物质的各分子全部与多个荧光物质结合,多个荧光物质特别地与至少一部分的同种的被检测物质的分子结合即可。另外,局部存在状况的判别不限于被检测物质局部存在于核中还是局部存在于细胞质中的判别。例如,在如神经细胞那样具有突起形状的情况下,也可以判别被检测物质是否局部存在于突起的前端。
如图1所示,细胞信息获取方法包括步骤S1~S4的步骤。以下,说明操作者使用能够对荧光图像进行摄像的流式细胞仪和能够对摄像的图像进行解析的处理装置来执行图1的细胞信息获取方法的情况。图1的各步骤也可以通过细胞信息获取装置中的处理来执行。随后,参照图5以后,说明细胞信息获取装置进行图1的各步骤的情况下的结构以及处理。
在步骤S1中,操作者用荧光波长相互不同的荧光物质11、12标识从被检者提取的细胞中包含的NF-κB。例如,如图2所示,经由一次抗体和二次抗体,荧光物质11、12与细胞中包含的NF-κB结合。荧光物质11、12既可以通过多个一次抗体而与NF-κB结合,也可以通过抗体的一部分或者抗体的全部而与NF-κB结合。另外,在步骤S1中,操作者用荧光波长与荧光物质11、12不同的荧光物质13,标识细胞中包含的核。
荧光物质11、12、13是荧光色素。荧光物质11、12、13分别构成为当被照射波长λ1、λ2、λ3的光时激励相互不同的波长段的荧光。即,用于从荧光物质11~13激励荧光的光的波长被设定为相互不同。这样,通过步骤S1调制试样。此外,在被检测物质是mRNA、microRNA的情况下,荧光物质经由核酸探测器而与被检测物质结合。
在步骤S2中,操作者驱动流式细胞仪,使包含用荧光物质11~13标识的细胞的试样流入到流通池,对在流通池中流动的细胞照射波长λ1~λ3的光,使得从荧光物质11~13产生荧光。
如图2所示,当对细胞照射波长λ1~λ3的激光时,从荧光物质11~13分别产生不同的波长段的荧光。滤光片部件21使从荧光物质11产生的波长段B1的荧光通过,遮断波长段B1以外的光。通过滤光片部件21,从荧光物质11产生的波长段B1的荧光被分离。滤光片部件22使从荧光物质12产生的波长段B2的荧光通过,遮断波长段B2以外的光。通过滤光片部件22,从荧光物质12产生的波长段B2的荧光被分离。滤光片部件23使从荧光物质13产生的波长段B3的荧光通过,遮断波长段B3以外的光。通过滤光片部件23,从荧光物质13产生的波长段B3的荧光被分离。
在此,以高功率对细胞照射波长λ1的激光,以低功率对细胞照射波长λ2的激光。通过以高功率对细胞照射波长λ1的激光,通过了滤光片部件21的波长段B1的荧光成为高强度。通过以低功率对细胞照射波长λ2的激光,通过了滤光片部件22的波长段B2的荧光成为低强度。
在步骤S3中,处理装置根据从荧光物质11~13产生的荧光,针对每个细胞获取3个荧光信息。流式细胞仪具备用于使通过滤光片部件21~23分离的波长段B1~B3的荧光分别成像到由摄像元件构成的受光部而获取基于各荧光的图像的结构。处理装置根据流式细胞仪的受光部输出的摄像信号,获取基于波长段B1的高强度的荧光的图像、基于波长段B2的低强度的荧光的图像以及基于波长段B3的荧光的图像作为荧光信息。
关于波长段B1~B3的荧光,既可以通过3个受光部分别个别地进行摄像,也可以通过1个受光部进行摄像。光学系统构成为,在通过1个受光部对波长段B1~B3的荧光进行摄像的情况下波长段B1~B3的荧光在受光部的受光面上在不同的区域中成像。
如图3所示,当是NF-κB局部存在于核中的细胞的情况下,在步骤S3中,例如获取图像31、32。图像31是基于波长段B1的高强度的荧光的图像,图像32是基于波长段B2的低强度的荧光的图像。在图像31、32中,设定核存在的区域33。区域33是从基于与图像31、32同时生成的波长段B3的荧光即从核产生的荧光的图像获取的。
在是NF-κB局部存在于细胞质中的细胞的情况下,在步骤S3中,例如获取图像41、42。图像41是基于波长段B1的高强度的荧光的图像,图像42是基于波长段B2的低强度的荧光的图像。在图像41、42中都设定核存在的区域43。区域43是从基于与图像41、42同时生成的波长段B3的荧光的图像获取的。
在是NF-κB的发现量少的细胞的情况下,根据图像31,荧光的强度适当,并且在核与细胞质之间在荧光强度上出现差异,所以能够判别NF-κB局部存在于核的区域33。另一方面,根据图像32,荧光的强度过低,所以无法判别NF-κB局部存在于核的区域33。另一方面,在是NF-κB的发现量多的细胞的情况下,根据图像41,荧光的强度过高,所以成为在核与细胞质之间在荧光强度上没有差异的状态。因此,无法判别NF-κB局部存在于核的区域43和比核的区域43宽的细胞质的区域中的哪一个区域。另一方面,根据图像42,荧光的强度适当,并且在核与细胞质之间在强度上产生差异,所以能够判别NF-κB局部存在于比核的区域43宽的细胞质的区域。
在NF-κB局部存在于细胞质中的情况下,NF-κB以包围核的方式分布在细胞内。即,在摄像方向上观察了细胞时,在核的跟前也分布有NF-κB。因此,在基于高强度的荧光的图像41中,通过分布在核的跟前的NF-κB在核的区域中也产生强的荧光。因此,在图像41中,存在无法适当地判别NF-κB局部存在于核中还是局部存在于细胞质中的趋势。相对于此,在基于低强度的荧光的图像42中,虽然通过分布在核的跟前的NF-κB在核的区域中也产生荧光,但该荧光的强度低。因此,在图像41中,即使NF-κB局部存在于细胞质中的情况下,也能够适当地判别局部存在状况。
另外,在NF-κB局部存在于核中的情况下,NF-κB的一部分分布在细胞质中,但大半分布在核内。因此,在基于高强度的荧光的图像31中,从分布在核内的NF-κB产生强的荧光,能够适当地判别NF-κB局部存在于核中。另一方面,在基于低强度的荧光的图像32中,来自分布在核内的NF-κB的荧光过弱,所以存在无法适当地判别NF-κB局部存在于核中还是局部存在于细胞质中的趋势。
这样,根据作为细胞内的被检测物质的NF-κB的量和分布,用于判别NF-κB的局部存在的适当强度不同。
因此,波长λ1的激光的功率被设定为在NF-κB局部存在于核中的细胞中能够适当地判别如图像31所示NF-κB局部存在于核中。波长λ2的激光的功率被设定为在NF-κB局部存在于细胞质中的细胞中能够适当地判别如图像42所示NF-κB局部存在于细胞质中。由此,在成为判别对象的细胞中,不论NF-κB局部存在于核和细胞质中的哪一个中,都能够使用2个图像中的至少某一方来判别NF-κB的局部存在。
返回到图1,在步骤S4中,操作者参照基于波长段B1的高强度的荧光的图像和基于波长段B2的低强度的荧光的图像,判别作为被检测物质的NF-κB的分布状况。具体而言,操作者选择基于波长段B1的高强度的荧光的图像和基于波长段B2的低强度的荧光的图像中的、能够判别NF-κB的局部存在位置的图像,根据该图像,判别在该细胞中NF-κB局部存在于核和细胞质中的哪一个中、即局部存在状况。也可以代替局部存在状况,判别NF-κB分布在哪个位置、例如细胞内的分布范围等。
如上所述,在实施方式1中,通过调整从标识了NF-κB的荧光物质11、12产生的2个荧光,成为基于高强度的荧光的图像和基于低强度的荧光的图像中的某一方能够适当地判定NF-κB的局部存在的状态。因此,操作者能够根据2个图像,精度良好地解析细胞中的分布多种多样的NF-κB。具体而言,能够精度良好地判别细胞中的NF-κB的局部存在状况、即NF-κB局部存在于核和细胞质中的哪一个。
另外,在实施方式1中,还考虑如下情况:即使NF-κB局部存在于核中的情况下,由于NF-κB的量多,所以成为图像31的荧光的强度过高的状态,成为图像32的荧光的强度适当的状态。在该情况下,也通过使用荧光的强度适当的图像32来能够判别NF-κB局部存在于核中。另外,还考虑如下情况:即使在NF-κB局部存在于细胞质中的情况下,由于NF-κB的量少,所以成为图像41的荧光的强度适当的状态,成为图像42的荧光的强度过低的状态。在该情况下,也通过使用荧光的强度适当的图像41来能够判别NF-κB局部存在于细胞质中。这样,根据实施方式1,根据2个图像,无论NF-κB的量多少,都能够精度良好地判别细胞中的NF-κB的局部存在状况。
在此,血管内皮细胞从血管的内壁剥离而流入到血液中。血管内皮细胞的剥离,除了由于因炎症所致的刺激而产生以外,还由于因压迫等所致的压力的变化也产生。在由于因炎症所致的刺激而剥离的血管内皮细胞中,NF-κB倾向于局部存在于核中,在由于因炎症所致的刺激以外的刺激而剥离的血管内皮细胞中,NF-κB倾向于不局部存在于核中。根据实施方式1,如上所述能够精度良好地判别NF-κB的局部存在,所以能够根据作为信号分子的NF-κB是否局部存在于核中来判定是由于这些剥离原因中的炎症所致的刺激而产生的剥离,能够判定血管内皮细胞有无活性化。由此,例如,能够判断血管内皮细胞的剥离是由于采血时的压迫而产生还是以疾病等为主要原因而产生,有临床上的意义。
也可以通过与波长λ1、λ2不同的波长的中功率的激光,获取中强度的荧光的图像。即,也可以用荧光波长相互不同的3个荧光物质标识NF-κB,对细胞照射3个激光而使得从3个荧光物质产生强度不同的荧光来获取基于各荧光的图像。由此,通过从荧光的强度不同的3个图像中使用最适当的图像,能够精度更良好地判别NF-κB的局部存在。从被检测物质产生的荧光的强度也可以是4个等级以上,也可以针对1个细胞获取基于4个以上的强度的荧光的4个以上的图像。
进而,在步骤S4中,操作者根据如上所述判别的每个细胞的局部存在状况,获取试样中包含的细胞中的、NF-κB局部存在于特定部位中的细胞的比例。具体而言,如果将判别为NF-κB局部存在于核中的细胞的数量设为N1,将判别为NF-κB局部存在于细胞质中的细胞的数量设为N2,则操作者通过以下的式,获取核局部存在率和细胞质局部存在率。此外,在步骤S4中,操作者也可以代替核局部存在率和细胞质局部存在率而获取核局部存在数和细胞质局部存在数。
核局部存在率={N1/(N1+N2)}×100
细胞质局部存在率={N2/(N1+N2)}×100
在步骤S2中,如上所述使用流式细胞仪来获取了各荧光的图像,但不限于此,也可以使用显微镜,获取各荧光的图像作为荧光信息。即,也可以通过显微镜,获取从荧光物质11产生的高强度的荧光图像、从荧光物质12产生的低强度的荧光图像以及从荧光物质13产生的与核对应的图像。
<实施方式1的验证>
接下来,说明发明人进行的实施方式1的验证。
1.准备
作为细胞,准备了人类心脏微小血管内皮细胞(HMVEC-C)(Lonza CatNo.CC-7030,Lot No.0000296500(P4))。作为一次抗体,准备了NF-κB p65(D14E12)XP Rabbit mAb(Cell Signaling Technologies #8242S)。作为二次抗体,准备了Goat anti-Rabbit IgG(H+L)Secondary Antibody,Alexa Fluor 647 conjugate(Life technologies A-21245)、Goat anti-Rabbit IgG(H+L)Secondary Antibody,Alexa Fluor 488 conjugate(Life technologies A-11008)。对二次抗体,作为荧光色素,结合了Alexa Fluor 647、Alexa Fluor 488。作为核染色色素,准备了Cellstain Hoechst 33342 solution(DOjinDO H342)。另外,准备了EGM-2MV Medium(Lonza Cat No.CC-3202)、EGM-2MV SingleQuots Kit(Lonza Cat No.CC-3202)、PBS pH7.4(GIBCO Cat No.10010-023)、BSA(LAMPIRE Cat No.7500805)、PFA(WAKO Cat No.160-16061)、TritonX100(Nacalai Tesque CatNo.35501-15)。
2.试剂调制
对500mL的EGM-2MV Medium添加EGM-2MV SingleQuots Kit的FBS以外的试剂,将100mL移到无菌瓶,制作了无血清培养基。对无血清培养基制作的剩余量(400mL),添加20mL的Single Quots Kit的FBS,制作出培养基。在利用pH12的PBS溶解多聚甲醛以其最终浓度为8%w/v之后,调整为pH7.4。对PBS加上1.5g的BSA并溶解而补足成50mL,调制了3%BSA/PBS。对PBS加上0.5g的BSA并溶解而补足成50mL,调制了1%BSA/PBS。利用PBS调制TritonX100以其最终浓度为0.1%w/v。
3.步骤
HMVEC-C是遵照制造商推荐协议,利用EGM-2MV培养基来培养的。在本验证中使用了从购入后起继代次数为6次以内的细胞。关于培养基,将开封后的使用期限设为3周期间。关于TNF-α刺激培养,去除约70%合流的HMVEC-C细胞的培养上清,加上以成为最终浓度25ng/mL的方式添加了Recombinant Human TNF-alpha的EGM-2MV培养基,并在37℃的CO2恒温箱内静置了1小时。保留3mL左右而用电动移液器去除培养基,并用刮刀剥离了细胞。加上与回收的悬浮液等量的8%PFA/PBS,在室温下反应了15分钟。在室温下,以1000rpm进行了3分钟的离心分离。用1mL的PBS将细胞颗粒冲洗了2次。去除上清,加上1mL的0.1%Triton X-100/PBS,在室温下反应了15分钟。在室温下,以1000rpm进行了3分钟的离心分离。用1mL的1%BSA/PBS冲洗了2次。去除上清,加上1mL的3%BSA/PBS,在室温下静置了30分钟。在3%BSA/PBS中添加了1/1600的400μL的一次抗体。在室温下反应了1小时。在室温下,以1000rpm进行了3分钟的离心分离。用1mL的1%BSA/PBS进行了冲洗。在3%BSA/PBS中添加了1/1000的400μL的二次抗体。在室温下反应了30分钟。用1mL的1%BSA/PBS冲洗了2次。去除上清,添加了50μL的1%BSA/PBS。
4.利用流式细胞仪进行检测
作为能够获取荧光图像的流式细胞仪,使用了ImageStreamX Mark II Imaging Flow Cytometer(Merck Millipore)。使依照上述3调制的试样流入到该流式细胞仪的流通池中,对在流通池中流动的试样,照射了波长488nm、647nm、405nm的激光。波长488nm、647nm、405nm的激光与上述波长λ1、λ2、λ3的激光对应。波长488nm、647nm、405nm的激光的射出功率分别为55mW、10mW、120mW。波长488nm、647nm的激光照射到标识NF-κB的2种荧光色素,由此分别产生了高强度的荧光和低强度的荧光。波长405nm的激光照射到核染色色素而产生了荧光。
在上述流式细胞仪中,经由透射波长段505nm~560nm的滤光片部件,对通过波长488nm的激光产生的荧光进行摄像,获取了高强度的荧光图像。经由透射波长段642nm~740nm的滤光片部件,对通过波长647nm的激光产生的荧光进行摄像,获取了低强度的荧光图像。经由透射波长段430nm~505nm的滤光片部件,对通过波长405nm的激光产生的荧光进行摄像,获取了与核对应的荧光图像。另外,对在流通池中流动的试样,照射了波长被设定为430nm~480nm之间的激光。经由透射波长段430nm~480nm的滤光片部件,对该激光透射了细胞后的光进行摄像,获取了明视场图像。此外,在上述流式细胞仪中,通过滤光片部件等来去除不需要的波长段的光以使成为对象的波长段的光适当地入射到受光部。此外,在本验证中获取了明视场图像,但不限于此,也可以获取暗视场图像。
参照图4(a),说明通过上述检测来获取的图像。
“明视场”表示细胞的明视场图像。“高强度的荧光”和“低强度的荧光”分别是基于从标识了NF-κB的荧光色素产生的高强度的荧光的图像和基于从标识了NF-κB的荧光色素产生的低强度的荧光的图像。“来自核的荧光”是基于从对核进行了染色的核染色用色素产生的荧光的图像。“合成”是合成左侧的4个图像而得到的图像。横向排列的5个图像是从1个细胞获取的图像。“高强度的荧光”、“来自核的荧光”、“低强度的荧光”以及“合成”表示的图像是为方便起见对所获取的彩色图像进行灰阶化而得到的图像。在“高强度的荧光”、“来自核的荧光”以及“低强度的荧光”表示的图像中,白的部分表示荧光的强度强。
在上段所示的细胞的情况下,基于低强度的荧光的图像的强度过低,所以难以判别NF-κB的局部存在。另一方面,基于高强度的荧光的图像的强度适当,所以能够判别为NF-κB局部存在于核中。在下段所示的细胞的情况下,基于高强度的荧光的图像的强度过高,所以难以判别NF-κB的局部存在。另一方面,基于低强度的荧光的图像的强度适当,所以能够判别为NF-κB局部存在于细胞质中。
5.核局部存在率的计算
通过对所获取的图像进行目视,针对每个细胞判别了NF-κB的局部存在。与上述步骤S4同样地进行了该判别。即,根据来自核的荧光图像设定核的区域,将核的区域以外的区域作为细胞质的区域。另外,在认为核的荧光强度为细胞质的荧光强度的约2倍以上的情况下,判别为在该细胞中NF-κB局部存在于核中,在认为核的荧光强度小于细胞质的荧光强度的约2倍的情况下,判别为在该细胞中NF-κB局部存在于细胞质中。
参照图4(b),说明针对用上述流式细胞仪识别的131个细胞判别了NF-κB的局部存在的结果。
判别为局部存在于核中的细胞的数量是44,判别为局部存在于细胞质中的细胞的数量是87。无法判别局部存在的细胞的数量是0。此时的核局部存在率是44/131=34%。
在此,说明仅根据高强度的荧光图像判别了局部存在的比较例1和仅根据低强度的荧光图像判别了局部存在的比较例2。在比较例1的情况下,判别为局部存在于核中的细胞的数量是42,判别为局部存在于细胞质中的细胞的数量是10。荧光的强度过高,所以无法判别局部存在的细胞的数量是79。比较例1的核局部存在率是81%。在比较例2的情况下,判别为局部存在于核中的细胞的数量是16,判别为局部存在于细胞质中的细胞的数量是84。荧光强度过低,所以无法判别局部存在的细胞的数量是31。比较例2的核局部存在率是16%。
如以上那样,根据本验证可知,在如实施方式1那样根据强度不同的2个荧光图像判别局部存在的情况下,关于在比较例1、2的情况下不可判别的细胞,也能够判别NF-κB的局部存在。另外可知,在如实施方式1那样判别局部存在的情况下,不可判别的细胞少,所以能够精度良好地判别细胞中的NF-κB的局部存在。因此,根据实施方式1,能够将不可判别的细胞的数量抑制得较低,精度良好地判别NF-κB的局部存在。由此,例如,即使从被检者提取的细胞少的情况下,也能够在确保能够判别的细胞的同时,精度良好地判别NF-κB的局部存在。
在实施方式1中,作为被检测物质的分布状况的判别,示出了判别NF-κB的局部存在状况的例子,但在被检测物质的分子的量发生变化的情况下,也可以判别该分子的量。在该情况下,操作者用荧光物质11、12标识分子,处理装置根据从荧光物质11、12产生的强度不同的2个荧光,获取图像。操作者在分子的量多的情况下,使用低强度的荧光图像来判别量,在分子的量少的情况下,使用高强度的荧光图像来判别量。由此,能够精度良好地判别分子的量。
<实施方式1的装置结构>
说明用于根据实施方式1的细胞信息获取方法对细胞图像进行摄像并判别细胞中的被检测物质的局部存在的细胞信息获取装置的结构。
如图5所示,细胞信息获取装置100具备处理部110、试样调制部120、光学检测部130、驱动部140、显示部150、输入部160以及存储部170。
处理部110由微型计算机以及CPU等构成。存储部170由RAM、ROM、硬盘等构成。存储部170存储由处理部110执行的处理程序、图像等各种数据。处理部110在与细胞信息获取装置100的各部之间进行信号的发送接收,控制各部。在处理部110中,通过存储在存储部170中的程序,赋予获取部111和解析部112的功能。
试样调制部120依照图1的步骤S1,混合细胞和试剂,由此调制试样。也可以由操作者进行试样的调制。在该情况下,从细胞信息获取装置100省略试样调制部120。光学检测部130是流式细胞仪。光学检测部130对试样中包含的细胞照射光,对产生的荧光进行摄像。随后,参照图6说明光学检测部130的结构。驱动部140驱动后述光学检测部130的光源301~304。
显示部150由显示器构成。显示部150显示针对每个细胞获取的图像、针对每个细胞判别的NF-κB的局部存在、NF-κB局部存在于核中的细胞数、NF-κB局部存在于细胞质中的细胞数、核局部存在率以及细胞质局部存在率等。输入部160由鼠标以及键盘构成。操作者经由输入部160针对细胞信息获取装置100输入指示。
如图6所示,光学检测部130具备流通池200、光照射部300、聚光部400以及受光部501~504。在流通池200中形成了流路210,在流路210中,流过利用试样调制部120调制的试样。在图6中,为方便起见,图示了相互正交的XYZ轴。
光照射部300对在流通池200中流通的试样中包含的细胞照射光,从图2所示的荧光物质11、12产生强度不同的荧光。另外,光照射部300对细胞照射光而使得从图2所示的荧光物质13产生荧光,进而,对细胞照射明视场用的光。光照射部300具备光源301~304、聚光透镜311~314以及二向色镜321、322。
光源301~304由半导体激光源构成。从光源301~304射出的光分别是波长λ1~λ4的激光。波长λ1~λ4分别是例如488nm、647nm、405nm、785nm。波长λ1~λ3是如图2所示用于从荧光物质11~13激励荧光的光。聚光透镜311~314分别对从光源301~304射出的光进行聚光。二向色镜321使波长λ1的光透射,使波长λ2的光反射。二向色镜322使波长λ1、λ2的光透射,使波长λ3的光反射。
这样,光照射部300对在流路210中流动的试样中包含的细胞,以相互重叠的状态照射从光源301~303射出的波长λ1~λ3的光。另外,光照射部300对被照射波长λ1~λ3的流路210的位置,照射波长λ4的光。如果对在流通池200中流动的试样照射波长λ1~λ3的光,则如参照图2说明那样从荧光物质11~13产生不同的波长段的荧光。如果对在流通池200中流动的试样照射波长λ4的光,则该光透射细胞。透射了细胞的波长λ4的光被用于明视场图像的获取。
在此,光源301以高功率射出波长λ1的光,光源302以低功率射出波长λ2的光。通过图5所示的驱动部140,控制光源301、302的射出功率。由此,如参照图2说明那样从荧光物质11产生的荧光成为高强度,从荧光物质12产生的荧光成为低强度。此外,在该实施方式1以及后述实施方式2、3中,也可以不调整光源301以及302的射出功率。通过选择即便是同一射出功率但所得到的荧光强度有差异的荧光标识,从荧光物质11产生的荧光成为高强度,从荧光物质12产生的荧光成为低强度。
聚光部400使通过波长λ1~λ3的光的照射从流通池200产生的荧光聚光。聚光部400使从荧光物质11~13产生的荧光分别聚光到受光部501~503。另外,聚光部400使从流通池200产生的波长λ4的光聚光到受光部504。聚光部400具备聚光透镜401、滤光片部件411~413、421~424以及聚光透镜431~434。
聚光透镜401使从在流通池200中流动的试样产生的荧光和透射了在流通池200中流动的试样的波长λ4的光聚光。滤光片部件411~413由二向色镜构成。
滤光片部件411使通过聚光透镜401聚光的光中的、波长段B1的光反射,使波长段B1以外的光透射。滤光片部件421仅使通过滤光片部件411反射的光中的、波长段B1的光透射,遮断波长段B1以外的光。这样,滤光片部件411、421构成为只能够分离从流通池200产生的光中的、波长段B1的荧光。同样地,滤光片部件412、422构成为只能够分离从流通池200产生的光中的、波长段B2的荧光,滤光片部件413、423构成为只能够分离从流通池200产生的光中的、波长段B3的荧光。滤光片部件424使透射了滤光片部件411~413的光中的、波长λ4的光透射,遮断波长λ4以外的光。
受光部501接受通过聚光透镜431聚光的波长段B1的光,将基于接受到的光的图像信息作为摄像信号输出。受光部502接受通过聚光透镜432聚光的波长段B2的光,将基于接受到的光的图像信息作为摄像信号输出。受光部503接受通过聚光透镜433聚光的波长段B3的光,将基于接受到的光的图像信息作为摄像信号输出。受光部504接受通过聚光透镜434聚光的波长λ4的光,将基于接受到的光的图像信息作为摄像信号输出。受光部501~504由例如彩色CCD等摄像元件构成。
聚光部400使波长段B1~B3的光和波长λ4的光分别聚光到受光部501~504,但也可以在1个受光部中成像。在该情况下,光学检测部130构成为:使波长段B1~B3的光和波长λ4的光在受光部的受光面上在不同的区域中成像。
在图6所示的结构中,为了分离波长段B1的光而使用了多个滤光片部件,但也可以如图7所示,通过1个滤光片部件分离从流通池200产生的光。如图7所示,聚光部400具备聚光透镜441~444、滤光片部件451~454以及聚光透镜461~464。波长段B1~B3的光分别通过滤光片部件451~453被分离,波长λ4的光通过滤光片部件454被分离。
接下来,参照图8的流程图,说明通过细胞信息获取装置100进行图1的步骤S4的处理的情况。
如图8所示,在步骤S11中,处理部110驱动试样调制部120,与图1的步骤S1同样地,用荧光物质11、12标识细胞中包含的NF-κB,用荧光物质13标识细胞中包含的核,来调制试样。在步骤S12中,处理部110使试样流入流通池200,通过驱动部140驱动光源301~304,对在流通池200中流动的细胞照射光。在步骤S13中,处理部110通过受光部501~503对波长段B1~B3的荧光进行摄像,通过受光部504对波长λ4的光进行摄像。然后,处理部110的获取部111根据受光部501~504输出的摄像信号,获取图像。
在步骤S14中,处理部110的解析部112从高强度和低强度的荧光图像,选择能够进行局部存在的判别的图像。具体而言,解析部112选择高强度的荧光图像和低强度的荧光图像中的、从图像获取的荧光的强度例如图像整体的亮度处于预定的范围内的图像。由此,荧光的强度极端地大的图像、荧光的强度极端地小的图像与图3的图像32、图像41同样地无法判别NF-κB的局部存在,所以从在判别中使用的图像去掉。
另外,解析部112选择高强度和低强度的荧光图像中的、细胞的解析对象部位处的荧光强度与解析对象部位以外的细胞中的荧光强度之差比预定的阈值大的图像。在实施方式1中,解析对象部位是核。即,选择核内的荧光强度与核外的细胞的荧光强度之差比预定的阈值大的图像。由此,核内与核外的荧光强度之差小的图像与图3的图像32、图像41同样地无法判别NF-κB的局部存在,所以从在判别中使用的图像去掉。
接下来,在步骤S15中,解析部112使用在步骤S14中选择的图像,针对每个细胞判别细胞中的NF-κB的局部存在。即,解析部112计算细胞的解析对象部位处的NF-κB的局部存在量相对细胞整体中的NF-κB的局部存在量的比例。例如,解析部112在步骤S14中选择的图像中,将核的区域中的荧光的强度除以细胞整体的区域中的荧光强度。解析部112在除法结果是2以上的情况下,判别为NF-κB局部存在于核中,在除法结果比2小的情况下,判别为NF-κB局部存在于细胞质中。判定除法结果的值不限于2,也可以是其它值。
此外,在步骤S14中选择了2个图像的情况下,在步骤S15中,针对两方的图像,如上所述取得除法结果并判别局部存在。另外,在步骤S14中未选择图像的情况下,在步骤S15中,该细胞的局部存在视为“不可判别”。
在步骤S16中,解析部112根据进行了处理的所有细胞的判别结果,计算上述核局部存在数、细胞质局部存在数、核局部存在率以及细胞质局部存在率。在步骤S17中,处理部110将在步骤S16中计算出的数值、针对每个细胞获取的图像以及每个细胞的判别结果等显示于显示部150。具体而言,处理部110将包括上述内容的画面161显示于显示部150。
如图9所示,画面161具备区域161a、161b。区域161a显示核局部存在数、细胞质局部存在数、核局部存在率以及细胞质局部存在率。区域161b显示图像和NF-κB的局部存在的判别结果。在区域161b中,用实线包围在步骤S15中用于局部存在的判别的图像,以知道在局部存在判别中使用了该图像。
在步骤S13中获取的荧光信息也可以是表示随时间变化的荧光强度的波形信号。在该情况下,在光学检测部130中,作为受光部501~503,分别配置光电倍增管等光检测器。3个光检测器接受波长段B1的高强度的荧光、波长段B2的低强度的荧光以及波长段B3的荧光,分别输出表示各荧光的强度的波形信号。
如图10所示,解析部112根据光检测器输出的波形信号,在是NF-κB的发现量少的细胞的情况下,例如获取图表51、52,在是NF-κB的发现量多的细胞的情况下,例如获取图表61、62。另外,解析部112根据光检测器输出的波形信号,获取与核对应的图表。解析部112根据与图表51、52同时获取的核的图表,在图表51、52中设定与核对应的波形的宽度W1,根据与图表61、62同时获取的核的图表,在图表61、62中设定与核对应的波形的宽度W2。
根据图表51,荧光的峰值处于阈值Sh1、Sh2之间,在与核对应的宽度W1中存在波形的峰值,所以解析部112能够判别为NF-κB局部存在于核中。另一方面,根据图表52,荧光的峰值比阈值Sh1小,所以解析部112无法判别NF-κB的局部存在。根据图表61,荧光的峰值比阈值Sh2大,所以解析部112无法判别NF-κB的局部存在。另一方面,根据图表62,荧光的峰值处于阈值Sh1、Sh2之间,在与核对应的宽度W2中存在波形的凹陷,所以解析部112能够判别为NF-κB局部存在于细胞质中。因此,在该情况下,也与如图3所示使用图像的情况同样地能够通过强度不同的2个荧光来精度良好地判别NF-κB的局部存在。
<实施方式2>
在实施方式2中,并非使用2个光,而是仅使用波长λ1的光来获取相互不同的强度的荧光。在实施方式2中,相比于实施方式1,图1所示的细胞信息获取方法的步骤中的、只有步骤S1、S2中的一部分步骤不同。以下,说明与实施方式1不同的步骤。
在步骤S1中,如图11所示,用荧光波长相互不同的荧光物质14、15标识细胞中包含的NF-κB。荧光物质14、15是荧光色素。荧光物质14如果被照射波长λ1的光,则激励与实施方式1的荧光物质11同样的波长段的荧光。荧光物质15如果被照射波长λ1的光,则激励与图2的荧光物质12同样的波长段的荧光。即,荧光物质14、15的激励用的光的波长实质上相同。
在步骤S2中,包含用荧光物质14、15、13标识的细胞的试样流入到流通池,波长λ1、λ3的光照射到在流通池中流动的细胞,从荧光物质14、15、13产生荧光。从荧光物质14、15产生的荧光分别通过滤光片部件21、22而成为波长段B1、B2的荧光。此时,荧光物质14、15构成为,波长段B1的荧光成为高强度,波长段B2的荧光成为低强度。
在实施方式2的装置结构中,相比于实施方式1,省略了图6所示的光学检测部130中的、光源302、聚光透镜312以及二向色镜321。
在实施方式2中,也与实施方式1同样地,能够产生波长段B1的高强度的荧光和波长段B2的低强度的荧光,获取高强度的荧光图像和低强度的荧光图像。因此,与实施方式1同样地,能够根据高强度的荧光图像和低强度的荧光图像,精度良好地解析细胞中的分布以及量多种多样的NF-κB。
<实施方式3>
在实施方式3中,并非使用2个光和2个荧光物质,而是使用1个波长λ1的光和1个荧光物质11,获取相互不同的强度的荧光。在实施方式3中,相比于实施方式1,图1所示的细胞信息获取方法的步骤中的、只有步骤S1、S2中的一部分步骤不同。以下,说明与实施方式1不同的步骤。
在步骤S1中,如图12所示,仅用与实施方式1同样的荧光物质11标识细胞中包含的NF-κB。此时,荧光物质11也可以经由1个抗体而与NF-κB结合。在步骤S2中,包含用荧光物质11、13标识的细胞的试样流入到流通池,波长λ1、λ3的光照射到在流通池中流动的细胞,从荧光物质11、13产生荧光。
如图12所示,将从荧光物质11产生的荧光分割为2个,使一方通过与实施方式1同样的滤光片部件21,使另一方通过与实施方式1同样的滤光片部件22。滤光片部件21仅使波长段B1的光透射,滤光片部件21仅使波长段B4的光透射。如图13所示,波长段B1包含例如从荧光物质11产生的荧光的强度为峰值的波长。波长段B4例如被设定为比波长段B1大的波长段、并且、被设定为不与波长段B1重叠的波长段。由此,如图12所示,通过了滤光片部件21的波长段B1的荧光成为高强度,通过了滤光片部件22的波长段B4的荧光成为低强度。
此外,波长段B1也可以未必包含从荧光物质11产生的荧光的强度为峰值的波长。波长段B4也可以设定为比波长段B1小的波长段,也可以与波长段B1重叠一部分。
<实施方式3的验证>
接下来,说明发明人进行的实施方式3的验证。
1.准备
作为细胞,准备了人类心脏微小血管内皮细胞(HMVEC-C)(Lonza CatNo.CC-7030,Lot No.0000296500(P4))。作为一次抗体,准备了NF-κB p65(D14E12)XP Rabbit mAb(Cell Signaling Technologies #8242S)。作为二次抗体,准备了Goat anti-Rabbit IgG(H+L)Secondary Antibody,Alexa Fluor 647 conjugate(Life technologies A-21245)。对二次抗体,作为荧光色素,结合了Alexa Fluor 647。另外,准备了EGM-2MV Medium(Lonza Cat No.CC-3202)、EGM-2MV SingleQuots Kit(LonzaCat No.CC-3202)、PBS pH7.4(GIBCO Cat No.10010-023)、BSA(LAMPIRE Cat No.7500805)、PFA(WAKO Cat No.160-16061)、TritonX100(Nacalai Tesque CatNo.35501-15)。
2.试剂调制
对500mL的EGM-2MV Medium添加EGM-2MV SingleQuots Kit,制作了培养基。在利用pH12的PBS溶解多聚甲醛以其最终浓度为8%w/v之后,调整为pH7.4。对PBS加上1.5g的BSA并溶解而补足成50mL,调制了3%BSA/PBS。对PBS加上0.5g的BSA并溶解而补足成50mL,调制了1%BSA/PBS。利用PBS调制TritonX100以其最终浓度为0.1%w/v。
3.步骤
HMVEC-C是遵照制造商推荐协议,利用EGM-2MV培养基培养的。在本验证中使用了从购入后起继代次数为6次以内的细胞。关于培养基,将开封后的使用期限设为3周期间。关于TNF-α刺激培养,去除约70%合流的HMVEC-C细胞的培养上清,加上以成为最终浓度25ng/mL的方式添加了Recombinant Human TNF-alpha的EGM-2MV培养基,并在37℃的CO2恒温箱内静置了1小时。保留3mL左右而用电动移液器去除培养基,并用刮刀剥离了细胞。加上与回收的悬浮液等量的8%PFA/PBS,在室温下反应了15分钟。在室温下,以1000rpm进行了3分钟的离心分离。将细胞颗粒用1mL的PBS冲洗了2次。去除上清,加上1mL的0.1%Triton X-100/PBS,在室温下反应了15分钟。在室温下,以1000rpm进行了3分钟的离心分离。用1mL的1%BSA/PBS冲洗了2次。去除上清,加上1mL的3%BSA/PBS,在室温下静置了30分钟。在3%BSA/PBS中添加了1/1600的400μL的一次抗体。在室温下反应了1小时。在室温下,以1000rpm进行了3分钟的离心分离。用1mL的1%BSA/PBS进行了冲洗。在3%BSA/PBS中添加了1/1000的400μL的二次抗体。在室温下反应了30分钟。用1mL的1%BSA/PBS冲洗了2次。去除上清,添加了50μL的1%BSA/PBS。
4.利用流式细胞仪进行检测
作为能够获取荧光图像的流式细胞仪,使用了ImageStreamX Mark II Imaging Flow Cytometer(Merck Millipore)。使依照上述3调制出的试样流入到该流式细胞仪的流通池中,对在流通池中流动的试样,照射了波长647nm的激光。波长647nm的激光与图12所示的波长λ1的激光对应。波长647nm的激光的射出功率为10mW。通过对标识NF-κB的荧光色素照射波长647nm的激光,产生了荧光。
在上述流式细胞仪中,经由透射波长段642nm~740nm的滤光片部件,对通过波长647nm的激光产生的荧光进行摄像,获取了高强度的荧光图像。另外,经由透射波长段740nm~800nm的滤光片部件,对通过波长647nm的激光产生的荧光进行摄像,获取了低强度的荧光图像。此外,在上述流式细胞仪中,通过滤光片部件等来去除了不需要的波长段的光,以使成为对象的波长段的光适当地入射到受光部。
参照图14(a)、(b),说明通过上述检测来获取的图像。
“高强度的荧光”和“低强度的荧光”分别是基于从标识了NF-κB的荧光色素产生的高强度的荧光的图像和基于从标识了NF-κB的荧光色素产生的低强度的荧光的图像。在图14(a)、(b)中,横向排列的2个图像是从1个细胞获取的图像。各图像是为方便起见对所获取的彩色图像进行灰阶化而得到的图像。在各图像中,白的部分表示荧光的强度强。
在图14(a)所示的3个细胞的情况下,基于低强度的荧光的图像的强度过低,所以难以判别NF-κB的局部存在。另一方面,基于高强度的荧光的图像的强度适当,所以能够判别为NF-κB局部存在于细胞质中。在图14(b)所示的3个细胞的情况下,基于高强度的荧光的图像的强度过高,所以难以判别NF-κB的局部存在。另一方面,基于低强度的荧光的图像的强度适当,所以能够判别为NF-κB局部存在于细胞质中。
如以上那样,根据本验证可知,即使在如实施方式3那样根据强度不同的2个荧光图像判别局部存在的情况下,也能够判别NF-κB的局部存在。这样,根据实施方式3,使从1种荧光色素产生的荧光通过使不同的波长段的荧光通过的滤光片部件21、22来获取2个荧光图像,由此能够针对1个细胞在一次的测定中正确地获取NF-κB的局部存在。
<实施方式3的装置结构>
如图15所示,在实施方式3的装置结构中,相比于实施方式1,省略图6所示的光学检测部130中的、光源302、聚光透镜312以及二向色镜321,代替滤光片部件412、422而分别追加滤光片部件414、425。滤光片部件414使透射了滤光片部件411的光中的、波长段B4的光反射,使波长段B4以外的光透射。滤光片部件425仅使通过滤光片部件414反射的光中的、波长段B4的光透射,遮断波长段B4以外的光。这样,滤光片部件414、425构成为能够仅分离从流通池200产生的光中的、波长段B4的荧光。受光部502对波长段B4的低强度的荧光进行摄像。
在实施方式3中,也与实施方式1同样地,使得分别产生高强度的荧光和低强度的荧光,能够获取高强度的荧光图像和低强度的荧光图像。因此,与实施方式1同样地,能够根据高强度的荧光图像和低强度的荧光图像,精度良好地解析细胞中的分布以及量多种多样的NF-κB。
<实施方式4>
在实施方式4中,相比于实施方式1,图1所示的细胞信息获取方法的步骤中的、只有步骤S1、S2中的一部分步骤不同。以下,说明与实施方式1不同的步骤。
在步骤S1中,如图16所示,仅用与实施方式1同样的荧光物质11标识细胞中包含的NF-κB。在步骤S2中,包含用荧光物质11、13标识的细胞的试样流入到流通池,波长λ1、λ3的光照射到在流通池中流动的细胞,从荧光物质11、13产生荧光。此时,针对细胞以高功率照射波长λ1的光,所以透射滤光片部件21的波长段B1的荧光与实施方式1同样地成为高强度。进而,使该细胞在流通池内移动,对移动的细胞照射波长λ1的光,从荧光物质11产生荧光。此时,针对细胞以低功率照射波长λ1的光。因此,透射滤光片部件21的波长段B1的荧光成为低强度。
在实施方式4的装置结构中,相比于实施方式1,省略图6所示的光学检测部130中的、光源302、聚光透镜312、二向色镜321、滤光片部件412、422、聚光透镜432以及受光部502。另外,如图17所示,在实施方式3的装置结构中,相比于实施方式1,对光照射部300追加光源305和聚光透镜315,对聚光部400追加聚光透镜471、滤光片部件472以及聚光透镜473。另外,在实施方式3的装置结构中,相比于实施方式1,追加受光部505。
此外,图17是在与XY平面平行的方向上观察了光学检测部130的图。在图17中,为方便起见,关于光照射部300,图示了在Y轴正方向上观察的状态,关于聚光部400和受光部505,图示了在X轴负方向上观察的状态。
在流通池200的流路210中,对位置211照射从光源301射出的波长λ1的光。光源305与光源301同样地构成,以比光源301低的功率射出光。聚光透镜315使从光源305射出的光聚光到在流路210中位于位置211的Z轴正侧的位置212。聚光透镜471使从位置212产生的荧光聚光。滤光片部件472仅使由聚光透镜471聚光的光中的、波长段B1的光透射。受光部505接受由聚光透镜473聚光的波长段B1的低强度的光,将基于接受到的光的图像信息作为摄像信号输出。
预先取得细胞从位置211对位到位置212的时间T。由此,如果在通过受光部501接受到基于某个细胞的光之后,经过时间T,则基于同一细胞的光被受光部505接受。因此,能够将根据受光部501获取的图像和根据受光部505获取的图像与从同一细胞获取的图像对应起来。
在实施方式4中,也与实施方式1同样地,使得分别产生高强度的荧光和低强度的荧光,能够获取高强度的荧光图像和低强度的荧光图像。因此,与实施方式1同样地,能够根据高强度的荧光图像和低强度的荧光图像,精度良好地解析细胞中的分布以及量多种多样的NF-κB。
<实施方式5>
在实施方式5中,相比于实施方式1,图1所示的细胞信息获取方法的步骤中的、只有步骤S2中的一部分步骤不同。以下,说明与实施方式1不同的步骤。
在步骤S2中,如图18所示,包含用荧光物质11~13标识的细胞的试样流入到流通池,波长λ1~λ3的光照射到在流通池中流动的细胞,从荧光物质11~13产生荧光。从荧光物质11、12产生的荧光合起来入射到滤光片部件24。滤光片部件24由棱镜构成。从荧光物质11、12产生的荧光根据波长段的差异而通过滤光片部件24分成波长段B1的荧光和波长段B2的荧光。在此,与实施方式1同样地,针对细胞以高功率照射波长λ1的光,针对细胞以低功率照射波长λ的光。由此,与实施方式1同样地,透射滤光片部件21的波长段B1的荧光成为高强度,透射滤光片部件22的波长段B2的荧光成为低强度。
此外,也可以是,从荧光物质11~13产生的荧光合起来入射到滤光片部件24,根据波长段的差异通过滤光片部件24分别分成波长段B1~B3的荧光。在此,示出了针对实施方式1的结构使用的例子,但也可以在实施方式2~4的结构中使用滤光片部件24。
如图19所示,在实施方式5的装置结构中,相比于实施方式1,省略图6所示的光学检测部130中的、滤光片部件411、412、421、422,对聚光部400追加滤光片部件481。滤光片部件481由棱镜构成。
从在流通池200中流动的试样产生的荧光入射到滤光片部件481。根据荧光的波长,从滤光片部件481以不同的角度射出入射到滤光片部件481的荧光。聚光透镜431和受光部501配置于与从滤光片部件481射出的荧光中的波长段B1的荧光对应的方向。由此,受光部501能够对波长段B1的高强度的荧光进行摄像。聚光透镜432和受光部502配置于与从滤光片部件481射出的荧光中的波长段B2的荧光对应的方向。由此,受光部502能够对波长段B2的低强度的荧光进行摄像。
在实施方式5中,也与实施方式1同样地,使得分别产生高强度的荧光和低强度的荧光,能够获取高强度的荧光图像和低强度的荧光图像。因此,与实施方式1同样地,能够根据高强度的荧光图像和低强度的荧光图像,精度良好地解析细胞中的分布以及量多种多样的NF-κB。
<实施方式6>
在实施方式6中,使基质接触到细胞中包含的被检测物质来使得产生荧光物质,对产生的荧光物质照射光,根据通过光的照射从荧光物质产生的荧光,判别被检测物质的局部存在状况。在实施方式6中,被检测物质是细胞质。基质包括当接触到被检测物质时被切断的切断部位,如果切断部位被切断则产生荧光物质。更具体而言,基质通过接触到作为被检测物质的细胞质,被存在于细胞质中的酶切断。在实施方式6中,根据来自标识细胞质的荧光物质的荧光,判定细胞质的局部存在。此外,被检测物质也可以是例如细胞质中的蛋白质、细胞小器官、细胞膜等除了细胞中包含的细胞质以外的物质。
在实施方式6中,相比于实施方式3,图1所示的细胞信息获取方法的步骤中的、步骤S1中的一部分的步骤不同。以下,说明与实施方式3不同的步骤。
在步骤S1中,如图20所示,细胞和基质16a混合。基质16a是当通过细胞质中包含的酯酶加水分解时产生荧光物质16b的物质。如果细胞和基质16a混合,则透射了细胞膜的基质16a通过与细胞质接触,通过细胞质中包含的酯酶加水分解,产生荧光物质16b。这样,利用荧光物质16b标识细胞质。
接下来,与实施方式3同样地,进行步骤S2以后的处理。即,在步骤S2中,包含用荧光物质16b标识的细胞的试样流入到流通池,如图20所示,波长λ1、λ3的光照射到在流通池中流动的细胞,分别从荧光物质16b、13产生荧光。然后,如图20所示,从荧光物质16b产生的荧光分割成2个,使一方通过滤光片部件21,使另一方通过滤光片部件22。由此,与实施方式3同样地,透射了滤光片部件21的波长段B1的荧光成为高强度,透射了滤光片部件22的波长段B4的荧光成为低强度。此外,基于实施方式6的装置与实施方式3同样地构成。
在实施方式6中,也与实施方式3同样地,使得产生强度不同的2个荧光,能够获取高强度的荧光图像和低强度的荧光图像。因此,能够根据高强度的荧光图像和低强度的荧光图像,精度良好地判别细胞质的局部存在。这样,如果能够精度良好地判别细胞质的局部存在,则能够精度良好地定义细胞质的范围。由此,例如,能够将细胞质的范围与其它解析组合而进行更详细的解析。另外,例如,能够使细胞质的范围在细胞等的研究中发挥作用。
<实施方式6的验证>
接下来,说明发明人进行的实施方式6的验证。
1.准备
作为细胞,准备了人类心脏微小血管内皮细胞(HMVEC-C)(Lonza CatNo.CC-7030,Lot No.0000296500(P4))。作为细胞质标识试剂,准备了Cell Explorer Fixable Live Cell Tracking Kit*Green Fluorescence*(Cosmobio 22621)。细胞质标识试剂包含与图20所示的基质16a对应的物质。细胞质标识试剂具有疏水性。细胞质标识试剂通过细胞膜,由于通过细胞内酯酶加水分解而产生荧光物质。在此产生的荧光物质与图20所示的荧光物质16b对应。作为核染色色素,准备了Cellstain Hoechst 33342 solution(DOjinDO H342)。另外,准备了EGM-2MV Medium(Lonza Cat No.CC-3202)、EGM-2MV SingleQuots Kit(LonzaCat No.CC-3202)、PBS pH7.4(GIBCO Cat No.10010-023)、BSA(LAMPIRE Cat No.7500805)、PFA(WAKO Cat No.160-16061)、TritonX100(Nacalai Tesque CatNo.35501-15)。
2.试剂调制
对500mL的EGM-2MV Medium添加EGM-2MV SingleQuots Kit,制作了培养基。在利用pH12的PBS溶解多聚甲醛以其最终浓度为8%w/v之后,调整为pH7.4。对PBS加上1.5g的BSA并溶解而补足成50mL,调制了3%BSA/PBS。对PBS加上0.5g的BSA并溶解而补足成50mL,调制了1%BSA/PBS。利用PBS调制TritonX100以其最终浓度为0.1%w/v。在Track kit Green的瓶中添加100μL的DMSO,制作1000×Track kit Green stock solution,对Kit附属的Assay buffer添加1/1000量,从而调整了Track kit working solution。
3.步骤
HMVEC-C是遵照制造商推荐协议,利用EGM-2MV培养基培养的。在本验证中,使用了从购入后起继代次数为6次以内的细胞。关于培养基,将开封后的使用期限设为3周期间。在将细胞按照70%合流培养之后,保留3mL左右的培养基并用电动移液器去除培养基,用刮刀剥离了细胞。对回收的3mL的悬浮液添加3μL的Track kit working solution,在37℃的CO2恒温箱内静置了30分钟。在静置了30分钟之后,在室温下,以1000rpm进行了3分钟的离心分离。将细胞颗粒用5mL的PBS冲洗3次。去除上清,添加了50μL的1%BSA/PBS。
4.利用流式细胞仪进行检测
作为能够获取荧光图像的流式细胞仪,使用了ImageStreamX Mark II Imaging Flow Cytometer(Merck Millipore)。使依照上述3调制的试样流入到该流式细胞仪的流通池,对在流通池中流动的试样照射了波长488nm、405nm的激光。波长488nm、405nm的激光与图20所示的波长λ1、λ3的激光对应。波长488nm、405nm的激光的射出功率分别为50mW、20mW。由于波长488nm的激光照射到标识细胞质的荧光色素而产生了荧光。由于波长405nm的激光照射到核染色色素而产生了荧光。
在上述流式细胞仪中,经由透射波长段480nm~560nm的滤光片部件,对通过波长488nm的激光产生的荧光进行摄像,获取了高强度的荧光图像。另外,经由透射波长段560nm~595nm的滤光片部件,对通过波长488nm的激光产生的荧光进行摄像,获取了低强度的荧光图像。经由透射波长段420nm~505nm的滤光片部件,对通过波长405nm的激光产生的荧光进行摄像,获取了与核对应的荧光图像。另外,对在流通池中流动的试样照射了波长设定为420nm~480nm之间的激光。经由透射波长段420nm~480nm的滤光片部件,对该激光透射了细胞后的光进行摄像,获取了明视场图像。此外,在上述流式细胞仪中,通过滤光片部件等来去除了不需要的波长段的光,以使成为对象的波长段的光适当地入射到受光部。
参照图21,说明通过上述检测来获取的图像。
“明视场”表示细胞的明视场图像。“高强度的荧光”和“低强度的荧光”分别是基于从标识了细胞质的荧光色素产生的高强度的荧光的图像和基于从标识了细胞质的荧光色素产生的低强度的荧光的图像。“来自核的荧光”是基于从对核进行了染色的核染色用色素产生的荧光的图像。横向排列的4个图像是从1个细胞获取的图像。为方便起见,明视场图像以外的图像是对所获取的彩色图像进行灰阶化而得到的图像。在明视场图像以外的图像中,白的部分表示荧光的强度强。
在最上段所示的细胞以及最上段的下1段所示的细胞的情况下,基于低强度的荧光的图像的强度过低,所以细胞质的局部存在不清楚。另一方面,基于高强度的荧光的图像的强度适当,所以能够精度良好地判别细胞质的局部存在。在最下段所示的细胞以及最下段的上1段所示的细胞的情况下,基于高强度的荧光的图像的强度过高,所以难以判别细胞质的局部存在。另一方面,基于低强度的荧光的图像的强度适当,所以能够精度良好地判别细胞质的局部存在。
如以上那样,根据本验证可知,如果如实施方式6那样基于强度不同的2个荧光图像,则能够判别细胞质的局部存在。这样,根据实施方式6可知,使从标识细胞质的1种荧光色素产生的荧光通过使不同的波长段的荧光通过的滤光片部件21、22来获取2个荧光图像,由此能够针对1个细胞在一次的测定中正确地获取细胞质的局部存在。
<实施方式7>
在实施方式7中,使2种基质接触到细胞中包含的被检测物质来使得产生2种荧光物质,对产生的2种荧光物质照射光,根据通过光的照射从2种荧光物质产生的荧光,判别被检测物质的局部存在状况。即,在实施方式7中,并非如实施方式6那样使用1个光,而是使用相互不同的波长的光来获取相互不同的强度的荧光。此外,也可以使1种基质接触到被检测物质来使得产生2种荧光物质。
在实施方式7中,相比于实施方式6,图1所示的细胞信息获取方法的步骤中的、只有步骤S1、S2中的一部分步骤不同。以下,说明与实施方式6不同的步骤。
在步骤S1中,如图22所示,细胞和基质17a、18a混合。基质17a、18a是当通过细胞质中包含的酯酶加水分解时分别产生荧光物质17b、18b的物质。荧光物质17b、18b分别构成为当被照射波长λ1、λ2的光时激励相互不同的波长段的荧光。如果细胞和基质17a、18a混合,则透射了细胞膜的基质17a、18a与细胞质接触,从而通过细胞质中包含的酯酶加水分解,产生荧光物质17b、18b。这样,利用荧光物质17b、18b标识细胞质。
在步骤S2中,包含用荧光物质17b、18b标识的细胞的试样流入到流通池,如图22所示,波长λ1、λ2、λ3的光照射到在流通池中流动的细胞,分别从荧光物质17b、18b、13产生荧光。此时,以高功率对细胞照射波长λ1的激光,以低功率对细胞照射波长λ2的激光。通过使从荧光物质17b产生的荧光通过滤光片部件21来成为波长段B1的荧光。通过使从荧光物质18b产生的荧光通过滤光片部件22来成为波长段B2的荧光。这样,通过了滤光片部件21的波长段B1的荧光成为高强度,通过了滤光片部件22的波长段B2的荧光成为低强度。此外,基于实施方式7的装置与实施方式1同样地构成。
在实施方式7中,也与实施方式6同样地,能够产生强度不同的2个荧光,获取高强度的荧光图像和低强度的荧光图像。因此,与实施方式6同样地,能够根据高强度的荧光图像和低强度的荧光图像,精度良好地判别细胞质的局部存在。
- 还没有人留言评论。精彩留言会获得点赞!