一种用于EB病毒衣壳抗原和核抗原1蛋白抗体联合检测的蛋白质芯片及其制备和应用的制作方法
本发明涉及一种用于爱泼斯坦一巴尔病毒(Epstein一Barr virus,简称EB病毒)衣壳抗原和核抗原1蛋白抗体联合检测的蛋白质芯片,属于生物技术领域。
背景技术:
EB病毒是一种普遍存在的人类γ疱疹病毒,主要通过唾液传播感染人的上皮细胞和B细胞,与许多疾病的发生都有着密切的关系,威胁着人类的健康。EB病毒是传染性单核细胞增多症(IM)的病原体,30–70%在青春期获得的原发感染会发展为IM。而EB病毒潜伏性感染则存在于90%以上的世界人口,与多种恶性肿瘤的病因相关,包括鼻咽癌(NPC)、淋巴恶性肿瘤、移植后淋巴组织增生性疾病(PTLD)、系统性红斑狼疮(SLE)和胃癌(GC)等。EB病毒相关肿瘤的发病率约每年200000例,是一种广泛有用的肿瘤标志物。
目前EB病毒的检测,临床上常用Real-time PCR检测病毒载量(VL)、ELISA/IIF分析血清学抗体来反映病毒感染阶段和发展风险,但存在病毒载量没有标准临界值和ELISA/IIF检测灵敏度较低的缺陷。间接化学发光法(CLIA)是广泛使用的自动化EB病毒血清学检测平台,敏感性高于ELISA,但特异性稍差。ELISA和CLIA每次一般只能对一种抗体进行分析,而单个指标对感染状态不足以进行有效诊断。对多种抗体进行检测时,工作量也会增大。因而,研发一种简单易行的、以高特异性和敏感性为目标的新型生物芯片进行集成检测,将很有意义。
血清学检测是常用的诊断工具,可以检测EB病毒感染的不同阶段。病毒衣壳抗原(VCA)具有很强的免疫原性,最初感染EBV的患者血清中可检测到VCA-IgM抗体,是EB病毒近期感染的标志,对于免疫活性人群来说是诊断IM的最重要方法。VCA-IgG抗体随后出现。EBV核抗原1蛋白(EB病毒EBNA-1)是唯一一个在所有EB病毒相关肿瘤细胞中都表达的病毒蛋白,其IgG阳性结果可以排除急性EB病毒感染,是既往感染的标记。
本发明的检测指标是基于共识的EBV抗体谱:原发感染以VCA IgM抗体阳性和EBNA-1 IgG抗体阴性为特征,而既往感染的以VCA IgM抗体阴性和VCA IgG、EBNA-1IgG抗体阳性为特征。联合检测可进一步提高其检测性能,且联合检测方便省时,有利于检测芯片的应用推广。
技术实现要素:
本发明的目的之一在于提供一种用于EB病毒衣壳抗原和核抗原1蛋白联合抗体检测的蛋白质芯片及其制备方法和使用方法,以用于人血清中EB病毒衣壳抗原IgM抗体、衣壳抗原IgG抗体和核抗原1蛋白IgG抗体的联合检测。
本发明的另一个目的在于提供一种基于上述蛋白质芯片的蛋白质芯片试剂盒。
本发明解决技术问题采用如下技术方案:
一、本发明首先公开了一种用于EB病毒衣壳抗原和核抗原1蛋白联合抗体检测的蛋白质芯片,其特点在于:所述蛋白质芯片用于人血清中EB病毒衣壳抗原IgM抗体、衣壳抗原IgG抗体和核抗原1蛋白IgG抗体的联合检测;所述蛋白质芯片是在固相载体表面点阵固定有EB病毒衣壳抗原探针和EB病毒核抗原1蛋白探针;所述固相载体为S-S-PEG-COOH化学修饰的金箔芯片,在所述S-S-PEG-COOH上用EDC和NHS活化羧基以固定特异性抗原为探针。
二、本发明同时公开了上述蛋白质芯片的制备方法,包括如下步骤:
步骤1:对金箔芯片进行表面化学修饰,获得固相载体
以浓度为2mM的DT2的乙醇溶液为修饰液1;将NHS和EDS溶于0.1M的MES缓冲液中作为修饰液2,在所述修饰液2中NHS浓度为50mM、EDC浓度为200mM;
对金箔芯片进行清洗后,浸入所述修饰液1中,黑暗条件下室温摇荡孵育3小时,S-S-PEG-COOH通过Au-S键组装到金芯片,二硫键使结合稳定性更好;取出后用无水乙醇溶液清洗、氮气吹干;DT2修饰的芯片可保存数月。
固化探针前,再以所述修饰液2点样孵育0.5小时活化(活化的羧基可通过酰胺反应稳定结合蛋白质探针),取出后用PBST溶液清洗、氮气吹干,获得固相载体待用;
步骤2:固定EB病毒抗原探针
将衣壳抗原溶于PBST-BSA溶液中,配制浓度不低于50μg/mL的衣壳抗原溶液;
将核抗原1蛋白溶于PBST-BSA溶液中,配制浓度不低于6.25μg/mL的核抗原1蛋白溶液;
将所述衣壳抗原溶液点样孵育于固相载体的奇数行,将核抗原1蛋白溶液点样孵育于固相载体的偶数行,室温孵育2h,使固相载体的奇数行包被EB病毒衣壳抗原探针、偶数行包被EB病毒核抗原1蛋白探针;取出后将芯片浸没在1M乙醇胺中15分钟,以封闭剩余的已活化羧基,进一步有效避免实验的非特异性吸附;最后再用PBST溶液清洗、氮气吹干,即获得用于EB病毒衣壳抗原和核抗原1蛋白联合检测的的蛋白质芯片。
其中:步骤1对金箔芯片进行清洗的方法为:将NH3、H2O2及H2O按体积比1:1:5混合构成TL1清洗液,将金箔芯片浸入盛有TL1清洗液的不锈钢清洗盒内,82℃水浴6分钟,清洗2次,取出之后用超纯水冲洗,再用无水乙醇清洗,最后用氮气吹干。
三、本发明还进一步公开了上述蛋白质芯片的使用方法,具体为:
将Cy3标记驴抗人IgG抗体溶于PBST-BSA溶液中,构成浓度2.5μg/mL的IgG荧光二抗溶液;将Cy5标记羊抗人IgM抗体和Cy3标记驴抗人IgG抗体共同溶于PBST-BSA溶液中,构成浓度各为2.5μg/mL的IgM+IgG荧光二抗溶液;
将待检测患者血清稀释10~80倍,然后分别点样于所述蛋白质芯片任意一个奇数行的EB病毒衣壳抗原探针和一个偶数行的EB病毒核抗原1蛋白探针上,常温条件下孵育抗体1小时,取出后用PBST溶液清洗、氮气吹干;
将所述IgM+IgG荧光二抗溶液和所述IgG荧光二抗溶液分别点样于孵育有抗体的EB病毒衣壳抗原探针和EB病毒核抗原1蛋白探针之上,室温孵育1小时,然后用PBST溶液清洗、氮气吹干;
若EB病毒衣壳抗原探针处呈现荧光色,则待测患者血清中含有衣壳抗原IgM抗体和/或衣壳抗原IgG抗体,若EB病毒衣壳抗原探针处无荧光色,则待测患者血清中不含有衣壳抗原IgM抗体和衣壳抗原IgG抗体;
若EB病毒核抗原1蛋白探针处呈现荧光色,则待测患者血清中含有核抗原1蛋白IgG抗体,若EB病毒核抗原1蛋白探针处无荧光色,则待测患者血清中不含有核抗原1蛋白IgG抗体;
在使用时,还应同时将抗原抗体全阴性的健康人血清同时点样于同一蛋白质芯片的其他抗原探针上,作为阴性对照。
四、本发明还进一步公开了一种用于EB病毒衣壳抗原和核抗原1蛋白联合检测的试剂盒,其包含有:上述的蛋白质芯片;PBST-BSA溶液;将Cy3标记驴抗人IgG抗体溶于PBST-BSA溶液中,构成的浓度2.5μg/mL的IgG荧光二抗溶液;将Cy5标记羊抗人IgM抗体和Cy3标记驴抗人IgG抗体共同溶于PBST-BSA溶液中,构成的浓度各为2.5μg/mL的IgM+IgG荧光二抗溶液。
上述技术方案中:
所述PBST溶液是由浓度0.01M、pH=7.4的磷酸缓冲液PBS与Tween 20混合配置而成的,在所述PBST溶液中Tween20的体积浓度为0.1%;
所述PBST-BSA溶液是由浓度0.01M、pH=7.4的磷酸缓冲液PBS、Tween20及胎牛血清BSA混合构成,在所述PBST-BSA溶液中Tween20的体积浓度为0.1%,胎牛血清BSA的质量浓度为0.1%。
与已有技术相比,本发明的有益效果体现在:
一方面,本发明制备S-S-PEG-COOH新型化学修饰的金箔芯片作为基底。金箔与化学物质的结合与传统玻璃片和硅片相比更加牢固,并且金箔的生物亲和度较低,不易与基因或者蛋白质等物质产生非特异性吸附。S-S-PEG-COOH新型化学修饰利用活化的羧基末端与蛋白质结合,结合稳定且具有高敏感性。
另一方面,本发明具有高通量、联合检测三个抗体指标和仅需微量已稀释血清样本的显著优势。适用于EB病毒感染率高、临床检测样本量大且不止检测单一抗体的情况。本发明以高灵敏度和特异性(SE/SP)为目标,检测时间短,简便易行,可对有疑似EB病毒近期感染的患者进行原发感染的确认和排除。
附图说明
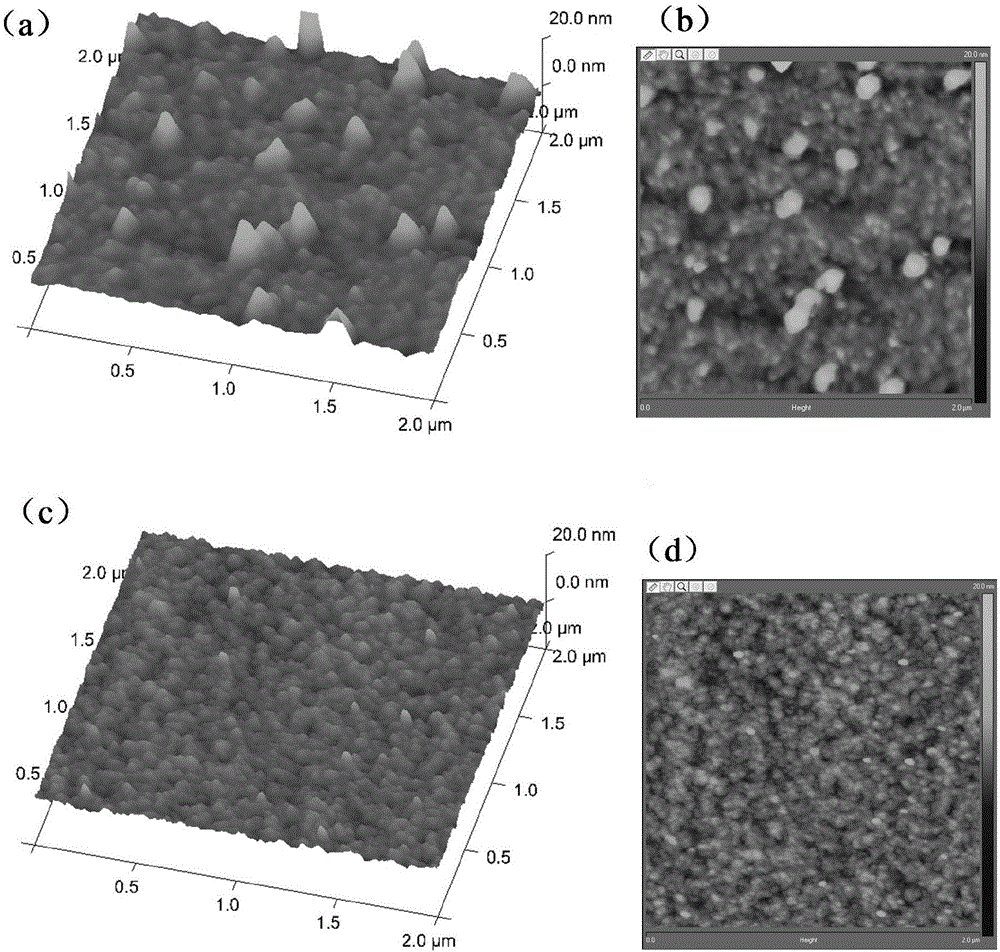
图1为原子力显微镜扫描化学修饰前后金箔芯片平面表征;
图2为EBNA-1抗原在芯片上包被浓度对荧光强度的影响;其中,图2(a)为不同浓度的EBNA-1抗原在芯片上包被所得荧光扫描图;图2(b)为所得荧光强度曲线图;
图3为EBV-VCA抗原在芯片上包被浓度对荧光强度的影响;其中,图3(a)为不同浓度的EBV-VCA抗原在芯片上包被所得荧光扫描图;图3(b)为所得荧光强度曲线图。
图4为EBNA-1抗体检测实验中,血清稀释度对荧光强度的影响;
图5为EBV-VCA抗体检测实验中,血清稀释度对荧光强度的影响;
图6为EBNA-1抗体和EBV-VCA抗体阻断的特异性实验;
图7为生物芯片和CLIA检测EB病毒抗体结果的相关性;
图8为组合芯片检测EB病毒相关疾病。其中,图8A为IgM抗体扫描结果,图8B为IgG抗体扫描结果。
具体实施方式
本发明各实施例中所用材料和试剂的来源与准备如下:
1、金箔芯片:
以玻璃片为基底、覆盖一层0.1μm厚度的纯金(纯度99.9%)的金箔芯片来自Interactiva公司(德国,乌尔姆),其上为区域化的50μm的TEFLON膜的阵列(96孔*2,8行*12列),阵列孔径为1.25mm。
2、表面化学修饰:
22-(3,5-bis((6-mercaptohexyl)oxy)phenyl)-3,6,9,12,15,18,21-heptaoxadocosanoic acid(DT2)购自Sensopath(美国)。N-羟基琥珀酰亚胺(NHS)和N-(3-二甲氨基丙基)-N-乙基碳二亚胺(EDC)购自Sigma-Aldrich公司(西班牙),乙醇胺和2-(N-吗啉代)乙烷磺酸一水(MES)缓冲液购自生工(上海,中国)。
以浓度为2mM的DT2的乙醇溶液为修饰液1;将NHS和EDS溶于0.1M的MES缓冲液中作为修饰液2,在所述修饰液2中NHS浓度为50mM、EDC浓度为200mM。
3、抗原、抗体、荧光素类
EBV-VCA天然抗原购自Mybiosource(圣地亚哥,美国),EBNA-1抗原购自Abcam(USA)。Cy3标记驴抗人IgG抗体购自Sangon公司;Cy5标记羊抗人IgM抗体购自KPL公司;磷酸缓冲液(PBS)、Tween20及胎牛血清(BSA)均购自SIGMA-ALDRICH公司。
4、PBST溶液:
将商品化PBS粉末溶解在去离子水中,形成浓度0.01M、pH=7.4的磷酸缓冲液PBS;然后加入Tween-20,混匀,获得PBST溶液,在所述PBST溶液中Tween20的体积浓度为0.1%。
5、PBST-BSA溶液:
配制:取BSA(200mg/mL)溶于PBST溶液中,震荡,静置,得PBST-BSA溶液(BSA质量浓度为0.1%)。
6、所用血清样本
本发明研发中,化学发光免疫分析法(CLIA)被选为参考方法,收集临床上有CLIA检测数据的EB病毒抗体的患者血清样本用于研发,并收集门诊CLIA检测结果阴性样本作为对照组。此外,收集相关疾病血清:传染性单核细胞增多症15例、系统性红斑狼疮25例、鼻咽癌36例用于筛查。所有血清分装并储存在-80℃以保持蛋白活性,避免反复冻融。
实施例1、分子自组装单层形成和探针固化
由NH3:H2O2:H2O=1:1:5的体积比例混合获得TL1清洗液。将金箔芯片置于盛有TL1清洗液的不锈钢清洗盒内,82℃水浴6分钟,清洗2次,取出之后用超纯水冲洗2分钟,2次,再用无水乙醇清洗2分钟,2次,之后用氮气吹干,置于干净密闭芯片盒中,待用
清洗后的金箔芯片浸没在修饰液1中,在室温用黑盒摇晃孵育3小时,封口膜封口。S-S-PEG-COOH通过Au-S键组装到金芯片,二硫键使结合稳定性更好;取出后用无水乙醇溶液清洗、氮气吹干;DT2修饰的芯片可保存数月。
固化探针前,再以修饰液2点样孵育0.5小时活化(活化的羧基可通过酰胺反应稳定结合蛋白质探针),取出后用PBST溶液清洗、氮气吹干,获得固相载体待用。
图1(a)、(b)为2μm视野下原子力显微镜观察修饰后金箔芯片(即所得固相载体)的表面形貌,图1(c)、(d)为未修饰金箔芯片(清洗后的金箔芯片)的表面形貌。用Nanoscope分析软件进行AFM离线数据分析(Rq是软件中显示粗糙度的参数),可知DT2修饰的金表面(Rq=1.90nm)比未修饰表面粗糙(Rq=0.922nm)。表明修饰后化学基团共价连接到金表面上,使其更易于蛋白质连接,增加了检测灵敏度。
实施例2、质控实验
在下述所有实验中,以pH为7.4的0.01M PBST-0.1%BSA作为抗原、抗体及血清稀释的溶剂。芯片在湿盒中室温孵育,每一步骤结束后,未结合的物质都会被PBST溶液清洗掉,并用氮气干燥芯片以便下一步孵育。
1、EBNA-1抗原探针包被浓度质控
为了优化EBNA-1抗原包被浓度,将100-0.097μg/mL梯度稀释的EBNA-1抗原溶液(共11个浓度)和空白对照PBST-BSA缓冲液分别点样孵育于实施例1所获得的固相载体上(每点1μL,每个浓度点样4个复孔),室温孵育2h,使固相载体上包被EBNA-1抗原探针;取出后将芯片浸没在1M乙醇胺中15分钟,以封闭剩余的已活化羧基,进一步有效避免实验的非特异性吸附;最后再用PBST溶液清洗、氮气吹干。
选择一例由CLIA测得EBNA-1抗体为466U的临床血清样本(≥20U是阳性)按经验比例1:20稀释后,依次点样于EBNA-1抗原探针上,常温条件下孵育抗体1小时,取出后用PBST溶液清洗、氮气吹干。用PBST-BSA缓冲液的平均荧光强度作为背景值。
将2.5μg/mL的Cy3驴抗人IgG荧光二抗溶液点样与上述孵育有抗体的EBNA-1抗原探针之上,并避光孵育0.5小时,用于捕获特异性目的检测抗体产生的荧光信号,取出用PBST溶液清洗、氮气吹干。通过芯片扫描仪LuxscanTM 10K-A(博奥有限公司,中国)对以上蛋白质芯片进行扫描检测,结果显示于图2(a)。图2(b)是以图2(a)中每一列同一浓度所得4个荧光强度的平均值为纵坐标、以抗原浓度为横坐标绘制的荧光强度曲线图。从图中可以看出,随着抗原浓度的降低,荧光值也降低。当EBNA-1抗原孵育浓度在6.25μg/mL以上时,所产生的荧光信号强度与阴性对照组产生的荧光信号强度有明显的差异。故显示孵育EBNA-1抗原最优浓度应在6.25μg/mL以上。
2、EBV-VCA抗原探针包被浓度质控
类似的,EBV-VCA抗原优化也被实现。200μg/mL至0.19μg/mL梯度稀释的EBV-VCA抗原溶液(共11个浓度)和空白对照PBST-BSA缓冲液分别点样孵育于实施例1所获得的固相载体上(每点1μL,每个浓度点样4个复孔),室温孵育2h,使固相载体上包被EBV-VCA抗原探针;取出后将芯片浸没在1M乙醇胺中15分钟,以封闭剩余的已活化羧基,进一步有效避免实验的非特异性吸附;最后再用PBST溶液清洗、氮气吹干。
选择一例由CLIA测得VCA-IgG抗体为640U的临床血清样本(≥20U是阳性)按经验比例1:20稀释后,依次点样于EBV-VCA抗原探针上,常温条件下孵育抗体1小时,取出后用PBST溶液清洗、氮气吹干。用PBST-BSA缓冲液的平均荧光强度作为背景值。
由于VCA有IgM和IgG抗体两个检测指标,Cy3标记的驴抗人IgG抗体和Cy5羊标记的抗人IgM抗体共同溶于PBST-BSA溶液中,配成浓度皆为2.5μg/mL的IgM+IgG荧光二抗溶液用于检测。
将IgM+IgG荧光二抗溶液点样与上述孵育有抗体的EBV-VCA抗原探针之上,并避光孵育0.5小时,用于捕获特异性目的检测抗体产生的荧光信号,取出用PBST溶液清洗、氮气吹干。通过芯片扫描仪LuxscanTM 10K-A(博奥有限公司,中国)对以上蛋白质芯片进行扫描检测,结果显示于图3(a)。图3(b)是以图3(a)中每一列同一浓度所得4个荧光强度的平均值为纵坐标、以抗原浓度为横坐标绘制的荧光强度曲线图。从图中可以看出,孵育EBV-VCA抗原最优浓度应在50μg/mL以上。
3、血清稀释度质控
任意取临床确诊抗体阳性和临床确诊抗体阴性的血清样本各三例。三例临床结果阳性血清等量混匀和三例临床结果阴性血清等量混匀后,分别以不同比例稀释(1:2.5、1:5、1:10、1:20、1:40、1:80、1:160、1:320、1:640、1:1280和1:2560),然后点样到含有核抗原1蛋白探针的芯片和衣壳抗原探针的芯片上,PBST-BSA缓冲液作为空白对照。常温条件下孵育一小时,然后用PBST清洗氮气吹干。避光孵育对应的荧光二抗0.5小时,用于捕获目的抗体产生的荧光信号,并通过与芯片扫描仪扫描检测。
图4和图5分别是EBNA-1和EBV-VCA实验的血清稀释度优化结果。图中(a):上面3排是阳性组(任取3例阳性病例),下面3排是对照组(任取3例阴性对照);图中(b)是以病例组荧光平均值与对照组荧光平均值的比值作为纵坐标、以稀释度作为横坐标绘制的曲线图,设定比值大于3的稀释度可以用于实验检测。从图中可以看出,血清最佳稀释度应在稀释10倍到80倍之间。
实施例3、抗体阻断试验和芯片特异性
在基于抗原的生物芯片免疫实验中,用过量抗原饱和血清抗体结合位点进行阻断的预处理,来检测抗体结合的特异性。
任意取三例临床CLIA诊断抗体阳性的EBNA-1抗体血清按质控优化条件混匀稀释,分装于5个PCR管。其中四管在孵育前,预先与0.1μg/ml、1μg/ml、10μg/ml和100μg/ml的对应抗原充分反应1小时。余下一管作阳性对照。
此外,混匀稀释三例确定抗体阴性的血清作为阴性对照。
EBV-VCA实验也进行相似处理。
图6为两个抗体阻断的结果,第一列为阴性对照,第二列为阳性对照,后四列为不同浓度抗原block的阳性血清,显示阳性EBNA-1和EBV-VCA血清可以被相应抗原完全阻断,特异性抗原为探针的生物芯片对血清抗体的结合检测是特异性的。
实施例4、生物芯片和CLIA检测EB病毒结果的相关性
CILA是发展起来的一项最新免疫测定技术,具有高敏感性和特异性,是一个可定量检测的方法。EBNA-1IgG抗体在3U到600U可以检测,但超出范围的检测结果被描述为“>600U”和“<3U”,且这种情况不在少数。因此本实施例随机选择四例EBNA-1阳性抗体、临床CLIA检测值分别为244U、321U、373U与433U的血清,分别梯度稀释(单位U,从1:2.5计算)以分析芯片检测与CLIA检测结果的相关性。
相对U值和对应荧光值的散点图及相关结果显示于图7,由图7A可以看出,几乎任一例样本在1:80(3~5U)处可检测到可见荧光。由生物芯片检测的荧光值与由CLIA检测的U值有较好的相关系数,R2=0.83(图7B)。
实施例5:组合芯片检测EB病毒相关疾病
在同一张芯片上,以收集的15例传染性单核细胞增多症(IM)、25例系统性红斑狼疮(SLE)、36例鼻咽癌(NPC)EB相关疾病血清样本为检测对象,同时筛查VCA IgM/IgG和EBNA-1IgG三个抗体指标。
在芯片第1、3、5、7行包被EB病毒衣壳抗原探针,2、4、6、8行包被EB病毒核抗原1蛋白探针。不同EB病毒血清模式的样本同时检测,按比例稀释后每一例分别孵育上下两孔。临床CLIA诊断阴性抗体结果的血清用作阴性对照,PBST-BSA缓冲液用作空白对照。清洗干燥后,第1、3、5、7行避光孵育2.5μg/mL的抗人IgG+IgM荧光二抗0.5小时,第2、4、6、8行避光孵育2.5μg/mL的的Cy3驴抗人IgG荧光二抗0.5小时,用于捕获的特异性目的抗体产生的荧光信号,并通过与芯片扫描仪扫描检测,结果显示于图8。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种人类免疫缺陷病毒抗原抗体联合检测试剂盒及其制备方法和应用的制作方法
- 用于检测抗人乳头瘤病毒抗体的抗原及试剂盒和应用的制作方法
- 丙型肝炎病毒第一高变区抗原及其在制备丙型肝炎病毒检测试剂中的用途的制作方法
- 测定sars病毒核衣壳蛋白的测定方法、测定用试剂盒、试验器具、sars病毒核衣壳蛋白单 ...的制作方法
- 猪圆环病毒2型抗原或抗体检测试纸条的制作方法
- 通过EB病毒p18与p23融合衣壳抗原检测EBV特异性的方法
- 重组赤羽病毒核衣壳蛋白、其制备方法及应用的制作方法
- 衍生自非洲淋巴瘤病毒VCA-p18衣壳抗原的肽及其用途的制作方法
- 隐孢子虫病毒衣壳蛋白抗体elisa检测方法及试剂盒的制作方法
- EB病毒衣壳抗原IgM抗体胶体金法检测试剂及其制备方法