一种复合型纳米结构拉曼增强基底、制备方法及应用与流程
本发明涉及一种多层复合型纳米结构拉曼增强基底、制备方法及应用于对1,4-苯二甲硫醇、孔雀石绿等进行定量检测,属于纳米结构基底的制备及检测应用技术领域。
背景技术:
1974年,英国南安普顿大学Fleischmann等通过电化学氧化还原法对银电极进行粗糙化处理,获得了吡啶分子吸附在粗糙银电极表面高质量的拉曼光谱。后经Van Duyne和Creighton等人通过详细的实验和理论研究,将此现象定义为表面增强拉曼散射(Surface enhanced Raman scattering, SERS)效应。自该现象被发现40多年以来,随着纳米技术、激光技术、检测技术、仪器结构优化等各方面的进步,SERS已经在分析检测、界面科学、环境监测、生物医学等领域获得了广泛的应用。其SERS基底,也已经从传统的金、银、铜等贵金属拓展到过渡金属、金属氧化物等;纳米基底的维度包括零维、一维、二维;纳米基底的形貌包括球形、立方体、长方体、棒状、八面体、三棱锥等;纳米基底的结构也发展了核壳、合金、超组装结构等。SERS的检测对象囊括了固体、液体、气体,检测体系包括常温常压、高温高压,甚至是超高真空体系。因此,SERS已经引起了化学家、物理学家、甚至是生物及医药研究者们的极大兴趣,使众多科学领域的实验和理论研究空前活跃。
可以发现,目前对SERS的很多研究仅仅限定在定性或半定量分析,在定量分析方面的获得成功的工作较少,这与SERS技术本身的特点有关。一般认为,SERS极高的增强效应得益于基底表面的热点(hot spots),若分子处在该热点区域内,分子的散射信号将被放大几个甚至十几个数量级。因此,热点在基底上的均匀性分布显得尤为重要。但是由于纳米结构的复杂性,导致基底的不同区域采集到的信号存在很大的差异,有时能达到几个数量级,这些技术上的局限性使SERS的定量应用受到限制。
也有一些科学家在SERS的定量化研究中做了较多的工作(参见文献:Bell S.E.J., Sirimuthu N.M.S. Chem. Soc. Rev., 2008, 37, 1012–1024)。主要集中在均匀基底的制备、内标标识等方面。在均匀基底制备方面,Gwo课题组采用烷基硫醇作为修饰剂,形成了六方密堆积的银纳米粒子膜。该膜具有面积大,高度的均一性及高增强信号的特点,检测限甚至可达单分子级别,他们以结晶紫为探针分子,结果表明,在一定的浓度范围内,信号与浓度呈线性的响应(参见文献:Chen H.Y., Lin M.H., et.al J. Am. Chem. Soc.2015, 137, 13698−13705)。Yao课题组利用吸附有聚乙烯吡咯烷酮的金纳米粒子在气液两相成膜形成了大尺寸的金单层膜,可达厘米级。结果表明,该金膜的SERS活性、均匀性及稳定性均十分理想。(参见文献:Guo Q.H., Xu M.M., Gu R.A., Yao J.L. Langmuir 2016, 32, 4530−4537)。Lei等利用纳米印刷技术制备了大面积的聚苯乙烯小球阵列,在银溶胶体系中采用电泳技术在聚苯乙烯小球阵列上涂覆上一层银,形成银纳米壳层结构。该结构的直径、表面粗糙度、间隙可控可调。(参见文献:Yang S.K., Cai W.P., Kong L.C., Lei Y. Adv. Funct. Mater. 2010, 20, 2527−2533)。
内标法是分析化学中进行定量分析的常用方法。在待分析的体系中,加入一定量的内标物质,计算被分析的物质与内标物质之间的关系,以SERS为例,通常是两种物质的SERS峰相对强度的大小,能推算出被分析物的浓度。Schultz 课题组结合了液相色谱的分离功能与SERS的高灵敏度的特点,利用乙腈作为内标分子实现了维生素B1,维生素B2与叶酸的在线分离与检测。(参见文献:Nguyen A., Schultz Z. D., Analyst 2016, 141, 3630−3635)。而Lu课题组则巧妙的利用牛奶自身的拉曼信号作为内标,利用SERS检测牛奶中残留的双氰胺,结果表明其线性范围为10-4~10-3 g·mL-1。(参见文献:Nguyen A., Schultz Z. D., Analyst 2016, 141, 3630−3635)。
由此可见,即使存在SERS技术本身的难点,科学家们通过采用各种方法,依然锲而不舍的追求如何使SERS技术在定量方面实现突破,以期能使SERS在更广泛的科研领域及民用领域获得进一步的应用。
技术实现要素:
本发明针对现有SERS技术在定量检测方面存在的不足,提供一种具有良好的基底均匀性及内标物稳定性的复合型纳米结构拉曼增强基底、制备方法及其应用。
实现本发明目的的技术方案是提供一种复合型纳米结构拉曼增强基底的制备方法,利用现有技术,先在含有金纳米粒子的金溶胶的气液界面制备金纳米粒子单层膜,再进行如下步骤的操作:
(1)采用垂直提拉法将金纳米粒子单层膜转移至单晶硅片上,在单晶硅片的表面覆盖Au纳米粒子单层膜;
(2)将Au纳米粒子单层膜覆盖的单晶硅片浸泡在浓度为10-2 ~10-3 mol·dm-3 的1,4-苯二硫醇(记作1,4-BDT)的乙醇溶液中,在Au纳米粒子单层膜表面得到由1,4-苯二硫醇修饰的覆盖膜;
(3)采用垂直提拉法,将步骤(2)得到的单晶硅片的表面再覆盖一层Au纳米粒子单层膜,形成以1,4-苯二硫醇单层膜为中间层,内、外层均为Au单层膜的“三明治”结构修饰的单晶硅片;
(4)采用真空热蒸镀仪在步骤(3)的“三明治”结构表面蒸镀一层厚度为2~4 nm的三氧化钼层,用于隔绝内层金属与被检测分子的直接接触,防止发生内标分子与待测分子之间的竞争吸附,得到一种复合型纳米结构拉曼增强基底。
本发明技术方案还涉及按上述制备方法得到的一种复合型纳米结构拉曼增强基底。
本发明技术方案还包括所述复合型纳米结构拉曼增强基底的应用,以1,4-苯二硫醇为内标物,其拉曼信号用于标定待测分子的浓度,将基底用于对待测分子的定量检测。
所述复合型纳米结构拉曼增强基底的具体应用包括:
(1)建立1,4-苯二甲硫醇(记作1,4-BDMT)浓度从10-6~10-3 mol·dm-3的浓度对数-信号相对强度的标准曲线,将基底用于对1,4-苯二甲硫醇的定量检测。
(2)建立孔雀石绿(记作MG)浓度从10-9~10-6 mol·dm-3的浓度对数-信号相对强度的标准曲线,将基底用于对孔雀石绿的定量检测。
中国发明专利CN103590037B公开了一种金纳米粒子单层膜的制备方法及其装置;包括金溶胶的制备、单层膜的形成、转移和优化等步骤,先在含有金纳米粒子的金溶胶的气液界面制备金纳米粒子单层膜,再运用垂直提拉法将金纳米粒子单层膜转移至固相基底上。该项发明通过调控金溶胶的单分散性,溶剂的挥发,设计界面单层膜的转移等,获得所需的金纳米粒子单层膜。本发明利用气液两相法制备的单层金纳米粒子膜具有均匀性好、易转移至固相基底等优点,以较为稳定的常用SERS探针,1,4-BDT为内标分子,通过采用Au膜-1,4-BDT-Au膜-Au膜的“三明治”方式,实现了内标分子的固定;同时,在外层金膜表面进行可控蒸镀超薄氧化层,杜绝分子之间的相互干扰,尤其是竞争吸附。经测试,该种复合型基底可同时获得内标与被检测分子的特征光谱信号,在一定的浓度范围内,其特征峰相对强度的大小与浓度的对数呈线性关系。采用本发明技术方案可利用SERS进行定量化检测。
本发明的原理是:通过设计一种复合型纳米结构拉曼增强基底,选择合理的内标分子,使其固定在两层致密、均匀的金单层膜之间,利用内标分子的特征峰与被测分子的特征峰之间的相对强度关系,在一定的浓度范围内,建立了待测分子SERS相对信号强度与浓度对数之间的关系曲线,可应用于具有较强吸附能力的分子的定量检测,如对1,4-BDMT的可检测范围为10-6~10-3 mol·dm-3,MG分子的检测范围为10-9~10-6 mol·dm-3。
本发明与现有技术相比,具有如下优点:
1、本发明采用两层金单层膜固定内标分子,使内标分子在待测分子吸附时不脱附;采用超薄氧化物层隔绝内标分子与被测分子,使两种分子不发生竞争吸附,从而保证内标分子的稳定性。
2、本发明结合了均匀基底及固定内标这两种定量化实验的技术手段,发挥了基底均匀性及内标稳定性的各自优势,可实现SERS的定量化检测。
3、本发明所提供的制备增强拉曼基底的方法、工艺流程及操作步骤比较简单,涉及的反应及检测条件温和。基底的制作成本低廉,可批量制作,具有推广应用前景。
附图说明
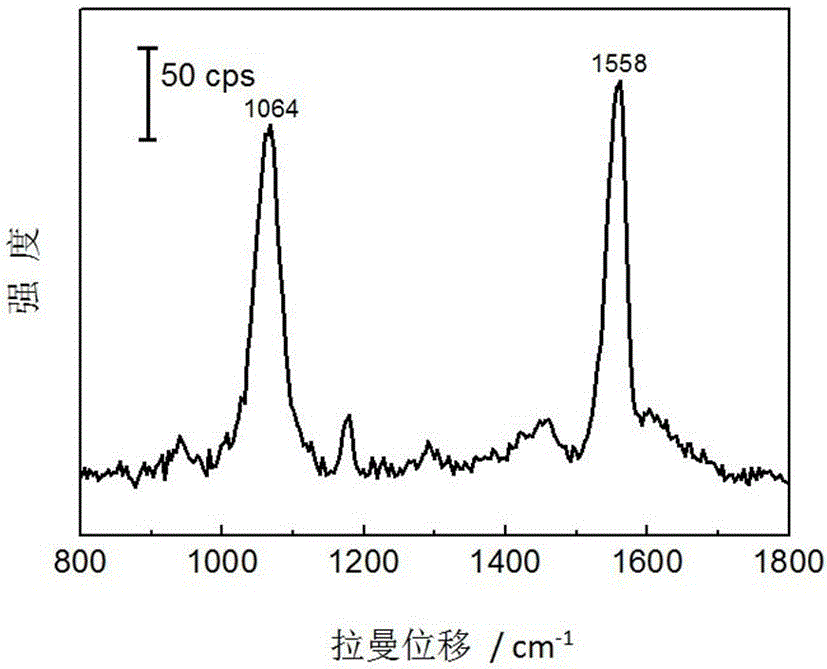
图1为复合型纳米结构拉曼增强基底中内标分子1,4-BDT的SERS光谱图,分子组装浓度为10-3 mol·dm-3。
图2为本发明实施例1提供的内标1,4-BDT与不同浓度被测分子1,4-BDMT的混合SERS光谱图。
图3 为本发明实施例1中1603 cm-1 与1064 cm-1相对强度与分子溶液浓度对数的关系图。
图4为本发明实施例2提供的内标1,4-BDT与不同浓度被测分子MG的混合SERS光谱图。
图5 为本发明实施例2中1615 cm-1 与1064 cm-1相对强度与分子溶液浓度对数的关系图。
具体实施方式
实施例1
1、Au单层膜的制备及转移
本实施例按中国发明专利CN103590037B提供的装置和方法,先在含有金纳米粒子的金溶胶的气液界面制备金纳米粒子单层膜,再运用垂直提拉法将金纳米粒子单层膜转移至固相基底上,具体步骤如下:
(1)Au纳米粒子膜的制备:三颈烧瓶中加入100 mL(0.25 mmol·dm-3)氯金酸溶液,加热至沸,加入2 mL(0.01 g·mL-1)柠檬酸钠溶液,保持沸腾15 min,得到15 nm金溶胶。取该溶胶25 mL,分别加入1 mL(0.01 g·mL)柠檬酸钠溶液,1 mL(0.01 g·mL)PVP溶液和20 mL (2.5 mmol·dm-3)盐酸羟胺溶液;搅拌下用注射泵以1 mL·min-1的速度滴加(2.5 mmol·dm-3)的氯金酸溶液20 mL,得到50 nm金溶胶。将该溶胶于40 ℃下放置10 h,可观察到漂浮在气液界面,致密光亮的金纳米粒子单层膜。
(2)Au纳米粒子膜的转移:采用0.4 cm×0.4 cm的洁净硅片垂直插入气液界面,然后缓慢垂直提拉,即可将金纳米粒子单层膜附着于硅片表面,随着硅片逐渐离开气液界面,可将整片硅片表面覆盖上金膜。
2、内标分子的修饰
将按上述制备方法所得到的覆盖有金膜的硅片浸泡在1,4-BDT的乙醇溶液中,形成1,4-BDT修饰的Au纳米粒子单层膜覆盖的单晶硅片。
3、二次转移Au纳米粒子膜
在步骤2修饰1,4-BDT后,采用与步骤1相同的提拉法,再次附上一层金膜,形成两层金膜包夹1,4-BDT的“三明治”结构。
4、真空热蒸镀隔绝氧化层
采用热蒸镀仪在步骤3制备得到的“三明治”结构表面蒸镀上一层厚度为2~4 nm的三氧化钼层,可从物理上直接隔绝内外两种分子可能发生的竞争吸附,从而保证内标分子的稳定性。至此,复合型纳米结构拉曼增强基底制备完成。
5、内标分子的SERS检测
对上述未添加被检测分子的基底进行SERS检测,可获得内标1,4-BDT的信号。参见附图1,为复合型纳米结构拉曼增强基底中内标分子1,4-BDT的SERS光谱图,分子组装浓度为10-3mol·dm-3;如图1所示,位于1064 cm-1处的为苯环的呼吸振动,本实施例中,将以此为特征峰,与被测分子的特征峰进行比较。
6、1,4-BDMT的SERS检测及标准曲线的建立
本实施例提供一种对1,4-BDMT的检测及标准曲线的建立方法,步骤如下:
(1)配制不同浓度的1,4-BDMT溶液:称取1,4-BDMT 0.017 克,加乙醇10 mL溶解,形成浓度为10-2 mol·dm-3的乙醇溶液。从上述10 mL溶液中取出1 mL,用乙醇稀释至10 mL, 形成10-3 mol·dm-3的乙醇溶液。从10 mL 10-3 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀释至10 mL, 形成10-4 mol·dm-3的乙醇溶液。从10 mL 10-4 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀释至10 mL, 形成10-5 mol·dm-3的乙醇溶液。从10 mL 10-5 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀释至10 mL, 形成10-6 mol·dm-3的水溶液。从10 mL 10-6 mol·dm-3的乙醇溶液中吸取1 mL,用乙醇稀释至10 mL, 形成10-7 mol·dm-3的乙醇溶液。
(2)采用本实施例提供的复合基底,将上述配制的各种浓度的1,4-BDMT溶液浓度由低到高依次吸附,然后分别进行SERS检测,获得不同浓度1,4-BDMT溶液在该复合基底上SERS光谱,参见附图2,为内标1,4-BDT与不同浓度被测分子1,4-BDMT的混合SERS光谱图,图中曲线(a)~(e)分别对应为1,4-BDMT的不同浓度:(a)为10-6 mol·dm-3、(b)为10-5 mol·dm-3、(c)为10-4 mol·dm-3、(d)为10-2 mol·dm-3和(e)为10-2 mol·dm-3。由于10-7 mol·dm-3的1,4-BDMT乙醇溶液中无法检测到该分子的特征信号,因此,图2中未包含该浓度以下的光谱;其中,位于1603 cm-1为1,4-BDMT分子苯环的碳碳伸缩振动峰,将1,4-BDT的1064 cm-1与1,4-BDMT的1603 cm-1相比较,建立了1,4-BDMT浓度的对数与两特征峰相对强度之间的关系,参见附图3,1,4-BDMT在10-6~10-3 mol·dm-3范围内,其特征峰相对强度的大小与浓度的对数呈线性关系。
实施例2
1、Au单层膜的制备及转移
(1)Au纳米粒子膜的制备:三颈烧瓶中加入100 mL(0.25 mmol·dm-3)氯金酸溶液,加热至沸,加入2 mL(0.01 g·mL-1)柠檬酸钠溶液,保持沸腾15 min,得到15 nm金溶胶。取该溶胶25 mL,分别加入1 mL(0.01 g·mL)柠檬酸钠溶液,1 mL(0.01 g·mL)PVP溶液和20 mL (2.5 mmol·dm-3)盐酸羟胺溶液;搅拌下用注射泵以1 mL·min-1的速度滴加(2.5 mmol·dm-3)的氯金酸溶液20 mL,得到50 nm金溶胶。将该溶胶于40 ℃下放置10 h,可观察到漂浮在气液界面,致密光亮的金纳米粒子单层膜。
(2)Au纳米粒子膜的转移:采用0.4 cm×0.4 cm的洁净硅片垂直插入气液界面,然后缓慢垂直提拉,即可将金纳米粒子单层膜附着于硅片表面,随着硅片逐渐离开气液界面,可将整片硅片表面覆盖上金膜。
2、内标分子的修饰
将步骤1所得到的覆盖有金膜的硅片浸泡在1,4-BDT的乙醇溶液中,形成1,4-BDT修饰的Au纳米粒子单层膜覆盖的单晶硅片。
3、二次转移Au纳米粒子膜
在步骤2修饰1,4-BDT完成后,采用步骤1中相同的提拉法,再次附上一层金膜,形成两层金膜包夹1,4-BDT的“三明治”结构。
4、真空热蒸镀隔绝氧化层
采用热蒸镀仪在步骤3的“三明治”结构表面蒸镀上一层2~4 nm的三氧化钼层,可从物理上直接隔绝内外两种分子可能发生的竞争吸附,从而保证内标分子的稳定性。至此,复合型纳米结构拉曼增强基底制备完成。
5、内标分子的SERS检测
对按上述制备方法得到的基底在未添加被检测分子的条件下进行SERS检测,可获得内标1,4-BDT的信号,如附图1所示,位于1064 cm-1处的为苯环的呼吸振动,本实施例将以此为特征峰,与被测分子的特征峰进行比较。
6、MG的SERS检测及标准曲线的建立
本实施例提供一种对MG的检测及标准曲线的建立方法,步骤如下:
(1)不同浓度MG分子溶液的配制:称取MG 0.0365 克,加水10 mL溶解,形成浓度为10-2mol·dm-3的水溶液。从上述10 mL溶液中取出10 μL,用水稀释至10 mL, 形成10-5 mol·dm-3的水溶液。从10 mL 10-5 mol·dm-3的水溶液中吸取1 mL,用水稀释至10 mL, 形成10-6mol•dm-3的水溶液。从10 mL 10-6 mol•dm-3的水溶液中吸取1 mL,用水稀释至10 mL, 形成10-7 mol·dm-3的水溶液。从10 mL 10-7 mol·dm-3的水溶液中吸取1 mL,用水稀释至10 mL, 形成10-8 mol·dm-3的水溶液。从10 mL 10-8 mol·dm-3的水溶液中吸取1 mL,用水稀释至10 mL, 形成10-9 mol·dm-3的水溶液。
根据国标GB/T 19857-2005《水产品中孔雀石绿和结晶紫残留量的测定》,其要求的检测浓度为1 ppb,而经过浓度换算,10-9 mol·dm-3为0.364 ppb,已经低于国标,因此配制10-9 mol·dm-3为最低的截止浓度。
(2)采用该复合基底,将上述配制的各种浓度的MG溶液浓度由低到高依次吸附,然后分别进行SERS检测,获得不同浓度MG溶液在该复合基底上SERS光谱,参见附图4,图中,曲线(a)~(e)分别为不同浓度,对应为(a)10-9 mol·dm-3、(b)10-8 mol·dm-3、(c)10-7 mol·dm-3、(d)10-6 mol·dm-3和(e)10-5 mol·dm-3。其中,位于1615 cm-1为MG分子碳碳伸缩振动峰,将1,4-BDT的1064 cm-1与MG的1615 cm-1相比较,建立了MG浓度对数与两特征峰相对强度之间的关系,参见附图5,MG在10-9~10-6 mol·dm-3范围内,其特征峰相对强度的大小与浓度对数呈线性关系。
- 还没有人留言评论。精彩留言会获得点赞!