一种基于发光量子点纳米微乳探针检测样品中角质蛋白19片段与癌胚抗原含量的试剂盒的制作方法
本发明涉及免疫检测
技术领域:
,具体地,涉及一种基于发光量子点纳米微乳探针检测样品中角质蛋白19片段与癌胚抗原含量的试剂盒。
背景技术:
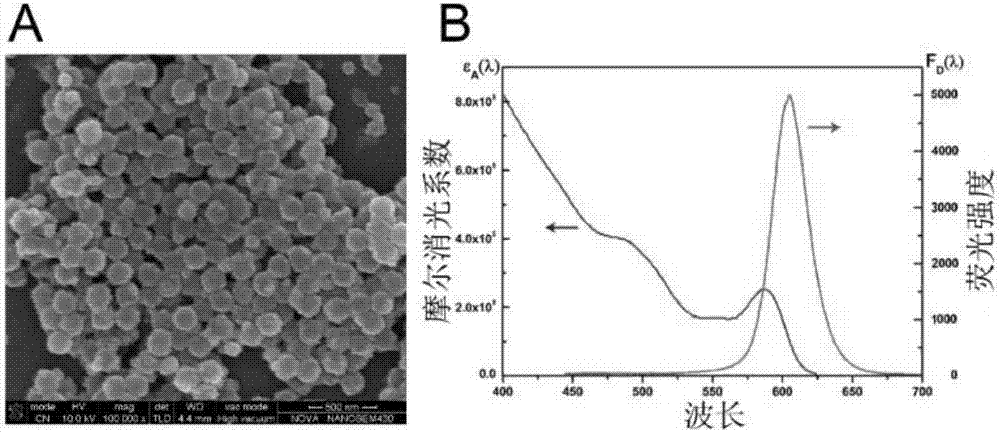
:细胞角质蛋白19片段(cyfra21-1)分子量约为30kda。生理状况下,细胞角质蛋白19广泛表达在多种组织细胞表面,常见于鳞状上皮和层状上皮细胞。在上皮细胞恶性癌变的进程中,激活的蛋白酶系统加速了细胞的降解,大量的细胞角质蛋白片段随之释放进入血液循环系统。由于该可溶性片段可与两株单克隆抗体ks19.1和bm19.21特异性结合,故称为cyfra21-1。cyfra21-1目前被认为是一种主要用于检测肺癌的肿瘤标记物。癌胚抗原(cea)是一种糖蛋白复合物,分子量约为220kda左右,它是由加拿大科学家samuelo.freedman和philgold于1965年在结肠癌组织提取物当中首次发现。通常而言,癌胚抗原是在胎儿时期,由胃肠道组织、胰和肝脏细胞合成,并在出生后基本停止合成。因此正常健康个体的血清当中癌胚抗原的含量维持在很低的水平,约为2.5µg/ml。通常认为,血清中cea水平的升高在胃癌、胰腺癌、肺癌、乳腺癌、甲状腺髓样癌患者当中较为常见,也常见于一些非肿瘤性疾病当中,比如溃疡性结肠炎、胰腺炎、肝硬化、慢性阻塞性肺病、克罗恩病等。因此,血清当中cea含量的检测对上述疾病的诊断与治疗具有重要的价值。肺癌是常见的恶性肿瘤,是难治的实体瘤之一,死亡率在各类恶性肿瘤中居首位,发病率呈逐年上升趋势。其5年生存率仅为13%,而当中将近60%的患者由于发现得较晚,已经不能进行手术治疗,大部分腺癌对化疗、放疗不敏感。提高肺癌患者生存的主要手段是早期诊断,早期治疗。血清肿瘤标志物的异常往往早于影像学的异常,对于无临床相关症状患者,任何一项标志物的异常都可能具有提示意义。因此,多个肿瘤标志物的同步联合检测具有非常重要的临床意义。目前常规的肿瘤标志物的免疫学检测大多采用酶免疫分析、化学发光免疫分析和时间分辨荧光免疫分析(trfia)等。酶联免疫法试剂盒为定性或半定量试剂,不能为临床医生提供精确的定量,很难有效指导临床的治疗。化学发光免疫分析与其它标记技术相比有许多优点:①无放射性辐射的危害;②灵敏度高,检测线性范围宽;③稳定性好、自动化程度高;④应用范围宽,可检测不同分子大小的抗原、半抗原和抗体,又可以用于核酸探针的检测。缺点是发光过程短、样品不能重复检测、本底较高及易受环境物质干扰。目前国内使用大部分为roche、abbott、beckman为代表的进口试剂。trfia技术是继放射免疫分析之后标记物发展的一个新里程碑,已成为生物医学研究和临床超微量生化检验中一项最有发展前景的分析手段。trfia以稀土离子作为标记物,具有制备简便、储存时间长、无放射性污染、标准曲线范围宽、不受样品自然荧光干扰和应用范围十分广泛等优点。然而,目前国内外厂家均采用基于微孔板trfia技术,由于微孔板的固液相反应面积小,需要的免疫反应时间较久;微孔板包被抗体或抗原是通过物理吸附包被,包被抗体或抗原很难标准化,使得检测结果精密度较差;微孔板trfia技术主要为半自动检测,或前处理加上trfia检测仪的准全自动检测,使得样本需要积累到一定量后才能检测。免疫侧向流(lfia)是一种将免疫检测与层析分析技术等多种方法有机结合在一起的固相标记免疫检测技术。其原理在于,以纤维素硝酸酯薄膜为固相载体,样品在毛细作用下在测试条上泳动,样品中的待测分子与膜上的特异性抗体结合,最终形成抗体-抗原-抗体的三文治样免疫复合物。通过一定的检测手段,可以测得膜上的信号,从而对样品中待测物进行定性或定量分析。该检测方法与传统免疫学检测方法相比,有着明显的优势:1.检测快速。通常而言,lfia检测只需15到30分钟,即可完成整个检测过程,因为lfia把样品的预处理、加样、免疫反应等步骤整合在一起。2.检测方便。一般lfia检测信号的仪器都较为轻便,方便家庭或灾害现场使用。3.无需特殊技术培训。对于lfia,操作人员只需完成一个步骤即可:加样-检测。因此特别适合家庭或社区用于疾病的检查。传统的免疫侧向流,是使用胶体金作标记物,并对结果用肉眼进行判断,通常只能作定性或半定量检测,而且通常一次只能检测一项抗原分子。随着技术的进步,近年来也有使用荧光物质作标记物的lfia。而一般的荧光物质,有着荧光信号较弱,容易被光漂白,不易于保存等弱点。技术实现要素:本发明的目的是为了克服现有技术的上述不足,提供一种基于发光量子点纳米微乳探针检测样品中角质蛋白19片段与癌胚抗原含量的试剂盒。为了实现上述目的,本发明是通过以下技术方案予以实现的:一种检测样品中cyfra21-1与cea含量的试剂盒,包括免疫层析检测试纸条和功能性量子点纳米微乳探针;所述功能性量子点纳米微乳探针的制备方法如下:将发射波长在520~620nm之间的油溶性量子点镶嵌或包裹入羧基、氨基、羟基、醛基或磺酸基修饰的聚苯乙烯纳米微球,制备得到量子点纳米微乳,将量子点纳米微乳分别与cyfra21-1检测单抗、cea检测单抗、质控检测抗体共价连接,并对其表面修饰葡聚糖凝胶,分别得到抗cyfra21-1量子点探针、抗cea量子点探针、质控量子点探针;所述免疫层析检测试纸条的检测线上分别包被cyfra21-1包被单抗、cea包被单抗,质控线上包被质控包被抗体。本发明使用量子点纳米微乳作标记物,与普通荧光物质相比,它有着激发波谱宽,发射谱窄而对称,光稳定性好,荧光信号强等优点。另外,虽然目前量子点在免疫分析、细胞成像等领域已有广泛的应用,但量子点与聚苯乙烯纳米材料相结合并用于lfia检测肿瘤相关抗原尚无文献报道。一般而言,基于生物相容性的考虑,在生物学、医学领域使用的量子点是水溶性量子点。然而,由于量子点自身的胶体特性,转相的量子点十分不稳定,容易发生聚集、沉淀,而荧光强度也较低。而本发明使用的发光量子点纳米微乳探针则能很好的解决上述难题。通过把油溶性量子点包埋在聚苯乙烯纳米乳胶内部,可以有效避免外部水相环境带来的影响,保证其优异的光学性能。油溶性量子点的材料可以是硒化镉,硫化镉或碲化镉为核的各种半导体纳米晶体,根据具体情况选择所需波长的量子点,只要其发射波长在520~620nm之间,均适合本发明。量子点的生物应用层出不穷,因其抗光漂白性极强,亮度高,一束激光光源可同时激发不同颜色的量子点,而且能经受激光的多次激发照射而荧光强度无明显变化;此外,量子点的光谱stock位移比较宽,荧光发射峰窄而对称,无拖尾,该特性使得发光量子点纳米微乳探针能满足该免疫分析方法灵敏度和精密度要求,不需要昂贵的红敏检测器件。本发明使用的乳胶球是羧基、氨基、羟基、醛基或磺酸基等生活活性化合物修饰的聚苯乙烯纳米微球,这些微球具备以下特性:表面具有多孔性、表面含有羧基化合物、光学通透性、粒径分布均匀。优选地,所述乳胶球为聚苯乙烯-二乙烯基苯羧酸改性胶乳纳米微球。所述量子点纳米微乳的具体制备方法为:取溶解于正己烷浓度为1~5μm的量子点加入甲醇中,震荡后离心、去除上清液;然后加入三氯甲烷溶解沉淀得量子点溶液,其中溶解于正己烷浓度为1~5μm的量子点:甲醇:三氯甲烷的体积比为2:20:1~2;取胶乳纳米微球加入到相当于微球8~9倍体积的正丁醇中,制得纳米微球悬液;将纳米微球悬液与量子点溶液按照10:1~4.5:1的体积比混合,室温孵育,离心、洗涤数次后得到发光量子点纳米乳胶微球。本发明制得的量子点纳米乳胶微球作为检测肿瘤标志物抗原传感器的重要组成部分,其表面含有大量的羟基、羧基和氨基官能团,能单分散于生物用缓冲液中,克服了自身因为羧基的负电荷密度高所导致的沉淀问题,也解决了对生物分子的非特异性吸附问题。发光量子点纳米乳胶微球与抗体的连接方法为:(1)量子点纳米乳胶微球用mes溶液离心、洗涤2~3次,洗涤后的量子点纳米乳胶微球用mes溶液配置成2~3mg/ml的量子点纳米乳胶微球溶液;(2)往上述量子点纳米乳胶微球溶液中分别加入溶于mes溶液、浓度为10~15mg/ml的sulfo-nhs溶液和溶于mes溶液、浓度为10~15mg/ml的edac溶液,室温震荡孵育得混合液a,点纳米乳胶微球溶液、sulfo-nhs溶液、edac溶液的体积比为40:9:1;(3)将准备用于偶联的抗体溶于mes溶液中得到浓度为1~2mg/ml抗体溶液;(4)向混合液a中加入步骤(3)制得的抗体溶液,室温下震荡孵育即得,混合液a与抗体溶液的体积比为4~6:1。优选地,步骤(1)、(2、(3)中所述mes溶液均为50mm,ph5.0的mes溶液。优选地,步骤(1)中配置成2.5mg/ml的量子点纳米乳胶微球溶液。优选地,步骤(1)中sulfo-nhs溶液和edac溶液的浓度均为10mg/ml。优选地,抗体溶液的浓度为1mg/ml,混合液a与抗体溶液的体积比为5:1。更优选地,发光量子点纳米乳胶微球与抗体的连接方法为:(1)量子点纳米乳胶微球用mes溶液离心、洗涤2~3次,洗涤后的量子点纳米乳胶微球用mes溶液配置成2.5mg/ml的量子点纳米乳胶微球溶液;(2)往上述量子点纳米乳胶微球溶液中分别加入溶于mes溶液、浓度为10mg/ml的sulfo-nhs溶液和溶于mes溶液、浓度为10mg/ml的edac溶液,室温震荡孵育得混合液a,点纳米乳胶微球溶液、sulfo-nhs溶液、edac溶液的体积比为40:9:1;(3)将准备用于偶联的抗体溶于mes溶液中得到浓度为1mg/ml抗体溶液;(4)向混合液a中加入步骤(3)制得的抗体溶液,室温下震荡孵育即得,混合液a与抗体溶液的体积比为5:1。之后需要对量子点纳米乳胶微球探针进行表面非特异性处理。具体的表面非特异性处理方法如下:使用磷酸缓冲液配置浓度为5%的牛血清白蛋白(质量/体积),将量子点纳米乳胶微球探针加入到牛血清白蛋白溶液中,孵育48小时,离心洗涤后即可得到功能性发光量子点纳米微乳探针。因为牛血清白蛋白含有较多的憎水基团,往往用于生物学领域的各种器皿或生物分子的非特异性吸附处理,该方法简便,易于大批量处理。本发明中免疫层析试纸条中检测线或质控线上的抗体的包被步骤为:用包被液(50mmtris-hcl,ph7.0)稀释包被抗体,抗体终浓度为2mg/ml;用biodot画膜仪进行画线,速度为0.8μl/cm,画线距离膜条末端2.5cm,随后把膜条置于37℃烘干过夜。本发明中样品垫处理液的制备方法为:准确称取na2b4o7·10h2o38.18g,nan30.2g,casein-na2g溶解于800ml去离子水中,完全溶解后加入60mltritonx-100,并定容至1l。玻璃纤维垫用所得样品垫处理液完全浸润两小时。用吸水纸吸干后将该样品垫放置于37℃烘干过夜。本发明使用的分析缓冲液配方为:tris-hcl(50mmol/l)、peg6000(1.5%)、bsa(0.2%)、proclin300(0.1%)、牛igg(0.02%)、tween20(0.1%)和nacl(0.84%)ph7.8缓冲液。本发明的发光量子点纳米微乳探针悬浮保存液配制方法为:准确称取tris0.242g,bsa1g,nan30.02g,蔗糖20g,海藻糖5g,加入80ml去离子水,待完全溶解后调整ph为9.0并定容至100ml。本发明的校准品制备步骤为:用含2g/lbsa及1g/lnan3的50mmol/lph7.8tris-hcl缓冲液,分别将cyfra21-1抗原与cea抗原配制成0、1.3、3.6、18、95、480ng/ml和0、2.8、8、40、145、640ng/ml系列浓度的校准溶液,按每瓶1ml分装冻干,4℃保存备用。本发明的测定方法为:取抗cyfra21-1量子点探针(2mg/ml)7.5µl、抗cea量子点探针(2mg/ml)10µl、质控量子点探针(0.5mg/ml)1.5µl与761µl的分析缓冲液相混合震匀,得到量子点探针工作液;取10µl样品或校准品与60µl量子点探针工作液相混合后滴加在试纸条样品垫上。静置15min后在读膜仪上读取荧光值。在本发明的研究过程中,发明人首先对所用的原材料进行筛选试验和质量检定,包括功能性发光量子点纳米微乳探针的制备、标记物和抗体的比例、标记物的稀释度等通过反复探索和试验比对最终找到了简便、效率高、成本低、质量可靠的连接和标记方法。本发明公开了基于上述探索试验得到的各种试剂配方,包括:样品垫处理液、分析缓冲液、量子点纳米微乳探针悬浮保存液配方。本发明的检测试剂盒的基础是双抗体夹心的免疫反应:以纤维素硝酸酯薄膜为固相载体并包被上特异的单克隆抗体;样品与发光量子点纳米微乳探针标记的单克隆抗体混合后滴在试纸条上;混合液在毛细作用下在测试条上泳动,样品中的待测分子与膜上的特异性抗体结合,最终形成抗体-抗原-抗体的三文治样免疫复合物。用读条仪分别读取检测线1、检测线2和质控线的荧光值,并分别计算检测线与质控线之间的荧光比值(r值)。该r值与样品中对应的待测物的浓度成正比,对照标准曲线即可确定样品中抗原含量。与现有技术相比,本发明具有如下有益效果:本发明提供的试剂盒对cyfra21-1和cea具有较高的检测灵敏度、特异性及稳定性,且反应时间短,操作简便,可提高临床检验速度,可实现样本的即时检测。附图说明图1为制备所得量子点纳米微乳探针的场发射扫描电镜照片与荧光谱图。图2为本发明检测的流程示意图。图3为基于发光量子点纳米微乳探针的新型快速诊断检测细胞角质蛋白19片段与癌胚抗原的检测方法的校准品拟合标准曲线。图4为本方法与roche公司的电化学发光试剂盒检测临床血样结果的相关性分析(回归分析)。具体实施方式下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。实施例中所使用的聚苯乙烯-二乙烯基苯羧酸改性胶乳购自thermofisherscientific公司(货号8300-0520100390),脂溶性量子点(货号q21701mp)购自invitrogen公司,偶联剂edac、sulfo-nhs等化学试剂均购自美国sigma-aldrich公司,所用到的癌胚抗原单克隆抗体(s001及6f11)、cyfra21-1单克隆抗体(标记抗体及包被抗体)、山羊抗兔igg、兔igg、癌胚抗原重组抗原、cyfra21-1重组抗原均购自中山大学达安基因公司,其他化学试剂购自国药集团化学试剂有限公司。实施例1一种基于发光量子点纳米微乳探针检测样品中角质蛋白19片段与癌胚抗原含量的试剂盒,包括免疫层析试纸条和功能性发光量子点纳米微乳探针。其中,功能性发光量子点纳米微乳探针包括三种,一种是偶联癌胚抗原单克隆抗体s001的功能性发光量子点纳米微乳探针,一种是偶联角质蛋白19片段单克隆抗体的功能性发光量子点纳米微乳探针、一种是偶联兔igg的功能性发光量子点纳米微乳探针。一、功能性量子点纳米微乳探针的制备,方法如下:1、乳胶球的预处理:将100µl纳米乳胶球(粒径205±3nm,质量浓度为100mg/ml,固体浓度为10%)于14000rmp,4℃离心;弃去上清液,并重悬于400µl正丁醇溶液中,超声重悬,得乳胶球溶液。2、量子点的预处理:取100µl油溶性量子点(发射波长为605nm,浓度为3mg/ml),加入到1ml甲醇中,剧烈震荡1分钟后,14000rpm离心3分钟,去除上清液,沉淀用100µl三氯甲烷溶解,得量子点溶液。3、将步骤2的量子点溶液与步骤1的乳胶球溶液相混合,室温震荡孵育1.5h后,14000rpm,4℃离心,洗涤数次,最终用10ml的tbst溶液保存,得量子点纳米乳胶微球,其浓度为1mg/ml。4、量子点纳米乳胶微球与抗体的偶联:(1)取3ml上述制得的量子点纳米乳胶微球,加入到10ml的mes溶液中(50mm,ph5.0),14000rpm离心10分钟,去除上清液,往沉淀中加入10ml的mes溶液(50mm,ph5.0),超声重悬。重复上述步骤3次后,所得量子点纳米乳胶微球平均分为三份,每份1mg,每份微球重悬于400µl的的mes溶液(50mm,ph5.0)中;(2)分别称取0.3mg的edac与3mg的sulfo-nhs,分别溶解于300µl和30µl的mes溶液(50mm,ph5.0)中,使其浓度均为10mg/ml。往上述每份量子点纳米乳胶微球中分别加入90µl的sulfo-nhs溶液与10µl的edac溶液,室温震荡孵育30分钟;(3)将准备用于偶联的抗体分别加入到截留量为100kda的amicon®ultracentrifugalfilters截留管中,按说明书方法洗去抗体保存液中的叠氮钠等会影响到偶联效果的物质,同时对抗体进行了浓缩。最终浓缩抗体保存在mes溶液(50mm,ph7.4)中,浓度均为1mg/ml。(4)将步骤(2)中孵育完毕的量子点纳米乳胶微球离心、洗涤数次,以除去残留的未反应的分子,洗涤过程使用的缓冲液为mes溶液(50mm,ph7.4)。洗涤完毕的量子点纳米乳胶微球最终加入400µl的mes溶液(50mm,ph7.4),超声重悬分散。(5)分别往每份量子点纳米乳胶微球悬液中加入100µl步骤(3)制得的抗体溶液,混合液在室温下震荡孵育两小时。5、量子点纳米乳胶微球探针进行表面非特异处理,最终得到功能性发光量子点纳米微乳探针,步骤如下:(1)将上述与抗体偶联后的量子点纳米乳胶微球探针离心、洗涤数次,洗涤用溶液为pbs溶液。(2)每份量子点纳米乳胶微球探针分别加入1ml含bsa的tbst溶液(50mmol/l,bsa5%,ph7.0),超声重悬分散后,室温震荡孵育30分钟。(3)量子点纳米乳胶微球探针进行离心、洗涤数次,洗涤缓冲液为50mm的tbst缓冲液,以洗去多余的未参与反应的蛋白分子。最终得到的功能性发光量子点纳米微乳探针,分别加入500µl悬浮保存液,超声重悬分散,其浓度为2mg/ml,4℃保存待用。二、免疫层析试纸条的结构如图1所示,免疫层析试纸条的制备方法如下。预先对玻璃纤维薄膜作处理,同时在硝酸纤维素薄膜上包被检测抗体(检测线1、2上分别包被角质蛋白19片段单克隆抗体、癌胚抗原单克隆抗体,质控线上包被山羊抗兔igg),随后将玻璃纤维膜、硝酸纤维素薄膜、吸水纸组装并裁切得到试纸条。需要说明的是,与发光量子点纳米乳胶球偶联的癌胚抗原单克隆抗体,与包被在检测线上的癌胚抗原单克隆抗体是针对不同抗原决定簇的单抗,检测的原理是双抗夹心法,角质蛋白19片段单克隆抗体也是同理设计的。实施例2一种基于发光量子点纳米微乳探针检测样品中角质蛋白19片段与癌胚抗原含量的试剂盒,包括免疫层析试纸条和功能性量子点纳米微乳探针。一、功能性量子点纳米微乳探针的制备,方法同实施例1。二、免疫层析试纸条的结构如图1所示,免疫层析试纸条的制备方法如下:1、样品垫的预处理:将玻璃纤维膜裁切成1.2cm×30cm的条状,之后把条状玻璃纤维膜浸润在样品垫处理液中,室温下浸泡两小时。用吸水纸吸干其液体后,置于37℃烘干过夜,烘干的样品垫保存在干燥阴冷的场所待用。2、硝酸纤维素薄膜的处理:将硝酸纤维素薄膜裁切成2cm×30cm的条状。将欲包被在膜上的抗体预先用包被液稀释,使其终浓度为2mg/ml。用biodot划线仪器,将抗体均匀地画在硝酸纤维素薄膜上,37℃烘干过夜,烘干的硝酸纤维素薄膜保存在干燥阴凉的场所待用。3、检测试纸条的组装:将吸水纸、支持板、硝酸纤维素薄膜、样品垫按图2的方式组装并裁切成3mm×6cm,并与检测卡外壳相组装,制备好的试纸条保存在干燥阴凉的场所待用。应用例1本发明基于发光量子点纳米微乳探针检测样品中角质蛋白19片段与癌胚抗原含量的试剂盒本发明的使用方法如下:1、样本采集:取10微升全血样品或血清,可为指尖、耳垂或静脉采血。2、试剂准备:分别取抗cyfra21-1、抗cea、山羊抗兔的量子点纳米微乳探针和分析缓冲液,按7.5:10:1.5:761的比例混合即配制成工作液。3、上样操作:取上述工作液60µl与检测样本相混合,加到上样孔中。4、信号读取与结果研判:将检测试纸条水平静置15分钟后用仪器读取其荧光值,并由仪器内置软件计算同时得到样本中角质蛋白19片段与癌胚抗原含量。实施例3本发明的方法学检定按照本领域中常规的制造和检定规程对该分析方法进行检定,结果如下:1、分析灵敏度与线性范围:以零参考标准品当作样品测量8次,计算其r平均值及标准差。以该点r平均值加2倍标准差所得的荧光值代入标准曲线方程计算得出的浓度值为其灵敏度,经测定本试剂对cyfra21-1分析灵敏度为0.16ng/ml,对cea分析灵敏度为0.35ng/ml。将抗原稀释成不同浓度进行测定,测得标准曲线线性范围分别为cyfra21-1:1.3~500ng/ml;cea:1.2~1000ng/ml。2、精密度:用本发明对自制的质控品进行测定,各设10个复孔,结果如表1所示。表1本方法精密度检定结果3、特异度:将高浓度的afp、ca125、ca19-9及人白蛋白当作样品用本试剂盒测定,结果表明无明显交叉反应,见表2。表2特异性检定结果检测项目afpca125ca19-9白蛋白样品浓度1000iu/ml600u/ml500u/ml1000ng/ml测定浓度(ng/ml)0.090.10.070.135实施例4本发明的试剂盒与国内外相关试剂盒临床血样测值比较。用本发明的试剂盒和罗氏公司的电化学发光试剂盒同时对120例cyfra21-1和70例cea血样进行检测。对本方法所得结果与国外公司试剂盒所得结果作回归分析。结果如图4所示,其中cyfra21-1的回归方程为:y=0.9282×x+2.051(r2=0.9862),cea的回归方程为:y=1.650×x+13.41(r2=0.9509)。统计学结果表明,本发明检测方法与罗氏公司的电化学发光试剂盒临床血样测值具有显著相关性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1