一种检测七种β‑肾上腺素受体激动剂的免疫电化学传感器及其制备方法和应用与流程
本发明属于食品安全检测和分析化学技术领域,具体涉及一种检测七种β-肾上腺素受体激动剂的免疫电化学传感器及其制备方法和应用。
背景技术:
β-肾上腺素受体激动剂,简称β-激动剂,是动物源性食品中检出率最高、危害最严重的化学性残留危害物,其中最著名的就是克伦特罗(clenbuterol,CL),俗称“瘦肉精”。上世纪80年代,美国脂胺公司的科研人员意外发现,“瘦肉精”能增强动物脂肪分解,促进蛋白质合成,大大缩短肉品上市周期,显著提高胴体瘦肉率、饲料回报率和经济效益。随后在世界各地迅速推广,80年代后期,传入我国并在许多地区的饲料加工企业和养殖业推广使用,很快成为养殖业应用最广泛的“添加剂”。
“瘦肉精”除克伦特罗外,还包括沙丁胺醇(salbutamol,SAL)、莱克多巴胺(ractopamine,RAC)等20多个结构和性质相类似的化合物。这类化合物进入体内后选择性作用于腺苷酸环化酶,导致人体产生低敏感现象,哮喘发生率和发病程度升高;还可导致内分泌紊乱,诱发染色体畸变及恶性肿瘤,严重时可致人死亡。因此我国和世界上大多数国家都明文禁止“瘦肉精”用作饲料添加剂。
目前,β-激动剂类兽药残留的检测方法主要包括高效液相色谱法(HPLC)、液相色谱-质谱联用法(LC-MS)、气相色谱-质谱联用法(GC-MS)、酶联免疫法(ELISA)和荧光免疫法(FIA)等。
色谱法是β-激动剂兽药残留的主要检测方法,但是色谱法检测成本高、操作复杂、大量的阴性样品重复检测;而酶联免疫法具有特异性强、样品前处理简单等优点,但特异性强的特点同时也决定了它的致命缺点:一种酶联免疫试剂盒或试纸条只能检测一种兽药残留,而无法检测其它的同类兽药残留,这就是容易出现漏检的原因(如2011年轰动全国的“双汇瘦肉精”事件);此外,随着β-激动剂多种替代品的出现,如果进行完全检测,一个样品需要使用多种检测产品,大大提高了检测成本和工作时间,失去了快速筛选的意义。
多残留免疫分析能同时检测一类药物残留,其低成本、高通量、快速现场的优点是现有的色谱法和特异性免疫方法无法比拟的,是未来食品安全检测领域的关键技术之一,逐渐引起重视。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种检测七种β-肾上腺素受体激动剂的免疫电化学传感器及其制备方法和应用,所述电化学传感器基于宽谱特异性抗体抗体的交叉反应来实现七种β-肾上腺素受体激动剂的检测。
为解决现有技术问题,本发明采取的技术方案为:
一种检测七种β-肾上腺素受体激动剂的免疫电化学传感器,包括基底玻碳电极,和依次涂布在所述基底玻碳电极表面的石墨烯/壳聚糖混合膜层、检测层,所述检测层的材料为β-激动剂通用半抗原4-(4-(2-叔丁胺基)1-羟乙基)苯基丁酸(TBPBA)溶液,β-激动剂通用半抗原4-(4-(2-叔丁胺基)1-羟乙基)苯基丁酸的结构式为
作为改进的是,所述检测曾上设有封闭层。
作为改进的是,所述封闭层的材料为牛血清蛋白溶液。
上述检测七种β-肾上腺素受体激动剂的免疫电化学传感器的制备方法为,在洁净的基底玻碳电极表面滴涂石墨烯/壳聚糖分散液,晾干形成膜层,然后在膜层表面滴涂4-(4-(2-叔丁胺基)1-羟乙基)苯基丁酸溶液,晾干得免疫电化学传感器。
作为改进的是,所述石墨烯/壳聚糖分散液的体积为2-20μl,浓度为5mg/ml。
作为改进的是,所述4-(4-(2-叔丁胺基)1-羟乙基)苯基丁酸溶液的浓度为0.2mg/ml。
上述一种检测七种β-肾上腺素受体激动剂的免疫电化学传感器在食品中β-肾上腺素受体激动剂检测中的应用。
作为改进的是,所述所述β-肾上腺素受体激动剂为克伦特罗、沙丁胺醇、马布特罗、溴布特罗、西布特罗、妥布特罗或特步他林。
有益效果
本发明的传感器以K3[Fe(CN)6]为探针,基于抗TBPBA-BSA抗体对β-激动剂的交叉免疫反应,能实现对克伦特罗、沙丁胺醇、马布特罗、溴布特罗、西布特罗、妥布特罗和特步他林七种β-激动剂的检测。所述的传感器快速、高效、灵敏度高,并且所述的方法具有较低的检出限(0.3ng/ml~0.5ng/ml)和较宽的线性范围(50~5000ng/ml或10~7000ng/ml)。本发明免疫电化学传感器检测前样品处理简单,检测操作简便,灵敏度高,可实现多残留检测等优点,实用价值极强,市场潜力巨大。
附图说明
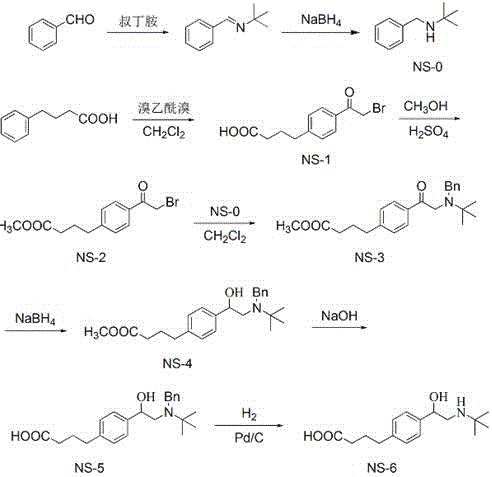
图1为通用半抗原TBPBA的合成路线图。
图2为石墨烯/壳聚糖/TBPBA修饰的免疫电化学传感器在含有效价浓度为1:6400的β-激动剂宽谱特异性抗体和不同浓度的游离的克伦特罗(a)6000ng/ml,(b)5000ng/ml,(c)4000ng/ml,(d)3000ng/ml,(e)1000ng/ml,(f)500ng/ml,(g)100ng/ml,(h)50ng/ml,(i)0的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的磷酸缓冲溶液中的DPV曲线图。
图3为响应电流的变化ΔI与克伦特罗浓度的工作曲线图。
图4为石墨烯/壳聚糖/TBPBA修饰的免疫电化学传感器在含有效价浓度为1:6400的β-激动剂宽谱特异性抗体和不同浓度的游离的沙丁胺醇(a)7000ng/ml,(b)5000ng/ml,(c)2000ng/ml,(d)1000ng/ml,(e)100ng/ml,(f)10ng/ml,(g)0ng/ml的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的磷酸缓冲溶液中的DPV曲线图。
图5为响应电流的变化ΔI与沙丁胺醇浓度的线性曲线图。
图6为石墨烯/壳聚糖/TBPBA修饰的免疫电化学传感器在含有效价浓度为1:6400的β-激动剂宽谱特异性抗体和不同浓度的游离的马布特罗(a)5000ng/ml,(b)4000ng/ml,(c)3000ng/ml,(d)2000ng/ml,(e)1000ng/ml,(f)500ng/ml,(g)100ng/ml,(h)50ng/ml,(i)0ng/ml的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的磷酸缓冲溶液中的DPV曲线图。
图7为响应电流的变化ΔI与马布特罗浓度的线性曲线图。
具体实施方式
实施例1β-激动剂通用半抗原4-(4-(2-叔丁胺基)1-羟乙基)苯基丁酸(TBPBA)的合成
(1)苄基叔丁胺(NS-0)
将4.8ml苯甲醛溶解于无水乙醇中,再加入5ml叔丁胺,室温反应2h后再加入1.8g硼氢化钠反应1h。用二氯甲烷萃取后经过硅胶柱纯化,得到产物NS-06.2g。
(2)4-(4-溴乙酰基)苯基丁酸(NS-1)
将8.56g无水氯化铝溶解于二氯甲烷中,加入1.64ml溴乙酰溴反应0.5h,再加入2.19g4-苯基丁酸反应3-5h。用二氯甲烷萃取后蒸去溶剂,得到产物3.5g。
(3)4-(4-溴乙酰基)苯基丁酸甲酯(NS-2)
将2.85g NS-1溶解于甲醇中,加入浓硫酸加热回流3h。蒸去甲醇后用二氯甲烷萃取,除去溶剂并纯化,得到产物2.6g。
(4)4-(4-(2-苄基叔丁胺基)乙酰基)苯基丁酸甲酯(NS-3)
将203mg NS-0和337mg NS-2溶解于乙腈中,加入314mg无水碳酸钾反应过夜。加水后用二氯甲烷萃取,经过硅胶柱纯化,得到产物187mg。
(5)4-(4-(2-苄基叔丁胺基)1-羟乙基)苯基丁酸甲酯(NS-4)
将74mg NS-3溶解于甲醇中,加入11mg硼氢化钠反应1h。加酸后用二氯甲烷萃取,经过硅胶柱纯化,得到产物41mg。
(6)4-(4-(2-苄基叔丁胺基)1-羟乙基)苯基丁酸(NS-5)
将45mg NS-4溶解于甲醇中,加入氢氧化钠反应过夜。加酸后用二氯甲烷萃取,经过硅胶柱纯化,得到产物39mg。
(7)4-(4-(2-叔丁胺基)1-羟乙基)苯基丁酸(TBPBA)
将37mg NS-5和适量钯碳加入到盛有甲醇的反应瓶中,置换空气后反应2h。过滤后过硅胶柱纯化,得终产物,即通用半抗原TBPBA 39mg。
实施例2用半抗原-牛血清白蛋白(TBPBA-BSA)偶联物的制备
将0.2mmol TBPBA溶于无水乙醇中,加入等量N-羟基琥珀酰亚胺(NHS)和1-[3-(二甲氨基)丙基]-3乙基碳二亚胺碳酸盐(EDC),室温下反应3~5h。将上述反应液缓慢加入到5~10ml含有5~10mg/ml牛血清白蛋白(BSA)的磷酸缓冲溶液中,室温反应过夜。将上述反应液用磷酸缓冲溶液透析3~6次,冷冻干燥即可得到TBPBA-BSA偶联物冻干粉。
实施例3宽谱特异性抗体(抗TBPBA-BSA抗体)的制备
用TBPBA-BSA偶联物作为免疫原免疫体重约2kg的健康大白兔。首次免疫时将0.25mg免疫原与等量弗氏完全佐剂混合并充分乳化,背部皮下多点注射。两周后用同样剂量免疫原与等量弗氏不完全佐剂进行乳化并进行加强免疫,每两周加强免疫一次,共加强三次。最后一次免疫10天后对大白兔进行颈静脉采血,放在4℃环境下静置30min,再用硫酸铵多级沉淀法进行纯化,即可得到抗TBPBA-BSA多克隆抗体。
实施例4免疫电化学传感器的制备
将直径为3mm的玻碳电极依次用直径为0.3μm和0.05μm的Al2O3抛光粉打磨,依次用无水乙醇-蒸馏水、蒸馏水超声清洗5min,再用蒸馏水冲洗干净。在电极上滴涂4μl石墨烯/壳聚糖(浓度为5mg/ml)分散液,然后将2μl的通用半抗原TBPBA溶液(浓度为0.2mg/ml)滴涂于电极表面,室温下晾干。最后将电极浸泡在质量百分为浓度5%的BSA溶液中,在37℃烘箱中孵育30min,以封闭剩余的活性位点。
实施例5对克伦特罗的检测
将实施例4中制备的免疫电化学传感器浸入总体积为50μL的含有不同浓度的游离克伦特罗,和效价浓度为1:6400的抗TBPBA-BSA抗体的磷酸缓冲溶液中,在37℃孵育30min,用磷酸缓冲溶液冲洗后于2mmol/L的K3[Fe(CN)6]溶液中进行差分脉冲伏安(DPV)扫描(图2)。
将在克伦特罗浓度为0的孵育液中孵育后的修饰电极的DPV峰电流定义为I0,在含有不同浓度克伦特罗的孵育液孵育后的修饰电极的DPV峰电流定义为IX,计算ΔI=IX-I0,以ΔI对克伦特罗浓度(C)作图可得ΔI-C工作曲线(图3)。采用线性回归法得到ΔI-C线性回归方程:Y=1.07415+0.00134X,克伦特罗的浓度在50~6000ng/ml范围内与ΔI成正比,线性相关系数为0.9932。以大于噪音信号3倍的电流信号对应的浓度为最低检出限,重复5次以上实验得出,上述方法的最低检出限为0.4ng/ml。
实施例6对沙丁胺醇的检测
将实施例4中制备的免疫电化学传感器浸入总体积为50μL的含有不同浓度的游离沙丁胺醇,和效价浓度为1:6400的抗TBPBA-BSA抗体的磷酸缓冲溶液中,在37℃孵育40min,用磷酸缓冲溶液冲洗后于2mmol/L的K3[Fe(CN)6]溶液中进行差分脉冲伏安(DPV)扫描(图4)。
将在沙丁胺醇浓度为0的孵育液中孵育后的修饰电极的DPV峰电流定义为I0,在含有不同浓度沙丁胺醇的孵育液孵育后的修饰电极的DPV峰电流定义为IX,计算ΔI=IX-I0,以ΔI对沙丁胺醇浓度(C)作图可得ΔI-C工作曲线(图5)。采用线性回归法得到ΔI-C线性回归方程:Y=1.20866+0.0014X,沙丁胺醇的浓度在10~7000ng/ml范围内与ΔI成正比,线性相关系数为0.99366。以大于噪音信号3倍的电流信号对应的浓度为最低检出限,重复5次以上实验得出,上述方法的最低检测限为0.3ng/ml。
实施例7对马布特罗的检测
将实施例4中制备的免疫电化学传感器浸入总体积为50μL的含有不同浓度的游离马布特罗,和效价浓度为1:6400的抗TBPBA-BSA抗体的磷酸缓冲溶液中,在37℃孵育30min,用磷酸缓冲溶液冲洗后于2mmol/L的K3[Fe(CN)6]溶液中进行差分脉冲伏安(DPV)扫描(图6)。
将在马布特罗浓度为0的孵育液中孵育后的修饰电极的DPV峰电流定义为I0,在含有不同浓度马布特罗的孵育液孵育后的修饰电极的DPV峰电流定义为IX,计算ΔI=IX-I0,以ΔI对马布特罗浓度(C)作图可得ΔI-C工作曲线(图7)。采用线性回归法得到ΔI-C线性回归方程:Y=3.09399+0.0006734X,马布特罗的浓度在50~5000ng/ml范围内与ΔI成正比,线性相关系数为0.99645。以大于噪音信号3倍的电流信号对应的浓度为最低检出限,重复5次以上实验得出,上述方法的最低检测限为0.5ng/ml。
实施例8猪肉样品中加标妥布特罗的测定
步骤1,猪肉样品的处理:称取1±0.0050g猪肉于到10ml的样品管中,加入妥布特罗标准液,和3ml乙腈-丙酮提取液(V:V=4:1),混合物超声振荡30分钟,于2000r/m下离心10分钟,将上清液转移至氮吹管中,残渣用3ml的相同提取液重复提取1次,上清液合并在氮吹管中。提取物在氮吹条件下于50℃温度下浓缩蒸发,浓缩物加入1ml的pH为7.4磷酸缓冲溶液溶解后用于电化学分析。
步骤2,猪肉样品中加标妥布特罗的测定:分别取等量的不同猪肉提取液样品,和抗TBPBA-BSA抗体溶液及磷酸缓冲溶液混合配成孵育液,使得总体积为50μl,且抗TBPBA-BSA抗体的浓度均相等。将石墨烯/壳聚糖/TBPBA修饰的免疫电化学传感器浸入孵育液中,在37℃孵育25min,用磷酸缓冲溶液冲洗后于2mmol/L的K3[Fe(CN)6]溶液中进行差分脉冲伏安(DPV)扫描。定义空白样品的峰电流为I0,其他样品的峰电流IX,计算△I=IX-I0。以与实施例7中相同的方法得到的DPV峰电流差值ΔI与妥布特罗的浓度C的ΔI-C工作曲线,得到妥布特罗的浓度,检测回收率结果如表1。
表1为免疫传感器检测加标猪肉中的妥布特罗浓度的回收率
实施例9鸭肉样品中加标溴布特罗的测定
步骤1,鸭肉样品的处理:称取1±0.0050g鸭肉于到10ml的样品管中,加入溴布特罗标准液,按照与实施例8步骤1)中相同的方法进行鸭肉样品前处理。
步骤2,鸭肉样品中加标溴布特罗的测定:分别取等量的不同鸭肉提取液样品,和抗TBPBA-BSA抗体溶液及磷酸缓冲溶液混合配成孵育液,按照与实施例7步骤2)中相同的方法进行鸭肉样品中加标溴布特罗的检测,检测回收率结果如表2。
表2为免疫传感器检测加标鸭肉中的溴布特罗浓度的回收率。
实施例10牛肉样品中加标西布特罗的测定
步骤1,牛肉样品的处理:称取1±0.0050g牛肉于到10ml的样品管中,加入西布特罗标准液,按照与猪肉样品中加标妥布特罗的测定中步骤1)中相同的方法进行牛肉样品前处理。
步骤2,牛肉样品中加标西布特罗的测定:分别取等量的不同牛肉提取液样品,和抗TBPBA-BSA抗体溶液及磷酸缓冲溶液混合配成孵育液,按照与猪肉样品中加标妥布特罗的测定中步骤2)中相同的方法进行牛肉样品中加标西布特罗的检测,检测回收率结果如表3。
表3为免疫传感器检测加标牛肉中的西布特罗浓度的回收率。
通过实验检测可知,本发明传感器对克伦特罗和溴布特罗的检测限为0.4ng/mL,线性范围为50~6000ng/mL;对沙丁胺醇和特步他林的检测限为0.3ng/mL,线性范围为10~7000ng/mL;对马布特罗和西布特罗的检测限为0.5ng/mL,线性范线性范围为50~5000ng/mL;对妥布特罗的检测限为0.5ng/mL,线性范围为50~6000ng/mL,为食品安全提供了保障。
- 还没有人留言评论。精彩留言会获得点赞!
- 包含与β-3-肾上腺素能受体激动剂组合的去氨加压素的方法和组合物的制作方法
- 具有毒蕈碱受体拮抗体和β2肾上腺素能受体激动剂两种活性的2-氨基-1-羟乙基-8-羟基 ...的制作方法
- 靶向于肌动蛋白结合蛋白Transgelin-2的化合物及其新用图
- 一种α-2肾上腺素受体和σ受体配体的组合物的制作方法
- 天然植物皂苷功效组分的筛选方法及用图
- 通过玻璃体内和前房内途径用于治疗眼内压和眼部疾病的α-2肾上腺素能激动剂的制作方法
- 用于治疗组织创伤的α-肾上腺素能激动剂的制作方法
- 具有β2肾上腺素能受体激动剂和M3毒蕈碱受体拮抗剂两种活性的2-氨基-1-羟乙基-8-羟 ...的制作方法
- 具有毒蕈碱受体拮抗剂和β2肾上腺素能受体激动剂活性的化合物的制作方法
- 具有毒蕈碱受体拮抗剂和β2肾上腺素能受体激动剂活性的化合物的制作方法
- 腺苷a-的制作方法
- 用于治疗或预防α-2B-肾上腺素受体介导疾病的化合物的制作方法
- 作为β-肾上腺素能受体激酶1抑制剂的吡唑并吡啶衍生物的制作方法
- 一种(±)-去甲肾上腺素的制备方法
- 有神经病痛治疗用血清素和去甲肾上腺素再摄取综合抑制作用的4-[2-(4-甲基苯硫基 ...的制作方法
- 去甲肾上腺素完全抗原的制备方法及偶联摩尔比测定方法
- 用于调节β2肾上腺素受体活性的4-羟基-2-氧代-2,3-二氢-1,3-苯并噻唑-7-基化合物的制作方法
- 胺衍生物及其在β2肾上腺素受体介导的疾病中的用途的制作方法
- 具有血清素源性活性和/或去甲肾上腺素能活性的取代芳氧基丙胺的制作方法
- 可用作肾上腺素能受体的甲酰胺衍生物的制作方法