一种β‑内酰胺类抗生素敏感性的快速检测方法与流程
本发明涉及一种抗生素敏感性快速检测方法,具体涉及采用等温微量热法检测β-内酰胺酶抗生素敏感性的快速检测方法,属于生化分析领域。
背景技术:
β-内酰胺类抗生素是一类含有β-内酰胺环的抗菌药物,包括青霉素类,头孢菌素类,碳青霉烯类以及单环β-内酰胺类等。β-内酰胺抗生素主要通过抑制与细菌细胞壁肽聚糖合成相关的 PBPs 转肽酶来实现杀菌目的。自1928年青霉素的发现以来,β-内酰胺类抗生素被长期用于细菌感染的治疗,显著提高了人类的生命健康质量。然而,随着抗生素的不合理使用,细菌的耐药性问题日益凸显。在全球范围内,抗生素耐药已成为导致患者发病及死亡的重要原因。因此,及时监测细菌耐药对于感染病人治疗方案的确定和预防医院内病菌的交叉感染具有重要意义。
传统的抗生素敏感性检测方法为琼脂稀释法,即最小抑菌浓度MIC检测法。该方法通过将抗菌药物配制到琼脂培养基中,制成一系列药物浓度递减的培养基以用于细菌过夜培养,以未见细菌生长的最低抗生素浓度(即MIC值)来评估细菌的药敏性。该方法的优点是定量、准确,其主要缺点是操作复杂耗时长,通常得到测试结果需要16到24小时,对于一些生长较慢的菌种所需时间更长。细菌对β-内酰胺类抗生素耐药的主要机制是细菌进化产生一种抗生素钝化酶,即β-内酰胺酶,其催化的β-内酰胺环水解反应可以导致该类抗生素失效。因此,近年来,基于抗生素钝化酶基因或生化活性的耐药检测方法越来越受欢迎。该方法的优点是可以较快地从分子水平确定特定β-内酰酶的表达,缺点是其所用引物只能用于检测已知基因,不能用于新β-内酰胺酶基因和突变基因的检测。直接检测细菌β-内酰胺酶活性的实验方法也有报道,例如伯纳乌、皮雷利等人采用紫外分光光度法分析细菌裂解液水解β-内酰胺抗生素水平以提供其耐药信息。但是该方法工作量大,而且仍需要数个小时才能得出测试结果。
技术实现要素:
本发明的目的是提供一种方便快捷、操作简单,基于等温滴定微量热技术快速检测β-内酰胺酶耐药特征的方法。该方法通过实时观察样品(e.g. β-内酰胺酶溶液或临床细菌)与抗生素混合后是否产生热量变化(抗生素水解是放热反应)从而快速获得药物对样品的敏感信息,或样品是否含β-内酰胺酶(e.g. 产酶菌株),对临床用药指导和预防耐药细菌传播具有重要指导意义。
本发明实现过程如下:
一种β-内酰胺酶药敏快速检测方法:将待测样品与β-内酰胺类抗生素在等温滴定微量热仪反应池中混合,记录实时热量变化,通过是否产生热量变化判断样品对药物的敏感信息,若放出热量,则待测样品含有β-内酰胺酶活。
上述待测样品为纯化的蛋白质、细菌裂解液或临床细菌。
上述临床细菌为大肠杆菌、鲍曼不动杆菌、绿脓杆菌、肺炎克雷伯菌、屎肠球菌或金黄色葡萄球菌。
上述β-内酰胺类抗生素为青霉素类、头孢菌素类、碳青霉烯类、单环β-内酰胺类。
具体地说,上述的β-内酰胺酶药敏快速检测方法,包括以下步骤:
1)给等温滴定微量热仪样品池加待测样品,待测样品浓度为纯化蛋白质0.5-50 nM 或细菌悬液 OD600 = 1~20;
2)滴定针加样β-内酰胺类抗生素药物,抗生素浓度 1-5 mM,缓冲液含50 mM Tris,pH 7.0;
3)将滴定针中β-内酰胺类抗生素药物加入样品池,实时记录样品池中热量变化;反应条件:滴定体积 20-40μL,spacing time = 400s,滴定针转速750 rpm, 反应温度25 ºC。
本发明具有如下优点:
(1)该方法灵敏快速,可以在10分钟内快速获得β-内酰胺酶是否对特定抗生素具有水解活性或样品是否含β-内酰胺酶的信息。大大节省了传统药敏测试的时间,因此可以用于临床实验室进行快速耐药分析,指导医生确定临床用药方案。
(2)该方法操作简单,无需标记抗生素也无需根据不同抗生素调整实验条件,唯一的探针是热量的变化。因此,所有的β-内酰胺抗生素都可以采用相同的实验体系进行测试,避免了紫外分光光度法中不同抗生素需要选择不同检测波长的缺点。
(3)本方法应用性广,既可用于纯化的蛋白,也可用于细菌裂解液、甚至是活细菌的耐药检测,而紫外分光光度法不适用于悬浊液的分析。
附图说明
图1为实施例1中纯化的金属β-内酰胺酶L1与青霉素G、亚胺培南、先锋霉素(V)进行滴定的ITC图谱;
图2为实施例1中表达L1蛋白的重组大肠杆菌细胞(E.coli-L1)与青霉素G、亚胺培南、先锋霉素(V)进行滴定的ITC图谱;
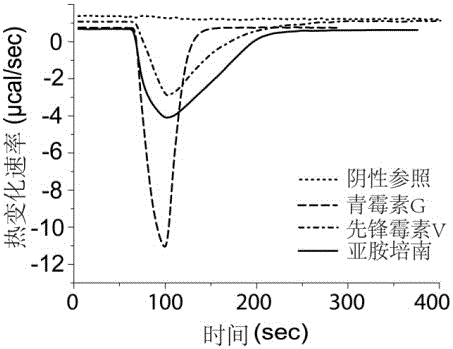
图3为实施例2中临床大肠杆菌与三种β-内酰胺抗生素的ITC图谱;
图4为实施例3中临床鲍曼不动杆菌与三种β-内酰胺药物的ITC图谱。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实例中所用等温滴定微量热仪型号为马尔文公司所生产的ITC200量热仪。
本发明采用等温滴定微量热仪(ITC)进行抗生素耐药性分析的实验方法,包括如下步骤:
(1)在等温滴定微量热仪(ITC)的滴定针内加入1mM 待测抗生素(青霉素、亚胺培南、先锋霉素等);
(2)在等温滴定微量热仪(ITC)的样品池内加入含有待测β-内酰胺酶的溶液或待测细菌悬浊液;
(3)设置电脑程序滴加20-40 μL 抗生素至样品池,滴定针转速750 rpm, 检测温度25 ºC, 在20 min 内通过电脑记录样品池中实时热量变化,直至热量变化回到基线(所有抗生素被水解完全);
(4)根据电脑记录的热量随时间变化曲线判定药物的敏感性,如所述样品对抗生素具有水解活性,即可观察到负热量变化(抗生素水解为放热反应)。如所述样品对抗生素无水解活性,或所述样品不含有β-内酰胺酶,则观察不到负热量变化。
实施例1、金属β-内酰胺酶L1耐药分析
如图1-2所示,本发明提供的实验方法可以用于分析金属β-内酰胺酶L1的耐药性,该实例中图1使用的样品是纯化的L1蛋白质,图2使用的是表达L1蛋白的重组大肠杆菌细胞(E.coli-L1)。根据该图,L1 可以水解青霉素G钠盐、亚胺培南、先锋霉素V这三种抗生素,与文献报道L1抗生素耐药谱一致。
耐药分析具体步骤如下:
(1)将L1单克隆大肠杆菌(pET26b-L1)接种于50 mL LB培养液中,37 ℃恒温隔夜培养;
(2)隔天接菌扩大培养,待 OD600 达到 0.6,加入 IPTG 诱导反应 3 h 后,离心收集细胞;
(3)步骤(2)所述细胞经超声破碎,收集清液用阴离子交换柱(Q柱)进行纯化;
(4)步骤(3)所述纯化蛋白透析至ITC缓冲液 (50 mM Tris, pH 7.0),用注射器吸取210 μL上样至样品池。优选蛋白浓度为20 nM;
(5)如果是细菌实验,将步骤(2)收集的细菌用ITC缓冲液 (50 mM Tris, pH 7.0)配制成菌悬液,优选浓度OD600 = 0.6,用注射器吸取210 μL上样至样品池;
(6)配制1 mM 抗生素溶液至 ITC 缓冲液 (50 mM Tris, pH 7.0),上样至滴定针。设置电脑程序分别滴加20 μL 抗生素溶液至样品池,实时记录样品池内热量变化曲线。滴定针转速优选750 rpm,检测温度优选25 ºC;
(7)如图1,三种抗生素与L1酶混合后均可检测到负的热量变化,说明L1可以水解这三种抗生素,且该水解反应是放热反应。其中L1酶催化青霉素G钠盐的水解反应最快,热量变化最快回到基线水平(180 sec)。如图2,三种抗生素与步骤(2)中重组大肠杆菌细胞(E.coli-L1)混合后检测到的热量变化曲线与图1类似,说明该方法同样适用于细菌对β-内酰胺的药敏分析。
实施例2、临床大肠杆菌β-内酰胺耐药性分析
如图3所示,本发明提供的实验方法可以用于分析临床大肠杆菌对β-内酰胺药物的耐药特征,且单次分析在400 sec 内即可完成。该实例中使用的样品是经西安交通大学第一附属医院从临床病人体液中分离得到的一株大肠杆菌菌株。
具体步骤如下:
(1)挑取新鲜血平板上的单菌落用MH肉汤培养液在37℃进行隔夜培养;
(2)离心培养液,用 ITC 缓冲液 (50 mM Tris, pH 7.0) 配制成 OD600 = 1~4 的菌悬液,优选浓度 OD600 = 3,用注射器吸取210 μL至样品池;
(3)如实施例1步骤(6)进行菌液ITC药敏实验。步骤(2)中的临床菌悬液分别与1mM 的青霉素G、亚胺培南、先锋霉素(V)进行滴定。 反应条件:滴定体积 20 μL,spacing time = 400 s,转速750 rpm, 反应温度25 ºC。标准菌株E.coli ATCC 25922 作为阴性参照;
(4)图3为三种抗生素滴定临床大肠杆菌和阴性菌株的热量变化。三种抗生素滴定阴性菌株 E.coli ATCC 25922 均无热量变化,符合该菌株对抗生素敏感的特征。青霉素G与先锋霉素(V)滴定临床大肠杆菌产生负的热量变化,而滴定亚胺培南无热量变化,说明该临床菌株对青霉素G钠盐与先锋霉素(V)有水解活性,对亚胺培南无水解活性;
(5)采用琼脂稀释法对该临床大肠杆菌菌株进行药敏实验,结果表明该菌株对
青霉素G、先锋霉素(V)和亚胺培南的最小抑菌浓度(MIC)分别为 25000、6300 和 1 μg/mL。该测试结果与ITC检测结果一致,此临床菌株对青霉素G与先锋霉素(V)耐药,对亚胺培南敏感。
实施例3、临床鲍曼不动杆菌β-内酰胺耐药性分析
如图4所示,本发明提供的实验方法可以用于分析临床鲍曼不动杆菌对β-内酰胺药物的耐药特征,且单次分析可在500 sec 内完成。该实例中使用的样品是经西安交通大学第一附属医院从临床病人体液中分离得到的一株鲍曼不动杆菌菌株。
具体步骤如下:
(1)用接种环在新鲜血平板上直接刮取鲍曼不动杆菌菌落,用ITC缓冲液 (50 mM Tris, pH 7.0) 配制成 OD600 = 1~4 的菌悬液,优选浓度 OD600 = 1.4,用注射器吸取210 μL至样品池;
(2)如实施例1步骤(6)进行菌液ITC药敏实验。步骤(1)中的菌液及阴性参照菌液分别与1mM 的青霉素G钠盐、亚胺培南、先锋霉素(V)进行滴定。 反应条件:滴定体积 20μL,spacing time = 400s,转速750 rpm, 反应温度25 ºC;
(4)图4为三种抗生素滴定临床大肠杆菌和阴性菌株的热量变化。三种抗生素滴定阴性菌株均无热量变化,滴定待测鲍曼不动杆菌均有明显负的热量变化,表明该菌株对青霉素G、先锋霉素(V)和亚胺培南均可水解;
(5)采用琼脂稀释法对该临床鲍曼不动杆菌菌株进行药敏实验,结果表明该菌株对青霉素G钠盐、先锋霉素(V)和亚胺培南的最小抑菌浓度(MIC)分别为 25000、6300 和 60 μg/mL。该测试结果与ITC检测结果一致,此临床菌株对青霉素G、先锋霉素(V)以及亚胺培南均耐药。
- 还没有人留言评论。精彩留言会获得点赞!