基于水溶性Cd‑Ag‑Te量子点/纳米金复合材料的光电免疫传感器的制作方法
本发明同时涉及疾病标志物检测、光电化学、免疫传感技术领域,具体涉及一种新型水溶性Cd-Ag-Te量子点/纳米金复合材料的制备、表征及量子点与纳米金间的能量转移在心肌肌钙蛋白I光电免疫传感器中的应用。
背景技术:
光电化学传感器是利用物质的光电特性来检测待测物的传感装置,是最近几年发展起来的一种分析方法。光电化学作为一种分析手段,它的检测过程和电致化学发光正好相反。由于采用不同形式的激发和检测信号,因而其背景信号较低,可能达到与电致化学发光相当的高灵敏度。并且,光电化学的仪器比较简单,容易微型化;由于采用电化学检测,同光学检测方法相比,其设备更加价廉。实际上,在使用相同设计进行同一物质检测时,基于光电化学传感器的方法也比基于电化学的方法呈现出更好的检测性能(如更低的检测限)。基于以上优点,光电化学传感器在生物分子测定方面有着广阔的应用前景。但光电化学传感技术目前还处于起步阶段,主要侧重于新型光电材料的利用、新型检测方法的构建、检测物质的多样化。
量子点是一种重要的半导体光电材料,广泛应用于光电化学传感研究,但单一量子点材料由于内部电子空穴对的复合导致光电转换效率较低。因此,寻找一个合适的方法,有效地提升光电材料的光电转换效率是非常重要的。随着新材料技术的进步,纳米材料的重要性日益凸显,它为光电化学传感器注入了新的力量。特别是纳米复合材料,比单一材料具有更高的光电转换效率。近年来,纳米复合材料的研究获得广泛关注。
纳米金具有比表面积大、表面自由能高、导电性好等优点,已被广泛应用于电化学领域。同时,纳米金还具有良好的生物相容性,适用于生物分子检测。
将新型水溶性Cd-Ag-Te量子点与纳米金复合,有望进一步提高光电化学传感器的性能,用于高灵敏测定心肌肌钙蛋白I,该传感器在心肌细胞受损排查中具有潜在的应用价值,是一个值得深入探讨的课题。
技术实现要素:
为了克服上述现有技术中存在的不足,本发明的目的在于:
第一,提供一种新型光电转换效率较高的水溶性Cd-Ag-Te量子点/纳米金复合材料及制备方法;
第二,提供一种基于上述新型水溶性Cd-Ag-Te量子点/纳米金复合材料修饰L型玻碳电极的光电免疫传感器;
第三,提供上述光电免疫传感器在测定心肌肌钙蛋白I中的应用。
为了实现上述诸发明目的,本发明采取了如下技术措施:
首先,制备一种水溶性三元Cd-Ag-Te量子点/纳米金复合材料,其方法包括以下步骤:
A、水溶性Cd-Ag-Te量子点溶液的制备:
氮气保护下,向250mL三颈圆底烧瓶中依次加入80mL 0.002mol·L-1CdCl2溶液、20mL 0.016mol·L-1N-乙酰-L-半胱氨酸溶液和40ml二次蒸馏水,混合均匀,得混合液;用1mol·L-1NaOH溶液调节混合液的pH值为11.5;加入2mL 0.01mol·L-1AgNO3溶液,避光反应1h;然后加入3mL新制备的0.01mol·L-1NaHTe溶液,氮气保护下,100℃反应1-4h,得到发射波长可调的Cd-Ag-Te量子点溶液。将上述溶液冷却至室温,用10kD的超滤管离心(以对量子点溶液进行浓缩和纯化),得到新型水溶性Cd-Ag-Te量子点溶液,4℃保存备用。
B、纳米金的制备:
(1)合成1-(10-溴癸基)-3-甲基咪唑溴盐:氮气保护下,向100mL三颈圆底烧瓶中加入7.5g 1,10-二溴癸烷,将0.9g 1-甲基咪唑溶于30mL乙腈,并逐滴加入上述三颈圆底烧瓶中,滴加完毕后升温至65℃,搅拌反应12h,蒸干溶剂,用乙醚洗掉未反应完全的1,10-二溴癸烷,将粗产物经硅胶柱分离得到黄色粘稠液体,即1-(10-溴癸基)-3-甲基咪唑溴盐,反应路线如下:
(2)合成金种:0.951mL二次蒸馏水中加入0.42mL 0.002mol·L-1HAuCl4溶液,混匀,加入1.25mL0.2mol·L-1 1-(10-溴癸基)-3-甲基咪唑溴盐溶液,再加入0.3mL新制备的0.01mol·L-1NaBH4溶液,室温下静置2h获得纳米金种;
(3)合成纳米金:试管中依次加入2.6mL二次蒸馏水、1.67mL 2×10-3mol·L-1HAuCl4溶液、3.96mL 0.4mol·L-1 1-(10-溴癸基)-3-甲基咪唑溴盐溶液和54μL 0.1mol·L-1抗坏血酸溶液,剧烈搅拌2min,最后加入80μL上述制备好的纳米金种,搅拌20s后室温静置24h制得纳米金溶液。
C、Cd-Ag-Te/AuNPs复合材料的制备:
向100μL纳米金溶液中加入16μL 0.01mol·L-1巯基乙胺溶液,均匀混合,室温下静置12h,得溶液A;向500μL步骤A得到的Cd-Ag-Te量子点溶液中加入100μL含有10mg·mL-1 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和20mg·mL-1N-羟基琥珀酰亚胺的混合溶液,均匀混合,37℃下静置1h,得溶液B;将溶液A和溶液B混合均匀,37℃下静置24h,用二次蒸馏水离心洗涤3次,用二次蒸馏水稀释至1mL,得Cd-Ag-Te量子点/纳米金复合材料,简称Cd-Ag-Te/AuNPs复合材料。
然后,制备一种基于Cd-Ag-Te/AuNPs复合材料修饰L型玻碳电极的心肌肌钙蛋白I光电免疫传感器,其方法包括以下步骤:
(1)玻碳电极预处理:L型的裸玻碳电极(直径3mm),用0.3μm Al2O3悬浊液抛光,蒸馏水冲洗干净,然后依次在HNO3、乙醇、二次蒸馏水中超声清洗,晾干备用;
(2)取5μL Cd-Ag-Te/AuNPs复合材料,滴涂至洁净的玻碳电极表面,室温下晾干,用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,得Cd-Ag-Te/AuNPs/GCE修饰电极;
再取5μL 10μg/mL的心肌肌钙蛋白I抗体anti-cTnI溶液,滴涂至Cd-Ag-Te/AuNPs/GCE修饰电极表面,室温下晾干,用0.01mol·L-1磷酸缓冲溶液(PBS)(pH=7.4)洗净未固定的anti-cTnI,得anti-cTnI/Cd-Ag-Te/AuNPs/GCE修饰电极;
取10mL 5%戊二醛溶液于50mL烧杯中,将电吹风机设置为冷风档,风口对准烧杯口,加速戊二醛蒸汽挥发,再将anti-cTnI/Cd-Ag-Te/AuNPs/GCE修饰电极在戊二醛蒸汽中交联5min,用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,晾干;在0.25wt%牛血清白蛋白溶液中浸泡0.5h,以封闭电极表面可能存在的非特异性结合位点,取出后用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,晾干,得心肌肌钙蛋白I光电免疫传感器;
以405nm LED为光源,在含0.1mol·L-1抗坏血酸的0.1mol·L-1PBS缓冲液(pH=7)中对上述心肌肌钙蛋白I光电免疫传感器进行光电性能测试,并将其用于心肌肌钙蛋白I测定,具有较好的灵敏度、准确度、精密度以及选择性。
35℃下,将心肌肌钙蛋白I光电免疫传感器分别置于不同浓度的cTnI溶液中,其浓度分别为:5pg·mL-1、10pg·mL-1、50pg·mL-1、100pg·mL-1、1ng·mL-1、10ng·mL-1、20ng·mL-1,孵育30min,然后用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,得结合了cTnI的心肌肌钙蛋白I光电免疫传感器,4℃储存,备用。
与现有技术相比,本发明的优点和有益效果在于:
(1)本发明以一种新型水溶性Cd-Ag-Te量子点/纳米金复合材料作为光电免疫传感器的敏感材料,该材料在405nm LED光源激发下,具有强而稳定的光电流,能够实现对心肌肌钙蛋白I的高灵敏检测,其检出限为1.756pg·mL-1(S/N=3)。
(2)本发明将水溶性Cd-Ag-Te三元量子点引入光电化学传感体系,该量子点生物相容性好、波长可调,具有较强的荧光强度和稳定性。
(3)本发明将Cd-Ag-Te量子点/纳米金复合材料作为光电敏感元件,经固载anti-cTnI后制备出cTnI光电免疫传感器,纳米金导电性好、生物相容性好、比表面积大,有助于保持抗体生物活性,并提高检测灵敏度。
(4)本发明的光电免疫传感器测定心肌肌钙蛋白I的操作过程简便,不需要特殊实验条件,仪器要求简单,可用于心肌细胞受损、心绞痛、心肌梗死等病人的临床检查,在医疗领域具有较好的应用前景。
附图说明
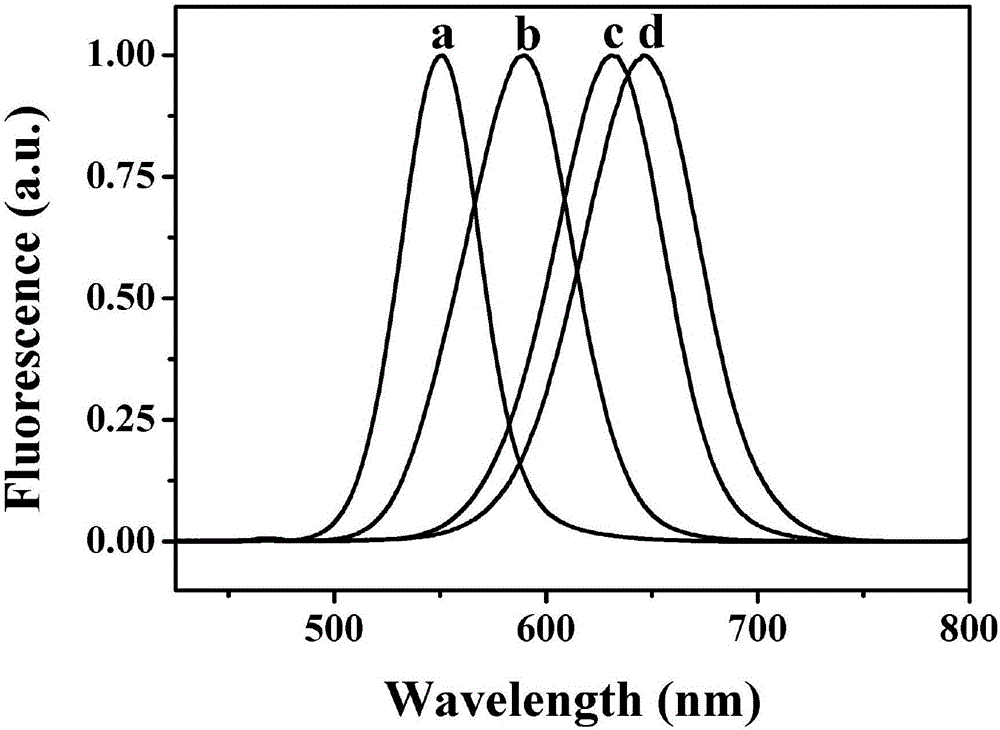
图1为实施例1制备的一种水溶性Cd-Ag-Te量子点的荧光光谱图。
图2为实施例1方案一制备的一种水溶性Cd-Ag-Te量子点的透射电镜图。
图3为N-乙酰-L-半胱氨酸(a)和实施例1方案一制备的一种水溶性Cd-Ag-Te量子点(b)的红外光谱图。
图4为实施例2制备的纳米金的紫外可见吸收光谱图。
图5为实施例2制备的纳米金的透射电镜图。
图6为实施例3制备的Cd-Ag-Te/AuNPs复合材料的透射电镜图。
图7为本发明的cTnI光电免疫传感器制备过程示意图。
图8为本发明制备的裸GCE电极(曲线a)、Cd-Ag-Te/AuNPs/GCE(曲线b)、anti-cTnI/Cd-Ag-Te/AuNPs/GCE(曲线c)、anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE(曲线d)、cTnI/anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE(曲线e)的交流阻抗图。
图9为本发明制备的Cd-Ag-Te/AuNPs/GCE(曲线a)、anti-cTnI/Cd-Ag-Te/AuNPs/GCE(曲线b)、anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE(曲线c)、cTnI/anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE(曲线d)光电流-时间响应曲线。
图10为本发明的免疫传感器检测cTnI的校准曲线。
图11为本发明的免疫传感器在无干扰物(a)和有干扰物(b)-(i)存在时的光电流响应图。
图12为本发明制备的1-(10-溴癸基)-3-甲基咪唑溴盐的核磁共振波谱图。
具体实施方式
下面结合具体实施例,进一步阐明本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明请求保护的范围。此外,还应理解,在阅读了本发明所讲授的内容之后,本领域技术人员可以对本发明做各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
以下实施例中所用405nm LED为100mW点状激光器,购自“梵彩激光模组店”淘宝店,网址为:https://item.taobao.com/item.htm?spm=a1z0k.7385993.1997994373.d4919385.J5xRrz&id=12662456969&_u=8mfhacuf65b&qq-pf-to=pcqq.c2c;电极材料L型玻碳电极购买于天津市高仕睿联科技有限公司,玻碳直径3mm;cTnI抗体为Anti-cTnIMcAb(labeling)(L3C00402)、cTnI抗原为cTnI(L4C00101),均购自上海领潮生物科技有限公司,以0.01mol·L-1PBS缓冲液(pH=7.4)稀释至所需浓度;实施例中用水均为二次蒸馏水。
以下实施例中所用1-(10-溴癸基)-3-甲基咪唑溴盐的制备方法如下:
氮气保护下,向100mL三颈圆底烧瓶中加入7.5g 1,10-二溴癸烷,将0.9g1-甲基咪唑溶于30mL乙腈,并逐滴加入上述三颈圆底烧瓶中,滴加完毕后升温至65℃,搅拌反应12h,蒸干溶剂,用乙醚洗掉未反应完全的1,10-二溴癸烷,将粗产物经硅胶柱分离得到黄色粘稠液体,即1-(10-溴癸基)-3-甲基咪唑溴盐。
经核磁共振氢谱1HNMR检测,其结果见图12。
1HNMR(400MHz,CDCl3)δ:10.14(1H,s),7.60(1H,t),7.43(1H,t),4.22(2H,t),4.02(3H,s),3.30(2H,t),1.81(2H,m),1.73(2H,m),1.28(12H,m)。通过图谱化学位移值以及峰面积的积分,可以确定分子中氢原子的种类和含量,从而证实产物的结构正确。
实施例1
一种新型水溶性Cd-Ag-Te量子点,其合成步骤如下:
NaHTe的制备:玻璃瓶中加入0.45g NaBH4,10mL超纯水,冰浴,加入0.0127g碲粉,密闭反应2h(方程式:2Te+4NaBH4+7H2O→2NaHTe+Na2B4O7+14H2↑),得无色透明NaHTe溶液(浓度为0.01mol·L-1),备用。
方案一:氮气保护下,向250mL三颈圆底烧瓶中依次加入80mL 0.002mol·L-1CdCl2溶液,20mL 0.016mol·L-1N-乙酰-L-半胱氨酸溶液,40ml二次蒸馏水,均匀混合溶液;用1mol·L-1NaOH溶液调节混合液的pH值为11.5;加入2mL 0.01mol·L-1AgNO3溶液,避光反应1h;然后加入3mL新制备的0.01mol·L-1NaHTe溶液,氮气保护下,100℃反应1h,得到荧光发射波长为550nm、如图1曲线a所示的Cd-Ag-Te量子点溶液。冷却至室温,用10kD的超滤管5500rpm冷冻离心40min,得到300μL新型水溶性三元Cd-Ag-Te量子点,4℃保存备用。并将此波长量子点用于后续光电免疫传感过程。其形貌以透射电子显微镜表征,TEM图如图2所示。从图中可以观察到,该量子点呈球形,分散性良好,尺寸在8-9nm左右。
方案二:氮气保护下,向250mL三颈圆底烧瓶中依次加入80mL 0.002mol·L-1CdCl2溶液,20mL 0.016mol·L-1N-乙酰-L-半胱氨酸溶液,40ml二次蒸馏水,均匀混合溶液;用1mol·L-1NaOH溶液调节混合液的pH值为11.5;加入2mL 0.01mol·L-1AgNO3溶液,避光反应1h;然后加入3mL新制备的0.01mol·L-1NaHTe溶液,氮气保护下,100℃反应2h,得到荧光发射波长为590nm、如图1曲线b所示的Cd-Ag-Te量子点溶液。冷却至室温,用10kD的超滤管5500rpm冷冻离心40min,得到300μL新型水溶性三元Cd-Ag-Te量子点,4℃保存备用。
方案三:氮气保护下,向250mL三颈圆底烧瓶中依次加入80mL 0.002mol·L-1CdCl2溶液,20mL 0.016mol·L-1N-乙酰-L-半胱氨酸溶液,40ml二次蒸馏水,均匀混合溶液;用1mol·L-1NaOH溶液调节混合液的pH值为11.5;加入2mL 0.01mol·L-1AgNO3溶液,避光反应1h;然后加入3mL新制备的0.01mol·L-1NaHTe溶液,氮气保护下,100℃反应3h,得到荧光发射波长为630nm、如图1曲线c所示的Cd-Ag-Te量子点溶液。冷却至室温,用10kD的超滤管5500rpm冷冻离心40min,得到300μL新型水溶性Cd-Ag-Te量子点,4℃保存备用。
方案四:氮气保护下,向250mL三颈圆底烧瓶中依次加入80mL 0.002mol·L-1CdCl2溶液,20mL 0.016mol·L-1N-乙酰-L-半胱氨酸溶液,40ml二次蒸馏水,均匀混合溶液;用1mol·L-1NaOH溶液调节混合液的pH值为11.5;加入2mL 0.01mol·L-1AgNO3溶液,避光反应1h;然后加入3mL新制备的0.01mol·L-1NaHTe溶液,氮气保护下,100℃反应4h,得到荧光发射波长为650nm、如图1曲线d所示的Cd-Ag-Te量子点溶液。冷却至室温,用10kD的超滤管5500rpm冷冻离心40min,得到300μL新型水溶性Cd-Ag-Te量子点,4℃保存备用。
图3为N-乙酰-L-半胱氨酸(曲线a)以及实施例1方案一得到的Cd-Ag-Te量子点的红外光谱图(曲线b)。由曲线a可知,2547cm-1为巯基的特征吸收;1718cm-1为羧基碳氧双键的特征吸收,1590cm-1为酰胺中-NH的面内弯曲振动的特征吸收峰,2965cm-1和1373cm-1为甲基的特征吸收,2900cm-1和2808cm-1的两个特征吸收峰表明含有亚甲基。从曲线b中可明显看出,巯基的特征谱带2547cm-1在修饰后量子点的谱图上消失,另外,甲基和亚甲基特征吸收依然存在,由此可知,巯基与量子点可能已通过Cd-S键结合,表明N-乙酰-L-半胱氨酸已成功修饰到Cd-Ag-Te量子点表面。
实施例2
一种纳米金的制备方法,其步骤如下:
(1)合成金种:0.951mL二次蒸馏水中加入0.42mL 0.002mol·L-1HAuCl4,混匀,加入1.25mL 0.2mol·L-1 1-(10-溴癸基)-3-甲基咪唑溴盐,再加入0.3mL新制备的0.01mol·L-1NaBH4溶液,室温下静置2h获得纳米金种;
(2)合成纳米金:试管中依次加入2.6mL二次蒸馏水,1.67mL 2×10-3mol·L-1HAuCl4,3.96mL 0.4mol·L-1 1-(10-溴癸基)-3-甲基咪唑溴盐,54μL 0.1mol·L-1抗坏血酸,剧烈搅拌2min,最后加入80μL上述制备好的金种,搅拌20s后室温静置24h制得纳米金。
紫外可见吸收光谱如图4所示,纳米金的最大吸收峰在540nm,显然与图1a所示Cd-Ag-Te量子点的荧光发射峰重合性最好,故其能量转换效率最高,光电流响应亦最大;此外,通过透射电镜如图5所示,纳米金形状均一,分散性良好,尺寸在30nm左右。
实施例3
一种水溶性Cd-Ag-Te量子点/纳米金复合材料的制备方法,其步骤如下:
将100μL纳米金溶液(实施例2中最后所得的纳米金)中加入16μL 0.01mol·L-1巯基乙胺溶液,均匀混合,室温下静置12h;将500μL量子点溶液(实施例1方案一最后所得的新型水溶性Cd-Ag-Te量子点)中加入100μL含有10mg·mL-1 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和20mg·mL-1N-羟基琥珀酰亚胺(NHS)的混合溶液,均匀混合,37℃下静置1h;将上述两种溶液混合均匀,37℃下静置24h,用二次蒸馏水离心洗涤3次,用二次蒸馏水稀释至1mL,得Cd-Ag-Te量子点/纳米金复合材料,简称Cd-Ag-Te/AuNPs复合材料。
通过透射电镜如图6所示,纳米金发生一定程度的团聚,且大量量子点紧密附着于纳米金的表面,表明成功地制备了Cd-Ag-Te/AuNPs复合材料。
关于实施案例3中,Cd-Ag-Te/AuNPs复合材料中纳米金与量子点的最佳制备比例,可通过考察不同比例的Cd-Ag-Te/AuNPs复合材料修饰电极在0.1mol·L-1抗坏血酸的0.1mol·L-1PBS缓冲溶液(pH=7.0)中的光电流-时间响应曲线来确定。随着量子点比例的增加,其对应的复合材料的光电流强度逐渐增强,当纳米金与量子点的物质的量之比为1:100时,其对应的复合材料的光电流达到最大,继续增加量子点比例其对应的复合材料的光电流强度减小。这可能是由于过多量子点的增加,电子的交换传导受到抑制。
实施例4
如图7所示,一种基于Cd-Ag-Te/AuNPs复合材料修饰L型玻碳电极的cTnI光电免疫传感器的制备方法,包括以下步骤:
(1)玻碳电极预处理:L型的裸玻碳电极(直径3mm),用0.3μm Al2O3悬浊液抛光,蒸馏水冲洗干净,然后依次在HNO3(,由65wt%浓硝酸与水等体积混合后形成)、乙醇(50v/v%)、二次蒸馏水中超声清洗,晾干备用;
(2)构建cTnI光电免疫传感器:
取5μL实施例3中制得的Cd-Ag-Te/AuNPs复合材料溶液,滴涂至洁净的玻碳电极表面,室温下晾干,用0.01mol·L-1PBS缓冲液(pH7.4)洗净,得Cd-Ag-Te/AuNPs/GCE修饰电极;
再取5μL 10μg·mL-1的anti-cTnI溶液滴涂至Cd-Ag-Te/AuNPs/GCE修饰电极表面,室温下晾干,用0.01mol·L-1PBS缓冲液(pH=7.4)洗净未固定的anti-cTnI,得anti-cTnI/Cd-Ag-Te/AuNPs/GCE修饰电极;
再将anti-cTnI/Cd-Ag-Te/AuNPs/GCE修饰电极在戊二醛蒸汽中交联5min,用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,晾干;在0.25wt%牛血清白蛋白溶液中浸泡0.5h,以封闭电极表面可能存在的非特异性结合位点,取出后用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,晾干,得anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE修饰电极,即心肌肌钙蛋白I光电免疫传感器;
将anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE修饰电极分别置于不同浓度的cTnI溶液中,其浓度分别为:5pg·mL-1、10pg·mL-1、50pg·mL-1、100pg·mL-1、1ng·mL-1、10ng·mL-1、20ng·mL-1,35℃孵育30min,然后用0.01mol·L-1PBS缓冲液(pH=7.4)洗净,得cTnI/anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE修饰电极,即结合了cTnI的心肌肌钙蛋白I光电免疫传感器,4℃保存备用。
(3)自组装光电化学测试系统:以100mW 405nm LED为激发光源,经光纤引导至电极表面,采用三电极系统测试光电流:以3mm的L型玻碳电极作为工作电极,Hg/Hg2Cl2电极(饱和KCl)作为参比电极,铂丝电极作为对电极,光电流由CHI660E电化学工作站(上海辰华仪器公司)测定。光电流在恒定电位(0V vs Hg/Hg2Cl2)、0.1mol·L-1抗坏血酸的0.1mol·L-1PBS缓冲溶液(pH=7.0)中进行。
关于步骤(2)中,cTnI抗原的最佳孵育时间可通过考察传感器的光电流响应与孵育时间的关系曲线来确定:在10~40min范围内,随着孵育时间延长,免疫传感器识别cTnI前后的电流响应差值快速增加,30min后趋于稳定,表明抗原-抗体免疫结合趋于饱和,因此,本发明选择30min为最佳孵育时间。
关于步骤(2)中,cTnI抗原的最佳孵育温度可通过考察传感器的光电流响应与孵育时间的关系曲线来确定:在20~45℃范围内,随孵育温度升高,免疫传感器识别cTnI前后的电流响应差值快速增加,35℃时达到最大值;当温度高于35℃后,会影响蛋白质活性,降低其识别能力,电流响应差值降低。因此,本发明选择35℃为最佳孵育温度。
关于本步骤(3)中,抗坏血酸的浓度是通过同一传感器在不同浓度抗坏血酸的0.1mol·L-1PBS缓冲溶液(pH=7.0)中的光电流-时间响应曲线来确定。从0mol·L-1~0.25mol·L-1,随着抗坏血酸浓度逐渐增加,光电流也逐渐増大。随抗坏血酸浓度进一步增大,光电流减小。这是由于浓度太大,抗坏血酸在溶液中的吸光度增加,从而导致照射到电极表面的光强度下降而致使量子点的激发效率降低。因此,考虑到电极响应对抗坏血酸浓度的敏感性,本发明选择0.1mol·L-1作为抗坏血酸的最佳浓度。
以下光电化学性能测试也均选用上述确定下来的最佳参数条件。
实施例5
如图8所示,对实施例4各步骤所制得的修饰电极进行电化学交流阻抗谱(EIS)表征,EIS是探索化学修饰电极界面性质的有效工具之一。其图由低频区和高频区两部分组成,其中的低频区对应于扩散控制区,而半圆部分的高频区则对应于动力学控制区,其半圆的直径大小反映电极表面电荷转移电阻大小。在5.0mmol·L-1K3[Fe(CN)6]/K4[Fe(CN)6](1:1)+0.1mol·L-1PBS(pH=7.0)+0.1mol·L-1KCl溶液中进行交流阻抗表征。传感器制备过程中各类修饰电极的Nyquist曲线如图8所示,可以看出裸电极(曲线a)的交流阻抗图谱在高频部分的半圆很小;当Cd-Ag-Te/AuNPs复合材料修饰至电极表面后,其高频部分的半圆直径增加(曲线b),阻抗增加;曲线c是anti-cTnI/Cd-Ag-Te/AuNPs/GCE修饰电极界面的交流阻抗谱图,由于抗体是不利于电子传递的生物大分子,会阻碍界面的电子传递,其阻抗明显增大;当用BSA封闭电极表面可能存在的非特异性活性位点后,交流阻抗谱的半圆直径大大增加(曲线d);当免疫传感器与cTnI抗原专一性结合后,抗原-抗体复合物覆盖电极表面,其界面电荷传递电阻进一步增加(曲线e)。以上结果表明,本发明经逐步修饰后,成功制备出cTnI光电免疫传感器。
如图9所示,当修饰电极表面结合anti-cTnI抗体(b)及BSA(c)封闭非活性位点后,光电流均降低,这可能是由于蛋白对电子传递的阻碍作用,使溶液中电子给体抗坏血酸难以扩散至电极表面,从而导致光电流强度的降低。当免疫传感器与cTnI抗原特异性结合后(d),观察到光电流强度进一步降低。表明修饰步骤及免疫测定的成功进行。
如图10所示,用光电流-时间法考察了实施例4中的光电免疫传感器对于不同浓度cTnI抗原的光电流响应情况,当cTnI的浓度在5pg·mL-1-20ng·mL-1之间时,键合cTnI抗原前后的光电流差与键合抗原前的光电流比值与cTnI抗原浓度的对数成良好的线性关系,线性方程为:I=0.1186logccTnI(ng·mL-1)+0.4235(R2=0.992),检出限为1.756pg·mL-1(S/N=3)。这表明基于水溶性Cd-Ag-Te量子点与纳米金间能量转移的光电免疫传感器可用于cTnI抗原的高灵敏检测。
实施例6
测定实施例4所制得的cTnI光电免疫传感器(即anti-cTnI(BSA)/Cd-Ag-Te/AuNPs/GCE修饰电极)的选择性,抗干扰性能是衡量电化学传感器的实用性的重要指标之一。配制9份cTnI抗原溶液:(a)含0.1ng·mL-1cTnI抗原;(b)含0.1ng·mL-1cTnI抗原及10ng·mL-1的免疫球蛋白(IgG);(c)含0.1ng·mL-1cTnI抗原及10ng·mL-1的肌红蛋白(Mb);(d)含0.1ng·mL-1cTnI抗原及10ng·mL-1的人血清白蛋白(HAS);(e)含0.1ng·mL-1cTnI抗原及10ng·mL-1的甲胎蛋白(AFP);(f)含0.1ng·mL-1cTnI抗原及10ng·mL-1的谷氨酸(Glu);(g)含0.1ng·mL-1cTnI抗原及10ng·mL-1的甘氨酸(Gly);(h)含0.1ng·mL-1cTnI抗原及10ng·mL-1的丝氨酸(Ser);(i)含0.1ng·mL-1cTnI抗原及10ng·mL-1的赖氨酸(Lys)。在最佳条件下,将cTnI光电免疫传感器分别在9份溶液中孵育30min后进行测定,结果如图11。由图可知,(b)-(i)与(a)的电流响应差值的偏差均小于5%,说明以上物质不干扰cTnI抗原的测定,即该免疫传感器具有良好的选择性。
- 还没有人留言评论。精彩留言会获得点赞!