胆固醇合成吸收标志物的测试系统及样本前处理装置的制作方法
本实用新型涉及胆固醇合成吸收标志物的测试系统及应用于该测试系统的样本前处理装置,特别是涉及基于液相色谱串联质谱的胆固醇合成吸收标志物测试系统及样本前处理装置。
背景技术:
人体中的胆固醇主要来源两个方面,一方面是从食物中摄取,另外一方面是体内自身合成。目前对胆固醇水平的判定多采用传统血脂指标,而这些指标体现的只是胆固醇代谢的最终结果。然而,受到遗传和环境因素的影响,机体胆固醇吸收和合成呈现高度个体差异,因此,传统血脂指标并不能明确反映体内胆固醇的升高出现在合成和吸收哪个环节上。
并且,检测血清总胆固醇多采用传统的生化方法,因为检测响应值低或者沸点过高,还需要进衍生化,且前处理过程中涉及危险化学品,会对环境及检测人员造成较大的危害。液相色谱串联质谱(LC‐MS)是一种新型的检测手段,它具有自动化程度高,分离能力强,定量分析结果稳定可靠,分析时间快等优点。
技术实现要素:
基于此,有必要提供一种能够对胆固醇合成吸收平衡做出完整全面的评估的胆固醇合成吸收标志物的测试系统及样本前处理装置。
一种胆固醇合成吸收标志物的测试系统,包括:合成吸收标志物加标样本处理器,用于将第一待测样本处理成胆固醇合成吸收标志物加标样本;总胆固醇样本处理器,用于将第二待测样本处理成总胆固醇加标样本;以及液相色谱串联质谱仪,用于对所述胆固醇合成吸收标志物加标样本和总胆固醇加标样本进行液相色谱串联质谱检测。
一种样本前处理装置,包括:合成吸收标志物加标样本处理器,用于将第一待测样本处理成胆固醇合成吸收标志物加标样本;以及总胆固醇样本处理器,用于将第二待测样本处理成总胆固醇加标样本。
相较于现有技术,本发明提供的样本前处理装置及胆固醇合成吸收标志物的测试系统能够对胆固醇合成吸收标志物进行同时检测,且能够检测总胆固醇及胆固醇,避免检测中引入跨平台偏差,能够对胆固醇合成吸收平衡做出完整全面的评估。
附图说明
图1为本实用新型实施例胆固醇合成吸收标志物的测试系统的结构示意图;
图2为本实用新型实施例血清样本胆固醇合成吸收标志物总离子流(TIC)图;
图3为本实用新型实施例血清样本总胆固醇TIC图;
图4为本实用新型实施例总胆固醇LC‐MS检测与生化检测相关性曲线。
具体实施方式
为了使本实用新型的目的、技术方案及优点更加清楚明白,以下结合附图及实施例对本实用新型胆固醇合成吸收标志物的测试系统进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本实用新型,并不用于限定本实用新型。
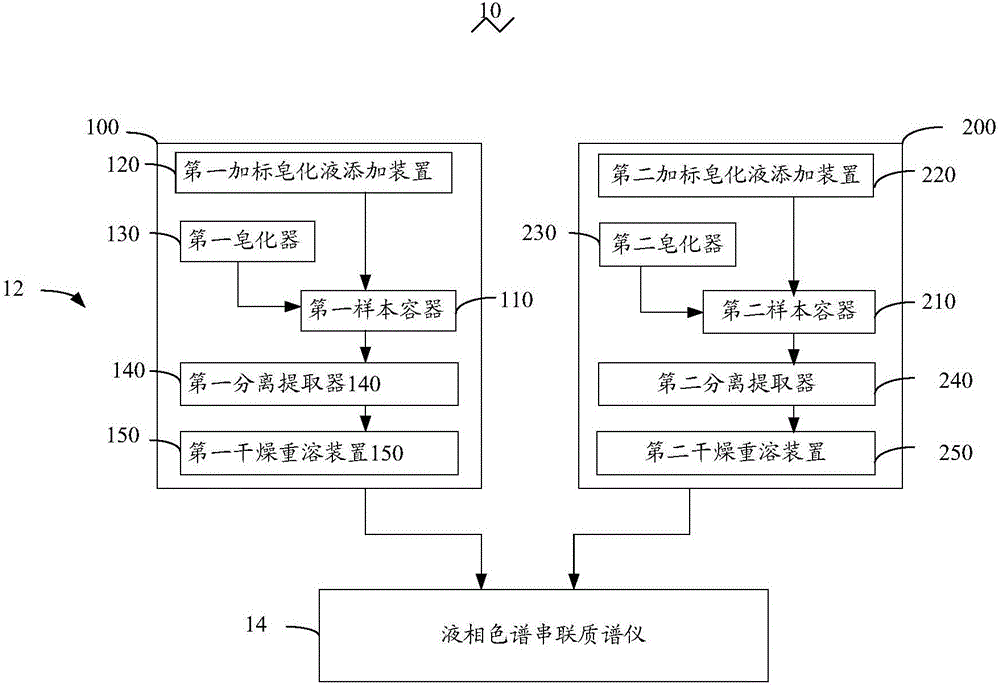
请参阅图1,本实用新型实施例提供一种胆固醇合成吸收标志物的测试系统10,包括样本前处理装置12以及液相色谱串联质谱仪14。该样本前处理装置12包括合成吸收标志物加标样本处理器100及总胆固醇样本处理器200。
该合成吸收标志物加标样本处理器100用于将采集的第一待测样本处理成胆固醇合成吸收标志物加标样本。采集的第一待测样本例如可以是人血清样本。在一实施例中,该采集的第一待测样本在该合成吸收标志物加标样本处理器100中经过加标、皂化、提取、干燥及重溶,重溶后即得到胆固醇合成吸收标志物加标样本。
该合成吸收标志物加标样本处理器100可包括第一样本容器110、第一加标皂化液添加装置120、第一皂化器130、第一分离提取器140及第一干燥重溶装置150。采集的具有一定体积的第一待测样本容置在第一样本容器110中。该第一加标皂化液添加装置120用于将加标皂化液添加至该第一样本容器110中。在一实施例中,该第一加标皂化液添加装置120包括添加控制器及加标皂化液容器。优选的,该加标皂化液容器中的加标皂化液为含浓度为0.3mol/L至8.9mol/L的强碱,及浓度为0.5mg/L至2.0mg/L的内标物质的溶液。该加标皂化液中溶剂可以是乙醇及水中的至少一种,强碱可以是氢氧化钠及氢氧化钾中的至少一种。该内标物质可以是胆甾烷醇‐d7、链甾醇‐d6、烯胆烷醇‐d4、菜油固醇‐d3及β‐谷固醇‐d7中的至少一种。该添加控制器用于根据该第一样本容器110中的第一待测样本的体积控制该加标皂化液的添加量,该加标皂化液与该第一待测样本的体积比优选为5:1至10:1。该第一皂化器130用于皂化样本中的油脂,得到第一加标皂化样本。在一实施例中,该第一皂化器130可包括涡旋混合器及水浴装置。该第一分离提取器140用于分离该第一加标皂化样本中的皂化油脂与胆固醇,从该第一加标皂化样本中获得含有胆固醇的液相,例如可以是溶剂萃取该胆固醇。在更为具体的实施例中,该第一分离提取器140包括萃取剂注入装置、混合装置、冷冻装置及分离装置,该萃取剂注入装置向该加标皂化样本中加入水和正己烷,该混合装置将该加标皂化样本、水及正己烷混合,该冷冻装置将得到的混合液在超低温(0℃至‐95℃)冷冻,该分离装置将冷冻后形成的固相与液相分离,该液相中包括正己烷及胆固醇。该第一干燥重溶装置150用于将含有胆固醇的液相干燥后加入预定量溶剂重新形成溶液,即得到该胆固醇合成吸收标志物加标样本。该溶剂可以是甲醇、乙醇及乙腈中的至少一种。加入的溶剂与该第一待测样本的体积比优选为1:1至1:3。该第一干燥重溶装置150可包括干燥装置和溶剂注入装置,该溶剂注入装置能够根据该第一待测样本的体积控制该溶剂的加入体积。
该总胆固醇样本处理器200用于将采集的第二待测样本处理成总胆固醇加标样本。采集的第二待测样本例如可以是人血清样本。在一实施例中,该采集的第二待测样本在该总胆固醇样本处理器200中经过加标、皂化、提取、干燥及重溶,重溶后即得到总胆固醇内标样本。
该总胆固醇样本处理器200可包括第二样本容器210、第二加标皂化液添加装置220、第二皂化器230、第二分离提取器240及第二干燥重溶装置250。采集的第二待测样本容置在第二样本容器210中。该第二加标皂化液添加装置220用于将第二加标皂化液添加至该第二样本容器210中。在一实施例中,该第二加标皂化液添加装置220包括添加控制器及加标皂化液容器。优选的,该加标皂化液容器中的第二加标皂化液为含浓度为0.3mol/L至8.9mol/L的强碱,及浓度为0.5mg/L至2.0mg/L的内标物质的溶液。该第二加标皂化液中溶剂可以是乙醇及水中的至少一种,强碱可以是氢氧化钠及氢氧化钾中的至少一种。该内标物质可以是胆固醇‐d6(cholesterol‐d6)。该添加控制器用于根据该第二样本容器210中的第二待测样本的体积控制该加标皂化液的添加量,该加标皂化液与该第二待测样本的体积比优选为5:1至10:1。该第二皂化器230用于皂化样本中的油脂,得到第二加标皂化样本。在一实施例中,该第二皂化器230可包括涡旋混合器及水浴装置。该第二分离提取器240用于分离该第二加标皂化样本中的皂化油脂与胆固醇,从该第二加标皂化样本中获得含有胆固醇的液相,例如可以是溶剂萃取该胆固醇。在更为具体的实施例中,该第二分离提取器240包括萃取剂注入装置、混合装置及离心分离装置,该萃取剂注入装置向该第二加标皂化样本中加入水和正己烷,该混合装置将该加标皂化样本、水及正己烷混合,该离心分离装置将混合液离心分离,上层清液中包括正己烷及胆固醇。该第二干燥重溶装置250用于将含有胆固醇的上层清液干燥后加入预定量溶剂重新形成溶液,即得到该总胆固醇样本。该溶剂可以是甲醇、乙醇及乙腈中的至少一种。加入的溶剂与该第二待测样本的体积比优选为1:1至3:1。该第二干燥重溶装置250可包括干燥装置和溶剂注入装置,该溶剂注入装置能够根据该第二待测样本的体积控制该溶剂的加入体积。
该第二样本容器210容置的该第二待测样本的体积小于该第一样本容器110容置的第一待测样本的体积。优选的,该第二加标皂化液添加装置220加入的加标皂化液中强碱及内标物质的浓度分别大于该第一加标皂化液添加装置110 加入的加标皂化液中强碱及内标物质的浓度。该合成吸收标志物加标样本处理器100与该总胆固醇样本处理器200满足下述关系式:
待测样本中包括菜油固醇(campesterol)、β‐谷固醇(β‐sitosterol)、胆甾烷醇(cholestanol)、7-烯胆烷醇(lathosterol)及链甾醇(desmosterol)中的至少一种,该菜油固醇、β‐谷固醇及胆甾烷醇为非胆固醇类固醇,即膳食来源的植物固醇,能够反映机体对外源性胆固醇的吸收,该7-烯胆烷醇及链甾醇为胆固醇合成过程的中间产物,即胆固醇前体固醇,能够反映内源性胆固醇的合成,因而上述几种物质可作为胆固醇合成吸收标志物。该液相色谱串联质谱仪300用于所述对胆固醇合成吸收标志物加标样本和总胆固醇加标样本进行液相色谱串联质谱检测,可以是现有设备,如安捷伦1290‐6495液相色谱串联质谱仪。
实施例
待测样本处理条件:
第一待测样本体积:200μL;第一加标皂化液体积:1mL;第一加标皂化液组分:0.3mol/L氢氧化钠,内标物质:胆甾烷醇‐d7、链甾醇‐d6、烯胆烷醇‐d4、菜油固醇‐d3及β‐谷固醇‐d7,90%乙醇;第一皂化器水浴温度:37℃;第一干燥重溶装置150中重溶溶剂:300μL甲醇;第二待测样本体积:50μL;第二加标皂化液体积:1mL皂化液;第二加标皂化液组分:8.9mol/L氢氧化钾,内标物质:1.4mg/L胆固醇‐d6,90%乙醇;第二皂化器水浴温度:50℃;第二干燥重溶装置250中重溶溶剂:500μL甲醇。
液相色谱条件:色谱柱:SUPELCO Express F5液相色谱柱(15cm×2.1mm,5μm);柱温:25.0±0.8℃;进样量:1μL;流动相A:含有0.1%甲酸及10mM甲酸铵的水溶液,流动相B:含有0.1%甲酸及10mM甲酸铵的甲醇溶液;流动相A%+流动相B%=100%;梯度洗脱程序:0~0.5分钟,80%B~85%B;0.5~7.0分钟,85%B~90%B;7.0~7.1分钟,90%B~100%B;7.1~9.0分钟100%B,9.0~9.1分钟100%B~80%B;流速:0.3mL/min。
质谱条件:电喷雾离子源(ESI),正模式采集,多重反应监测(MRM)模式检测,干燥气温度:200℃;流速:12L/min;鞘气温度为350℃,鞘气流速:10L/min;毛细管电压:3500V;喷嘴电压:1500V;离子漏斗(iFunnel)高、低射频电压分别为150V和60V。质谱采集参数如表1。检测血清样本时胆固醇吸收合成标志物及胆固醇的出峰位置及时间如图2和图3所示。
表1
测试结果:
1.胆固醇及胆固醇合成吸收标志物线性关系分析
以扣除本底质谱中分析物和对应内标的峰面积的比值为y、以添加分析物的浓度为x(mg/L)绘制标准曲线,权重取1/x,拟合线性方程,各指标线性方程及相关系数R2结果如表2所示:
表2
结果显示,胆固醇在浓度15.625~2000mg/L范围内线性关系良好,菜油固醇、胆甾烷醇、链甾醇、烯胆烷醇、谷固醇在浓度0.078125~10mg/L范围内线性关系良好。
2.胆固醇合成吸收标志物回收率及精密度(RSD)
该第一加标皂化液添加装置120添加的第一加标皂化液中内标物质浓度分别为0.5mg/L、1mg/L、2mg/L及7mg/L,内标物质回收率及精密度如表3所示:
表3
可以看到,胆固醇合成吸收标志物各添加浓度水平的回收率可控制在20±100%之内,说明检测准确性有所保障,精密度基本可以覆盖在10%之内,说明重复性较好。
3.LC‐MS平台与生化平台检测总胆固醇的相关性结果
请参阅图4,30个血清样本分别用本发明实施例胆固醇合成吸收标志物的测试系统10和传统生化平台检测,以传统生化检测值(mM)为x坐标,所述胆固醇合成吸收标志物的测试系统10的检测值(mM)为纵坐标进行拟合,得拟合曲线y=1.0535x+0.1533,R=0.9564,斜率趋近于1,说明相关性非常好。
以上所述实施例仅表达了本实用新型的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本实用新型专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本实用新型构思的前提下,还可以做出若干变形和改进,这些都属于本实用新型的保护范围。因此,本实用新型专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!