存在于人体外周静脉血中的脑源性微粒及其分离提纯鉴定方法和应用与流程
本发明涉及利用特殊方法来研究或分析材料领域,更具体地是一种存在于人体外周静脉血中的脑源性微粒及其分离提纯鉴定方法和应用。
背景技术:
微粒(Microparticles,MPs)是一类在某些生理或病理状况下,由正常细胞出芽脱落的富含磷脂的颗粒,具有一定的促凝活性。目前在人体外周静脉血中已经发现了一些血细胞及血管内皮细胞来源的微粒,如:血小板源微粒(Platelet derived MPs,PMPs)、内皮细胞源微粒(Endothelial MPs,EMPs)等。研究结果显示:MPs(如PMPs)具有较强的促凝活性与免疫炎症功能,在血栓性相关疾病等领域中具有很大的研究价值。
创伤性颅脑损伤(Traumatic brain injury,TBI)是我们前期研究工作的重点,颅脑受到创伤后所引发的一系列病理反应直接影响患者的生命及预后,而且病程发展很快。研究TBI的多种病理反应及时阻断病程的发展对疾病的预后有重大意义。
由于脑源性微粒(鼠源性)(Brain-derived microparticles,BDMPs)的概念与特性是我们团队首次在国际上报道,属于最新的研究领域。另外,BDMPs的结构非常微小(直径0.1~1.0μm),使得分离提纯鉴定工作十分困难;并且由于人体十分复杂而又极其精密,使得人体来源的BDMPs的分离提纯鉴定与鼠来源的有很大区别,因此理论和前期工作的实践都表明不能套用照搬鼠源性的实验方案。所以急需一套人源性BDMPs的分离提纯鉴定实验方案以及应用此套方案来探究人源性BDMPs的临床特性。因此很有必要建立一种灵敏、精确、定量的人源性BDMP s检测方法。
技术实现要素:
本发明为了解决鼠源性脑源性微粒的提取方法不能应用于人源性脑源性微粒的提取的问题,所提出一种存在于人体外周静脉血中的脑源性微粒及其分离提纯鉴定方法和应用。
本发明是按照以下技术方案实现的。
一种存在于人体外周静脉血中的脑源性微粒,所述脑源性微粒的磷脂双分子膜上富含磷脂酰丝氨酸和组织因子并携带神经细胞特异性标记物。
一种上述存在于人体外周静脉血中的脑源性微粒在制备治疗创伤性颅脑损伤引发的凝血功能障碍药物中的应用。
一种上述存在于人体外周静脉血中的脑源性微粒的分离提纯鉴定方法,包括以下步骤:
a.采集脑创伤病人/健康人血液样本:
采集脑创伤病人/健康人外周静脉血放入枸橼酸钠抗凝管中,在常温下进行120 g-150g离心20 min-30min;
b.分离提纯人源性BDMPs:
Ⅰ.取上层血浆,在常温下进行1500 g-2000g离心20 min-30min;
Ⅱ.取上层血浆,常温下13000 g-15000g离心2 min-5min;
Ⅲ.取上层血浆,4℃下100000 g -120000 g离心60min-70min,留取沉淀,即为BDMPs,用PBS重悬后分别得到病人/健康人的富含BDMPs的悬液,用于后续流式检测;
c.体外培养神经细胞制备BDMPs作为流式细胞技术检测的阳性对照:
Ⅰ.在神经元细胞和成长到对数生长期的胶质细胞中,加入钙离子超载剂,37℃孵育10-30 min;
Ⅱ.收集细胞上清液,在常温下1500 g-2000g离心20 min-30min;
Ⅲ.取上清,在常温下13000 g-15000g离心2 min-5min;
Ⅳ.取上清,4℃下100000 g -120000 g离心60min-70min,留取沉淀,即为BDMP,用PBS重悬后用于作为流式检测人血脑源性微粒检测的阳性对照;
d. 流式细胞技术鉴定人源性BDMPs:
Ⅰ.取9支无菌流式管,分别编号1~9,1号管为无抗体或染料染色的阴性对照管,2、3、4号管分别为PE Mouse anti-GFAP、MitoTracker® Green FM、APC-Annexin V抗体或染料染色的单染管,5、6号管分别为脑创伤病人、健康人,7号管为体外制备BDMPs的上述3种抗体或染料染色的三染管;8号管为APC-Annexin V抗体的阴性对照管;9号管为PE Mouse anti-GFAP抗体的阴性对照管;
分别取健康人的富含BDMPs的悬液至1,6号试管中,分别取病人的富含BDMPs的悬液至2,3,4,5,8,9号试管中,取体外制备BDMPs的悬液至7号试管中;
Ⅱ.向2,5,6,7号试管中加入PE Mouse anti-GFAP抗体,低速震荡,充分混合,室温避光孵育10 min-30min;向试管9中加入同型对照PE Mouse IgG1抗体,低速震荡,充分混合,室温避光孵育10 min-30min;
Ⅲ.用DMSO将免疫荧光染料MitoTracker® Green FM稀释;向3,5,6,7号试管中加入免疫荧光染料MitoTracker® Green FM,低速震荡,充分混合,室温避光孵育10 min-30min;
Ⅳ.分别向4,5,6,7号试管中加入抗体APC-Annexin V,同时加入4X Annexin V结合试剂,混合后室温避光孵育10 min-30min;向8号试管中同时加入抗体APC-Annexin V、EDTA和4X Annexin V结合试剂,混合后室温避光孵育10min-30min;
Ⅴ.分别向试管1,2,3中加入4X Annexin V结合试剂,最后分别向试管1~8中加入2X Annexin V结合试剂将液体体积补足,混匀后进行流式细胞仪检测。
本发明获得了如下有益效果。
本发明采用梯度离心与超速离心结合的方式获得了存在于人体外周静脉血中的脑源性微粒。虽然梯度离心与超速离心是医学科研工作的常用方法,但我们将二者有机结合起来,集中了两者的优点,并分别采取不同的离心速度与离心时间,极大的提高了人血BDMPs的检出率,获得了意想不到的效果;另外,离心过程的温度、升降设置也与鼠脑提取BDMPs大为不同,更加突显了本技术方案的创造性。
本发明的方法排除了其它血细胞碎片和污染颗粒对脑源性微粒检测的影响,定性定量地检测出了存在于人体外周静脉血中的BDMPs。本发明方法保证了BDMPs检测的可行性、简便性的同时,也提高了其检测的准确性;并且,应用本发明方法初步探明了脑源性微粒所具有的特殊临床特性,这将有利于阐明TBI相关凝血功能障碍的理论机制,建立预防治疗TBI引发的凝血功能障碍的新方法。
附图说明
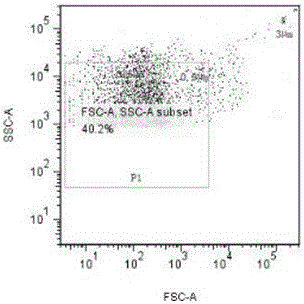
图1是本发明Megamix标准微粒流式检测结果图;
图2是本发明流式细胞仪检测7号管阳性对照结果图;
图3是本发明流式细胞仪检测7号管APC-Annexin V+FITC-MitoTracker双阳性对照染色结果图;
图4是本发明流式细胞仪检测7号管APC-Annexin V+PE-GFAP双阳性对照染色结果图;
图5是本发明流式细胞仪检测1号管阴性对照图;
图6是本发明流式细胞仪检测1号管阴性对照图;
图7是本发明流式细胞仪检测1号管阴性对照图;
图8是本发明流式细胞仪检测5号管脑创伤病人APC-Annexin V+PE-GFAP双阳性染色结果图;
图9是本发明流式细胞仪检测5号管脑创伤病人APC-Annexin V+FITC-MitoTracker双阳性染色结果图;
图10是本发明流式细胞仪检测6号管健康人APC-Annexin V+PE-GFAP双阳性染色结果图;
图11是本发明流式细胞仪检测6号管健康人APC-Annexin V+FITC-MitoTracker双阳性染色结果图;
图12是本发明流式细胞仪检测4号管APC-Annexin V单阳性管图;
图13是本发明流式细胞仪检测8号管EDTA+APC-Annexin 阴性对照管图;
图14是本发明流式细胞仪检测2号管PE-GFAP单阳性管图;
图15是本发明流式细胞仪检测9号管PE-GFAP的阴性对照IgG图;
图16是本发明流式细胞仪检测3号管FITC-MitoTracker 单阳性管图。
具体实施方式
下面结合附图及实施例对本发明作进一步描述。
1.采集脑创伤病人/健康人血液样本:
(1)采集4毫升脑创伤病人/健康人外周静脉血放入枸橼酸钠抗凝管中,在常温下进行120 g离心20 min,以去除红细胞、白细胞等大型细胞,注意离心要缓降;
2.分离提纯人源性BDMPs:
(1)小心取出上层血浆,在常温下进行1500 g离心20 min,以去除血小板等小型细胞和较大的细胞颗粒(离心机设置为快升慢降,即无闸设置);
(2)小心取出上层血浆,常温下13000 g离心2 min,以去除较大的细胞颗粒;
(3)小心取出上层血浆,4℃下100000g离心1h,留取沉淀,沉淀即为BDMPs,用PBS重悬后即分别得到病人/健康人的富含BDMPs的悬液,用于后续流式检测。
(4)体外培养神经细胞制备BDMPs作为流式细胞技术检测的阳性对照,采用以下步骤:
①培养14 d的神经元细胞和成长到对数生长期的胶质细胞中,加入钙离子超载剂A23187(终浓度10 μg/ml),37℃孵育20 min;
②收集细胞上清液,在常温下1500 g离心20 min,以去除悬浮的神经元或胶质细胞;
③取上清,在常温下13000 g离心2 min,以去除大的细胞碎片;
④取上清,4℃下100000g离心1h,留取沉淀,即为BDMP,用PBS重悬后用于作为流式检测人血脑源性微粒检测的阳性对照。
3. 应用流式细胞技术鉴定人源性BDMPs
(1)取9支无菌流式管,分别编号1~9,1号管为无抗体或染料染色的阴性对照管,2、3、4号管分别为PE Mouse anti-GFAP、MitoTracker® Green FM、APC-Annexin V抗体或染料染色的单染管,单染管用于调补偿,5、6号管分别为脑创伤病人、健康人,7号管为体外制备BDMPs的上述3种抗体或染料染色的三染管,为阳性对照管;8号管为APC-Annexin V抗体的阴性对照管;9号管为PE Mouse anti-GFAP抗体的阴性对照管。分别取50 µl 健康人的富含BDMPs的悬液至试管1,6中,分别取50 µl 病人的富含BDMPs的悬液至试管2,3,4,5,8,9中,取50 µl 体外制备BDMPs的悬液至试管7中;
(2)然后向试管2,5,6,7中加入PE Mouse anti-GFAP抗体(终浓度为10 ng/µl),低速震荡,充分混合,室温避光孵育20min;向试管9中加入同型对照PE Mouse IgG1抗体(终浓度为10 ng/µl),低速震荡,充分混合,室温避光孵育20min;
(3)用DMSO将免疫荧光染料MitoTracker® Green FM稀释为1 mM,注意全程避光低温操作;向试管3,5,6,7中加入免疫荧光染料MitoTracker® Green FM(终浓度为10 ng/µl),低速震荡,充分混合,室温避光孵育15min;
(4)然后向试管4,5,6,7中分别加入抗体APC-Annexin V(终浓度为50 ng/µl),同时加入50 µl 4X Annexin V结合试剂,混合后室温避光孵育15min;向试管8中分别同时加入抗体APC-Annexin V(终浓度为50 ng/µl)和EDTA(终浓度为50 ng/µl),同时加入50 µl 4X Annexin V结合试剂,混合后室温避光孵育15min;
(5)向试管1,2,3中分别加入50 µl 4X Annexin V结合试剂,最后向试管1~8中分别加入2X Annexin V结合试剂将液体体积补足到500µl,在避光条件下用移液器无涡流吹打各试管中的悬液,轻轻混匀避免产生气泡,混匀后进行流式细胞仪检测;
注意,每个标本上机前在避光条件下用移液器无涡流吹打悬液,轻轻混匀避免产生气泡,混匀后即可进行流式细胞仪检测。
(6)在FSC/SSC散点图中,应用购买的Megamix标准微粒(直径分别为0.5,0.9和3 µm)确定不同微粒大小的位置(图1)。根据结果我们圈选直径小于0.9 µm的区域即为P1区域,图2中所示P2区域即为MPs区域,横纵坐标FSC和SSC均采用对数刻度。圈选P2区域的MPs进入散点图(图3和图4),图3横坐标为APC结合的PS标记Annexin V,纵坐标为FITC结合的线粒体标记;图4横坐标为APC结合的PS标记Annexin V,纵坐标为PE结合的神经胶质细胞标记GFAP,横纵坐标均采用对数刻度。共收集100万个细胞颗粒。图1为Megamix标准微粒流式检测结果;图2、图3和图4均为7号管流式检测结果;图5、图6和图7均为1号管流式检测结果;图8、9为5号管脑创伤病人流式检测结果;图10、11为6号管健康人流式检测结果;图12为4号管流式检测结果;图13为8号管流式检测结果;图14为2号管流式检测结果;图15为9号管流式检测结果;图16为3号管流式检测结果。
通过研究发现:BDMPs具有独特的结构与功能,其磷脂双分子膜上富含磷脂酰丝氨酸(phosphatidylserine,PS)和组织因子(tissue factor,TF)并携带神经细胞特异性标记物。BDMPs的直径相对较小,但其促凝活性较PMPs更强。
通过应用流式细胞仪技术发现:TBI病人外周静脉血中的BDMPs含量远多于健康人。这一发现说明机体在遭受颅脑创伤后,血脑屏障受到了破坏,神经元与神经胶质细胞释放的BDMPs会通过血脑屏障释放到外周血中。
目前,创伤后出现凝血功能障碍是导致创伤患者死亡的一个主要原因,但是相关凝血功能障碍发生发展的机制仍然知之甚少,而本发明对于BDMPs的发现与研究则有望能够阐明TBI相关凝血功能障碍的理论基础,明确相关机制,建立预防治疗TBI引发的凝血功能障碍的新方法。
- 还没有人留言评论。精彩留言会获得点赞!