基于背景荧光猝灭‑免疫层析测定牛奶中林可霉素的方法与流程
本发明涉及牛奶检测技术领域,是一种基于背景荧光猝灭-免疫层析测定牛奶中林可霉素的方法。
背景技术:
林可霉素(linconycin,lin)属于林可胺类抗生素,对于革兰氏阳性菌有较强抗菌作用,对支原体也有抑菌作用,但对革兰氏阴性菌无效。临床上主要应用于葡萄球菌、化脓性链球菌、肺炎球菌及厌氧菌所致的呼吸道感染、皮肤软组织感染、女性生殖道及盆腔感染和厌氧菌所致的腹腔感染等。还可用于链球菌和葡萄球菌所致的败血症、骨和关节感染、慢性骨和关节感染的外科辅助治疗、葡萄球菌所致的急性血源性骨髓炎等。作为兽药,常被添加在饲料中或直接乳房注射治疗奶牛的乳房炎,但残留在乳腺管中的林可霉素,会经乳汁排出,导致生鲜乳中抗生素残留,对消费者引起机体的过敏反应或抗药性。各国都对其有限量要求,中华人民共和国农业部公告第253号-2002牛奶中最高残留限量为100ng/ml。
在进出口动物源性食品snt2218-2008中林可胺类药物残留量检测方法中林可霉素的检测方法为液相色谱-串质谱法和质谱法。在中华人民共和国国家标准gb/t4789.27-2008规定鲜乳中林可霉素残留的检验方法为嗜热链球菌抑制法和嗜热脂肪芽孢杆菌抑制法。文献报道有酶联免疫吸附法(elisa)、高效液相色谱法、胶体金免疫层析法等。嗜热链球菌抑制法和嗜热脂肪芽孢杆菌抑制法试验价格低廉,但样品前处理过程繁琐,重现性差;高效液相色谱法、液相色谱串联质谱法等,这类方法灵敏度高,特异性好,但是此类仪器没有便携性,价格昂贵,样品前处理复杂;elisa方法灵敏度较高、快速、经济,但在检测实验过程需多次洗板,重复性较差,试剂需低温保存等,适用于实验室大量样本初筛,不适合现场快速检测;胶体金免疫层析因快速、简便且经济实用,在食品检测的大量样本筛查中表现出较强的优势,但只能用于定性检测,而不能进行定量,筛选后的阳性样本需送实验室进行进一步定量分析。
技术实现要素:
本发明提供了一种基于背景荧光猝灭-免疫层析测定牛奶中林可霉素的方法,克服了上述现有技术之不足,其能有效解决现有鲜乳中林可霉素残留的检验方法存在样品前处理过程繁琐、重现性差、不适合现场快速检测和不能进行定量分析的问题。
本发明的技术方案是通过以下措施来实现的:一种基于背景荧光猝灭-免疫层析测定牛奶中林可霉素的方法,按下述步骤进行:第一步,将林可霉素标准曲线方程和名称输入二维码制码器,制成林可霉素二维码,然后把林可霉素二维码粘贴在林可霉素试纸条上的二维码粘贴处,得到林可霉素检测卡;第二步,取待检测样品200μl至固定有金标抗体的小试杯中,充分混匀后吸取100μl滴加至林可霉素检测卡上的加样孔内,室温下层析10min;第三步,层析后将林可霉素检测卡插入荧光免疫分析仪的插卡口,点击测样,荧光免疫分析仪的显示屏上就会显示出待检测样品名称和待检测样品中林可霉素的浓度。
下面是对上述发明技术方案的进一步优化或/和改进:
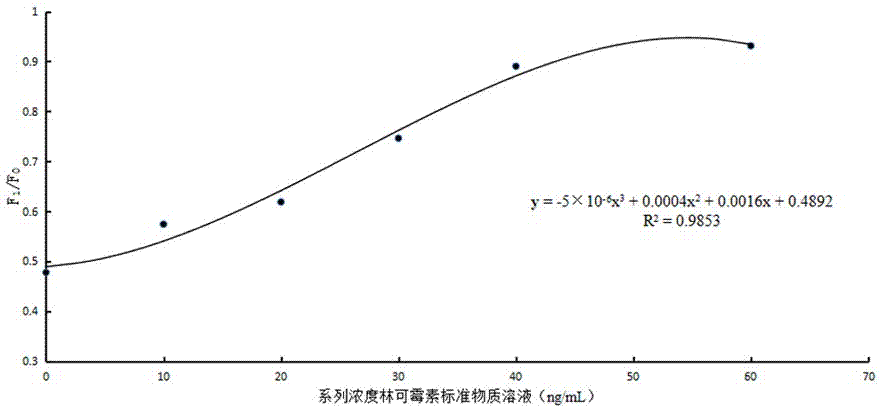
上述林可霉素标准曲线方程按下述方法得到:第一步,林可霉素储备液的配置,取林可霉素标准物质,用pbs配成1μg/ml的林可霉素溶液,得到林可霉素储备液;第二步,林可霉素系列浓度标准溶液的配置,将林可霉素储备液用标准牛奶样依次配成10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml的林可霉素系列溶液,得到林可霉素系列浓度标准溶液;第三步,取标准牛奶样200μl、林可霉素系列浓度标准溶液各200μl至固定有金标抗体的小试杯中,充分混匀后吸取100μl滴加至林可霉素试纸条上的加样孔内,室温下层析10min;第四步,层析后将林可霉素试纸条插入荧光免疫分析仪的插卡口,点击测样,荧光免疫分析仪扫描林可霉素试纸条上的t线和c线,获得样品f1/f0的比值;第五步,以溶液中林可霉素的浓度为横坐标,相对应的f1/f0为纵坐标,得到林可霉素标准曲线方程y=-5×10-6x3+0.0004x2+0.0016x+0.4892。
上述标准牛奶样为经检测不含有林可霉素的牛奶样。
上述待检测样品为待检测牛奶。
本发明测定牛奶中林可霉素的检测限为0.088μg/kg,最优加样量为100μl,最优层析时间为10min;本发明较现有方法灵敏度高、反应时间短、操作简便,可实现牛奶中林可霉素现场快速定量检测,为广泛应用于食品安全领域奠定了基础。
附图说明
附图1为现有林可霉素试纸条的背景荧光猝灭-免疫层析检测示意图。
附图2为本发明林可霉素标准曲线。
附图3为本发明林可霉素检测卡和荧光免疫分析仪的立体结构示意图。
具体实施方式
本发明不受下述实施例的限制,可根据本发明的技术方案与实际情况来确定具体的实施方式。
实施例1,该基于背景荧光猝灭-免疫层析测定牛奶中林可霉素的方法,按下述步骤进行:第一步,将林可霉素标准曲线方程和名称输入二维码制码器,制成林可霉素二维码,然后把林可霉素二维码粘贴在林可霉素试纸条上的二维码粘贴处,得到林可霉素检测卡;第二步,取待检测样品200μl至固定有金标抗体的小试杯中,充分混匀后吸取100μl滴加至林可霉素检测卡上的加样孔内,室温下层析10min;第三步,层析后将林可霉素检测卡插入荧光免疫分析仪的插卡口,点击测样,荧光免疫分析仪的显示屏上就会显示出待检测样品名称和待检测样品中林可霉素的浓度。
实施例2,林可霉素标准曲线方程按下述方法得到:第一步,林可霉素储备液的配置,取林可霉素标准物质,用pbs配成1μg/ml的林可霉素溶液,得到林可霉素储备液;第二步,林可霉素系列浓度标准溶液的配置,将林可霉素储备液用标准牛奶样依次配成10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml的林可霉素系列溶液,得到林可霉素系列浓度标准溶液;第三步,取标准牛奶样200μl、林可霉素系列浓度标准溶液各200μl至固定有金标抗体的小试杯中,充分混匀后吸取100μl滴加至林可霉素试纸条上的加样孔内,室温下层析10min;第四步,层析后将林可霉素试纸条插入荧光免疫分析仪的插卡口,点击测样,荧光免疫分析仪扫描林可霉素试纸条上的t线和c线,获得样品f1/f0的比值;第五步,以溶液中林可霉素的浓度为横坐标,相对应的f1/f0为纵坐标,得到林可霉素标准曲线方程y=-5×10-6x3+0.0004x2+0.0016x+0.4892。
实施例3,作为上述实施例的优化,标准牛奶样为经检测不含有林可霉素的牛奶样。
实施例4,作为上述实施例的优化,待检测样品为待检测牛奶。
现有林可霉素试纸条的背景荧光猝灭-免疫层析检测示意图见图1所示,图1中,1.小试杯底部固定有胶体金标记的目标物抗体(金标抗体)和胶体金标记的羊抗鼠抗体,2.供试品溶液进行层析的样品垫,3.包被有“目标物抗原-牛血清白蛋白(bsa)偶联物”的测试线(t线),4.包被有“羊抗鼠抗原-牛血清白蛋白(bsa)偶联物”控制线(c线),5.带有背景荧光f0的硝酸纤维素膜;图1中,底部固定有胶体金标记的目标物抗体(金标抗体)和胶体金标记的羊抗鼠抗体的小试杯,固定有荧光试剂的硝酸纤维素膜荧光区(可产生背景荧光f0),在荧光区包被有“目标物抗原-牛血清白蛋白偶联物”的测试线(t线),包被有“羊抗鼠抗原-牛血清白蛋白偶联物”的控制线(c线)。样品检测原理为:将一定量样品溶液,加入固定有金标抗体小试杯中,混匀(样品溶液中的待测目标物-林可霉素抗原与金标抗体特异性结合),吸取一定量的混匀溶液滴加至样品垫上,通过毛细管作用进行层析。当混合溶液到达t线处,剩余的金标抗体与t线处的目标物-林可霉素抗原结合,形成抗原-金标抗体复合物,被截留在t线上,使背景荧光猝灭,以t线处荧光强度的测量值记为f1,荧光猝灭程度(f1/f0)与供试品中待测目标物含量有关。当供试品中目标物浓度大时,结合小试杯中金标抗体的量就多,小试杯中剩余的金标抗体与t线处“目标物抗原-牛血清白蛋白偶联物”结合的就少,猝灭程度就弱,f1/f0的值就大。f1/f0随待测物浓度增大而增大,零值样本f1/f0值最小。为对试纸条进行质控,在具有背景荧光的硝酸纤维素膜上还固定了“羊抗鼠抗原-牛血清白蛋白偶联物”(c线),用于对试纸条进行质控,当上述混合溶液继续前行到达c线处,金标羊抗鼠抗体与c线处的“羊抗鼠抗原-牛血清白蛋白偶联物”结合,使c线处的背景荧光发生猝灭。说明试纸条质量合格。
本发明试验如下:
1.实验部分
1.1仪器与材料
荧光免疫分析仪(zc2015-0797,上海鑫谱生物科技有限公司);
林可霉素标准物质(lin,10ppm,上海鑫谱生物科技有限公司,批号:20160911);林可霉素试纸条、固定有林可霉素金标抗体的小试杯(上海鑫谱生物科技有限公司,批号:20160926);
标准牛奶样(经检测没有林可霉素,上海荣辉生物科技有限公司);
供试品,为了验证背景荧光猝灭-免疫层析法和国标规定方法的差异,本实验在标准牛奶样中人为添加一定量的林可霉素标准物质,制成含林可霉素300ng/ml、220ng/ml和50ng/ml的供试品004、005、006。
1.2溶液的配制
林可霉素储备液的制备:将林可霉素标准物质(10ppm),用pbs配成1μg/ml的溶液,得到林可霉素储备液。
林可霉素系列浓度标准溶液:将1μg/ml的林可霉素储备液,用标准牛奶样配成10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml的林可霉素系列溶液,得到林可霉素系列浓度标准溶液。
2.方法与结果
2.1反应时间与加样量的确定
2.1.1反应时间的选择
取200μl标准牛奶样,加到固定有金标抗体的小试杯中,混匀后吸120μl加入林可霉素试纸条上的加样孔中,分别层析8min和10min,用荧光免疫分析仪检测,记录f1/f0的值见表1所示。
从表1可以看出,层析时间为8min时,rsd值为6.12%,层析时间为10min时,rsd值为4.30%;说明层析时间为10min时的rsd值小,所以选择层析10min。
2.1.2加样量的选择
取三份标准牛奶样,每份200μl,分别加到固定有金标抗体的小试杯中,混匀后依次从三个固定有金标抗体的小试杯中吸80μl、100μl、120μl分别加入三个林可霉素试纸条上的加样孔中,层析10min,层析后将林可霉素试纸条插入荧光免疫分析仪的插卡口,点击测样,记录f1/f0的值,见表2所示。
从表2可以看出,当加样量为80μl、100μl和120μl时,rsd值依次为6.35%、1.41%、3.68%;说明当加样量为100μl时,rsd值最小,所以选择100μl加样量。
2.2方法学验证
2.2.1曲线方程与范围
分别取标准牛奶样200μl、1.2项下的10ng/ml的林可霉素系列浓度标准溶液200μl、20ng/ml的林可霉素系列浓度标准溶液200μl、30ng/ml的林可霉素系列浓度标准溶液200μl、40ng/ml的林可霉素系列浓度标准溶液200μl、60ng/ml的林可霉素系列浓度标准溶液200μl,分别加到固定有金标抗体的小试杯中,混匀后各吸100μl分别加入林可霉素试纸条上的加样孔中,层析10min,用荧光免疫分析仪检测,记录f1/f0,见表3所示;以溶液中林可霉素的浓度为横坐标,对应的f1/f0为纵坐标,进行回归,得到林可霉素标准曲线方程为y=-5×10-6x3+0.0004x2+0.0016x+0.4892,林可霉素标准曲线见图2所示;从表3和图2可以看出,林可霉素在0.102ng/ml至60ng/ml之间呈良好的相关性,相关系数为r=0.9923。取标准牛奶样200μl,加到固定有金标抗体的小试杯中,混匀后吸100μl加入林可霉素试纸条上的加样孔中,层析10min,用荧光免疫分析仪检测,记录f1/f0,重复操作20次,计算20次的均值和标准差(sd),以均值+2sd计算检出限为0.088ng/ml。
2.2.2精密度实验
取10ng/ml、30ng/ml、40ng/ml三个浓度的林可霉素系列浓度标准溶液,各取200μl,加到固定有金标抗体的小试杯中,混匀后各吸100μl分别加入林可霉素试纸条上的加样孔中,层析10min,用荧光免疫分析仪检测,记录f1/f0,见表4所示;从表4可以看出,10ng/ml、30ng/ml、40ng/ml三个浓度的林可霉素系列浓度标准溶液的f1/f0值的rsd依次为1.2%,0.6%,1.1%,精密度的rsd小于5%,符合要求。
2.2.3加标回收率
取3份标准牛奶样分别置ep管中,每份1ml,依次在3份标准牛奶样中加入林可霉素储备液20μl、30μl和40μl,依次配成低、中和高三个浓度,每个浓度平行3份,各取200μl,加到固定有金标抗体的小试杯中,混匀后各吸100μl分别加入林可霉素试纸条上的加样孔中,层析10min,用荧光免疫分析仪检测,记录各样本中林可霉素的检测浓度,见表5所示;从表5可以看出,标准牛奶样中高、中、低林可霉素测定的平均加标回收率分别为103.4%,99.7%,98.5%,rsd为2.46%,rsd小于5%,符合要求。
2.2.4重复性试验
取标准牛奶样995μl于ep管中,再加入林可霉素储备液5μl,混匀,配成5ng/ml的样品。取200μl加到固定有金标抗体的小试杯中,混匀,再吸100μl加入林可霉素试纸条上的加样孔中,层析10min,用荧光免疫分析仪检测,记录供试品中林可霉素检测值的f1/f0,见表6所示;从表6可以看出,林可霉素重复性实验中,f1/f0测定值的rsd为0.82%,浓度测定值的rsd为1.25%,rsd小于5%,符合要求。
2.2.5长期重复性实验
取同一批次林可霉素试纸条、标准牛奶样200μl和1.2项下的林可霉素系列浓度标准溶液各200μl,分别加到固定有金标抗体的小试杯中,混匀后各吸100μl分别加入林可霉素试纸条上的加样孔中,层析10min,用荧光免疫分析仪检测,每个月重复一次林可霉素标准曲线,连续做5个月,林可霉素长期重复性实验考查测定结果见表7所示;从表7可以看出,5个月内,标准牛奶样、林可霉素系列浓度标准溶液10ng/ml、20ng/ml、30ng/ml、40ng/ml和60ng/ml,对应的rsd为依次为0.42%、0.35%、0.39%、0.27%、0.24%和0.31%;rsd小于5%,符合要求。
2.3二维码的制作
以上经方法学验证,林可霉素标准曲线方程符合要求,将获得的林可霉素标准曲线方程和对应林可霉素名称输入二维码制码器,制成林可霉素二维码,贴在林可霉素试纸条上,得到林可霉素检测卡。
2.4样品测定
分别取供试品004、005和006各200μl至固定有金标抗体的小试杯中,充分混匀后吸取100μl滴加至林可霉素检测卡上的加样孔内,室温下层析10min;层析后将林可霉素检测卡插入荧光免疫分析仪的插卡口,点击测样,荧光免疫分析仪先扫描林可霉素二维码,获得二维码中储存的林可霉素标准曲线方程,再依次扫描林可霉素检测卡上的t线和c线,获得样品f1/f0的比值,荧光免疫分析仪中的simple1软件将f1/f0的比值代入林可霉素标准曲线方程进行计算,计算后显示屏将显示待检测样品名称和待检测样品的浓度。再分别取供试品004、005和006按国标(gb29685-2013)进行测定;采用spss17.0软件,对本发明和国标法测定后测定值作t检验分析;供试品中林可霉素测定结果(
本发明应用的背景荧光猝灭-免疫层析法(backgroundfluorescencequenchingimmunochromatographicassay,bfqica)主要包括林可霉素检测卡和荧光免疫分析仪,本发明林可霉素检测卡和荧光免疫分析仪的立体结构示意图见图3所示;荧光免疫分析仪安装有simple1软件系统。
本发明基于背景荧光猝灭-免疫层析技术,建立检测牛奶中林可霉素的方法学,本发明将林可霉素标准曲线方程和名称输入二维码制码器,制成林可霉素二维码,然后把林可霉素二维码粘贴在林可霉素试纸条上的二维码粘贴处,得到林可霉素检测卡;林可霉素检测卡与荧光免疫分析仪配合使用,用于实际样品的快速测定,与国标法比较没有显著性差异。
3.小结
本发明应用已研制的林可霉素检测卡,建立了检测牛奶中林可霉素的检测方法。本发明测定牛奶中林可霉素的浓度范围为0.102ng/ml至60.0ng/ml,最低检测限为0.088ng/ml。本发明牛奶样品中高、中、低林可霉素测定的平均加标回收率分别为103.4%,99.7%,98.5%,rsd为2.46%(n=9)。
用本发明测定牛奶中的林可霉素与国标方法(gb29685-2013)测定牛奶中林可霉素的方法相比,本发明是基于抗原、抗体的反应,所以专属性强;本发明中的硝酸纤维素膜上标记有背景荧光,胶体金猝灭剂与抗体结合,硝酸纤维素膜上的t线处固定有对应的抗原,当液体在试纸条上流动,t线处抗原-抗体-胶体金结合,引起t线处背景荧光猝灭,猝灭的程度用f1/f0表示,进行定量分析,所以检测灵敏度高。用本发明测定牛奶中林可霉素的检测限是0.088μg/kg,国标方法(gb29685-2013)中的液质联用测定牛奶中林可霉素的检测限是8μg/kg;用本发明测定牛奶中的林可霉素,不需要样品前处理,且本发明将检测牛奶中林可霉素标准曲线的信息,储存在林可霉素二维码中,检测人员不用现场做标曲,使检测变的方便、快捷,每份样本仅需10min。而国标方法(gb29685-2013)中的液质联用测定牛奶中林可霉素不仅需要样品前处理,还需要检测人员现场做标曲,每份样本的检测需要55min;本发明与gica方法相比较,gica只能进行定性分析,适合大量样本的最初筛选,筛选出的样本还需要采用定量的方法再检测。而本发明不仅可以根据t线处抗原-抗体-胶体金结合引起的颜色变化进行定性分析,还可进行定量分析。
综上所述,本发明测定牛奶中林可霉素的检测限为0.088μg/kg,最优加样量为100μl,最优层析时间为10min;本发明较现有方法灵敏度高、反应时间短、操作简便,可实现牛奶中林可霉素现场快速定量检测,为广泛应用于食品安全领域奠定了基础。
以上技术特征构成了本发明的实施例,其具有较强的适应性和实施效果,可根据实际需要增减非必要的技术特征,来满足不同情况的需求。
表1不同反应时间的选择
表2不同加样量的选择
表3牛奶中林可霉素标准曲线数据
表4精密度试验(n=6)
表5牛奶中林可霉素加标回收率
表6林可霉素的重复性试验
表7林可霉素长期重复性实验考查测定结果
表8供试品中林可霉素测定结果(
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺