在线监测用葡萄糖氧化酶丝网印刷电极及其制备方法与流程
本发明涉及一种在线监测用葡萄糖氧化酶丝网印刷电极及其制备方法,属于生物传感器及电分析化学测试技术领域。
背景技术:
生物传感器是一种以化学或物理传感器为基底换能器件,通过特定的生物活性器件的修饰形成的可用于对特定物质进行定性或定量分析的传感元件,在工业、医疗、环境、军事等重要领域有广泛应用。由酶修饰获得的电流型生物传感器适用范围广、原材料品种繁多、生产制造简易、传感性能可靠、使用便捷简单、响应快速省时,是生物传感器领域中的重要组成部分。
工业化生产过程中,往往需要对发酵过程中的反应底物的浓度变化进行实时监测,这要求为发酵领域提供一种廉价、使用方便、分析结果可靠的在线检测方法及设备。葡萄糖是一种极为常见的发酵原料,对其浓度进行在线实时监测在工业生产中具有重要意义。
发酵过程中的实时监测面临诸多较为棘手的问题,如:便捷自动化的在线取样、有效避免取样及分析过程中可能造成的生物污染、较长期保证传感器的稳定性能等。迄今,美国专利商标局公布的专利中,有关生物传感器的专利近12,000项,其中约6,000项与葡萄糖的分析测试有关;欧洲专利局公布近10,000项,其中逾700项与葡萄糖分析检测直接相关;中国专利局公布约600项生物传感领域的专利,其中不足20项与葡萄糖的分析检测直接相关。上述专利中,尚未见到面向工业发酵过程中葡萄糖在线分析检测的报道。
面向市场的葡萄糖生物传感器,正面临或难以多次、重复进行分析测试,或难以批量、工业化生产等问题。同时,发酵液的成分通常较为复杂,电流型酶生物传感器往往难以避免其中非目标检测组分的干扰。这些都是阻碍葡萄糖生物传感器进入工业发酵过程在线分析的主要困难。
技术实现要素:
为了解决以上技术问题,本发明提供了一种适于工业化生产及工业生产实际应用的酶传感器电极。该电极以固定化的葡萄糖氧化酶作为其生物活性元件,以普鲁士蓝修饰的丝网印刷电极片为电化学换能元件构成。同时提供该酶传感器电极的电化学基底电极、固定化酶及完整酶电极的制作方法及使用方法。通过与在线取样系统的联用,本发明适于发酵过程中的葡萄糖在线分析测试要求。
本发明技术方案如下:
1)普鲁士蓝掺杂的介体型过氧化氢丝网印刷电极制作:
配制含等摩尔浓度k3fe(cn)6和kcl的水溶液,以盐酸调节其ph在1.0-2.5范围内,在快速搅拌条件下向其中逐滴加入1-1.33倍体积含等摩尔浓度的fecl3水溶液,充分反应后以4000rpm离心分离获得深蓝色物质即普鲁士蓝;置于烘箱内于95℃烘干至恒重,再于同一烘箱内于100℃-150℃下烘制0.5-2h,得到活化的普鲁士蓝,干燥器内冷却后以研钵研细成颗粒待用;称取普鲁士蓝颗粒0.05g,配和入1mln,n-二甲基甲酰胺以研钵研细,随后加入3g导电碳浆和2ml导电碳浆专用溶剂精细研磨20min使物料充分混匀,制成普鲁士蓝掺杂的碳基导电油墨;
取厚度为0.5mm的聚氯乙烯基片,以1mol/lnaoh溶液浸泡处理4h后洗净晾干;制作普鲁士蓝掺杂丝网印刷电极:
(1)首先,在洗净的聚氯乙烯基片上以导电碳浆印制导线及两个电极,印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发;
(2)两个电极中取其中一个作为对电极,另一个电极上印制普鲁士蓝掺杂的碳基导电油墨成工作电极,印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发并使基底电极得到活化;
(3)最后以环氧树脂印制环氧树脂绝缘层,覆盖其导电部分,仅暴露出其工作面积、对电极及同检测器连接的导电部;印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发;
2)酶固定化载体(pei-cho)制备
以含有0.1mol/l冰乙酸的水溶液在90℃条件下溶解固体聚乙烯亚胺获得质量浓度为1.0-2.0wt%的聚乙烯亚胺水溶液,冷却后过滤得纯净的聚乙烯亚胺溶胶;
取1.0-2.0wt%聚乙烯亚胺溶胶,在磁力搅拌条件下逐滴滴加入含量为20-500倍聚乙烯亚胺干重的戊二醛水溶液中进行充分反应,所用戊二醛为质量分数为25%-50%的水溶液,反应时间为12-16h得到pei-cho合成母液;
为去除pei-cho合成母液内的戊二醛以获得纯净的pei-cho,使用截留分子量为8-50kda的透析袋进行2-3d的透析,其间每隔4-6h更换一次透析液,所用透析液为0.01-0.1mol/l的na2ac-hac缓冲液;或以乙醚或三氯甲烷为萃取剂对合成母液进行反复透析后,与萃取产物等体积的0.01-0.1mol/l的na2ac-hac缓冲液混合;或以截留分子量(mwco)为3-50kda的超滤膜进行超滤;
3)固定化葡萄糖氧化酶(pei-co-gox)的制备及酶电极的制作
(1)取2.5-3份体积的纯化pei-cho以0.01-0.1mol/l的na2ac-hac缓冲液稀释成pei-cho含量为0.1-0.5wt%的稀溶液;
(2)以0.01-0.1mol/l的na2ac-hac缓冲液配制含300-340u/ml的gox酶稀释液,取0.8-1份与步骤(1)所述的溶液均匀混合并静置0-30min,于4℃、2000-6000rpm条件下离心5-10min,收集其沉淀部分待用;
(3)将沉淀部分以5-6份体积0.01-0.1mol/lna2ac-hac的缓冲液重新分散,再将分散液同1.7-3.4份体积0.01-0.1mol/lna2ac-hac缓冲液配置的含1-3wt%的羧基化聚乙烯亚胺(c-chit)、羧甲基纤维素钠(cmc)、牛血清蛋白(bsa)或其混合物均匀混合,静置0-30min后所得悬浊液即经固定化修饰后的酶制剂;
(4)将25-50μl该悬浊液滴加于介体掺杂的丝网印刷电极片工作面积上成固定化酶层,于室温条件下静置3-4小时;以切割成合适尺寸的纤维素滤纸或玻璃纤维素滤纸为保护膜紧密覆盖电极片的工作面积,以双面胶密封后成为成品酶电极(见图2);
4)安培型测试
将酶电极片的两电极接口部分同检测器电路相连接构成完整检测器,检测时以ph6.0-7.0的磷酸盐缓冲液浸没电极片工作面积,在恒速磁力搅拌的条件下向电极体系施加一定的恒定电压,记录其电流-时间响应曲线;当电流响应稳定后,记录对含纯品葡萄糖量确定的标定液的电流响应值作为满值,检测器系统自动生成回归方程用于定量检测,随后可开始对发酵液样本进行在线检测;按照本发明方法所制备的酶电极在不同的葡萄糖浓度下测定的传感结果(见图3),响应时间12-20s,在葡萄糖浓度为0.05-1mmol/l范围内获得电流与葡萄糖浓度的线性关系。利用仪器自动标定产生的回归方程可定量分析试样中的葡萄糖浓度。
丝网印刷电极具有制作简便、成本低廉、成品间的重现性理想、电极体积小等优势,已在多种电化学检测器件的工业化生产中占用重要地位。普鲁士蓝是一种过氧化氢的理想电化学催化剂,不仅能够在极低的电位条件下对过氧化氢产生高效电催化,同时其电催化作用以电化学还原反应的形式体现,不同于常规测试方法中所依赖利用的电化学氧化反应。大量实验已经证实,应用普鲁士蓝修饰的电化学传感器能够实现对过氧化氢的高效、专一性电分析检测。
化学沉积法同电化学沉积法制备的普鲁士蓝相比具有相似的过氧化氢电化学活性,但操作更为简单,所需的合成设备简易而廉价,合成时间短,可按照生产需要进行批量合成的明显优势,特别适合应用于批量生产的电化学修饰电极设计、制造中。将丝网印刷技术与普鲁士蓝结合,适合可工业化生产的过氧化氢电极的开发。目前国内外均已出现普鲁士蓝修饰的丝网印刷电极产品。
通过对葡萄糖氧化酶对其底物葡萄糖的酶促反应产物过氧化氢的定量分析,可以间接实现对葡萄糖的定量分析。相比于第一代溶氧测量型传感器具有明显优势。
本发明利用普鲁士蓝作为电子媒介体制备修饰基底电极,制作简单、成本低廉,利用过氧化氢的电化学还原过程进行定量分析有效避免了分析试样中易氧化成分带来的干扰。以本发明提供的方法制备的固定化酶活力保留率高,寿命较长,用于制作酶电极片修饰操作简单,对分析物的传质阻力小。借助丝网印刷工艺,电极片的生产简易、经济且信号重现性良好,适于投入工业化生产,用于发酵工业中的在线分析。
附图说明
图1为本发明介体掺杂丝网印刷电极片的制作过程示意图;
图2为本发明基于介体掺杂丝网印刷电极片的固定化酶修饰过程示意图;
图3为本发明完整酶电极的结构示意图;
图4为固定化载体pei-coh及固定化酶pei-co-gox的红外表征结果图;
图5为本发明实施例1中酶电极对0.05-1mmol/l的葡萄糖标准溶液的电流-时间响应关系图;
图6为本发明实施例2中酶电极对以1mmol/l葡萄糖标准溶液定标的电流-时间响应、对发酵液(柠檬酸发酵液,发酵时间57h)实际样本的响应及其对5次0.1mmol/l葡萄糖标准溶液的加标响应。
具体实施方式
以下通过具体实施例对本发明做进一步阐述:
实施例1
葡萄糖标准品的检测
1)普鲁士蓝掺杂的介体型过氧化氢丝网印刷电极制作:
配制含等摩尔浓度k3fe(cn)6和kcl的水溶液,以盐酸调节其ph在1.0-2.5范围内,在快速搅拌条件下向其中逐滴加入1-1.33倍体积含等摩尔浓度的fecl3水溶液,充分反应后以4000rpm离心分离获得深蓝色物质即普鲁士蓝;置于烘箱内于95℃烘干至恒重,再于同一烘箱内于100℃-150℃下烘制0.5-2h,得到活化的普鲁士蓝,干燥器内冷却后以研钵研细成颗粒待用;称取普鲁士蓝颗粒0.05g,配和入1mln,n-二甲基甲酰胺以研钵研细,随后加入3g导电碳浆和2ml导电碳浆专用溶剂精细研磨20min使物料充分混匀,制成普鲁士蓝掺杂的碳基导电油墨;
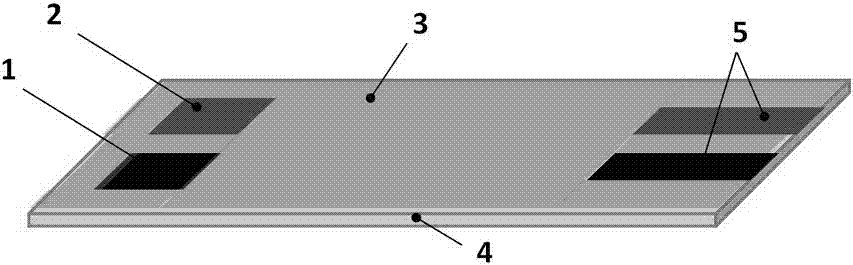
取厚度为0.5mm的聚氯乙烯基片4,以1mol/lnaoh溶液浸泡处理4h后洗净晾干;制作普鲁士蓝掺杂丝网印刷电极:
(1)首先,在洗净的聚氯乙烯基片上以导电碳浆印制导线6及两个电极,印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发;
(2)在两个电极中取其中一个作为对电极2,另一个电极上印制普鲁士蓝掺杂的碳基导电油墨成工作电极1,印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发并使基底电极得到活化;
(3)最后以环氧树脂印制环氧树脂绝缘层3,覆盖其导电部分,仅暴露出其工作面积1、对电极2及同检测器连接的导电部5;印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发;见图1;
2)酶固定化载体(pei-cho)制备
以含有0.1mol/l冰乙酸的水溶液在90℃条件下溶解固体聚乙烯亚胺获得质量浓度为1.0-2.0wt%的聚乙烯亚胺水溶液,冷却后过滤得纯净的聚乙烯亚胺溶胶;
取1.0-2.0wt%聚乙烯亚胺溶胶,在磁力搅拌条件下逐滴滴加入含量为20-500倍聚乙烯亚胺干重的戊二醛水溶液中进行充分反应,所用戊二醛为质量分数为25%-50%的水溶液,反应时间为12-16h得到pei-cho合成母液;
为去除pei-cho合成母液内的戊二醛以获得纯净的pei-cho,使用截留分子量为8-50kda的透析袋进行2-3d的透析,其间每隔4-6h更换一次透析液,所用透析液为0.01-0.1mol/l的na2ac-hac缓冲液;或以乙醚或三氯甲烷为萃取剂对合成母液进行反复透析后,与萃取产物等体积的0.01-0.1mol/l的na2ac-hac缓冲液混合;或以截留分子量(mwco)为3-50kda的超滤膜进行超滤;
3)固定化葡萄糖氧化酶(pei-co-gox)的制备及酶电极的制作
(1)取2.5-3份体积的纯化pei-cho以0.01-0.1mol/l的na2ac-hac缓冲液稀释成pei-cho含量为0.1-0.5wt%的稀溶液;
(2)以0.01-0.1mol/l的na2ac-hac缓冲液配制含300-340u/ml的gox酶稀释液,取0.8-1份与步骤(1)所述的溶液均匀混合并静置0-30min,于4℃、2000-6000rpm条件下离心5-10min,收集其沉淀部分待用;
(3)将沉淀部分以5-6份体积0.01-0.1mol/lna2ac-hac的缓冲液重新分散,再将分散液同1.7-3.4份体积0.01-0.1mol/lna2ac-hac缓冲液配置的含1-3wt%的羧基化聚乙烯亚胺(c-chit)、羧甲基纤维素钠(cmc)、牛血清蛋白(bsa)或其混合物均匀混合,静置0-30min后所得悬浊液即经固定化修饰后的酶制剂;其红外表征图如图4:(a)gox纯品;(b)pei纯品;(c)pei-gdi纯品;(d)pei-gdi-gox,所有样品皆为经过脱水处理:并制作brk压片后进行表征。1107cm-1:c-n伸缩振动;1637cm-1:西弗碱(c=n)伸缩振动;1717cm-1:游离醛基c=o;2869cm-1及2939cm-1:甲基及饱和c-h伸缩振动;3424cm-1:n-h或nh2伸缩振动;可以看出,pei经戊二醛处理后形成了西弗碱结构并使分子体系携带有游离醛基,说明分子改造过程已经使pei-gdi形成;pei-gdi同酶分子结合后,分子体系的西弗碱结构含量有所增加而游离醛基的特征峰基本消失,表明pei-gdi结合酶分子并同其建立共价联接的能力;
(4)将25-50μl该悬浊液滴加于介体掺杂的丝网印刷电极片工作面积上成固定化酶层7,于室温条件下静置3-4小时;以切割成合适尺寸的纤维素滤纸或玻璃纤维素滤纸为保护膜8紧密覆盖电极片的工作面积,以双面胶密封后成为成品酶电极(见图2、图3);
4)安培型测试
将新制的酶电极片与一支饱和ag/agcl电极组成三电极系统。测量时于容量为5ml的反应池内以浓度为0.1mol/l的ph6.0磷酸盐缓冲液浸没电极体系,在恒速磁力搅拌下向电极施加一定的恒定电压。待电流响应稳定后向反应池内加入已知浓度的葡萄糖标准溶液,记录其对葡萄糖标准样品的电流-时间响应曲线(见图5)。利用由该响应曲线绘制的电流-浓度关系曲线及其回归方程可完成发酵液实际样品的定量分析。
实施例2
1)普鲁士蓝掺杂的介体型过氧化氢丝网印刷电极制作:
配制含等摩尔浓度k3fe(cn)6和kcl的水溶液,以盐酸调节其ph在1.0-2.5范围内,在快速搅拌条件下向其中逐滴加入1-1.33倍体积含等摩尔浓度的fecl3水溶液,充分反应后以4000rpm离心分离获得深蓝色物质即普鲁士蓝;置于烘箱内于95℃烘干至恒重,再于同一烘箱内于100℃-150℃下烘制0.5-2h,得到活化的普鲁士蓝,干燥器内冷却后以研钵研细成颗粒待用;称取普鲁士蓝颗粒0.05g,配和入1mln,n-二甲基甲酰胺以研钵研细,随后加入3g导电碳浆和2ml导电碳浆专用溶剂精细研磨20min使物料充分混匀,制成普鲁士蓝掺杂的碳基导电油墨;
取厚度为0.5mm的聚氯乙烯基片4,以1mol/lnaoh溶液浸泡处理4h后洗净晾干;制作普鲁士蓝掺杂丝网印刷电极:
(1)首先,在洗净的聚氯乙烯基片上以导电碳浆印制导线6及两个电极,印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发;
(2)在两个电极中取其中一个作为对电极2,另一个电极上印制普鲁士蓝掺杂的碳基导电油墨成工作电极1,印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发并使基底电极得到活化;
(3)最后以环氧树脂印制环氧树脂绝缘层3,覆盖其导电部分,仅暴露出其工作面积1、对电极2及同检测器连接的导电部5;印刷完成后,置于90℃的烘箱内使有机溶剂充分挥发;见图1;
2)酶固定化载体(pei-cho)制备
以含有0.1mol/l冰乙酸的水溶液在90℃条件下溶解固体聚乙烯亚胺获得质量浓度为1.0-2.0wt%的聚乙烯亚胺水溶液,冷却后过滤得纯净的聚乙烯亚胺溶胶;
取1.0-2.0wt%聚乙烯亚胺溶胶,在磁力搅拌条件下逐滴滴加入含量为20-500倍聚乙烯亚胺干重的戊二醛水溶液中进行充分反应,所用戊二醛为质量分数为25%-50%的水溶液,反应时间为12-16h得到pei-cho合成母液;
为去除pei-cho合成母液内的戊二醛以获得纯净的pei-cho,使用截留分子量为8-50kda的透析袋进行2-3d的透析,其间每隔4-6h更换一次透析液,所用透析液为0.01-0.1mol/l的na2ac-hac缓冲液;或以乙醚或三氯甲烷为萃取剂对合成母液进行反复透析后,与萃取产物等体积的0.01-0.1mol/l的na2ac-hac缓冲液混合;或以截留分子量(mwco)为3-50kda的超滤膜进行超滤;
3)固定化葡萄糖氧化酶(pei-co-gox)的制备及酶电极的制作
(1)取2.5-3份体积的纯化pei-cho以0.01-0.1mol/l的na2ac-hac缓冲液稀释成pei-cho含量为0.1-0.5wt%的稀溶液;
(2)以0.01-0.1mol/l的na2ac-hac缓冲液配制含300-340u/ml的gox酶稀释液,取0.8-1份与步骤(1)所述的溶液均匀混合并静置0-30min,于4℃、2000-6000rpm条件下离心5-10min,收集其沉淀部分待用;
(3)将沉淀部分以5-6份体积0.01-0.1mol/lna2ac-hac的缓冲液重新分散,再将分散液同1.7-3.4份体积0.01-0.1mol/lna2ac-hac缓冲液配置的含1-3wt%的羧基化聚乙烯亚胺(c-chit)、羧甲基纤维素钠(cmc)、牛血清蛋白(bsa)或其混合物均匀混合,静置0-30min后所得悬浊液即经固定化修饰后的酶制剂;
(4)将25-50μl该悬浊液滴加于介体掺杂的丝网印刷电极片工作面积上成固定化酶层7,于室温条件下静置3-4小时;以切割成合适尺寸的纤维素滤纸或玻璃纤维素滤纸为保护膜8紧密覆盖电极片的工作面积,以双面胶密封后成为成品酶电极(见图2、图3);
4)安培型测试
酶电极的安培型测试:将新制的酶电极片按照图6所示连接方式组成完整葡萄糖在线检测系统。测量时于容量为5ml的反应池内以浓度为0.1mol/l的ph6.0磷酸盐缓冲液浸没电极体系,在恒速磁力搅拌下向电极施加一定的恒定电压,待电极在空白缓冲溶液中的电流响应稳定后,向反应池中加入100mmol/l的葡萄糖标准溶液50μl,记录其加入18s后的相应电流值作为满度值。更换反应池内的缓冲溶液,待电极的电流响应再次稳定后,向反应池内加入50μl发酵液样本原液,以标准加入法计算其葡萄糖浓度。随后逐次向反应池内加入50μl的100mmol/l葡萄糖标准溶液共5批,并由此计算其回收率(见图6、表1)。
- 还没有人留言评论。精彩留言会获得点赞!