一种基于荧光染色观察的农药降解菌活性检测方法与流程
本发明涉及的是一种可以快速、方便、直观、准确检测有机农药降解菌活性的方法,具体涉及一种基于荧光染色观察的农药降解菌活性检测方法,属于微生物活性检测技术领域。
背景技术:
农药作为一种重要的农业生产资料,对防治作物病虫害、提高农业产量发挥了重要作用,长时间、高频次、过量地施用有机农药在环境中产生大量残留,严重威胁生态环境安全和人类健康,微生物修复因具有无毒高效、不产生二次污染、操作简便、经济实用和应用范围广等优点,成为去除环境中有机农药污染的一种重要途径。
国内外研究者已通过驯化、筛选、富集和分离从污泥、污水、土壤、沉积物等环境样品中得到了多种有机农药降解菌,并利用微生物固定化、降解菌剂制备等技术将一些农药降解菌应用于污染区域原位修复中,在进行微生物固定化、降解菌剂制备及原位修复时必须保证体系中活菌的数量、比例和降解活性,因此对农药降解菌活性的检测尤为重要,为保证农药降解菌的原位修复效果的重要前提,农药降解菌活性的传统检测方法多在一段时间内分析降解菌培养系统中目标污染物的残留量,计算降解效率以代表系统中降解菌的活性,传统农药降解菌活性监测方法取样周期长、农药残留监测费时费力且花费较高。同时,传统方法不具有时效性,待一个取样分析周期完成时,系统中农药降解菌的活性、丰度等生长状态早已改变,并不能代表应用时的真实状态;因此,亟需发展一种快速、实时、方便、直观、准确检测有机农药降解菌活性的方法。
技术实现要素:
本发明提出的是一种基于荧光染色观察的有机农药降解菌活性检测方法,其目的旨在弥补现有农药降解菌活性检测方法的不足,尤其克服现有方法耗时长、费用高、时效性差等方面的弊端。
本发明的技术解决方案:基于荧光染色观察的有机农药降解菌活性检测方法,具体包括以下步骤:
(1)针对降解菌进行扩大培养;
(2)配置n组含不同活菌死菌比例的培养体系;
(3)计算活菌荧光和死菌荧光比值;
(4)通过降解实验测定n组菌液的农药降解活性;
(5)绘制荧光比值与降解活性的相关性曲线,建立降解菌活性计算公式;
(6)用未知活性菌液验证公式准确性后用于后续测试。
本发明的优点:
1)本发明提出的基于荧光染色观察的有机农药降解菌活性检测方法通过分析培养系统中活菌和死菌的不同颜色荧光强度,能够直观的反映培养体系中菌株的活性状态;
2)检测用时短、费用低,通过荧光强度即可以评价降解菌活性,不必费时、费力的去检测系统中降解菌对农药的降解量,且该方法一经建立,后续测试非常方便简单,大大简化了降解菌活性检测的步骤;
3)能够对降解菌活性进行实时快速检测,具有时效性;
4)适用范围广,能用于在不同环境条件下检测多种降解菌活性,也适用于原位修复中降解菌活性的监测。
附图说明
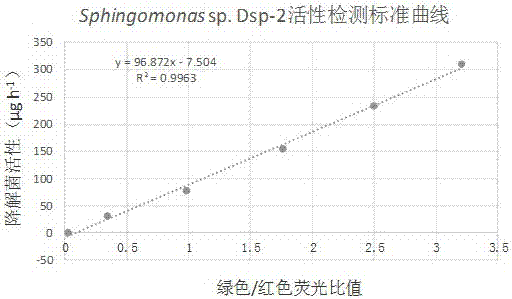
附图1是实施例1中毒死蜱降解菌sphingomonassp.dsp-2绿色/红色荧光比值与降解菌活性的相关性标准曲线。
具体实施方式
基于荧光染色观察的有机农药降解菌活性检测方法,具体包括以下步骤:
(1)针对降解菌进行扩大培养;
(2)配置n组含不同活菌死菌比例的培养体系;
(3)计算活菌荧光和死菌荧光比值;
(4)通过降解实验测定n组菌液的农药降解活性;
(5)绘制荧光比值与降解活性的相关性曲线,建立降解菌活性计算公式;
(6)用未知活性菌液验证公式准确性;
(7)测定样品中的降解菌活性。
所述步骤(1)针对降解菌进行扩大培养:针对某种降解菌,准备相应培养基,培养基灭菌后,接种降解菌进行扩大培养,利用分光光度计设置波长od600检测培养过程降解菌的生长情况。
所述步骤(2)配置n组含不同活菌死菌比例的培养体系:在降解菌生长达到稳定期后,取两份等量的菌液,其中一份进行高温灭活,将摇匀后的活菌液与灭活菌液以不同比例配比,形成n组培养体系,各培养体系中的活菌占总菌的百分比在0%-100%间均匀分布,为确保方法准确性,每组至少三个重复,所述n≥6。
所述步骤(3)计算活菌荧光和死菌荧光比值:培养体系配置结束后,摇匀并立即取少量不同培养体系中的菌液,菌液经荧光染料染色后在荧光显微镜下镜检,所用荧光染料能够区分活菌和死菌,在不同激发波长下,染色后的活菌和死菌的荧光显色不同,拍照后利用图像处理软件分析视野中不同荧光光密度值,代表不同培养体系中活菌和死菌荧光强度比值。
所述步骤(4)通过降解实验测定n组菌液的农药降解活性:首次镜检后,向各培养体系中加入同样浓度的有机农药作为降解菌的底物,分时段取样分析各培养体系中农药残留量,在活菌占100%的培养组的有机农药残留量小于30%时终止降解实验,分析各培养体系中的的农药降解率。
所述步骤(5)绘制荧光比值与降解活性的相关性曲线,建立降解菌活性计算公式:以n组培养体系中活菌和死菌荧光强度比值为横坐标,对应各组的农药降解率为纵坐标,荧光强度和农药降解率均为同组三个重复的平均值,选择合适的曲线对二维平面中数据点进行拟合,绘制降解菌活性测试标准曲线,建立降解菌活性计算公式。
所述步骤(6)用未知活性菌液验证公式准确性:对于绘制的降解菌活性测试标准曲线的准确性进行验证,验证方法为对未知活菌百分比的培养液取样进行荧光染色观察,同时测试培养液中降解菌的活性,通过比较降解菌活性测试标准曲线计算的降解菌活性与实际测得的活性,验证降解菌活性测试标准曲线的准确性。
所述步骤(7)测定样品中的降解菌活性:测定样品中的降解菌活性时,震荡摇匀菌液后取少量进行荧光染色观察,分析样品中活菌和死菌的荧光强度比值,然后根据荧光强度比值在标准曲线上直接查出该样品中降解菌的活性。
以下通过具体实施例详细说明发明的实施步骤,目的在于使本领域的技术人员进一步理解本发明,但不以任何形式限制本发明;应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
实施例1
基于荧光染色观察的有机磷农药毒死蜱降解菌sphingomonassp.dsp-2的活性检测。
利用本发明对纯培养的sphingomonassp.dsp-2降解毒死蜱活性检测由以下步骤组成:
(1)将sphingomonassp.dsp-2菌株接种至4llb培养基中(lb培养基含胰蛋白胨10g/l、酵母提取物5g/l、氯化钠10g/l;ph7.0)在震荡摇床进行扩大培养,摇床转速200rmp,培养条件为温度30oc,培养期间在超净工作台内取1ml均匀菌液,用分光光度计测定吸光度od600,检测降解菌的生长情况;
(2)待降解菌生长至稳定期时,取2l培养液高温灭活形成灭活培养液,剩余2l为活菌培养液,按表1形成6组培养体系,每组设三个重复:
表1培养组1-6配置加入活菌及灭活培养液体积
(3)培养体系配置结束后,摇匀后准备降解菌悬浮液用于荧光染色,荧光染色试剂选择l7012live/deadbaclightbacterialviability试剂盒(美国invitrogen公司),该试剂盒中syto9荧光染料结合与已死或将死的、细胞膜受损的细胞,在激发波长480nm/发射波长500nm时死细胞显红色;而试剂盒中propidiumidodide荧光染料结合与细胞膜完好的活细胞,在在激发波长490nm/发射波长635nm时这些活细胞显绿色,降解菌悬浮液准备及染色步骤具体细节参照试剂盒说明书;染色结束后,在荧光显微镜下观察、拍照,利用photoshop软件获得视野中绿色和红色荧光光密度值,计算绿色荧光与红色荧光光密度比值;
(4)荧光显微镜观察结束后,对各培养组进行降解菌对毒死蜱降解活性检测,向各培养组中加入100mg/l毒死蜱,每隔3h取2ml分析农药残留量,在第48h时测得1-6组毒死蜱残留量、降解率、降解菌活性及荧光比值如表2所示(显示数据为三个重复均值):
表2培养组1-6荧光比值及降解活性检测结果
(5)以1-6组活菌和死菌荧光强度比值为横坐标,对应各组的农药降解率为纵坐标,荧光强度和降解菌活性均为同组三个重复的平均值,绘制降解菌活性测试标准曲线(请参照附图1);由标准曲线可知,不同活菌和死菌配比的培养组中毒死蜱降解菌sphingomonassp.dsp-2绿色/红色荧光比值与降解菌活性符合线性相关关系(r2=0.9963),降解菌活性的计算公式为降解菌活性(μg/h)=96.872×绿色/红色荧光比值-7.504;
(6)取活菌百分比未知的菌液进行荧光染色观察,分析绿色/红色荧光比值为1.75,将比值代入步骤(5)中公式计算培养体系中降解菌活性为每小时降解毒死蜱162.0μg,利用降解实验验证方法的准确性,将毒死蜱加入至菌液中,终浓度为100mg/l,48h后菌液中残留毒死蜱浓度为61.20mg/l,降解总量为7.76mg,降解菌活性为每小时降解毒死蜱161.7μg,与基于荧光比值计算的毒死蜱降解菌sphingomonassp.dsp-2降解活性(162.0μg/h)相差很小,表明荧光检测方法和标准曲线具有准确性和可靠性。
实施例2
污染水体修复过程中生物炭负载的毒死蜱降解菌sphingomonassp.dsp-2活性测定。
将毒死蜱降解菌sphingomonassp.dsp-2通过共培养方法与粉末状生物炭负载后,将降解菌-生物炭复合体装入透水袋中,在室内利用生态水槽模拟稻田退水系统复杂环境条件,为确保该复合体在实际原位修复中的高降解活性、强适应性,生态水槽中水体取自野外水稻退水系统,确定附着于生物炭上的降解菌sphingomonassp.dsp-2的生长状态和降解活性,为原位修复策略的指定和降解系统稳定性的评价提供理论依据和数据支撑。
利用本发明提出的基于荧光染色观察的方法检测降解菌-生物炭复合体在生态水槽中放置不同时间后毒死蜱降解菌sphingomonassp.dsp-2的降解活性;
用取自野外稻田退水系统的水体作为培养基质,将未灭活和灭活后的负载降解菌的生物炭匀浆液以不同配比形成如实施例1中所述的1-6培养组,取少量培养液进行荧光染色观察,计算绿色/红色荧光比值,通过实施例1中所述的降解实验计算负载于生物炭上的降解菌对毒死蜱的降解活性,绿色/红色荧光比值和降解活性呈线性相关,计算公式为降解菌活性(μg/h)=112.3×绿色/红色荧光比值+1.023,在生态水槽中放置装有降解菌-生物炭复合体的透水袋,在实验开始前(0h)首先进行荧光染色观察,并计算得到降解菌-生物炭复合体降解毒死蜱活性为75.3μg/h,运行8h、12h、24h、48h、72h后从透水袋取降解菌-生物炭复合体进行荧光染色观察,获得绿色/红色荧光比值,根据公式计算不同取样时间的毒死蜱降解活性如表3所示(显示数据为三个重复均值):
表3附着于生物炭的毒死蜱降解菌在不同运行时间时的荧光比值及降解活性检测结果
利用本发明提出的基于荧光染色的农药降解菌活性快速检测方法,快速、直观、准确的获得该降解菌-生物炭复合体在应用不同时间时对毒死蜱的降解活性,进而确定该降解菌-生物炭复合体在应用24h后对毒死蜱的降解活性最高,在72h后降解活性低于初始值,暗示在农田退水系统原位农药污染修复中该降解菌-生物炭复合体最高降解活性在24h,而在应用72h后需要更换透水袋中的降解菌-生物炭复合体,以保障降解效果。
- 还没有人留言评论。精彩留言会获得点赞!